元素周期及特征谱线表
- 格式:xls
- 大小:32.00 KB
- 文档页数:6

—/[ *、…氢(H)[主要性质和用途熔点为℃,沸点为℃,密度为0. 089 88 g/L(10 ℃)。
无色无臭气体,不溶于水,能在空气中燃烧,与空气形成爆炸混合物。
工业上用于制造氨、环已烷、甲醇等。
发现1766年由卡文迪许()在英国判明。
氦(He);主要性质和用途熔点为℃(加压),沸点为-℃,密度为 5 g/L(0 ℃)。
无色无臭气体。
化学性质不活泼。
用于深海潜水、气象气球和低温研究仪器。
发现1895年由拉姆塞(Sir )在英国、克利夫等(和在瑞典各自独立分离出。
锂(Li)。
主要性质和用途熔点为℃,沸点为1 347 ℃,密度为g/cm3(20 ℃)。
软的银白色金属,跟氧气和水缓慢反应。
用于合金、润滑油、电池、玻璃、医药和核弹。
发现1817年由阿尔费德森(. Arfvedson)在瑞典发现。
铍(Be)主要性质和用途~熔点为1 278±5 ℃,沸点为2 970 ℃(加压下),密度为g/cm3(20 ℃)。
较软的银白色金属,在空气和水中稳定,即使在红热时也不反应。
用于与铜和镍制合金,其导电性和导热性极好。
发现1798年由沃克兰()发现硼(B)主要性质和用途*熔点为2 300 ℃,沸点为3 658 ℃,密度为g/cm3(β-菱形)(20 ℃)。
具有几种同素异形体,无定形的硼为暗色粉末,跟氧气、水、酸和碱都不起反应,跟大多数金属形成金属硼化物。
用于制硼硅酸盐玻璃、漂白和防火。
发现1808年由戴维(Sir Humphrey Davy)在英国、盖-吕萨克()和泰纳)在法国发现。
碳(C)主要性质和用途熔点约为3 550 ℃(金刚石),沸点约为4 827 ℃(升华),密度为g/cm3(金刚石)、g/cm3(石墨)(20 ℃)。
用于首饰(金刚石)、炼钢(焦炭)、印刷(炭黑)和精制糖(活性炭)等。
;发现在自然界中以石墨(和金刚石)存在。
古代已知有木炭和烟炱。
氮(N)主要性质和用途熔点为℃,沸点为℃,密度为g/L(0 ℃)。





化学元素的周期化学元素是组成物质的基本单位,它们按照一定的规律排列在元素周期表中。
这个周期表准确地展示了元素的特性及其在化学反应中的行为。
本文将探讨化学元素的周期以及在元素周期表中的组织。
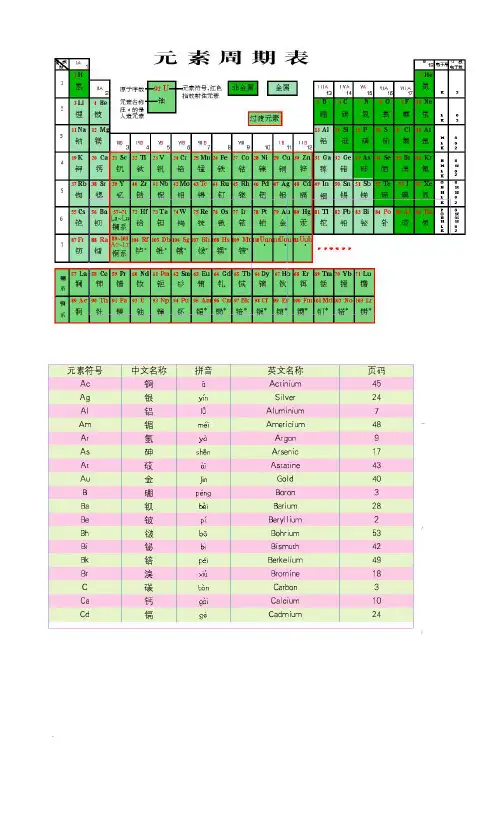
1. 元素周期表的基本结构元素周期表是由化学元素按照一定规律排列而成的表格。
表格的横向行称为周期,纵向列称为族。
每一个元素都有自己的原子序数,原子序数按照从小到大的顺序排列在周期表中。
同时,元素周期表还根据元素的化学性质划分为不同的区域,如金属、非金属和过渡金属区域等。
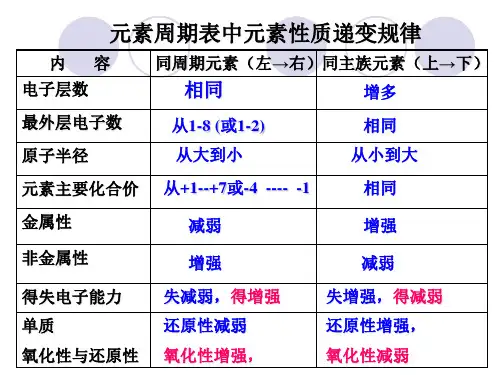
2. 周期表中的周期性规律化学元素按照原子序数的增大顺序排列在元素周期表中,这种排列方式使得元素的特性出现周期性变化。
以下是一些周期性规律的例子:2.1 原子半径的周期性变化元素周期表中,从左到右,原子半径逐渐减小,而在同一周期中,从上到下,原子半径逐渐增大。
这是因为原子核的正电荷随着原子核的层数增加而增加,吸引外层电子的能力增加,导致原子半径减小。
而在同一周期中,由于电子壳层的增加,层数增多,从而导致原子半径增大。
2.2 电离能的周期性变化电离能是指从一个原子或离子中去掉一个电子所需要的能量。
元素周期表中,从左到右,电离能逐渐增大,而在同一周期中,从上到下,电离能逐渐减小。
这是由于原子核的正电荷增加,使得外层电子与原子核之间的吸引力增强,导致电离能增大。
而在同一周期中,由于电子层的增加,使得电子与原子核之间的距离增加,从而降低了电离能。
2.3 电负性的周期性变化电负性是一个衡量原子吸引和保留电子的能力的指标。
在元素周期表中,从左到右,电负性逐渐增加,而在同一周期中,从上到下,电负性逐渐减小。
这是因为原子核的正电荷增加,吸引和保留电子的能力增强,导致电负性增加。
而在同一周期中,由于电子层的增加,使得电子与原子核之间的距离增加,降低了电负性。
3. 元素周期表的应用元素周期表对于化学的研究和应用有着重要的意义。
它使得科学家能够更好地理解元素之间的相互作用,探索化学反应的规律。

元素光谱波长表
元素光谱波长表是一种列出各种元素光谱波长的表格。
元素光谱波长表对化学、物理和天文学等领域的研究具有重要意义,因为它可以帮助科学家了解元素的特性、原子结构和电子排布等。
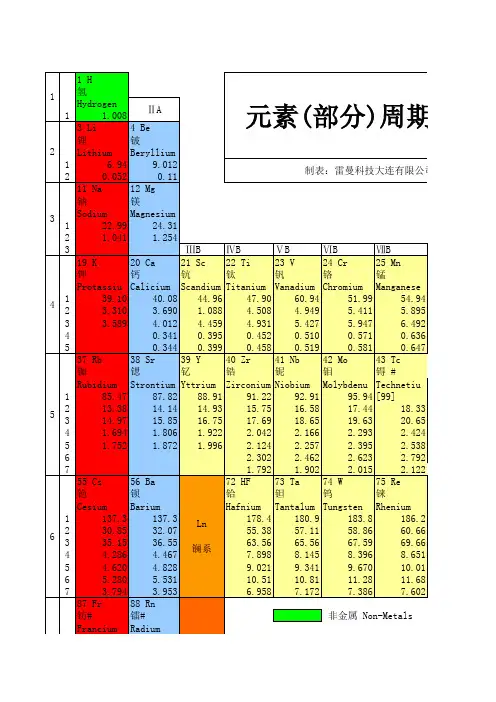
元素周期表:元素周期表是按照元素的原子序数从小到大排列的一系列表格,每行表示一个周期,每列表示一个族。
它包括了世界上已知的所有元素,是化学领域最重要的工具之一。
原子序数:原子序数是元素在元素周期表中的序号,表示元素的核电荷数。
它决定了元素的核外电子数,从而决定了元素的化学性质。
元素符号:元素符号是表示元素的简写字母或数字,例如H表示氢元素,C 表示碳元素。
原子量:原子量是元素的平均原子质量,以碳-12原子质量的1/12为基准进行比较。
原子量可以用来衡量元素的相对含量和物质的质量。
电负性:电负性是元素的一种化学性质,表示原子吸引电子的能力。
元素的电负性越大,越容易吸引电子成为负离子。
原子半径:原子半径是原子核到最外层电子的平均距离。
不同元素的原子半径不同,同一元素在不同状态下的原子半径也可能不同。
电子构型:电子构型是指元素的核外电子排布方式,包括电子层数、电子亚层和电子云的形状等。
电子构型决定了元素的化学性质和稳定性。
光谱线系:光谱线系是指元素在吸收或发射光时所呈现的一系列光谱线。
这些光谱线可以用来鉴别元素和确定其含量。
特征谱线:特征谱线是指元素在光谱中具有特定波长的谱线,这些谱线是鉴别元素和测量其含量的重要依据。
不同元素的特征谱线不同,同一元素在不同状态下的特征谱线也可能不同。