生化工程,第二章酶促反应动力学
- 格式:ppt
- 大小:6.75 MB
- 文档页数:88

酶促反应动力学名词解释
酶促反应动力学是研究酶催化反应速率、酶与底物之间的相互作用以及反应机制的科学领域。
酶是一种生物催化剂,能够加速化学反应的速率,而酶促反应动力学则是用来描述和解释酶催化反应速率的规律。
酶促反应动力学的主要研究内容包括反应速率、反应机理和酶动力学参数等。
反应速率是指单位时间内反应物转化为产物的量,可以通过测量底物浓度的变化来确定。
酶催化反应速率通常比非酶催化的速率高几个数量级,这是因为酶能够提供更适合反应进行的环境,如形成特定的活性位点、降低反应的活化能等。
反应机理是指酶催化反应中涉及的化学步骤和中间产物的生成过程。
酶催化的反应通常包括底物与酶结合形成底物-酶复合物、底物在酶的活性位点上发生化学反应、产物与酶解离的过程。
通过研究反应机理,可以更好地理解酶催化反应的特点和机制。
酶动力学参数是描述酶催化反应速率和酶与底物之间相互作用的定量指标。
常见的酶动力学参数包括最大反应速率(Vmax)、米氏常数(Km)和催化效率(kcat/Km)等。
Vmax表示在酶的浓度饱和状态下的最大反应速率,Km表示酶与底物结合的亲和力,kcat/Km则是酶催化反应的效率常数。
总的来说,酶促反应动力学的研究对于理解酶催化的反应机制、设计高效的酶催化反应以及开发新型药物和工业催化剂等方面具有重要的意义。
通过深入研究酶
促反应动力学,可以为生物工程、医药化学和工业生产等领域的应用提供理论和实践基础。

酶促反应动力学米氏方程摘要:1.酶促反应动力学的基本概念2.米氏方程的推导过程3.米氏方程的应用4.酶促反应动力学的影响因素5.总结正文:一、酶促反应动力学的基本概念酶促反应动力学是研究酶促反应速度及其影响因素的科学。
在酶促反应中,酶作为催化剂,可以降低反应所需的活化能,从而加速反应速率。
酶促反应动力学主要研究酶浓度、底物浓度、温度、pH、抑制剂和激活剂等因素对反应速率的影响。
二、米氏方程的推导过程米氏方程是描述酶促反应速度与底物浓度之间关系的经典方程。
其推导过程如下:1.假设酶分子的数量为[E],底物浓度为[S],酶促反应速度为v。
2.酶在催化过程中会与底物结合形成酶- 底物复合物(ES),此过程为慢反应。
3.酶- 底物复合物在达到一定程度后会分解为酶和产物,此过程为快反应。
4.根据慢反应和快反应的速率常数,可以得到酶促反应速度的表达式。
5.将表达式中的慢反应和快反应速率常数用米氏常数(Km)表示,即可得到米氏方程:v = (Km * [S]) / (Km + [S])三、米氏方程的应用米氏方程可以用于分析酶促反应的动态过程,预测反应速度与底物浓度的关系,以及研究酶的结构与功能。
此外,通过比较不同底物和酶的米氏方程,可以了解酶的专一性和底物选择性。
四、酶促反应动力学的影响因素酶促反应动力学受到多种因素的影响,主要包括:1.酶浓度:在一定范围内,酶浓度的增加会提高反应速率,但当酶浓度达到饱和时,反应速率不再随酶浓度增加而提高。
2.底物浓度:底物浓度的增加会提高反应速率,但当底物浓度达到一定程度时,反应速率不再随底物浓度增加而提高。
3.温度:温度的升高会加速反应速率,但过高的温度会导致酶失活,使反应速率降低。
4.pH:酶的活性受pH 值的影响,pH 值的改变会影响酶的催化效率。
5.抑制剂和激活剂:抑制剂会降低酶的催化效率,而激活剂会提高酶的催化效率。
五、总结酶促反应动力学是研究酶促反应速度及其影响因素的科学。







酶促反应的动力学酶促反应动力学是研究酶促反应速度及其影响因素的科学。
这些因素主要包括底物浓度、酶浓度、温度、PH、激活剂和抑制剂等。
在研究某一因素对酶促反应速度的影响时,应该维持反应中其它因素不变,而只改变要研究的因素。
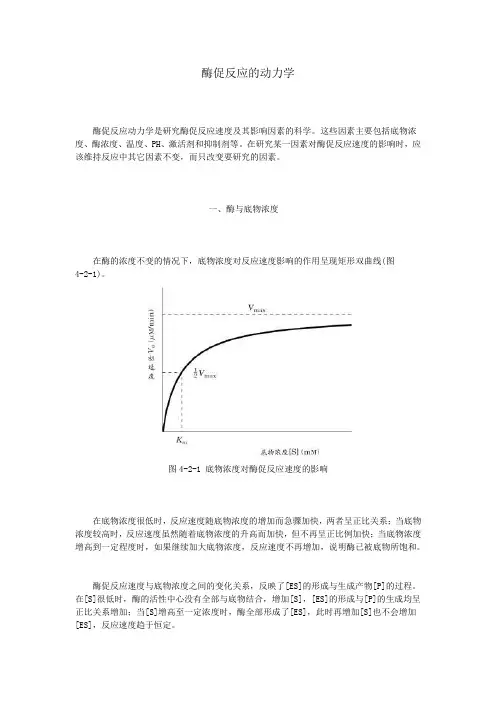
一、酶与底物浓度在酶的浓度不变的情况下,底物浓度对反应速度影响的作用呈现矩形双曲线(图4-2-1)。
图4-2-1 底物浓度对酶促反应速度的影响在底物浓度很低时,反应速度随底物浓度的增加而急骤加快,两者呈正比关系;当底物浓度较高时,反应速度虽然随着底物浓度的升高而加快,但不再呈正比例加快;当底物浓度增高到一定程度时,如果继续加大底物浓度,反应速度不再增加,说明酶已被底物所饱和。
酶促反应速度与底物浓度之间的变化关系,反映了[ES]的形成与生成产物[P]的过程。
在[S]很低时,酶的活性中心没有全部与底物结合,增加[S],[ES]的形成与[P]的生成均呈正比关系增加;当[S]增高至一定浓度时,酶全部形成了[ES],此时再增加[S]也不会增加[ES],反应速度趋于恒定。
(一)米氏方程为了解释底物浓度与酶促反应速度的关系,1913年Michaelis和Menten把图4-2-1归纳为酶促反应动力学最基本的数学表达式---米氏方程:V=Vmax[S]/(Km+[S])Vmax为反应的最大速度,[S]为底物浓度,Km是米氏常数,V是在某一底物浓度时相应的反应速度。
(二)米氏常数(Km)的意义:1.当反应速度为最大速度一半时,米氏方程可以变换如下:1/2Vmax=Vmax[S]/(Km+[S])所以 Km=[S]。
因此,Km值等于酶促反应最大速度一半时的底物浓度。
2.Km值可判断酶与底物的亲和力(Km值愈大,酶与底物的亲和力愈小;反之亦然)。
3.Km值是酶的特征性常数,只与酶的结构、酶所催化的底物和酶促反应条件有关,与酶的浓度无关。
酶的种类不同,Km值不同,同一种酶与不同底物作用时,Km值也不同。
