天然气催化燃烧近零污染物排放机理和应用(张世红[等]著)思维导图
- 格式:xmin
- 大小:4.53 KB
- 文档页数:1

第一单元、走进化学世界化学:是研究物质的组成、结构、性质以及变化规律的科学。
物理变化:没有新物质生成的变化。
化学变化:有新物质生成的变化。
物理性质:物质不需要通过化学变化就能表现出来的性质(包括:颜色、状态、气味、硬度、熔点、沸点、密度、水溶性)化学性质:物质在化学变化中表现出来的性质(包括:可燃性、还原性、氧化性、稳定性、活泼性)化学变化:蜡烛燃烧;区别: 化学性质:蜡烛能(可、易、是…的)燃烧。
对蜡烛燃烧的探究(P12—13)对人体呼出气体和吸入空气的探究(P14—16) ①使用药品要做到“三不”:不能用手接触药品,不要把鼻孔凑到容器口去闻药品的气味,不得尝任何药品的味道。
②取用药品应严格按照实验规定的用量取用,若没有说明用量,一般应按最小量,即液体1~2ml ;固体只需盖满试管底部。
③用剩的药品不能放回原瓶,也不要随意丢掉、更不要拿出实验室。
粉末状:(药匙或纸槽)(一斜二放三直立) 块状:(镊子或药匙)(一横二放三慢竖)大量:倾倒法(倾倒时瓶盖要倒放,标签向手心) 少量:用胶头滴管(注意胶头滴管的使用方法) 定量:量筒+胶头滴管(注意量筒的使用方法:读数时量筒必须放平,视线与量筒内液体的凹液面最低处保持水平)俯视:读数偏大,实际数偏小 仰视:读数偏小,实际数偏大 酒精灯的使用主要事项能直接加热:试管、燃烧匙、蒸发皿 加热仪器 垫石棉网:烧杯、烧瓶不能加热:量筒、集气瓶、滴管等 液体:管外干燥;先预热;试管内液体不超过1/3;试管口向上倾斜45度,试管口不对人;固体:试管口略向下倾斜5、仪器的洗涤(干净标准:玻璃仪器内壁附着的水既不聚成水滴,也不成股流下)6.仪器连接:右插进左,先湿润,再慢慢转动插进。
变化 物质的变化与性质 性质 学习化学的一个重要途径——化学实验 1、药品取用的规则2、固体药品的取用3、液体药品的取用4、给物质的加热 化学实验基本操作第二单元、我们周围的空气、物性:无色无味的气体,密度比空气略小,难溶于水2、化性:不能燃烧,不支持燃烧,不能呼吸、用途:1、氧气含量的实验测定(用红磷在空气中燃烧)实验现象:①红磷燃烧,产生大量白烟;②水进入瓶中大约占瓶体积的1/5化学方程式:4P + 5O 2 ===== 2P 2O 5结论:氧气约占空气体积的1/5①红磷量不足②装置漏气 ③瓶未冷却就打开夹子2、物性:无色无味的气体,密度比空气大,不易溶于水,在一定条件下可液化为淡蓝色液态氧,也可固化为淡蓝色的固态氧。


第二单元 我们周围的空气空气空气的组成粗略测定空气中氧气的含量原理点燃红磷消耗氧气减小容器内的压强吸入水的体积即为消耗的氧气的体积实验现象红磷燃烧发出黄光放热产生大量的白烟打开弹簧夹后,进入集气瓶内的水约为空气体积的五分之一结论氧气的体积约为空气体积的五分之一注意事项密闭的容器防止容器内外气体交换反应物要过量充分消耗氧气反应的生成物为固体,或产生气体易被吸收减小对容器内气体体积的影响冷却至室温因反应条件多加热或点燃,冷却后方可准确测定消耗的氧气的体积减小的气体的体积即为消耗的氧气的体积空气成分体积分数:氮气78%、氧气21%、稀有气体0.94%、二氧化碳0.03%、其他0.03%物质的分类混合物由两种或两种以上的物质组成各种成分分别保持各自的性质纯净物由一种物质组成空气是一种宝贵的自然资源氧气支持燃烧炼钢、气割、气焊、航天支持呼吸动植物呼吸、医疗急救、潜水氮气含有氮元素制造硝酸、氮肥化学性质不活泼保护气液氮温度低麻醉剂超导材料在低温下显示超导性能稀有气体化学性质不活泼保护气通电时可发出不同颜色的光做电光源航标灯闪光灯霓虹灯空气的污染及防治常见的空气污染物有害气体二氧化硫、二氧化氮、一氧化碳、臭氧烟尘PM 2.5污染来源化石燃料的燃烧工厂废气植被破坏污染防治减少化石燃料的燃烧使用清洁能源处理工厂废气植树造林加强大气监测氧气氧气的性质及用途性质物理性质标况下,无色无味密度比空气略大不易溶于水化学性质与金属反应与非金属反应与某些化合物反应用途供给呼吸支持燃烧氧气的实验室制法反应原理收集方法排水法向上排空气法检验方法将带火星的木条伸入集气瓶中,木条复燃验满方法将带火星的木条靠近集气瓶口,木条复燃则说明已收集满氧气概念分子是保持由分子构成的物质的化学性质的最小粒子第四单元 自然界的水爱护水资源分布海洋水、大气水、湖泊水、地下水等海洋中有80多种化学元素淡水占全球总水量的2.53%,其中可利用的占30.4%(不到总水量1%)爱护水资源水污染原因工业:三废末经处理,直接排放生活污水任意排放农业:农药、化肥的不合理施用水污染危害鱼类大量死亡人引用:中毒、致病、甚至死亡工农业生产使用——降低产品质量防止水体污染加强水质检测工业三废处理后排放生活污水集中处理后排放农业:合理使用农药、化肥水的净化自来水厂水的净化过程沉降→过滤→吸附→投药消毒过滤原理:分离不溶于水的固体与液体的操作仪器:铁架台、漏斗、烧杯、玻璃棒、滤纸操作注意事项一贴;二低;三靠硬水和软水硬水(较多Ca₂⁺和Mg₂⁺)和软水(不含或较少Ca₂⁺和Mg₂⁺)硬水、软水的检验:肥皂水硬水:泡沫少,浮渣多软水:泡沫多,浮渣少硬水的软化实验室:蒸馏生活:煮沸水的组成水的组成水的电解正极:氧气;负极:氢气正负极体积比:1:2原理:H₂O→(通电)H₂+O₂结论水是由氢、氧元素组成的在化学反应中,分子可分,原子不可分氢气燃烧氢气的物理性质氢气的化学性质可燃性氢气燃烧产生淡蓝色火焰,火焰上方罩一烧杯,有水雾出现原理:H₂+O₂→(点燃)H₂O可燃性气体在点燃前要验纯物质的分类纯净物单质化合物氧化物混合物化学式与化合价化学式意义(H₂O)宏观水这种物质水由H、O元素组成微观一个水分子一个水分子由2个氢原子和1个氧原子构成水分子中H、O原子的个数比是2:1书写金属在前,非金属在后读法正写反读根据化学式求化合价单质化合价为0化合物中各元素化合价代数和为0H为+1,O为-2金属正价,非金属负价化学式的计算相对分子质量某元素的质量分数元素的质量比化合价化合价囗诀化合价规律根据化合价写化学式第五单元 化学方程式理论依据:质量守恒定律质量守恒定律的内容实质宏观物质的质量总和不变元素的种类、质量不变微观原子的种类不变原子的数目不变原子的质量不变概念用化学式表示化学反应的式子含义表示反应物、生成物和反应条件表示反应物、生成物各物质之间的质量比表示参加反应的各粒子的数量关系书写原则以客观事实为基础遵守质量守恒定律书写步骤一写二配三标配平方法最小公倍数法奇数配偶法设“1”法读法读出反应物、生成物和反应条件读出反应物、生成物各物质间的质量比应用:根据化学方程式计算计算步骤:设、写、找、列、答根据题意设未知量正确书写化学方程式找出已知量与未知量的质量关系列出比例式,求解简明地写出答案第六单元 碳和碳的氧化物碳单质化学性质在常温下化学性质不活泼与氧气反应,可燃性氧气充足时,碳能充分燃烧,生成二氧化碳氧气不充分时,碳不充分燃烧,生成一氧化碳与某些氧化物反应,还原性在高温下,碳能与某些氧化物反应,使氧化物被还原,所以焦炭能用于冶金工业碳的几种单质金刚石自然界中最硬的物质,无色透明,正八面体不导电用途:裁玻璃、钻石等石墨最软的矿物之一,深灰色可用于制铅笔芯导电用途:铅笔芯、润滑剂、干电池电极等无定形碳木炭和活性炭具有疏松的结构具有吸附性用途:吸附异味、有毒气体等c60由60个碳原子构成的分子,形似足球,结构稳定二氧化碳定义碳的氧化物特性和功能特性无色无味气体密度比空气略大沸点和熔点沸点:-56.6℃(5270pa)熔点:-78.5℃(升华)能溶于水生成碳酸H₂CO₃弱酸不能燃烧可以使烧杯中的蜡烛熄灭参与光合作用绿色植物(包括藻类)吸收光能,把二氧化碳和水合成富能有机物,同时释放氧气的过程分子结构O=C=O的直线结构产生温室效应产生途径燃料燃烧动植物呼吸微生物分解动植物尸体获取和收集获取方法高温煅烧石灰石:CaCO₃==高温==CaO+CO₂↑收集方法向上排空气法实验室制取实验室制法:CaCO₃+2HCl==CaCl₂+H₂O+CO₂↑稀盐酸浓盐酸有挥发性,会使收集到的二氧化碳不纯验满:燃着的木条靠近容器口熄灭即已收集满检验:使澄清石灰水变浑浊应用千冰制冷剂:人工增雨可以产生白色烟雾的舞台效果低温灭火器冷藏运输领域一氧化碳性质与用途物理性质无色、无味、难溶于水、密度比空气略小化学性质可燃性还原性毒性极弱的氧化性用途气体燃料冶炼金属可用于制甲酸钠危害有毒气体,会与人体血液中的血红蛋白结合,使人体缺氧而中毒可燃物九年级下册化学第八单元 金属和金属材料金属材料金属材料包括纯金属以及它们的合金物理性质常温下一般为固态(汞为液态),有金属光泽大多数呈银白色(铜为紫红色,金为黄色)有良好的导热性、导电性、延展性金属之最铝:地壳中含量最多的金属元素钙:人体中含量最多的金属元素铁:目前世界年产量最多的金属(铁>铝>铜)银:导电、导热性最好的金属(银>铜>金>铝)铬:硬度最高的金属钨:熔点最高的金属汞:熔点最低的金属锇:密度最大的金属锂:密度最小的金属金属分类黑色金属通常指铁、锰、铬及它们的合金有色金属重金属:如铜、锌、铅等轻金属:如钠、镁、铝等合金由一种金属跟其他一种或几种金属(或金属与非金属)一起熔合而成的具有金属特性的物质一般说来,合金的熔点比各成分低,硬度比各成分大,抗腐蚀性能更好钛和钛合金被认为是21世纪的重要金属材料,钛合金与人体有很好的“相容性”,因此可用来制造人造骨等优点熔点高、密度小可塑性好、易于加工、机械性能好抗腐蚀性能好金属的化学性质大多数金属可与氧气的反应金属+酸→盐+H ₂↑Fe+CuSO ₄= Cu + FeSO ₄(“湿法治金”原理)金属+盐→另一金属+另一盐(条件:“前换后,盐可溶”)常见金属活动性顺序→K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au →金属的位置越靠前,它的活动性就越强位于氢前面的金属能置换出盐酸、稀硫酸中的氢(不可用浓硫酸、硝酸)位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来(除K,Ca,Na,Ba)金属资源的利用和保护铁的冶炼原理在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石里还原出来3CO + Fe ₂O ₃=高温=2Fe + 3CO ₂原料铁矿石、焦炭、石灰石、空气常见的铁矿石有磁铁矿(主要成分是Fe ₃O ₄)、赤铁矿(主要成分是Fe ₂O ₃)铁的锈蚀铁与O ₂、水接触(铁锈的主要成分:Fe ₂O ₃)铁生锈的条件铜生铜绿铜与O ₂、水、CO ₂接触铜绿:Cu ₂(OH)CO ₃防止铁制品生锈的措施保持铁制品表面的清洁、干燥表面涂保护膜制成不锈钢铁锈很疏松,不能阻碍里层的铁继续与氧气、水蒸气反应,因此铁制品可以全部被锈蚀铝与氧气反应生成致密的氧化铝薄膜,从而阻止铝进一步氧化,因此,铝具有很好的抗腐蚀性能金属资源的保护和利用保护金属资源的途径防止金属腐蚀回收利用废旧金属合理开采矿物寻找金属的代用品节约金属资源,减少环境污染一种或几种物质分散到另一种物质里形成的均一的稳定的混。

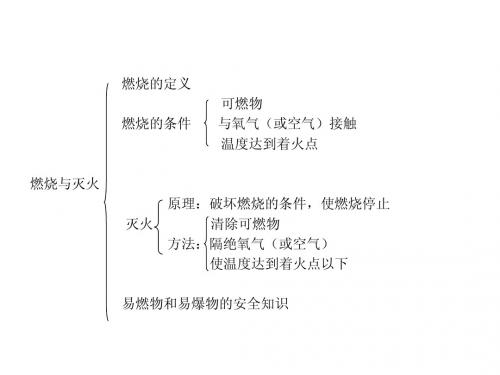
第七单元:燃料及其利用
燃烧
可燃物
氧气
着火点
灭火原理
隔离可燃物
隔绝氧气
降低温度
灭火器
干粉灭火器
二氧化碳灭火器
水基型灭火器
易燃物和易爆物
的安全知识
安全标识
存放注意事项
运输注意事项
火灾处理注意事项
化学反应中
的能量变化
吸热反应
放热反应
化石燃料的利用
煤
主要含碳元素
煤的综合利用
石油
主要含碳、氢元素
石油的综合利用
天然气
可燃性
利用
合理利用和
开发化石能源
使燃料充分燃烧
开发可燃冰
使用燃料对环境的影响
粉尘污染
有害气体污染
温室效应
能源的利用和开发
氢能、风能、太阳能
地热能、核能、潮汐能
九年级上册化学
制作工具
:知
犀思
维导
图。

燃烧与燃料4.通过学习自然界中的碳循环,认识二氧化碳的变化规律,了解大气中二氧化碳含量增加对环境可能造成影响。
5、初步学习在实验室制取二氧化碳。
能举例说明二氧化碳的主要性质和用途。
过程与方法:1.能利用对比实验的方法设计和完成一些简单的化学实验,发展科学探究能力。
2.发展善于合作、勤于思考、严谨求实、勇于创新和实践的科学精神。
3、知道化学变化的发生需要一定的条件,控制条件能够促进或抑制化学变化。
情感态度与价值观:1、树立环境意识和资源意识,懂得保护自然平衡、人与自然和谐相处的重要性。
2、了解我国能源和资源的国情,树立资源观的树立、环保意识的强化、化学科学价值的体现。
对应课标1、认识燃烧发生的条件,了解防火灭火的措施。
燃烧条件的实验探究。
2、认识常见化石燃料。
探究化石燃料燃烧对大气环境的污染,选择燃料时应考虑的因素,学会统筹安排选择合适的燃料。
知道石油、煤的一些代表性的综合利用措施。
2.分别点燃两支蜡烛,将其中一支蜡烛用大烧杯罩住,另一支蜡烛放在空气中燃烧,观察实验现象。
实验结束将蜡烛吹灭。
3.用镊子分别夹取一根木条和一小块煤,同时在酒精灯上点燃,观察实验现象。
【提出问题】1.酒精为什么会燃烧,而水却没有燃烧?2. 用大烧杯罩住的蜡烛为什么会熄灭,而没有罩住的蜡烛却能正常燃烧?3.木条要比煤先燃烧?【追问】物质燃烧需要几个条件?这些条件是必须同时具备,还是有一个即可?【板书】燃烧的定义和条件【点拨】着火点:是使物质能够持续燃烧的最低温度,一般不会改变。
【教师演示】将蘸了酒精和水的混合物的手绢点燃。
【引言】火给我们带来了美好的生活,使用不当也会给人类带来巨大的损失和灾难。
【展示】多媒体展示火给人类带来的灾难图片。
在日常生活中你用过哪些灭火方法呢?想想看,在下面的情况下应采用什么方法灭火?采用这些方法为什么能够灭火。
【多媒体出示】寻找灭火的方法:【设疑】灭火的原理与燃烧的条件有什么样的关系?对比分析,增强理解与记忆。
身边的化学物质形成悬浊液 乱油液溶解性:在某溫度,压强下,一种物质在另一种物质里溶解能力的大小 槪念饱和溶液,不饱和溶液转化槪念:溶质质量与溶液质量之比 公式计算空气的成分(体R 分数> R 气的ft®及用途MW 气体的11®及用i« 空气、氧气 氣't 空,®量LJB 的主赛》«1容(空气污M «'<-= ^VS, 5气《量纽期、空气®量状况> 史气獨量B 緝 丨什乂gn/G 染IHB 的项冃:MM , co 、NOi.珂吸入_輪物,O >««_与非会《««反应・c . s. r. in• i 、与金属_质氏曲1 Fe ・Al. Ca与化学tt 反fib CH4. CUIMIII| niit <支N«ct.供给柙明) 实W 审 W 法I KMnO4 . KCIO3、HlOl物现矜城1无&.无味.不易番;于•水.»度比g 气大 I 收《枝:分興®态空气&初中似性质组成:电解分解净化:静置沉淀、过滤,吸附、蒸® 硬水与软水区分、危害、转化 用途 保护水资源:节约用水,防治水污染氬气物理性质:无色无味,难溶于水,所有气体密度嚴小的气体 性质 化学性质:可燃性(不纯燸炸)、还原性 用途:氢能源、氢气球、冶金 制取溶液:均一、稳定溶质 溶剂水,溶液 溶液 与浓、稀溶液的关系溶解度固体的溶解度气体的溶解度槪念影晌因素 外因:温度内因:溶质溶剂的性质溶解度曲线槪念彩响因索结晶:固体物质从溶液中析出晶体的过程莰发结晶 冷却热饱和溶液溶液的溶质质■分数无色透明正八面体形状固阼金刚石J 天然物质中最硬的物质 L —可作钻头、装饰品、玻璃刀头 (-深灰色磷片状固阼,不透明,石墨质软—作铅笔芯 S-s 滑鼠感—作润滑剤物理性质 导电性—作电极及用途木炭、活性炭:吸附性—作净水剤、防橐面具滤春剤广①一般愔况下不燃烧也不支持燃烧② 不供给呼吸③ 与水反应:H 2CO 3=H 2O+CO 2H 2O+CO2= H2CO3 化学性质J ④与喊反应:Ca (OH )2+CO 2=CaCO 3 \ +H 20⑤光合作用:6CO 、+6HoO_ 光眩 C 6H 12O 6+6O 2叶妹京、⑥氧化性:CO 2+C=^2CO用途:①灭火②干冰用于人工降雨、作致冷剤③碳酸饮料 ④温室肥料⑤工业原料制法:①CaCO 3+2HCl=CaCl2+H 2O+CO21 (实验室)② CaCO 3=^=CaO+ C021 (工业制法)温室效应:温室气体包括C02、03、CH4、氣氳代烷等、C02在自然界的循环:即产生和消耗的途径物理性质:无色无味气体,密度比空气略小,难滔于水①可燃性:2CO+O 2=^=2CO 2化学性质4 ②还原性:CO+CuO=^=Cu+CO 2③砉性:极易与血红蛋白r _造矽机怍鈸氧 L 用途:①作燃料②冶炼金厘单质: (金刚石、 Ceo:石墨、 C+O 2=^=CO 2 (充分燃烧) 2C+O 2=^=2CO (不充分'鵬)2CuO+C^=2Cu+CO 2t (现象:黒色粉末变成红色,澄潛石灰水变浑浊)物理性质:无色无味气体,密度比空气大,易溶干水,固阼叫 <干冰易JI 化可作燃料CO 2+C=^=2CO可冶炼金厘物理性质:大部分常溫下固体,具有金厲光潘,电和热的良导体,錄 较好的延展性,密度大,熔沸点较S 用途-性质溉念-•混合物硬度: >纯金展合金合金与纯金属性质差异熔点:〈纯金属 抗腐蚀性: >纯金展 常见的合金(含碳量,生铁〉钢)寻找金風®代品金厲材科金属的化学性质金质与金质材料反应类型:置换反应反应类型:置换反应 反应条件:前換后 窻义应用铁的冶炼(CO 还原Fe203)金厲资源在自然界的存在 单质:金矿石:磁铁矿、赤铁矿 金属资源的利用和保护铁的锈蚀与防护•保护金風资源的措施防止金属生锈回收利用废旧金属 有计划合理开采矿物 与氯气反应活泼金属与黢反应与盐溶液的反应金厲活动性顾序表浓盐酸-挥发性浓硫酸-吸水性、强腐蚀性,强氧化性,稀释 指示剂:紫色石S 变红,无色酚酞不变色 +活泼金属~»益+水♦金風组化物■♦益+水 +減>*盐+水♦某些盐"♦新益♦水指示剂:紫色石蕊变蓝,无色酚酞变红+非金展氣化物■♦益+水 +酸-»盐+水+某些盐-♦新盐+水 弦定义:金属离子/NH3++M 根离子 NaCI. Na2CO3、NaHCO3、CaCOMl 质与用途 定义 氮肥:尿素等 磺肥:矿粉等 钾肥:草木灰等复合使!用途 化学肥料常见化肥酸碱性: 蛇碱度用梅示剂检验槪念:定量表示酸碱性 表示方法:pH測定pH 的方法:用干净的玻璃棒程取被測溶液 并滴在pH 试纸上,半分钟后对比试纸与 标准比色卡的顔色 改变溶液pH 的方法通性格动的拥子益及化学肥科通性:阴离子:0H-金風离子/NH3++0H-溶液的黢碱性与酸碱度相0H 性质、俗称,用途 Sa (OH) 2性质、俗秣、 MUH2O混合物纯净物单质化合物分子离子分子是保持物质化学性质的最小粒子性质:质量体积小,不断运动,有间隔,可分割表示方法原子是化学变化中最小的粒子性质:质ft体积小,不断运动,有间隔,可分割表示方法:元紊符号结构带电的原子或原子团分类:阴阳离子表示方法离子与原子的相互转化具有相同核电荷数即核内电子数的一类原子的总数元素的存在形式:单质、化合物元素的表示方法元素与原子的关系:总体和个体元素周期表:7周期16族化学式化合价元素符号和数字组成表示物质组成的式子一种元素一定数目的原子跟其他元素一定数目相化合的性质. 叫做这种元素的化合价表示方法物理变化槪念參加反应的各种物质的质量总和=反应后的各物质的质量总和五个不变物质的变化化学变化物质的变化和性质物质的性质燃烧与灭火遇守质量守恒定律两个一定变两个可能变宏观:反应物.生成物的总量不变;元承的种类不变、微观:原子的种类、数目,质■不变宏观:物质的种决一定变做现:构成物痪的分子种类一定变分子的总数可能变物质的状态可能变化学方程式:写.配,注反应现象:题色的变化,发光,放热,生成气体薄化合反应分解反应置换反应复分解反应有眾参加的反应:ft化还原反应一般反应条件为高湿的反应基本类型相据能量变化吸热反应放热反应物理变化与化学变化的区别和联系判断:在变化中是否有某他物质生成物理性质化学性质物质不W要发生化学变化就表现出来的性质熔点,密度,硬度,气味,状S,賴色等物质在化学变化中表现出来的性珉可燃性,还厍《,S化性,薄性,般味性等物理性班与化学性质的区别和联系燃烧定义:发光,发热的斟烈的氰化反应条件:可燃物,讯气/空气、溫度达到着火点灭火内因:可燃物的性质外囚:与《气榜触的®积灭火原理:破坏燃烧的条件泡沬灭火H党见的灭火器干粉灭火器二氣化砖灭火器缓慢氣化、自燃燸炸J4-W66含杂质的质量应換成纯物质的质量 _时位祕成観密度•体积质■单位代入化学方程式咬囂胃 统一化学方程式中物胰质■单位应统一 比例法 关系式法守恒法差量法平均值法暮本的实tt 技期化学仪a 的识别与《用«■的连罎发生装震幻收集装霣的达择M 学S 究气》的»IB. f?JSK2与净化气<«的Uft 气镡”质的Kii 气体的净化化华球合实tt«««»的分®«质的検嗆与榷醣來兕化学物拓的袷的«质格K 的方法 分A.曲浼的K 本願n相夜的分离与提鲭,物理方法:过»,结«.费»权方法,化气法,济3法,冒换5 ?皆>:川秘.时法"V-/ '.’化««興 化聿与V 康石浪天K 气元素在人体内的ft 在形武0, C 、H, N 、C«、P 、*,5,如,CI, «« M ■光扇 Fe * 加,加,Cr ' 如,r * *• W ■元章 鴻汴薷 太曲廉元薫与人停tt 康&•费富物质 破瀵 化石燃对坏凌的彩_化史,衣灼利环》的影_水汽染2气污» 土®污史环磔?itt 及W 沿 白色穴染化擎与蛘壤 化学与W®*«会食金羼M 愈S合tom 僉成濬K着合鉍科 •精不冏功®和灼鼸的多裨F.戶iXIMtfc **•柃相对®子质最的计算W 念:以一个味-12原子届■的1/12为标准, 其他原子的屏酱跟它的比值化学计算有关化学式的计算 溶液的相关计算相对分子质■ 化学式中各®子的相对傑子的总和 物质组成的元累质量比各元子个败与相对原子质■的番R 之比 物质中某种元素的质■分数该元素的质■与组成物质的各元素总旗■之比 概念溶质质■分数计算公式溶质质■分数与溶解度的换算溶液与化学方程式的综合计算依据一质■守恒定律步现及格式设,写、列、解‘答纯物质的质不纯物质的质量*纯度根据化学方程式的计算方法技巧相时质子ft®。