高中有机化学流程专题
- 格式:doc
- 大小:654.51 KB
- 文档页数:6

有机化学实验的基本操作有机化学实验的基本操作2.1 加热与冷却方法2.1.1 加热方法在实验过程中,为了提高反应速度,经常要对反应体系加热。
另外,在分离、提纯化合物以及测定化合物的一些物理常数时,也常常需要加热。
实验室常用的热源有煤气灯、酒精灯、电炉、电热套等。
必须注意,玻璃仪器一般不能用火焰直接加热。
因为剧烈的温度变化和加热不均匀会造成玻璃仪器的损坏。
同时,由于局部过热,还可能引起有机化合物的部分分解。
为了避免直接加热可能带来的弊端,实验室中常常根据具体情况应用以下不同的间接加热方式。
(1)石棉网加热把石棉网放在三脚架或铁圈上,用煤气灯或酒精灯在下面加热,石棉网上的烧瓶与石棉网之间应留有空隙,以避免由于局部过热引起化合物分解。
加热低沸点化合物或减压蒸馏时不能用这种加热方式。
(2)水浴当所加热的温度在80℃以下时,可选用水浴加热。
将容器浸入装有水的水浴中(注意:勿将容器触及水浴底部),小心加热保持所需的温度。
对于像乙醚等低沸点易燃溶剂,不能用明火加热,应用预先加热好的水浴加热。
若需要加热到100℃时,可用沸水浴或水蒸气浴。
(3)油浴在100℃~250℃之间加热可选择油浴,在油浴中放一支温度计,可以通过控制热源来控制油浴温度。
用明火加热油浴应当十分谨慎,避免发生油浴燃烧事故。
油浴所能达到的最高温度取决于所用油的种类。
液体石蜡可加热到220℃,温度过高不易分解但容易燃烧。
固体石蜡也可以加热到220℃,由于它在室温时是固体,所以加热完毕后,应先取出浸在油浴中的容器。
甘油和邻苯二甲酸二丁酯适用于加热到140℃~150℃,温度过高则容易分解。
植物油如菜油、蓖麻油和花生油,可以加热到220℃,常在植物油中加入1%的对苯二酚等抗氧剂,以增加它们在受热时的稳定性。
硅油和真空泵油在250℃以上仍较稳定,是理想的浴油,但价格较高。
(4)砂浴加热温度在几百度以上要使用砂浴。
将清洁而又干燥的细砂平铺在铁盘中,盛有液体的容器埋人砂中,在铁盘下方加热。

一、研究有机化合物的基本步骤常用的分离、提纯方法包括蒸馏、萃取、重结晶。
二、蒸馏1.蒸馏原理:利用有机物与杂质的沸点差异,将有机化合物以蒸汽的形式蒸出,然后冷凝得到产品。
2.适用对象:互相溶解、沸点不同的液态有机混合物3.适用条件:①有机物的热稳定性较强;②有机物与杂质的沸点相差较大(一般约大于30 ℃)4.实验仪器:铁架台、酒精灯、石棉网、蒸馏烧瓶、温度计、直形冷凝管、牛角管(尾接管)、锥形瓶。
5.实验装置与注意事项①蒸馏烧瓶里盛液体的用量不超2/3,不少于1/3; ②加入沸石或碎瓷片,防止暴沸;③温度计水银球应与蒸馏烧瓶的支管口平齐; ④冷凝水应下口进入,上口流出;⑤实验开始时,先通冷凝水水,后加热;实验结束时,先停止加热,后停止通冷凝水;第03讲 有机物的分离、提纯知识导航知识精讲三、萃取1.原理:(1)液—液萃取:利用待分离组分在两种不互溶的溶剂中的溶解性不同,使待分离组分从溶解度较小的溶剂中转移到溶解度较大的溶剂中。
(2)固—液萃取:用溶剂从固体物质中溶解出待分离组分。
2.萃取剂(1)选择原则①与原溶剂互不相溶;②与溶质、原溶剂均不反应;③溶质在萃取剂中的溶解度远大于原溶剂。
(2)常用萃取剂乙醚(C2H5OC2H5)、乙酸乙酯、二氯甲烷等3.分液:将萃取后的两层液体(互不相溶、密度也不同的两种液体)分离开的操作方法。
4.主要仪器:分液漏斗5.实验装置与注意事项①分液漏斗使用之前必须检漏(在分液漏斗中注入少量的水,塞上玻璃塞,倒置,看是否漏水,若不漏水,正立分液漏斗后将玻璃塞旋转180°,再倒置看是否漏水)。
②使用时需将漏斗上口的玻璃塞打开,或使玻璃塞上的凹槽对准分液漏斗上的小孔。
③漏斗下端管口紧靠烧怀内壁,分液时下层液体从下口流出,上层液体从上口倒出。
四、重结晶1.重结晶原理:利用被提纯物质与杂质在同一溶剂中的溶解度不同而将杂质除去。
2.适用对象:固体有机化合物3.溶剂选择:要求杂质在此溶剂中溶解度很小或溶解度很大,易于除去;被提纯的有机化合物在此溶剂中的溶解度受温度的影响较大,能够进行冷却结晶。

高中化学必修——有机化学篇有机化学是化学学科中的重要分支之一,是研究有机物的结构、性质、合成以及它们与生命、环境等的关系的学科。
对于高中化学学生而言,有机化学是必修内容之一,了解和掌握有机化学基础知识对于学生们未来的学习和科研有着重要的作用。
I. 有机化学的基本概念在学习有机化学之前,首先需要了解化学中的一些基本概念,如化合物、分子、元素等。
有机物是由碳、氢、氧、氮、硫等元素组成的化合物,其中碳元素具有独特的性质,可以形成四个共价键,极大地扩展了有机物的种类和数量。
有机物的分子结构复杂多样,一个有机分子可以由许多不同的原子组成,形成不同的结构和化学性质,因此有机化学也是化学中最为复杂和多样化的领域之一。
II. 有机反应机理有机化学的学习主要包括有机化学反应机制、有机化学反应分类和应用等方面。
有机化学反应机制是指反应物与试剂之间的反应过程和反应中间体的构成,通常通过求解反应速率和反应物比例的变化来推测反应机理。
有机化学反应分类主要包括酸碱反应、加成反应、消除反应、取代反应等。
每种类型的反应都有其特点和应用,例如酸碱反应在化学工业生产中应用广泛,取代反应是构建复杂有机分子的基础。
III. 有机化学的应用随着科技的进步和工业的发展,有机化学在生产、生物、医学等领域的应用越来越广泛。
例如,乙二醇是一种有机化合物,在涂料、塑料、纺织品等工业制品中应用广泛;生物医学领域中许多药物也是有机化合物,如阿司匹林、头孢等。
此外,许多化妆品也是由有机化合物所组成。
总之,有机化学是一门广泛且重要的学科,它不仅代表着化学学科的一个分支,更与人们的日常生活有着密切的联系,如食品、药品、化妆品等。
高中化学学生应该认真学习有机化学的基础知识,以便将来更好地掌握和应用有机化学知识。
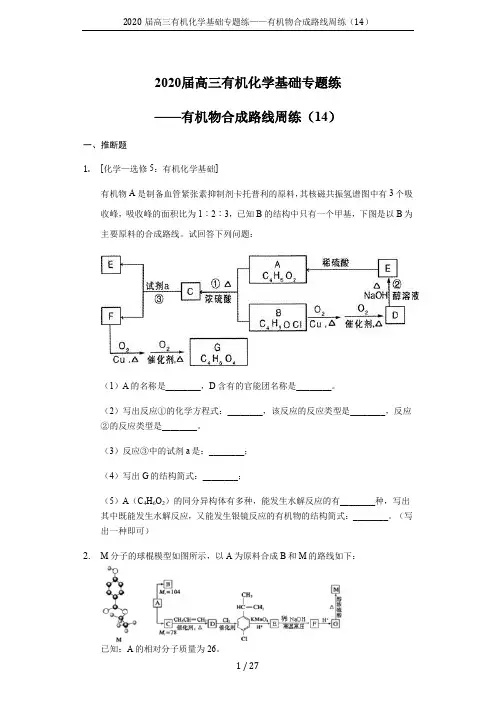
2020届高三有机化学基础专题练——有机物合成路线周练(14)2020届高三有机化学基础专题练——有机物合成路线周练(14)一、推断题1.[化学—选修5:有机化学基础]有机物A是制备血管紧张素抑制剂卡托普利的原料,其核磁共振氢谱图中有3个吸收峰,吸收峰的面积比为1︰2︰3,已知B的结构中只有一个甲基,下图是以B为主要原料的合成路线。
试回答下列问题:(1)A的名称是________,D含有的官能团名称是________。
(2)写出反应①的化学方程式:________,该反应的反应类型是________,反应②的反应类型是________。
(3)反应③中的试剂a是:________;(4)写出G的结构简式:________;(5)A(C4H6O2)的同分异构体有多种,能发生水解反应的有________种,写出其中既能发生水解反应,又能发生银镜反应的有机物的结构简式:________。
(写出一种即可)2.M分子的球棍模型如图所示,以A为原料合成B和M的路线如下:已知:A的相对分子质量为26。
1 / 27(1)A的名称为______ ,M的分子式为______ 。
(2)环状烃B的核磁共振氢谱中只有一种峰,其能使溴的四氯化碳溶液褪色,则B的结构简式为______ 。
(3)将1mol E完全转化为F时,需要______ molNaOH。
(4)G中的含氧官能团的名称是______ ,写出由G反应生成高分子的化学反应方程式:______ 。
(5)M的同分异构体有多种,则符合以下条件的同分异构体共有______ 种。
①能发生银镜反应②含有苯环且苯环上一氯取代物有两种③遇FeCl3溶液不显紫色④1mol该有机物与足量钠反应生成1mol氢气(一个碳原子上同时连接两个-OH不稳定)其中有一些经催化氧化可得三元醛,写出其中一种的结构简式______ 。
3.具有抗菌作用的白头翁素衍生物H的合成路线如图所示:已知:i.RCH2Br R-HC=CH-R'ii.iii.(以上R、R′、R″代表氢、烷基或芳基等)(1)A属于芳香烃,其名称是______。

有机化学实验步骤流程图下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!以下是一个简单的有机化学实验步骤流程图的示例,以苯甲酸的制备为例:实验名称:苯甲酸的制备一、实验目的1. 学习苯甲酸的制备方法。
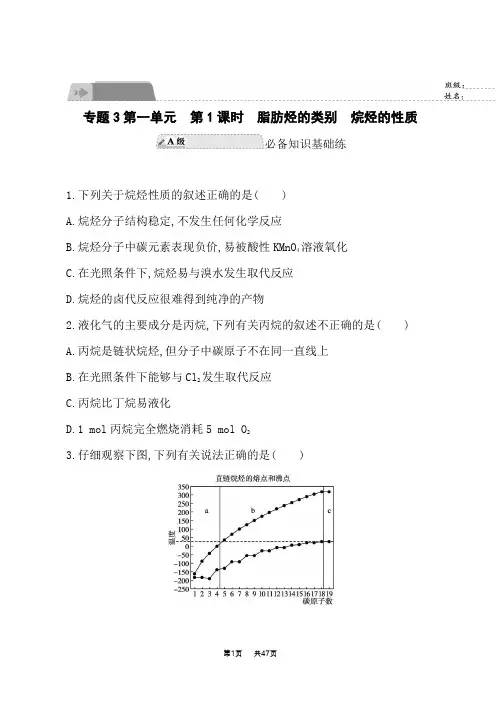
专题3第一单元第1课时脂肪烃的类别烷烃的性质必备知识基础练1.下列关于烷烃性质的叙述正确的是( )A.烷烃分子结构稳定,不发生任何化学反应B.烷烃分子中碳元素表现负价,易被酸性KMnO4溶液氧化C.在光照条件下,烷烃易与溴水发生取代反应D.烷烃的卤代反应很难得到纯净的产物2.液化气的主要成分是丙烷,下列有关丙烷的叙述不正确的是( )A.丙烷是链状烷烃,但分子中碳原子不在同一直线上B.在光照条件下能够与Cl2发生取代反应C.丙烷比丁烷易液化D.1 mol丙烷完全燃烧消耗5 mol O23.仔细观察下图,下列有关说法正确的是( )A.图中a区的直链烷烃在常温下呈液态B.直链烷烃的熔点随分子中碳原子数的增加一定逐渐升高C.碳原子数相同的不同烷烃,其沸点都相同D.汽油的化学成分为C5~C12的碳氢化合物,分馏石油时,收集汽油的温度应控制在20 ℃~200 ℃4.[江苏无锡梅村高级中学月考]1 mol某烷烃在氧气中充分燃烧,需要消耗氧气246.4 L(标准状况下)。
它在光照条件下与氯气反应能生成4种不同的一氯代物。
该烃是( )A.2,2-二甲基戊烷B.3-甲基己烷C.3-甲基戊烷D.3,3-二甲基戊烷5.[江苏无锡三中期中]烷烃广泛存在于自然界中,例如苹果表面的蜡状物质、蚂蚁分泌的信息素、石蜡和凡士林等物质中都含有烷烃。
(1)写出下列各烷烃的分子式。
①在同温同压下,烷烃A蒸气的密度是H2的43倍: 。
②0.1 mol烷烃B完全燃烧,消耗标准状况下11.2 LO2: 。
(2)烷烃分子可看成由—CH3、—CH2—、和等结构组成的。
如果某链状烷烃分子中同时存在这4种基团,所含碳原子数又最少,这种烃分子应含个碳原子,其结构简式可能为。
(3)把下列物质的沸点按由高到低的顺序排列为(填序号)。
①CH3(CH2)3CH3②(CH3)4C ③2,3,4-三甲基戊烷④(CH3)2C(CH2)2CH3(4)用系统命名法命名下面的烷烃A: ;A的一氯代物有种。

2022届高三化学一轮实验专题题型必练—28常见有机物的实验制备流程题学校:___________姓名:___________班级:___________考号:___________一、单选题(共14题)1.下列关于实验安全的说法中,不正确...的是A.点燃乙炔前,对气体进行验纯B.制备乙酸乙酯时,将浓硫酸沿试管壁缓缓加入乙醇中C.蒸馏时,向蒸馏烧瓶中加入少量碎瓷片D.将少量钠保存在乙醇中,置于阴凉处2.1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125 ℃,反应装置如图,下列对该实验的描述错误的是A.不能用水浴加热B.长玻璃管起冷凝回流作用C.提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤D.图中装置不能较好的控制温度为115~125 ℃3.实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。
下列说法不正确的是()A.水浴加热的优点为使反应物受热均匀、容易控制温度B.将浓硫酸、浓硝酸和苯混合时,应向浓硝酸中加入加入浓硫酸,待冷却至室温后,将所得混合物加入苯中C.实验过程中发现仪器b中未加入碎瓷片,可冷却后补加D.反应完全后,可用仪器a、b蒸馏得到产品4.乙酸乙酯广泛用于药物、染料、香料等工业,某学习小组设计以下两套装置用乙醇、乙酸和浓硫酸分别制备乙酸乙酯(沸点77.2℃)。
下列说法不正确...的是A.浓硫酸能加快酯化反应速率B.不断蒸出酯,会降低其产率C.装置b比装置a原料损失的少D.可用分液的方法分离出乙酸乙酯5.下列实验或操作不能达到目的的是( (A.制取溴苯:将铁屑、溴水、苯混合加热B.用NaOH 溶液除去溴苯中的溴C.鉴别己烯和苯:向己烯和苯中分别滴入酸性KMnO4溶液,振荡,观察是否褪色D.除去甲烷中含有的乙烯:将混合气体通入溴水中6.已知:,利用下图装置用正丁醇合成正丁醛。
相关数据如下:下列说法中,正确的是A.向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇B.当温度计1示数为90~95℃,温度计2示数在117.2℃左右时,收集产物C.反应结束,将馏出物倒入分液漏斗中以分去水层,粗正丁醛从分液漏斗上口倒出D.为加快反应,应将酸化的Na2Cr2O7溶液一次性全部加入正丁醇中7.硝基苯是一种重要有机合成中间体,实验室可用如下反应制备:C6H6 + HNO3C6H5—NO2 + H2O ΔH < 0。

常见有机物的制备实验流程注意事项:1.答题前填写好自己的姓名、班级、考号等信息2.请将答案正确填写在答题卡上第I卷(选择题)一、单选题(共15题)1.一种天然气臭味添加剂的绿色合成方法为:CH3CH2CH=CH2+H2S CH3CH2CH2CH2SH。
下列反应的原子利用率与上述反应相近的是A.乙烯与水反应制备乙醇B.苯和硝酸反应制备硝基苯C.乙酸与乙醇反应制备乙酸乙酯D.甲烷与Cl2反应制备一氯甲烷2.下列实验或操作不能达到目的的是()A.制取溴苯:将铁屑、溴水、苯混合加热B.用 NaOH 溶液除去溴苯中的溴C.鉴别己烯和苯:向己烯和苯中分别滴入酸性 KMnO4溶液,振荡,观察是否褪色D.除去甲烷中含有的乙烯:将混合气体通入溴水中3.下列实验方案合理的是()A.可用酸性高锰酸钾溶液除去甲烷中混有的杂质乙烯B.可用溴水鉴别己烯、己烷和四氯化碳C.制备氯乙烷:将乙烷和氯气的混合气放在光照条件下反应D.证明溴乙烷与NaOH醇溶液共热生成了乙烯:用如图所示的实验装置4.实验室用乙酸、乙醇、浓H2SO4制取乙酸乙酯,加热蒸馏后,在饱和Na2CO3溶液的液面上得到无色油状液体,当振荡混合时,有气泡产生,原因是( )。
A.产品中有被蒸馏出的H2SO4B.有部分未反应的乙醇被蒸馏出来C.有部分未反应的乙酸被蒸馏出来D.有部分乙醇跟浓H2SO4作用生成乙烯5.实验室制备硝基苯的反应装置如图所示,关于实验操作或叙述错误的是( )A.三颈烧瓶中的混合液的滴加顺序是苯、浓硝酸、浓硫酸B.恒压滴液漏斗有利于液体顺利滴入三颈烧瓶中C.加热装置可换成水浴加热D.反应结束后三颈烧瓶中下层液体呈油状6.实验室可用乙醇制备溴乙烷:CH3CH2OH+HBr CH3CH2Br+H2O,但通常采用溴化钠和浓硫酸与乙醇共热的方法。
下面是某同学对该实验的猜想,你认为可能错误的是()A.制备过程中可能看到有气泡产生B.可以将适量的NaBr、H2SO4(浓)、CH3CH2OH三种药品置入一种容器中加热制备CH3CH2Br C.如在夏天做制备CH3CH2Br的实验,实际收集到的产物可能较少D.为了除去CH3CH2Br中混有的HBr,可用热的NaOH溶液洗涤7.实验室用如图所示装置制取少量溴苯(已知该反应为放热反应),下列说法不正确的是()A.加入烧瓶a中试剂是苯、液溴和铁屑B.导管b的作用是导气和冷凝回流C.锥形瓶内可以观察到白雾,这是因为生成的HBr结合空气中的水蒸气D.实验结束后,向d中滴入AgNO3溶液若有淡黄色沉淀生成,则可以证明苯和液溴发生了取代反应8.工业上常用水蒸气蒸馏的方法(蒸馏装置如图)从植物组织中获取挥发性成分。

化学工艺流程综合题1.磷精矿湿法制备磷酸的一种工艺流程如下:已知:磷精矿主要成分为Ca5(PO4)3(OH),还含有Ca5(PO4)3F和有机碳等。
溶解度:Ca5(PO4)3(OH)<CaSO4·0.5H2O(1)上述流程中能加快反应速率的措施有__________。
(2)磷精矿粉酸浸时发生反应:2Ca5(PO4)3(OH)+3H2O+10H2SO4△10CaSO4·0.5H2O+6H3PO4①该反应体现出酸性关系:H3PO4__________H2SO4(填“>”或“<”)。
②结合元素周期律解释①中结论:P和S电子层数相同,__________。
(3)酸浸时,磷精矿中Ca5(PO4)3F所含氟转化为HF,并进一步转化为SiF4除去。
写出生成HF的化学方程式:__________。
(4)H2O2将粗磷酸中的有机碳氧化为CO2脱除,同时自身也会发生分解。
相同投料比、相同反应时间,不同温度下的有机碳脱除率如图所示。
80℃后脱除率变化的原因:____________________。
(5)脱硫时,CaCO3稍过量,充分反应后仍有2SO 残留,原因是4__________;加入BaCO3可进一步提高硫的脱除率,其离子方程式是____________________。
(6)取a g所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用b mol·L−1NaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液c mL。
精制磷酸中H3PO4的质量分数是________。
(已知:H3PO4摩尔质量为98 g·mol−1)2. 以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:已知:①Cl 2+2OH−ClO−+Cl−+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。

有机化学要义精讲:有机反应历程1.有机反应类型(1)加成反应亲电加成C=C,C≡C;亲核加成C=O,C≡C,C≡N;带有吸电子基团的加成C=C,如C=C-C=O,C=C-C≡N;自由基加成C=C。
(2)取代反应取代反应有三种:亲电取代,重要的是芳环上H 被取代;亲核取代,经常是非H原子被取代;自由基取代,重要的是α取代。
(3)消除反应主要是1,2-消除生成烯,也有1,1-消除生成碳烯。
(4)重排反应常见的是碳正离子重排或其它缺电子的中间体重排。
(5)周环反应包括电环化反应、环加成反应及σ迁移反应。
2.反应活性中间体主要活性中间体有其它活性中间体有碳烯R2C∶(卡宾Carbene)氮烯RN∶(乃春Nitrene);苯炔(Benzyne)。
(1)自由基自由基的相对稳定性可以从C—H键离解能大小判别,键离解能越大,自由基稳定性越小。
如按稳定性次序排列R3C·>R2CH·>RCH2·>CH3·C—H键离解能:380.7 395.4 410.0 435.1(kJ/mol)C6H5CH2·≈CH2=CH-CH2·>R3C·C—H键离解能:355.6 355.5(kJ/mol)Ph3C·>Ph2CH·>PhCH2·Ph3C·为涡轮形,具有约30°夹角,因此稳定性不会比Ph2CH·高得很多,且易发生二聚形成酿式结构。
(2)碳正离子含有带正电荷的三价碳原子的化合物叫碳正离子,它具有6个价电子,一般情况下是sp2杂化,平面构型,其稳定性次序为:任何使正电荷离域的条件都能稳定碳正离子。
孤电子对能分散正电荷故MeOCH2Cl溶解反应比CH3Cl快1014倍。
邻基效应生成桥式碳正离子芳香化稳定碳正离子,(3)碳负离子碳负离子是碳原子上带有负电荷的体系,其结构大多是角锥形sp3杂化构型,此构型使孤电子对和三对成键电子之间相斥作用最小。
有机专题五——有机反应类型1.取代反应(1)定义:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。
(2)能发生取代反应的物质:烷烃、芳香烃、醇、酚、酯、羧酸、卤代烃。
(3)典型反应2.加成反应(1)定义:有机物分子里不饱和的碳原子跟其他原子或原子团直接结合生成别的物质。
(2)能发生加成反应的物质:烯烃、炔烃、苯及同系物、芳香烃、醛、酮、单糖、不饱和高级脂肪酸的甘油脂及不饱和烃的衍生物等。
(3)典型反应3.加聚反应(1)定义:通过加成聚合反应形成高分子化合物。
(2)特征:①是含C=C双键或叁键物质的性质。
②生成物只有高分子化合物,因此其组成与单体相同。
(3)能发生加聚反应的物质:烯、二烯、含C=C的其他类物质。
(4)典型反应4.缩聚反应*(1)定义:通过缩合反应生成高分子化合物,同时还生成小分子(如H2O、NH3等)的反应。
(2)特征:有小分子生成,因此高分子化合物的组成与单体不同。
(3)能发生缩聚反应的物质①苯酚与甲醛②二元醇与二元酸③羟基羧酸④氨基酸⑤葡萄糖(4)典型反应5.加聚反应与缩聚反应的区别(1)加聚反应与缩聚反应,虽是合成高分子化合物的两大反应,但区别很大。
(2)加聚反应是由不饱和的单体聚合成高分子的反应,其产物只有—种高分子化合物。
(3)参加缩聚反应的单体一般含有两种或两种以上能相互作用的官能团(两个或两个以上易断裂的共价键)的化合物,产物中除一种高分子化合物外,还生成有小分子。
如H2O、HCl、NH3等。
产物的组成与参加反应的任何一种单体均不相同。
(4)从反应机理上看,加聚反应是不饱和分子中的双键或叁键发生的,实质还是加成反应。
所以,双键、叁键是发生加聚反应的内因。
缩聚反应是通过单体中的官能团相互作用经缩合生成小分子,同时又聚合成大分子的双线反应。
发生缩聚反应的内因是相互能作用的官能团(或较活动的原子)。
(5)发生加聚反应的单体不一定是一种物质,也可以是两种或两种以上。
2020届高三有机化学基础专题练——有机物合成路线周练 (10)一、简答题(本大题共12小题)1.有机物F是一种香料,其合成路线如图所示:已知:i.ii.(1)A的名称为______,试剂X的结构简式为______,步骤Ⅵ的反应类型为______。
(2)步骤Ⅰ的反应试剂和条件分别为______、______。
(3)步骤Ⅱ反应的化学方程式为______。
(4)满足下列条件的E的同分异构体有______种,其中核磁共振氢谱峰面积比为6:2:2:1:1的分子的结构简式为______。
①苯环上只有两个取代基②能与FeCl3溶液发生显色反应③能发生水解反应和银镜反应(5)依据题中信息,完成以为原料制取的合成路线图。
合成路线图示例如下:CH2=CH2CH3CH2Br CH3CHOH。
2.按要求回答下列问题:(1)取3.0g有机物X,完全燃烧后生成3.6g水和3.36L CO2(标准状况),已知该有机物的蒸气对氢气的相对密度为30,求该有机物的分子式:______。
X的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是______(填标号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪(2)中的含氧官能团名称是______。
(3)分子式为C6H12的某烃的所有碳原子都在同一平面上,则该烃的结构简式为:______,若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为______。
(4)肉桂酸苯甲酯G是一种香料,主要用于配制人造龙涎香,也可作皂用、化妆用及食用香精的调香原料。
如图是用乙烯和甲苯为原料合成肉桂酸苯甲酯的路线图。
已知:RCHO+CH3COOR'RCH=CHCOOR'。
回答下列问题:①A的结构简式是______,F的分子式是______。
②C生成D的化学方程式是______。
③D生成E的反应类型是______。
④含有苯环,与D互为同分异构体的有机物有______种(不考虑立体异构),其中不能与Na反应的结构简式是______。
高中化学有机合成教案及课后题一、教案概述本教案主要针对高中化学有机合成部分进行讲解,通过深入浅出的教学方法,使学生掌握有机合成的基本概念、原理和方法,提高他们的分析和解决问题的能力。
本教案共十个章节,本节课为前五个章节。
二、教学目标1. 了解有机合成的基本概念和意义;2. 掌握有机合成原理,包括加成反应、消除反应、取代反应等;3. 学会有机合成的方法和技巧,如选择合适的原子或基团、设计合成路径等;4. 能够分析有机合成反应的产物和产率;5. 培养学生的实验操作能力和团队协作精神。
三、教学内容1. 有机合成的基本概念和意义;2. 有机合成原理:加成反应、消除反应、取代反应;3. 有机合成的方法和技巧:选择合适的原子或基团、设计合成路径;4. 有机合成反应的产物和产率分析;5. 实验操作和团队协作能力的培养。
四、教学方法1. 讲授法:讲解有机合成的基本概念、原理和方法;2. 案例分析法:分析具体有机合成反应实例;3. 实验操作法:进行有机合成实验,培养学生的实验操作能力;4. 小组讨论法:分组讨论有机合成问题,培养团队协作精神。
五、教学步骤1. 引入:通过生活实例或化学故事引入有机合成主题,激发学生兴趣;2. 讲解:讲解有机合成的基本概念、原理和方法,引导学生理解并掌握;3. 案例分析:分析具体有机合成反应实例,让学生学会分析问题和解决问题;4. 实验操作:进行有机合成实验,让学生动手操作,培养实验能力;5. 小组讨论:分组讨论有机合成问题,培养团队协作精神;6. 总结:对本节课内容进行总结,强调重点和难点;7. 课后作业:布置相关课后作业,巩固所学知识。
六、课后题1. 简述有机合成的基本概念和意义;2. 列举三种有机合成原理,并简要说明其特点;3. 描述一种有机合成方法,并给出一个实例;4. 分析有机合成反应的产物和产率;5. 谈谈你在实验操作中遇到的困难和解决方法。
六、教案概述本节课将继续深入探讨有机合成的相关内容,重点关注有机合成反应的条件和机理,以及如何优化合成路径。
1
高三化学午间练习
2013.12.26
1.(15分)多昔芬主要用于防治骨质疏松等病症,其合成路线如下:
AlCl
3
H3O
+
A
B
C
D
E
F
G
H
SOCl
2
CH2COOH
I
CH2COCl
CH2C
O
I
C2H5Br
C2H5ONa
CHC
O
I
C2H
5
BrOCH2CH2BrBr
OCH2CH2N
Mg
乙醚
MgBr
OCH2CH2N
CHCH5C
2
OCH2CH
2
N
OH
I
CCH5C
2
OCH2CH
2
N
I
HCl/C2H5OH
H2O/
X
多昔芬
说明:D+G→H的转化中分别发生了加成反应和水解反应。
(1)D中含氧官能团的名称是 。
(2)C→D的反应类型是 ,H→多昔芬的反应类型是 。
(3)E→F转化中另一产物是HBr,则试剂X的结构简式是 。
(4)H分子中有 个手性碳原子。
(5)写出同时满足下列条件的A物质同分异构体的结构简式 。
①能发生银镜反应;②与FeCl3发生显色反应;③苯环上的一溴代物只有2种。
(6)苯甲酰氯(COCl)是合成药品的重要中间体。请写出以苯、乙醚、甲醛为原料制备
苯甲酰氯的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
CH2=CH2 CH3CH2Br CH3CH2OH
HBr NaOH溶液
△
2
2.(15分)盐酸阿立必利是一种强效止吐药。它的合成路线如下:
CH
3
NHCOCH
3
Br
ACOOHNHCOCH3BrCOOHNHCOCH3OCH3COOCH3NH2OCH3KMnO4/H+Cu , CH3ONaCH3OHBCD
CH3COCl
COOCH3NHCOCH3OCH3E浓HNO3浓H2SO4/COOCH
3
NHCOCH
3
OCH
3
F
O2N
…
…
盐酸阿立必利
浓H2SO4 /
(1)有机物D中含有的官能团有酯基、 ▲ 、 ▲ (写名称)。
(2)由E生成F的反应类型为 ▲ 。
(3)下列C D的有关说法正确的是 ▲ 。
a.使用过量的甲醇,可以提高D的产率
b.浓硫酸的吸水性可能会导致溶液变黑
c.甲醇既是反应物,又是溶剂
d.此反应中可能会生成一种化学式为C11H13NO4的副产物
(4)写出同时满足下列条件的D的一种同分异构体G的结构简式: ▲ 。
①属于α-氨基酸;
②能与FeCl3溶液发生显色反应;
③分子中有一个手性碳原子,有6种不同化学环境的氢。
(5)高聚物H由G通过肽键连接而成,H的结构简式是 ▲ 。
(6)写出由C生成D的化学方程式: ▲ 。
(7)已知:NO2FeHClNH2。请写出以、CH3CH2CH2COCl、
CH3OH
为原料制备 CH3COOCH3NHCOCH2CH2CH3的合成路线流程图(无机试剂任用)。
合成路线流程图示例如:
CH3CH2BrNaOH溶液H2CCH
2
HBr
CH3CH2OH
过量
3
3.(14分)物质F是合成多种手性药物和生物活性物质的重要中间体,其合成路线如下:
(C5H9NO2(C9H8O))
H
H
H
12
3
4
OCH
3
O
CH3NH
2
H3COOC
HN
CH
3
CHCHCHO
N
COOCH
3
H
2
Pd-C
N
COOCH
3
N
COOH
A
B
C
D
E
F
HCl
(1)反应①的类型为 ,反应④的类型为 。
(2)物质A聚合可得聚丙炔酸甲酯,其结构简式为 。
(3)物质C的俗名为肉桂醛,写出其同时满足下列条件的一种同分异构体的结构简
式 。
①能与氯化铁溶液显紫色;②苯环上有两个取代基;③分子的核磁共振氢谱有4个峰。
(4)若部分C被氧化为肉桂酸,反应②将产生副产物(分子式为C14H15NO3),写出其结构
简式 。
(5)已知:CH3CHO + HCHO NaOHH2CCHCHO,
以CHO、CH3CH2OH和CH3HNCH3COOC2H5为原料,合成NCOOC2H5CH3H,写出合成流程图
(无机试剂任用)。合成流程图示例如下:
CH2=CH2CH3CH2Br
NaOH溶液
△
CH3CH2OH
HBr
4
4.(15分)非索非那定(化合物H)是一种重要的抗过敏药,其部分合成路线如下:
(1)B→C的反应类型为____▲____,E分子中含氧官能团有____▲____(写名称)。
(2)D的结构简式为____▲____。
(3)F→G反应的化学方程式为____▲____。
(4)请写出一种同时满足下列条件的B的同分异构体的结构简式____▲____。
①苯环上有3个取代基;②具有α—氨基酸结构;③有6种不同化学环境的氢原子。
是一种重要的有机合成中间体,请完成以苯乙烯为主要原料(其他 (5)
试剂自选)合成该化合物的合成路线流程图。合成路线流程图示例如下:
H2C=CH2――→HBrCH3CH2Br――→NaOH溶液△CH3CH2OH
5
高三化学午间练习答案
1.(15分)
(1)羰基(2分) (2)取代反应(1分) 消去反应(1分
)
(3)NH (2分) (4)2 (2分
)
(5) (2分
)
(2分)
(6)Br2———→催化剂BrMg———→乙醚MgBrHCHO———→H3O+CH2OHKMnO4———→ COOHSOCl2———→COCl(5分
)
2.(15分)
(1)醚键、氨基(2分,各1分)
(2)取代反应(或其他合理答案)(1分)
(3)a、c、d (2分,答对一个或2各给1分,答对3个给2分,见错不给分)
(4)OHCCOOHNH2H3C(2分) (5)(2分)
(6)COOHOCH3NHCOCH3+2CH3OH浓 H2SO4COOCH3OCH3NH2+H2O+CH3COOCH3(2分)
(7)
CH
3
COOH
CH
3
COOH
NO
2
CH3COOHNH2CH3COOCH3NHCOCH2CH2CH3浓HNO3浓H2SO4 /FeHClCH3CH2CH2COClCH
3
COOCH
3
NH
2
CH3OH
浓H2SO4 /
3.(14分)
(1)加成 取代(水解)(各2分,共4分)
(2)HCCCOOCH3n(2分)
(3)C CCH3HO (2分)
6
(4)CHCHCNCHCHCOOCH3OCH3(2分)
(5)
CH
3
HN
CH
3
COOC2H
5
NCOOC2H5CH
3
CH3CH2OH
Cu
O
2
CH3CHO
CHO
CHCHCHO
H
2
NCOOC2H5CH
3
H
H
4.(15分)