第五章生物氧化与氧化磷酸化.pptx
- 格式:pptx
- 大小:1.16 MB
- 文档页数:90


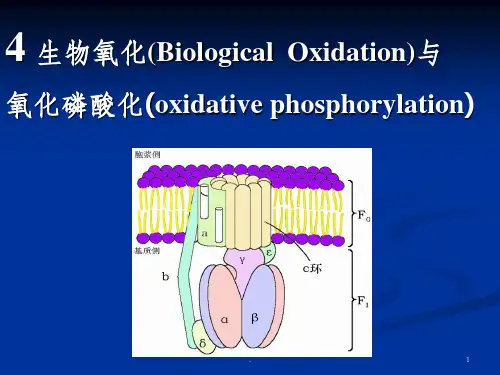
第五章生物氧化与氧化磷酸化第一节 生物氧化的特点及高能化合物生物氧化的实质是脱氢、失电子或与氧结合,消耗氧生成CO 2和H 2O ,与体外无机物的化学氧化〔如熄灭〕相反,释放总能量都相反。
生物氧化的特点是:作用条件平和,通常在常温、常压、近中性pH 及有水环境下停止;有酶、辅酶、电子传递体参与,在氧化恢复进程中逐渐放能;放出能量大多转换为ATP 分子中生动化学能,供生物体应用。
体外熄灭那么是在高温、枯燥条件下停止的猛烈游离基反响,能量迸发释放,并且释放的能量转为光、热流失于环境中。
〔一〕氧化恢来电势和自在能变化1.自在能生物氧化进程中发作的生化反响的能质变化与普通化学反响一样可用热力学上的自在能变化来描画。
自在能〔free energy 〕是指一集体系的总能量中,在恒温恒压条件下可以做功的那一局部能量,又称为Gibbs 自在能,用符号G 表示。
物质中的自在能〔G 〕含量是不易测定的,但化学反响的自在能变化〔ΔG 〕是可以测定的。
B A −→←ΔG =G B —G A当ΔG 为负值时,是放能反响,可以发生有用功,反响可自发停止;假定ΔG 为正值时,是吸能反响,为非自发反响,必需供应能量反响才可停止,其逆反响是自发的。
][][ln B A RT G G o +∆=∆假设ΔG =0时,说明反响体系处于静态平衡形状。
此时,平衡常数为K eq ,由的K eq 可求得ΔG °:ΔG °=-RT ln K eq2. 氧化恢来电势在氧化恢复反响中,失掉电子的物质称为恢复剂,失掉电子的物质称为氧化剂。
恢复剂失掉电子的倾向〔或氧化剂失掉电子的倾向〕的大小,那么称为氧化恢来电势。
将任何一对氧化恢复物质的氧化恢复对连在一同,都有氧化恢来电位的发生。
假设将氧化恢复物质与规范氢电极组成原电池,即可测出氧化恢来电势。
规范氧恢来电势用E°表示。
E°值愈大,取得电子的倾向愈大;E°愈小,失掉电子的倾向愈大。