排水法测定气体体积实验装置课件
- 格式:ppt
- 大小:140.00 KB
- 文档页数:4

丿/」、发生装置注意事项及优缺点、发生装置的选择依据发生装置注意事项及优缺点适用于固体+ 固体加热型制取气体①试管固定在铁架台上时,要注意试管口略向下倾斜,防止冷凝水倒流,炸裂试管;②铁夹应夹在试管中上部(距试管口约1/3处),防止试管因受热不均匀而破裂。
③加热时要先给试管预热,然后在药品的部位集中加热,防止试管局部受热而炸裂。
④用排水法收集,刚开始有气泡的时候不能收集,要等到有大量气泡连续均匀的冒出时,才开始收集⑤用排水法收集时,收集完氧气后,应该先把导管移出水槽,再熄灭酒精灯。
否则水槽中的水倒流到试管中,使试管炸裂。
同上,此外①用高锰酸钾制取氧气时,应在试管口放一团棉花,目的是防止高锰酸钾粉末进入导管。
②导管稍微伸出橡皮塞一点即可,便于气体排出;③加热时用酒精灯外焰加热。
适用于固+液不加热型制取气体注意:导管稍微伸出橡皮塞一点即可,便于气体排出缺点:不便于添加液体药品注意:①长颈漏斗下端应插入液面以下,目的是防止气体从长颈漏斗中逸出。
(固体放有孔塑料板上)②导管稍微伸出橡皮塞一点即可,便于气体排出。
优点:①可以随时添加液体药品;②控制反应速率;③可以控制反应的随时发生和停止;(当需要反应发生时打开弹簧夹b,不需要时关闭弹簧夹b)、收集装置的选择依据收集装置气体性质举例优缺点适用于固+液不加热C注意:①长颈漏斗下端应插入液面以下,目的是防止气体从长颈漏斗中逸出。
②导管稍微伸出橡皮塞一点即可,便于气体排出。
优点:可以随时添加液体药品排水集气法不易溶于水或难溶于水,且不与水反应。
氧气(Q)氢气(H2))甲烷(CH4)、一氧化碳(CO)等收集气体较纯,够干燥但含有水蒸气不瓶D 注意:①导管稍微伸出橡皮塞一点即可,便于气体排出。
②分液漏斗与长颈漏斗有区别有一个活塞,分液漏斗下端不需要插到液面以下优点:①控制反应速率②可以控制反应的随时发生和停止。
③可以随时添加液体药品密度比空气大,不与空气反应氧气(0)二氧化碳(CQ)等纯度不高,但气体较干燥向下排空气法密度比空气小,不与空气反应。


解读高考化学实验之二——实验装置中学化学的实验装置大部分与气体有关。
常见装置(组件)按其用途分大体有供气装置、安全装置、气体净化装置、气体性质验证反应或其它反应装置、收集装置、量气装置、尾气处理装置等。
一、供气装置。
常见的气体供给形式有反应制气、贮气释放和鼓入空气等形式。
且实验时,气体的流向通常是从左到右,所以供气装置一般在最左端。
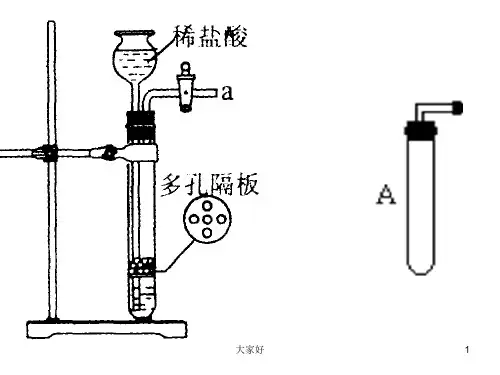
(1)反应制气供给气体——发生装置根据制气反应的反应物状态和反应要否加热,基本的气体发生装置有三类:①固体加热类如图1-1-1;②固-液(或液-液)加热类如图1-1-2;③固-液(或液-液)常温类如图1-1-3。
图1-1-4装置是图1-1-3装置的变形,分液漏斗用长颈漏斗替代,当广口瓶中不能形成液层时(如电石与水反应,需缓慢加水,控制反应速率)加小试管,加液时试管中首先充满液体,起“液封”作用,防止气体从漏斗逸出。
图1-1-5是启普发生器,启普发生器属于固-液常温类发生装置。
它的优点是能随时控制反应的发生或停止,使用的范围除了“固液、常温”外,还有附加条件如固体必须是块状且不易溶于水,生成的气体溶解度不大,反应放热不能过快,生成物要易溶。
根据启普发生器原理可自行设计图1-1-6装置。
(2)贮气释放供给气体——贮气装置若实验所需气体事先制备好,存于贮气装置中,在实验时用适当的方法使气体按一定的流速释放出来。
贮气装置的形式有多种,图1-2-1是实验室常用的贮气瓶,贮气时相当于用排水法收集气体于集气瓶中,使用时由漏斗进水把气体压出。
图1-2-2所示贮气装置原理与图1-2-1相当,优点是贮气量大,使用时只要打开活塞,利用“钟罩”自重下压,气体可自动流出。
(3)鼓入空气供给气体——鼓气装置图1-3-1中左边是用于鼓气的橡皮囊,广口瓶起缓冲气流的作用。
实验中经常要求将装置内的空气排尽,即可用此装置。
针对某种实验目的,通过对常用仪器的改进或组装,完成合乎题意的创新设计。
这类问题需要认真分析领会实验要求,特别要理解原型装置的原理,然后才能做到新仪器的替代或新装置的“创意”。

排水法收集气体的原理
首先,我们需要准备一个装有水的水槽或水槽,水的高度要能够覆盖气体收集
容器的出口,并且要保证水槽中没有气泡。
接下来,将气体收集容器倒置放入水中,确保容器口完全浸没在水中,这样就可以避免气体外泄。
然后,我们需要将产生气体的实验装置连接到气体收集容器上,当产生气体时,气体会逐渐充满容器,而水则会逐渐被排出。
当容器充满气体后,可以将容器轻轻拿出水槽,然后将容器口用玻璃板或塑料薄膜盖住,这样就可以将气体固定在容器中了。
排水法收集气体的原理就是利用了气体的相对密度差异,轻的气体会浮在水面上,而重的气体则会被水排除。
通过这种方法,我们可以很方便地收集各种气体,并且可以对气体进行进一步的实验操作。
需要注意的是,在进行排水法收集气体时,要确保实验装置的气体产生速度适中,以免产生气体速度过快而导致水被冲出容器。
另外,也要注意容器口的密封性,避免气体外泄或者水进入容器中影响实验结果。
总的来说,排水法是一种简单而有效的气体收集方法,它利用了气体的相对密
度差异,通过排水的方式将气体收集到指定的容器中。
在实验操作中,我们需要注意实验装置的气体产生速度和容器口的密封性,以确保实验的准确性和安全性。
希望通过本文的介绍,大家对排水法收集气体的原理有了更深入的了解。


![一种排水法测量气体流量的装置及方法[发明专利]](https://uimg.taocdn.com/7a58657e814d2b160b4e767f5acfa1c7aa0082c3.webp)
专利名称:一种排水法测量气体流量的装置及方法专利类型:发明专利
发明人:黄沣斌,柳迪,沈嘉城,徐秦,陈啸
申请号:CN202210254879.7
申请日:20220315
公开号:CN114563049A
公开日:
20220531
专利内容由知识产权出版社提供
摘要:本发明公开了一种排水法测量气体流量的装置及方法,本方法利用不溶于水的气体通过第二阀门的开合程度控制进气量,通气一段时间后测量排出水的体积,计算得到该气体的流量,当气体流量值达到预设值时,使外部气源和用气体装置连通,将相应流量的气体输送给用气装置,达到即测即用的功能;本发明所述装置不仅具有排水法测量准确的优点,同时还克服了排水法无法同时兼具气体流量的测量、控制和即测即用的弊端。
申请人:河海大学
地址:210000 江苏省南京市江宁区佛城西路8号
国籍:CN
代理机构:南京千语知识产权代理事务所(普通合伙)
代理人:祁文彦
更多信息请下载全文后查看。


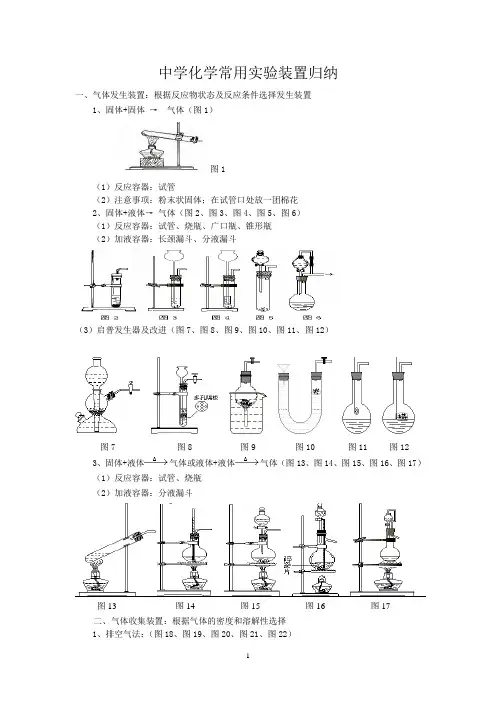
中学化学常用实验装置归纳一、气体发生装置:根据反应物状态及反应条件选择发生装置1、固体+固体→气体(图1)图1(1)反应容器:试管(2)注意事项:粉末状固体;在试管口处放一团棉花2、固体+液体→气体(图2、图3、图4、图5、图6)(1)反应容器:试管、烧瓶、广口瓶、锥形瓶(2)加液容器:长颈漏斗、分液漏斗(3)启普发生器及改进(图7、图8、图9、图10、图11、图12)图7 图8 图9 图10 图11 图123、固体+液体气体或液体+液体气体(图13、图14、图15、图16、图17)(1)反应容器:试管、烧瓶(2)加液容器:分液漏斗图13 图14 图15 图16 图17二、气体收集装置:根据气体的密度和溶解性选择1、排空气法:(图18、图19、图20、图21、图22)2、排水法图(图24、图25) (3)贮气瓶(图26)三、尾气处理装置:根据多余气体的性质选择 1、在水中溶解性不大的气体(图27)燃烧或袋装法 (图28、图29)3、在水中溶解性很大的气体:防倒吸(图30-图38)四、气体净化装置:根据净化剂的状态和条件选择(图39、图40、图41、图42)五、气体性质实验装置:根据反应物的状态及反应的条件选择 1、常温反应装置(图43、图44)图18 图19 图20 图21 图22 图23图24 图25图26图27 图28图29图30 图31 图32 图33 图34 图35 图36 图37 图38图39 图40 图41 图42图43图44 图45图46 图472、加热反应装置(图45、图46、图47)3、冷却装置(图48、图49、图50):图50六、排水量气装置:测量气体的体积(图51、图52、图53、图54)七、装置气密性检查:1、利用热源:用手捂或用酒精灯微热,看是否有气泡,移开热源,是否有一段水柱。
图55二、物质的分离与提纯方法方法适用范围主要仪器注意点实例固+液蒸发易溶固体与液体分开酒精灯、蒸发皿、玻璃棒①不断搅拌;②最后用余热加热;③液体不超过容积2/3NaCl(H2O)固+固结晶溶解度差别大的溶质分开NaCl(NaNO3) 升华能升华固体与不升华物分开酒精灯I2(NaCl)固+液过滤易溶物与难溶物分开漏斗、烧杯①一角、二低、三碰;②沉淀要洗涤;③定量实验要“无损”NaCl(CaCO3)液+液萃取溶质在互不相溶的溶剂里,溶解度的不同,把溶质分离出来分液漏斗①先查漏;②对萃取剂的要求;③使漏斗内外大气相通;④上层液体从上口倒出从溴水中提取Br2分液分离互不相溶液体分液漏斗乙酸乙酯与饱和Na2CO3溶液蒸馏分离沸点不同混合溶液蒸馏烧瓶、冷凝管、温度计、牛角管①温度计水银球位于支管处;②冷凝水从下口通入;③加碎瓷片乙醇和水、I2和CCl4 渗析分离胶体与混在其中的分子、离子半透膜更换蒸馏水淀粉与NaCl盐析 加入某些盐,使溶质的溶解度降低而析出烧杯用固体盐或浓溶液 蛋白质溶液、 硬脂酸钠和甘油气+气洗气 易溶气与难溶气分开洗气瓶长进短出 CO 2(HCl) 液化 沸点不同气分开U 形管常用冰水NO 2(N 2O 4)附:常见物质的分离和提纯装置:如图2方法 热分解法沉淀分离法酸碱分离法水解分离法氧化还原法实例NH 4Cl(NaCl) NaCl(BaCl 2)MgCl 2(AlCl 3) Mg 2+(Fe 3+)Fe 2+(Cu 2+)二、物质的鉴别物质的检验通常有鉴定、鉴别和推断三类,它们的共同点是:依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理。
排水法测气体体积的原理排水法是一种常用于测量气体体积的实验方法,其基本原理是根据气体体积的改变来推算出气体的体积。
以下将从实验步骤、原理和计算公式三个方面阐述排水法测量气体体积的原理。
一、实验步骤1.实验准备:准备好实验器材,包括一个容器(通常使用容积较大的圆底烧瓶或气球)、一根导管、一个容器(如盛水的波纹管或烧杯)、一个容器(容积已知的容器)和一台天平等。
2.密封容器:将要测量的气体充满容器,确保容器密封,使其不能有气体泄漏。
3.排水:将充满气体的容器倒置,将导管的一头插入放有水的容器中。
4.进行排水:打开容器的密封,让气体排出,并测量气体排出后的时间。
5.确定测量值:测量被排出气体的体积,并根据相应的计算公式计算出实际气体体积。
二、原理排水法测气体体积的原理基于压强差,即利用气体排出容器时,排放出的气体的压强差推动气体的排液。
根据波义耳定律(波伊尔定律),当气体的体积和温度保持不变时,气体的压强与气体的排出速度成正比。
在实验中,当气体从容器中排出时,气体的排放速度变化会引起水液面的高度变化。
根据气体排出的速度(时间)和水液面高度变化,可以推算出气体的体积。
三、计算公式根据排水法测气体体积的原理,可以得出如下计算公式:V2 = V1 - Ah其中,V2为气体的体积,V1为容器的体积,A为水液面的面积,h 为水液面的高度变化。
根据上述公式,通过测量水液面的高度变化和水液面的面积,可以得出气体的体积。
综上所述,排水法测气体体积的原理是通过压强差推动气体排液,并根据波义耳定律确定气体排放速度和气体体积之间的关系。
通过测量水液面的高度变化和水液面的面积,可以计算出气体的实际体积。
排水法是一种简单且实用的方法,广泛应用于实验室和工业领域中对气体体积的测量。