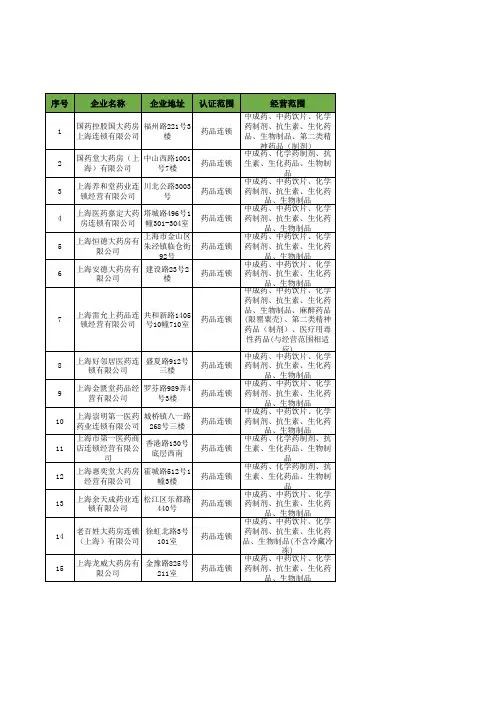
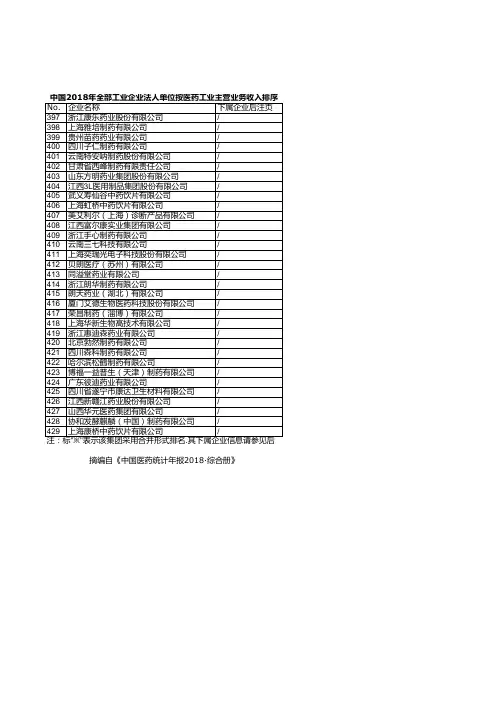
【优质数据】2018年上海市中成药工商企业名录黄页大全572家
- 格式:xls
- 大小:323.00 KB
- 文档页数:68
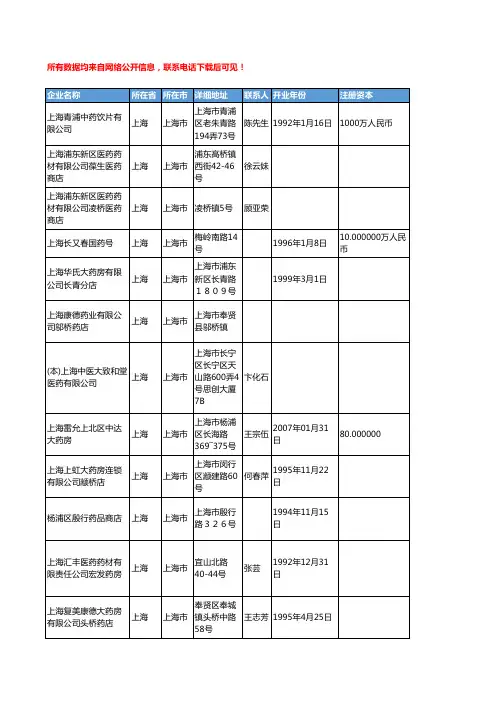

2018年度药品监管统计年报:全国零售药店门店数增⾄48.9万家5⽉9⽇,国家药监局发布了《2018年度药品监管统计年报》(《年报》),从⽣产和经营许可、注册审批、中药品种保护、投诉举报和案件查处五个⽅⾯,对2017年12⽉1⽇⾄2018年11⽉30⽇间的药品监管情况进⾏了统计。
《年报》显⽰,与2017年相⽐,药品、医疗器械、化妆品企业数量在2018年均有不同程度的增长。
其中,零售药店门店数量从2017年的45.4万家上升⾄48.9万家,同⽐增长7.7%。
药品⽣产许可⽅⾯,截⾄2018年11⽉底,全国共有原料药和制剂⽣产企业4441家。
药品经营许可⽅⾯,截⾄2018年11⽉底,全国共有《药品经营许可证》持证企业50.8万家,其中批发企业1.4万家;零售连锁企业5671家,零售连锁企业门店25.5万家;零售药店23.4万家。
药品注册审批⽅⾯,2018年,国家药监局共批准新药临床312件,批准新药⽣产的新药证书及批准⽂号25件,批准⽂号10件,批准按新药申请程序申报临床申请8件;批准仿制药临床申请58件,⽣产申请464件;批准进⼝药品临床申请154件,上市90件。
2018年,国家局共批准药品补充申请1862件。
全国各省(区、市)局共批准药品补充申请3276件,备案12648件。
中药品种保护⽅⾯,截⾄2018年11⽉底,共有中药保护品种证书192个,其中初次品种99个,同品种4个,延长保护期89个。
投诉举报情况,2018年各级监管机构共受理药品投诉举报6.4万件,⽴案3556件,结案4036件。
案件查处⽅⾯,2018年各级监管机构共查处药品案件9.8万件,取缔⽆证经营1037户,捣毁制假售假窝点148个,责令停产停业1093户,吊销许可证197件,移送司法机关2000件。


上海市药品监督管理局2018年第1期药品监督抽检质量公告文章属性•【制定机关】上海市药品监督管理局•【公布日期】2018.12.05•【字号】•【施行日期】2018.12.05•【效力等级】地方规范性文件•【时效性】现行有效•【主题分类】卫生监督,质量管理和监督正文上海市药品监督管理局2018年第1期药品监督抽检质量公告2018年第2号为了加强对药品和药包材的质量监督管理,规范市场秩序,保障上市药品和药包材产品质量安全,上海市药品监督管理局对本市药品和药包材生产、经营和使用单位实施了质量监督抽检,现将抽检不合格产品予以公告(见附表)。
对抽检不合格产品,上海市药品监督管理局已组织相关监管部门依法予以查处并采取控制措施,要求相关单位根据风险暂停销售使用、召回相关产品,并进行整改。
对抽检不合格产品及相应企业,上海市药品监督管理局将进一步加强跟踪检查和抽检力度,并要求企业所在地市场监管局加强日常监管,督促企业查清原因,制定并落实整改措施,消除风险隐患。
特此公告。
附表:1.药品监督抽检不合格情况(流通、使用环节抽检)2.药品监督抽检不合格情况(生产环节抽检)上海市药品监督管理局2018年12月5日小贴士:药品标准中的检查项包括反映药品的安全性与有效性的试验方法和限度、均一性与纯度等制备工艺要求等内容。
性状是指药品的物理特征或外观形状,性状不合格,可能会影响药品的质量和功效。
炮制是指中药材用烘、炮、炒、洗、泡、漂、蒸、煮等方法加工成饮片,目的是消除或减低药物的毒性,加强疗效,便于制剂和贮藏,使药物纯净。
水分系指药品中的含水量。
水分偏高通常受药品包装或储存环境影响,在储存和流通过程中引湿所导致。
含量测定是指用物理、化学或生物的方法,对供试品含有的有关成分进行检测。
浸出物测定指用水或其他适宜的溶剂对药材和饮片中可溶性物质进行的测定。
崩解时限是指固体制剂在规定的介质中,以规定的方法进行检查全部崩解溶散或成碎粒并通过筛网所需时间的限度。

上海市食品药品监督管理局关于对我市2018年第二批医疗器械临床试验监督抽查情况的通报文章属性•【制定机关】上海市食品药品监督管理局•【公布日期】2018.11.11•【字号】沪食药监械注〔2018〕225号•【施行日期】2018.11.11•【效力等级】地方规范性文件•【时效性】现行有效•【主题分类】医疗管理正文上海市食品药品监督管理局关于对我市2018年第二批医疗器械临床试验监督抽查情况的通报沪食药监械注〔2018〕225号上海市各药物临床试验机构、医疗器械生产企业及注册代理人:为贯彻《医疗器械监督管理条例》,进一步推进《医疗器械临床试验质量管理规范》的实施,加强我市医疗器械临床试验监督管理,提高我市临床研究水平,2018年9月我局发布了《2018年第二批医疗器械临床试验监督抽查项目的通告》,并于10月开展监督检查,重点检查医疗器械临床试验数据的真实性、完整性和规范性。
本次监督检查共出动26人次,涉及全市8家临床试验机构。
现场抽查项目6个,其中我市第二类在审注册项目1个、在我市通过临床试验方式获取临床试验数据的进口、境内第三类医疗器械过程项目5个,其中诊断试剂2个,创新产品1个。
现将有关检查情况和处理结果通报如下:一、检查情况通过现场检查发现临床试验存在以下合规性问题:(一)临床试验条件与合规性1、仪器使用记录未明确实际使用的仪器编号。
2、伦理委员会批件中未能明确对知情同意进行免除的审批内容。
(二)临床试验部分1、临床试验培训未体现试验方案的版本。
主要研究者发生变化,培训记录不全。
2、监查记录的内容未反馈。
监查报告中有关药物发放不规范问题,未告知药物管理人员。
3、临床试验病例报告表设计不合理,未设计研究者和检验人员签字栏。
(三)临床试验数据管理1、病例筛选不符合入组标准。
个别受试者年龄不符合入组标准。
2、研究病历中心磁图仪诊断报告的姓名与受试者鉴认代码表的姓名缩写不一致。
(四)受试产品的管理1、受试产品的《器械收登记录表》无产品状态描述。