第三章 官能团的导入、除去、互换及保护
- 格式:ppt
- 大小:5.36 MB
- 文档页数:106

有机合成中有机物官能团的引入消除和转化方法Document number【SA80SAB-SAA9SYT-SAATC-SA6UT-SA18】有机合成中有机物官能团的引入、消除和转化方法1.官能团的引入2.官能团的消去(1)通过加成反应消除不饱和键。
(2)通过消去反应、氧化反应或酯化反应消除羟基(—OH)。
(3)通过加成反应或氧化反应消除醛基(—CHO)。
(4)通过消去反应或水解反应消除卤素原子。
3.官能团的转化 (1)利用衍变关系引入官能团,如卤代烃水解取代伯醇(RCH 2OH)氧化还原醛――→氧化羧酸。
(2)通过不同的反应途径增加官能团的个数,如(3)通过不同的反应,改变官能团的位置,如有机合成中碳架的构建1.有机成环反应(1)有机成环:一种是通过加成反应、聚合反应来实现的;另一种是通过至少含有两个相同或不同官能团的有机物脱去小分子物质来实现的。
如多元醇、羟基酸、氨基酸通过分子内或分子间脱去小分子水等而成环。
(2)成环反应生成的五元环或六元环比较稳定。
2.碳链的增长有机合成题中碳链的增长,一般会以信息形式给出,常见的方式如下所示。
(1)与HCN 的加成反应(2)加聚或缩聚反应,如n CH 2(3)酯化反应,如CH 3CH 2OH +CH 3COOH 浓 CH 3COOCH 2CH 3+H 2O 。
3.碳链的减短(1)脱羧反应:R —COONa +NaOH ――→CaO△R —H +Na 2CO 3。
(3)水解反应:主要包括酯的水解、蛋白质的水解和多糖的水解。
(4)烃的裂化或裂解反应:C 16H 34――→高温C 8H 18+C 8H 16; C 8H 18――→高温C 4H 10+C 4H 8。
合成路线的选择1.中学常见的有机合成路线(2)一元合成路线R —CH=CH 2――→HX 卤代烃――→NaOH 水溶液△一元醇――→氧化一元醛――→氧化一元羧酸―→酯(3)二元合成路线CH 2=CH 2――→X 2CH 2X-CH 2X ――→NaOH 水溶液△二元醇――→氧化二元醛――→氧化二元羧酸→⎩⎪⎨⎪⎧ 链酯环酯高聚酯(3)芳香化合物合成路线:2.有机合成中常见官能团的保护(1)酚羟基的保护:因酚羟基易被氧化,所以在氧化其他基团前可以先使其与NaOH 反应,把—OH 变为—ONa(或—OCH 3)将其保护起来,待氧化后再酸化将其转变为—OH 。




有机合成中有机物官能团的引入、消除和转化方法1.官能团的引入2.官能团的消去(1通过加成反应消除不饱和键。
(2通过消去反应、氧化反应或酯化反应消除羟基(—OH。
(3通过加成反应或氧化反应消除醛基(—CHO。
(4通过消去反应或水解反应消除卤素原子。
3.官能团的转化(1利用衍变关系引入官能团,如卤代烃伯醇(RCH2OH醛羧酸。
(2通过不同的反应途径增加官能团的个数,如(3通过不同的反应,改变官能团的位置,如有机合成中碳架的构建1.有机成环反应(1有机成环:一种是通过加成反应、聚合反应来实现的;另一种是通过至少含有两个相同或不同官能团的有机物脱去小分子物质来实现的。
如多元醇、羟基酸、氨基酸通过分子内或分子间脱去小分子水等而成环。
(2成环反应生成的五元环或六元环比较稳定。
2.碳链的增长有机合成题中碳链的增长,一般会以信息形式给出,常见的方式如下所示。
(1与HCN的加成反应(2加聚或缩聚反应,如n CH2(3酯化反应,如CH3CH2OH+CH3COOH浓CH3COOCH2CH3+H2O。
3.碳链的减短(1脱羧反应:R—COONa+NaOHR—H+Na2CO3。
(3水解反应:主要包括酯的水解、蛋白质的水解和多糖的水解。
(4烃的裂化或裂解反应:C16H34C8H18+C8H16;C8H18C4H10+C4H8。
合成路线的选择1.中学常见的有机合成路线(1一元合成路线:卤代烃一元醇―→一元醛―→一元羧酸―→酯(2二元合成路线:二元醇―→二元醛―→二元羧酸―→(3芳香化合物合成路线:2.有机合成中常见官能团的保护(1酚羟基的保护:因酚羟基易被氧化,所以在氧化其他基团前可以先使其与NaOH反应,把—OH 变为—ONa(或—OCH3将其保护起来,待氧化后再酸化将其转变为—OH。
(2碳碳双键的保护:碳碳双键也容易被氧化,在氧化其他基团前可以利用其与HCl等的加成反应将其保护起来,待氧化后再利用消去反应转变为碳碳双键。
(3氨基(—NH2的保护:如在对硝基甲苯对氨基苯甲酸的过程中应先把—CH3氧化成—COOH之后,再把—NO2还原为—NH2。
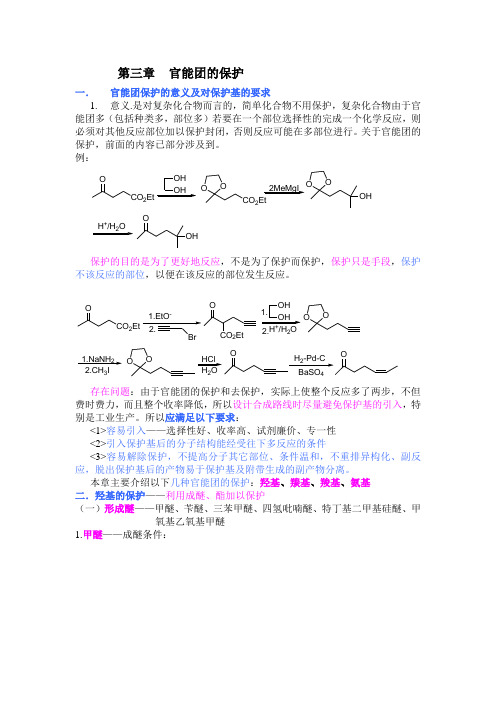
第三章 官能团的保护一. 官能团保护的意义及对保护基的要求1. 意义.是对复杂化合物而言的,简单化合物不用保护,复杂化合物由于官能团多(包括种类多,部位多)若要在一个部位选择性的完成一个化学反应,则必须对其他反应部位加以保护封闭,否则反应可能在多部位进行。
关于官能团的保护,前面的内容已部分涉及到。
例:CO 2EtOOH OHOO2Et2MeMgI OOOH+2OOH保护的目的是为了更好地反应,不是为了保护而保护,保护只是手段,保护不该反应的部位,以便在该反应的部位发生反应。
CO 2EtOOH OH O O+2O-CO 2Et 1.2.1.NaNH 23OOHCl 2 存在问题:由于官能团的保护和去保护,实际上使整个反应多了两步,不但费时费力,而且整个收率降低,所以设计合成路线时尽量避免保护基的引入,特别是工业生产。
所以应满足以下要求:<1>容易引入——选择性好、收率高、试剂廉价、专一性 <2>引入保护基后的分子结构能经受往下多反应的条件<3>容易解除保护,不提高分子其它部位、条件温和,不重排异构化、副反应,脱出保护基后的产物易于保护基及附带生成的副产物分离。
本章主要介绍以下几种官能团的保护:羟基、羰基、羧基、氨基 二.羟基的保护——利用成醚、酯加以保护(一)形成醚——甲醚、苄醚、三苯甲醚、四氢吡喃醚、特丁基二甲基硅醚、甲氧基乙氧基甲醚1.甲醚——成醚条件:1)Me 2SO 4/NaOH,Bu 4N +I -2)CH 2N 2/硅酸 0-10℃3)CH 2N 2/HBF 4,CH 2Cl 2,Et 3N,25℃4)CH 3I/固体KOH,DMSO 20℃5)(MeO)2POH/催化剂TSOH,90-100℃ 12h 6)MeO +BF 4-7)CH 3I-Ag 2O醚化条件例:OH+Me 2SO 4NaOHMeOSO 3Na+OCH3CH 2N 2+RCH 2OH RO -RCH 2OCH 3R 2CN 2ArOHR 2CHOAr CH 2N 2ROHHBF 4ROCH 3+++N 2特别是酚羟基一般用MeO -醚保护,反应容易,解脱也容易,醇羟基形成甲醚较稳定,不以脱掉,故少用,在糖类化合物中羟基的保护勿用形成醚。