最新高一全册同步练习-离子反应
- 格式:doc
- 大小:86.50 KB
- 文档页数:16

高中化学学习材料金戈铁骑整理制作高一化学大练习--离子反应一、选择题(每小题4分,共60分)1.下列物质中,属于电解质的是()A.CO2B.HCl C.BaSO4D.NaOH溶液2.电解质是()A.导电性很强的物质B.在溶于水或熔化状态下能导电的化合物C.可溶性盐类D.水溶液能导电的化合物都是电解质3.下列化学方程式改写成离子方程式不正确的是()A.CuCl2+2NaOH Cu(OH)2↓+2NaClCu2++2OH -Cu(OH)2↓B.BaCO3+2HCl BaCl2+CO2↑十H2OCO-23十2H +CO2↑十H2OA.Ca(NO3)2+Na2CO 3CaCO3↓+2NaNO3Ca2++CO-23CaCO3↓D.2KOH+H2SO4=K2SO4十2H2OH++OH -H2O4.下列各组离子反应可用H++OH—= H2O表示的是()A.氢氧化钡和硫酸 B.氢氧化铜和盐酸C.硝酸和氢氧化钠 D.硫酸和氨水5.下列物质的水溶液不能导电的是()A.氯酸钾 B.酒精 C.食盐 D.氨气6.下列叙述正确的是()A.固体氯化钠不导电,熔融态的氯化钠能导电,所以氯化钠不是电解质B.铜丝能导电,所以铜是电解质C.五氧化二磷溶于水能导电,所以五氧化二磷是电解质D.将硫酸钡放入水中不能导电,所以硫酸钡不是电解质7.下列电离方程式错误的是()A.NaHSO 4Na++H++SO42- B.NaHCO 3Na++H++CO32-C.MgCl 2Mg2++Cl2- D.Ba(OH)2Ba2++2OH-8.下列反应属于离子反应的是()A.H2和O2反应生成水 B.铁片投入稀硫酸中C.NH4HCO3受热分解 D.NH3遇HCl气体生成白烟(NH4Cl)9.下列离子方程式正确的是()A.碳酸钙和盐酸反应:CO-23+2H+= H2O+CO2↑B.向氢氧化钡溶液中加硫酸溶液:Ba2++SO-24= BaSO4↓C.向稀盐酸溶液中加铁:3Fe+6H+= 3Fe3++3H2↑D.向硝酸银溶液中加盐酸:Ag++C1-= AgCl↓10.离子方程式Ba2++SO42-=BaSO4↓可以是()A.氢氧化钡与硫酸铁溶液之间的反应B.稀硫酸与氢氧化钡溶液的反应C.稀硫酸与可溶性钡盐之间的反应D.氢氧化钡与硫酸铜溶液之间的反应11.下列各组中的离子,能在溶液中大量共存的是()A.Mg2+、H+、C1-、OH- B.Na+、Ba2+、CO-23、NO-3C.Na+、H+、Cl-、CO-23D.K+、Cu2+、NO-3、SO-24、12.在某溶液中酚酞呈粉红色。

高一离子反应练习及答案化学必修1离子反应题一选择题1、下列电离方程式错误的是()A NaHCO3 → Na+ + HCO3- (错误,应为NaHCO3 → Na+ + HCO3- + H+)B NaHSO4 → Na+ + HSO4- (正确)C MgCl2 → Mg2+ + Cl- (正确)D Ba(OH)2 → Ba2+ + 2OH- (正确)2、离子方程式CO32- + 2H+ = H2O + CO2↑中的CO32-代表的物质可以是()A CaCO3 (正确)B NaHCO3 (错误)C Na2CO3 (正确)D BaCO3 (正确)3、下列化学方程式中,不能用离子方程式Ba2+ + SO42- = BaSO4↓的是A.Ba(NO3)2 + H2SO4 = BaSO4↓ + 2HNO3 (正确)B.BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl (正确)C.BaCO3 + H2SO4 = BaSO4↓ + H2O + CO2↑ (错误,应为BaCO3 + H2SO4 = BaSO4↓ + CO2↑ + H2O)D.BaCl2 + H2SO4 = BaSO4↓ + 2HCl (正确)4.下列各组离子反应可用H+ + OH- + H2O表示的是()A.氢氧化钡和硫酸(Ba(OH)2 + H2SO4 = BaSO4↓ +2H2O)B.氢氧化铁和盐酸(Fe(OH)3 + 3HCl = FeCl3 + 3H2O)C.硝酸和氢氧化钠(HNO3 + NaOH = NaNO3 + H2O)D.硫酸氢钠和氢氧化钠(NaOH + H2SO4 = NaHSO4 + H2O)5、下列离子方程式,书写正确的是()A、盐酸与碳酸钡反应 CO32- + 2H+ = CO2↑ + H2OB、硫酸铜溶液中滴加氢氧化钡溶液 Ba2+ + 2OH- + Cu2+ + SO42- = BaSO4↓ + Cu(OH)2↓C、硝酸银溶液中加入铜粉Ag+ + Cu = Cu2+ + Ag↓D、铁与稀盐酸反应2Fe + 6H+ = 2Fe3+ + 3H2↑6、下列离子方程式书写正确的是()A、氧化铜与盐酸反应 CuO + 2HCl = CuCl2 + H2OB、碳酸氢钠溶于盐酸:HCO3- + H+ = H2O + CO2↑C、硫酸氢钠溶液与NaOH溶液混合:HSO4- + OH- =H2O + SO42-D、石灰石溶于硝酸:CO32- + 2H+ = H2O + CO2↑7.下列反应的离子方程式中,正确的是()A.向硝酸银溶液中加盐酸 Ag+ + Cl- = AgCl↓B.碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2 + 2H+ = Ca2+ + 2H2O + 2CO2↑C.盐酸跟氢氧化镁反应:H+ + OH- = H2OD.碳酸镁跟硫酸反应:MgCO3 + 2H+ = Mg2+ + H2O + CO2↑15、能在溶液中大量共存的离子组是B.Na、Ba2、CO3NO316、在强酸性无色透明溶液中,能大量共存的离子组是B、Ag+、Na+、NO3Cl17、该溶液中还可能大量存在的离子组是D.Na+、NH4Cl18、该厂废水中肯定不含有的离子组合是B.K+、NH4NO3SO4219、能引起离子浓度减小的是B、Cl二、1.Cu2++2OH-==Cu(OH)2Cu2++2OH-==Cu(OH)22.H++OH-==H2OH++OH-==H2O3.2H++CaCO3Ca2++H2O+CO2H2SO4+CaCO3==CaSO4+H2O+CO2↑4、2H++CO32-==+H2O+CO2H2CO3==H2O+CO2↑5.Cu2++Fe==Fe2++CuCu2++Fe==Fe2++Cu三、1)Fe2O3+3H2SO4==Fe2(SO4)3+3H2O 2)Na2CO3+2HCl==2NaCl+H2O+CO2↑3)CuSO4+Ba(OH)2==BaSO4↓+Cu(OH)24)Ca(OH)2+CO2==CaCO3↓+H2O5)FeCl3+3KOH==Fe(OH)3↓+3KCl6)Zn+CuSO4==ZnSO4+Cu1.Cu2+ reacts with Ag+ and Cl- to form AgCl precipitate.2.H2SO4 reacts with CO32- to produce H2O and CO2 gas。

班级姓名评分一、选择题(4分×11=44分)1.对溶液中的离子反应,下列说法:①不可能是氧化还原反应②只能是复分解反应③可能是置换反应④不能没有分子参加其中正确的是A.①③B.③C.①②D.③④2.2FeCl3+H2S=2FeCl2+S↓+2HCl的离子方程式是A.2FeCl3+H2S=2FeCl2+S↓+2Cl-B.2Fe3++S2-=2Fe2++S↓C.Fe3++H2S=Fe2++S↓+2H+D.2Fe3++H2S=2Fe2++S+2H+3.在强酸性溶液中能大量共存,并且溶液为无色透明的离子组是A.NH4+、Al3+、SO42-、NO3-B.K+、Na+、OH-、NO3-C.K+、NH4+、MnO4-、SO42-D.Na+、K+、NO3-、H+4.对四种无色溶液进行离子检验,实验结果如下,其中明显错误的是A.K+、Na+、Cl-、NO3-B.Cu2+、NO3-、OH-、HCO3-C.CO32-、OH-、Cl-、K+D.Ba2+、Na+、OH-、HCO3-5.下列各组两种物质在溶液中的反应,可用同离子方程式表示的是A.Cu(OH)2和盐酸;Cu(OH)2和CH3COOHB.BaCl2和Na2SO4;Ba(OH)2和(NH4)2SO4C.NaHCO3和NaHSO4;Na2CO3和NaHSO4D.NaHCO3(过量)和Ca(OH)2;Ca(HCO3)2和NaOH(过量)6.根据反应式:①2Fe3++2I-=2Fe2++I2和②Br2+2Fe2+=2Fe3++2Br-,可判断离子的还原性从强到弱的顺序是A.Br-、Fe2+、I-B.I-、Fe2+、Br-C.Br-、I-、Fe2+D.Fe2+、I-、Br-7.某溶液中只含有Na+ Al3+ Cl- SO42-四种离子,已知Na+ Al3+ Cl-的个数之比为3:2:1,则溶液中Al3+与SO42-离子的个数之比为A.1:2B.1:4C.3:4D.3:28.一种无色溶液中加入BaCl2溶液,生成不溶于稀HNO3的白色沉淀,则该溶液中含有的离子是A.一定含有SO42-B.一定含有CO32-C.一定含有Ag+D.可能含有SO42-,也可能含有Ag+9.已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液形成无色溶液,其化学方程式是PbSO4+2NH4Ac=Pb(Ac)2+(NH4)2SO4当在(醋酸铅)溶液中通入H2S时,有黑色沉淀PbS生成,表示这个反应的有关的离子方程式正确的是A.Pb(Ac)2+H2S=PbS↓+2HAcB.Pb2++H2S=PbS↓+2H+C.Pb2++2Ac-H2S=PbS↓+2HAcD.Pb2++2Ac-+2H++S2-= PbS↓+2HAc10.XR2++YH++O2=MR3+ +H2O的离子方程式中,对和判断正确的是A.M=4,R3+是氧化产物B.M=Y,R3+是氧化产物C.M=2,R3+是还原产物D.M=Y/2,R3+是还原产物11.在强酸性溶液中可发生如下反应:2Mn2++5R2O8x-+8H2O∆+Ag16H++10RO42-+2MnO4这个反应可定性地检验Mn2+的存在,在反应中当氧化剂的R2O8x-中x的值是A.0B.1C.2D.3二、填空题(8分×4=32分)12.将一小块镁溶于稀盐酸中,得到无色溶液,此溶液含有、、等离子,若向此溶液中加入足量的NaOH溶液离子减少,离子增多了13.除去括号中杂质,写出所加试剂与反应的离子方程式(1)SO42-(CO32-)所加试剂。

《离子反应》--同步练习题1.下列物质中,能够导电的电解质是()A.Cu丝B.熔融的MgCl2C.NaCl溶液D.蔗糖2.下面的叙述中不正确的是( )A.在熔化或溶解时均不导电的化合物叫非电解质.B.电解质、非电解质都一定是化合物,单质不属于此范畴.C.电解质在水中一定能导电.D.水是极弱的电解质. 3.下列电离子方程式错误的是()A.NaHCO3=Na++HCO3- B.NaHSO4=Na++H++SO42- C.H2SO4=2H++SO42- D.KClO3=K++Cl-+3O2-4.下列说法正确的是()A.CH3COOH与NaOH在相同条件下电离程度相等B.NaCl溶液能导电是因为有自由移动Na+和Cl-C.H2SO4在电流作用下在水中电离出H+和SO42-D.鉴别CO32-或HCO3-离子的方法是取少许样品加入盐酸,将产生的气体通入澄清石灰水5.下列离子方程式书写正确的是()A.碳酸钙与盐酸反应 CO32-+2H+=CO2↑+H2O B.硫酸和氯化钡溶液反应 Ba2++SO42-=BaSO4↓C.氢氧化钠和足量氢硫酸反应 2OH-+H2S=S2-+H2O D.铁钉放入硫酸铜溶液中 Fe+3Cu2+=2Fe3++3Cu6.下列物质的水溶液能导电而本身是非电解质的是()A.氯气 B.硫酸 C.二氧化碳 D.硫酸钠7.不能用H++OH-=H2O表示的反应是()A.盐酸与氢氧化钾溶液反应 B.氢溴酸与氢氧化钡溶液反应C.稀硝酸与氢氧化钠溶液反应 D.硅酸与氢氧化钠溶液反应8.某无色溶液加入氯化钡溶液后有白色沉淀,再加稀硝酸沉淀不消失,则该溶液中()A.一定含有SO42- B.一定含有Ag+ C.至少含有SO42-或SO32-或Ag+ D.一定含有Ag+、SO42-9.下列反应的离子方程式,书写不正确的是:A.铁和稀硫酸反应B.硫化亚铁和稀硫酸反应C.氢氧化钡溶液和稀盐酸反应D.氢氧化钠溶液和稀硫酸反应10.在强碱性溶液里能大量共存,且溶液为无色透明的离子组是A.K+、Fe2+、Cl-、SO B.Na+、Cl-、NO、COC.Na+、Ca2+、NO、SO D.Na+、HSO、S2-、Cl-11.下列各反应的离子方程式正确的是( )A.稀HNO3与氢氧化钠反应:NaOH+H+=== Na++H2OB.碳酸钙与醋酸反应:CaCO3+2H+=== Ca2++ H2O+CO2↑C .铁与盐酸反应:2Fe +6H + === 2Fe 3++3H 2↑D .氢氧化钡溶液和稀硫酸反应:Ba 2++2OH -+2H ++SO2-4=== BaSO 4↓+2H 2O 12.在强碱性溶液中,下列各组离子能大量共存的是( )A .Ag +、K +、CO 2-3、Cl -B .Cu 2+、Na +、NO -3、SO 2-4C .Na +、K +、Cl -、HCO -3D .Ba 2+、Na +、NO -3、Cl -13.下列离子方程式中,书写正确的是( )A .氨水和盐酸:NH 3·H 2O +H + === NH +4+H 2OB .碳酸钠溶液跟盐酸反应:Na 2CO 3+2H + === 2Na ++CO 2↑+H 2OC .氯化铵溶液跟氢氧化钠溶液加热反应:NH +4+OH - === NH 3·H 2OD .硫酸与氢氧化钡:Ba 2++SO 2-4=BaSO 4↓14.下列各组离子能大量共存且无色的是( )A .K +、Na +、OH -、Cl -B .Cu 2+、Ba 2+、NO -3、Cl -C .Na +、OH -、Mg 2+、Na +D .Ba 2+、H +、NO -3、OH -15.加入盐酸后,溶液中哪种离子数目会减少( )A .CO 2-3B .Al 3+C .SO 2-4D . Cl —16.下列离子反应方程式书写正确的是( )A 、 铁粉与稀硫酸反应2Fe+6H +==2Fe -3++3H 2↑B 、 碳酸钙与稀硝酸反应 CO 32--+2H +==CO 2↑+H 2OC 、 稀硫酸与氢氧化钡的反应 Ba 2++OH --+SO 42--+H +==BaSO 4↓+H 2OD 、 向NaHCO 3溶液中滴加NaOH 溶液HCO 3---+OH ---===CO 32--+H 2O 17. 下表中物质的分类组合完全正确的是( )18.现有①铁片 ②NaCl ③氨水 ④醋酸 ⑤酒精 ⑥盐酸 ⑦浓H 2SO 4 ⑧KOH ⑨蔗糖 ⑩H 2S ,其中属于电解质的是 ,属于非电解质的是 ,属于强电解质的是 ,属于弱电解质的是 。

高一化学必修一离子反应练习题一、选择题(共10题,每题2分,共20分)1. 下列标志着化学反应发生的现象是:()A. 发光B. 吸热C. 放热D. 发热2. 如果我们要灭火,可以使用以下哪种反应进行灭火?()A. 酸碱中和反应B. 加热反应C. 腐蚀反应D. 燃烧反应3. 在化学反应中,溶解离子之间的交换作用被称为()A. 脱水反应B. 提氧反应C. 氧化反应D.双盐反应4. 火药燃烧和橡胶燃烧属于同一类反应,是()A. 氧化-还原反应B. 酸碱中和反应C. 单双替反应D.有机和无机反应5. 在反应方程式:Na + Cl2 → NaCl 中,原子态转变的类型是()A. 氧化B. 还原C. 合成D. 分解6. 某合成反应摩尔比为1:1:1,则物质通常是()A. 非金属B. 金属C. 中性物质D. 不确定7. 燃烧过程中,物质质利用()A. 电子数B. 能量C. 分子D. 大气压8. 氧化反应和还原反应通常发生在两种()平衡下A. 电中子数B. 电子数C. 能量D. 大气压9. 化学方程式中表示的反应物种数应等于()A. 化学式种数和B. 离子数C. 总原子数D. 原子价电荷数10. 氧化还原反应中,尽管原子也是反应单位,但是运动单位是指()A. 离子B. 分子C. 原子D. 高能粒子二、解答题(共5题,每题16分,共80分)1. 以下质量反应方程式中,按摩尔计算配平出现问题的一组是?`C2H4 + O2 → CO2 + H2O`(2: 5: 2: 4)2. 某实验中,将5g具有金属小红球样子的A放入200ml的盛有CuSO4溶液中进行反应。
这时物质变化情况可以用下列表示。
根据实验现象写出反应方程式,并利用化学计量计算A的摩尔质量和分子式。
| 实验现象 | 反应类型 |3. 微量金属Na加入盛有水分子的试管中,放置一段时间,观察到水变红色,腾出气体,试管有冷的感觉。
分析反应类型,并写出反应方程式。
4. 商量如何解决我们所周围因日益消减的能源矛盾的问题。

离子反应同步练习1. 下列电离方程式正确的是()A.HCl水溶液中的电离:HCl+H2O = H3O++Cl-B.KHSO4融状态下的电离:KHSO4= K++H++SO42 -C.Na2CO3水溶液中的电离:Na2CO3= Na++ CO32 -D.Ca(OH)2液中的电离: Ca(OH)2= Ca2++OH-2. 下列离子方程式正确的是()A.石灰石与盐酸的反应:CaCO3+2H+= Ca2++H2O+CO2↑B.钠跟水的反应:Na+2H2O = Na++2OH-+H2↑C.CuSO4(aq)跟Ba(OH)2(aq)的反应:Ba2+ +SO42-=BaSO4↓D.FeSO4(aq)跟H2O2(aq)的反应Fe2++2H2O2+4H+=Fe3++4H2O3. 关于下列离子方程式的判断正确的是()xR2++yH++O2 =mR3+ +nH2OA. m=4B. m=yC. m=2D. 2m=y4. 下列物质属于电解质的是()A.不溶于水的BaSO4B.易溶于水的NH3C.导电的金属Fe、Cu、AlD.易溶于水的酒精(C2H5 OH)5.某100 mL溶液中含H2SO40.050 mol,加入下列物质,溶液导电性增强的是()A.0.50 mol Ba(OH)2B.100 ml水C.0.05 mol酒精D.0.50 mol Na2SO46. 下列图示正确的是()A.水合H+:B.OH-:C.水合Na+:D.水合Cl-:7.无论在酸性还是碱性溶液中,都能大量共存的离子组是()○1K+、SO32-、S2-、SO42-②Na+、Cu2+、SO42-、Cl-③Br-、Ba2+、C1-、K+④Ca2+、K+、CO32-、NO3-⑤Cl-、Na+、NO3-、SO42-⑥Mg2+、NH4+、CO32-、F-A.①②B.①④C.③⑤D.②⑥8.能用离子方程式H++OH-=H2O表示的化学反应是()A.Cu(OH)2 (s)和(H2SO4)(aq)的反应B.澄清石灰水和HCl(aq)的反应C. KOH(aq)和Na2SO4的反应D. Ba(OH)2(aq)和H 2SO 4(aq)的反应 9. 下列反应属干离子反应的是( ) A.H 2O 和CO 2气体的反应 B.NH 3溶于水的反应C.硝酸与Ca(OH)2溶液的反应D.Cu 与Hg(NO 3)2(aq)的反应10.下列物质:①Na ②Br 2 ③CO 2 ④SO 3 ⑤NH 3 ○6H 2S ⑦HCl ⑧H 2SO 4 ⑨H 2CO 3 ⑩Ba(OH)2 ○11NH 3·H 2O ○12NaCl ○13BaSO 4 ○14BaO ○15蔗糖 ○16C 2H 5OH 属于电解质的是 ,属于非电解质的是 ,属于酸的是 ,属于碱的是 ,属于盐的是 ,属于氧化物的是 ,属于单质的是 ,属于有机物的是 。

高一离子反应练习题高一离子反应练习题离子反应是化学中的重要概念之一,它描述了溶液中离子之间的相互作用和反应。
在高一化学学习中,离子反应也是一个重要的考点。
下面我将为大家提供一些高一离子反应的练习题,希望能够帮助大家更好地理解和掌握这一概念。
1. 在溶液中,硫酸钠(Na2SO4)和氯化银(AgCl)反应生成什么产物?写出反应方程式。
答案:硫酸钠和氯化银反应生成硫酸银(Ag2SO4)和氯化钠(NaCl)。
反应方程式:Na2SO4 + 2AgCl → Ag2SO4 + 2NaCl2. 在溶液中,氯化铵(NH4Cl)和氢氧化钠(NaOH)反应生成什么产物?写出反应方程式。
答案:氯化铵和氢氧化钠反应生成氯化钠(NaCl)和氨(NH3)。
反应方程式:NH4Cl + NaOH → NaCl + NH3 + H2O3. 在溶液中,硝酸银(AgNO3)和氯化钠(NaCl)反应生成什么产物?写出反应方程式。
答案:硝酸银和氯化钠反应生成氯化银(AgCl)和硝酸钠(NaNO3)。
反应方程式:AgNO3 + NaCl → AgCl + NaNO34. 在溶液中,硫酸钠(Na2SO4)和氢氧化钙(Ca(OH)2)反应生成什么产物?写出反应方程式。
答案:硫酸钠和氢氧化钙反应生成硫酸钙(CaSO4)和氢氧化钠(NaOH)。
反应方程式:Na2SO4 + Ca(OH)2 → CaSO4 + 2NaOH5. 在溶液中,硫酸铜(CuSO4)和氢氧化钠(NaOH)反应生成什么产物?写出反应方程式。
答案:硫酸铜和氢氧化钠反应生成氢氧化铜(Cu(OH)2)和硫酸钠(Na2SO4)。
反应方程式:CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4通过以上练习题,我们可以看出离子反应的基本特点:在溶液中,阳离子与阴离子之间发生置换反应,生成新的化合物。
这些化合物的生成可以通过化学方程式来描述,方程式中的离子必须满足电荷守恒的原则。
除了上述练习题,我们还可以通过更复杂的离子反应来提高自己的理解和应用能力。

高一化学(必修一)离子反应练习题(含答案解析)一、单选题1.下列物质属于电解质的是 ( ) A .汽油B .铝C .碳酸钠D .氯化钠溶液2.下列物质属于弱电解质的是 ( ) A .3CH COONaB .HClOC .2SOD .氨水3.下列物质之间不.能发生反应的是 ( ) A .CH 3COOH 与NH 3•H 2O B .BaCO 3与HNO 3 C .CuCl 2与KOHD .CuCl 2与H 2CO 34.下列物质的分类正确的是 ( ) A .液氨——混合物 B .漂白粉——纯净物 C .食盐水——电解质D .干冰——非电解质 5.下列物质不属于电解质的是 ( ) A .CH 3COOHB .NH 3·H 2OC .NaClOD .C 2H 5OH6.下列物质的水溶液因电离而呈酸性的是 ( ) A .CaCl 2B .NaHSO 4C .CH 3COONaD .NH 4Cl7.能正确表示下列反应的离子方程式的是 ( ) A .钠与水反应:Na+2H 2O=Na ++2OH -+H 2↑ B .钠与CuSO 4溶液反应:2Na+Cu 2+=Cu+2Na + C .钠与盐酸反应:Na+2H +=Na ++H 2↑D .钠与氯化钾溶液反应:2Na+2H 2O=2Na ++2OH -+H 2↑ 8.下列物质与对应的归类不正确...的是 ( ) A .水、液态氯化氢、小苏打都是电解质 B .“84”消毒液、水玻璃、液氨都是混合物 C .CO 2、Mn 2O 7、SO 3都属于酸性氧化物 D .NaH 、NaN 3、NaClO 都属于离子化合物9.下列热化学方程式或离子方程式中,正确的是( )A .甲烷的标准燃烧热为-890.3 kJ·mol -1,则甲烷燃烧的热化学方程式可表示为:CH 4(g) + 2O 2(g) = CO 2(g)+ 2H 2O(g) ΔH = -890.3 kJ·mol -1B .500ºC 、30MPa 下,将0.5 mol N 2和1.5 mol H 2置于密闭的容器中充分反应生成NH 3(g),放热19.3kJ ,其热化学方程式为:N 2(g) + 3H 2(g)2NH 3(g) ΔH = -38.6 kJ·mol -1C .向明矾溶液中加入过量的氢氧化钡溶液:Al 3+ + 2SO 42-+ 2Ba 2+ + 4OH -= 2BaSO 4↓+ 2H 2O + AlO 2-D .用浓盐酸酸化的KMnO 4溶液与H 2O 2反应,证明H 2O 2具有还原性:2MnO 4-+ 5H 2O 2 + 6H + = 2Mn 2+ + 5 O 2↑+8H 2O10.下列离子方程式的书写正确的是 ( )A .用饱和23Na CO 溶液浸泡锅炉水垢除去其中的4CaSO :223434CO (aq)+CaSO (s)=CaCO (s)+SO (aq)-- B .明矾溶液中加入2Ba(OH)溶液至沉淀物质的量最大:[]322444Al 2SO 2Ba4OH 2BaSO Al(OH)-+-+-+++↓+= C .碱性条件下,用KClO 溶液与3Fe(OH)反应制备新型净水剂24K FeO :23423ClO 2Fe(OH)2FeO 3Cl 4H H O ---++=+++D .氯碱工业制备氯气:-+22通电2Cl +2HCl ↑+H ↑11.下列离子方程式或化学方程式中书写错误的是 ( )A .用()36K Fe CN ⎡⎤⎣⎦检验Fe 2+的离子方程式:()()3-2+36622Fe CN +3Fe =Fe Fe CN ⎡⎤⎡⎤⎣⎦⎣⎦↓B .用TiCl 4制备TiO 2的化学方程式:()4222TiCl +x+2H O4HCl+TiO xH O ↓C .苯酚钠的水溶液中通入少量的CO 2:265226532C H O CO H O=2C H OH CO --+++D .电解CuCl 2溶液的化学方程式:22电解CuCl Cu+Cl ↑12.下列分子或离子在指定的分散系中一定能大量共存的一组是 ( ) A .空气:22CO CO SO NO 、、、 B .氢氧化铁胶体:2H K S Br ++--、、、C .使酚酞变红的溶液:23K Na SiO Cl ++--、、、D .与Al 反应放出2H 的溶液:34Na Cl NO NH +--+、、、13.下列离子方程式能用来解释相应实验现象的是 ( )A .氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解:Mg(OH)2+2+4NH =Mg 2++2NH 3•H 2OB .沸水中滴加饱和氯化铁溶液得到红褐色液体:Fe 3++3H 2O=Fe(OH)3↓+3H +C .用食醋能清洗水垢:2-3CO +2CH 3COOH=2CH 3COO+H 2O+CO 2↑D .84消毒液与洁厕灵混用产生有毒气体:ClO -+Cl -+2H +=Cl 2↑+2OH -14.电解质溶液导电的能力的强弱主要由自由移动电荷的浓度的大小决定。

高一化学离子反应同步练习题1.下列物质中,能够导电的电解质是:熔融的MgCl2、NaCl溶液、XXX。
2.下列物质的水溶液能导电,但属于非电解质的是蔗糖。
3.下面关于电解质的叙述中错误的是:C.电解质在水中一定能导电,在水中导电的化合物一定是电解质。
4.下列说法中不正确的是:②氨溶于水得到的溶液氨水能导电,所以氨水是电解质;③固态共价化合物不导电,熔融态的共价化合物可以导电;④固态的离子化合物不导电,熔融态的离子化合物也不导电。
因此,选项A.①④是正确的。
5.能用H++OH-=H2O表示的是NaOH溶液和盐酸反应。
6.下列各组离子在水溶液中能大量共存的是:A.Na+、Ba2+、Cl、SO42-。
7.在某无色透明的酸性溶液中,能共存的离子组是H+、Cl-、SO42-。
8.在强碱性的无色透明溶液中不可能大量共存的离子组是Na+、Cl-、K+、MnO4-。
9.在强酸性溶液中能大量共存的无色透明离子组是K+、Na+、NO3-、MnO4-。
10.能正确表示下列化学反应的离子方程式的是:无法确定,因为没有给出具体的反应方程式。
1.没有明显的格式错误或需要删除的段落。
需要改写的话可以改为:A。
氢氧化钡溶液和盐酸反应时,产生OH-离子和H+离子,最终生成水分子。
B。
澄清的石灰水和稀盐酸反应时,产生Ca2+离子和H+离子,最终生成CaCl2和水分子。
C。
铜片插入硝酸银溶液中时,铜原子失去电子成为Cu+离子,而Ag+离子接受电子成为Ag原子,最终生成Cu2+离子和Ag固体。
D。
碳酸钙溶于稀盐酸中,产生Ca2+离子、水分子和CO2气体。
2.可以改写为:A。
BaCl2和K2SO4反应时,产生BaSO4固体和2KCl离子。
B。
BaCO3和H2SO4反应时,产生BaSO4固体、CO2气体和水分子。
C。
Ba(NO3)2和H2SO4反应时,产生BaSO4固体和2HNO3离子。
D。
Ba(OH)2和2KHSO4反应时,产生BaSO4固体、K2SO4离子和2水分子。

离子反应练习题离子反应是化学反应中非常重要的一种类型,它涉及到离子的生成、消失和转化。
理解离子反应的基本原理和步骤对于化学学习至关重要。
下面是一些离子反应的练习题,帮助巩固相关的概念和应用。
在解答每个问题之前,请确保你已经掌握了离子的成对原则、离子的符号表示以及离子反应方程的写法。
题目一:给出以下离子反应,写出反应方程式。
1. 溴离子与银离子反应产生固态沉淀物。
2. 钾离子与氯离子反应产生溴浓溶液。
题目二:给出以下离子反应,写出反应方程式,指出产生的沉淀物。
1. 钡离子与硫酸离子反应。
2. 铝离子与氢氧根离子反应。
题目三:给出以下离子反应,写出反应方程式,指出反应条件。
1. 碳酸氢根离子与硝酸根离子反应。
2. 氧气离子与氢离子反应。
题目四:给出以下反应方程式,写出对应的离子反应式,并指出产物。
1. AlCl3 + NaOH →2. AgNO3 + BaCl2 →题目五:给出以下化学方程式,请根据反应物和产物确定离子反应方程式。
1. 2NaOH + H2SO4 → Na2SO4 + 2H2O2. Ca(NO3)2 + 2NaOH → Ca(OH)2 + 2NaNO3题目六:根据以下物质的化学式,写出每个物质所对应的离子。
1. NaCl2. Fe(NO3)23. Ca(OH)24. NH4OH题目七:在下列物质中,找到一个可以产生离子反应的化合物并写出其反应方程式。
1. ZnCl22. K2SO43. LiOH4. Al2(SO4)3题目八:根据离子的成对原则,判断下列离子化合物是否可溶于水,并写出可溶性规律。
1. NaCl2. AgNO33. PbSO44. K2CO3题目九:给出以下离子方程式,请写出对应的化学方程式。
1. 2Na+ + 2Br- → 2NaBr2. 3Ca2+ + 2PO43- → Ca3(PO4)2题目十:根据以下方程式,确定产生离子反应的溶液并写出反应方程式。
1. HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)2. H2SO4(aq) + Ba(OH)2(aq) → BaSO4(s) + H2O(l)这些离子反应练习题涵盖了离子的成对原则、离子反应方程式的书写和离子可溶性规律等知识点。
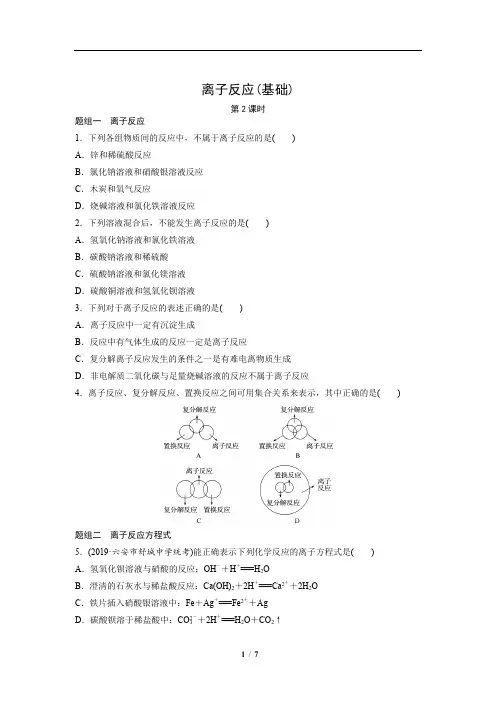
离子反应(基础)第2课时题组一离子反应1.下列各组物质间的反应中,不属于离子反应的是()A.锌和稀硫酸反应B.氯化钠溶液和硝酸银溶液反应C.木炭和氧气反应D.烧碱溶液和氯化铁溶液反应2.下列溶液混合后,不能发生离子反应的是()A.氢氧化钠溶液和氯化铁溶液B.碳酸钠溶液和稀硫酸C.硫酸钠溶液和氯化镁溶液D.硫酸铜溶液和氢氧化钡溶液3.下列对于离子反应的表述正确的是()A.离子反应中一定有沉淀生成B.反应中有气体生成的反应一定是离子反应C.复分解离子反应发生的条件之一是有难电离物质生成D.非电解质二氧化碳与足量烧碱溶液的反应不属于离子反应4.离子反应、复分解反应、置换反应之间可用集合关系来表示,其中正确的是()题组二离子反应方程式5.(2019·六安市舒城中学统考)能正确表示下列化学反应的离子方程式是() A.氢氧化钡溶液与硝酸的反应:OH-+H+===H2OB.澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+===Ca2++2H2OC.铁片插入硝酸银溶液中:Fe+Ag+===Fe2++AgD.碳酸钡溶于稀盐酸中:CO2-3+2H+===H2O+CO2↑6.下列离子方程式书写不正确的是()A.铁跟稀硫酸反应:Fe+2H+===Fe2++H2↑B.铜片插入硝酸银溶液中:Cu+Ag+===Cu2++AgC.铁与氯化铜溶液反应:Fe+Cu2+===Fe2++CuD.碳酸钙跟稀盐酸反应:CaCO3+2H+===Ca2++H2O+CO2↑7.离子方程式H++OH-===H2O所表示的反应可以是()A.所有酸和碱之间的中和反应B.碳酸氢钠和氢氧化钠之间的反应C.所有可溶性酸和可溶性碱的反应D.硫酸氢钠与氢氧化钠的反应8.下列反应①和②可以用同一离子方程式表示的是()A.①稀盐酸+碳酸钠溶液;②稀盐酸+碳酸氢钠溶液B.①氢氧化钠溶液+稀盐酸;②氢氧化钡溶液+稀硫酸C.①氯化钡溶液+稀硫酸;②氢氧化钡溶液+硫酸钠溶液D.①稀盐酸+碳酸钙粉末;②稀硫酸+碳酸钠溶液9.与下列离子方程式相对应的化学方程式书写不正确的是()A.Cu2++2OH-===Cu(OH)2↓CuSO4+2KOH===Cu(OH)2↓+K2SO4B.CO2-3+2H+===CO2↑+H2OBaCO3+2HCl===BaCl2+H2O+CO2↑C.Ca2++CO2-3===CaCO3↓CaCl2+Na2CO3===CaCO3↓+2NaClD.H++OH-===H2O2KOH+H2SO4===K2SO4+2H2O题组三离子共存10.下列各组离子能在溶液中大量共存的是()A.Ag+、K+、Cl-、NO-3B.Ba2+、Cl-、H+、SO2-4C.H+、CO2-3、Cl-、Na+D.Na+、Ba2+、OH-、NO-311.下列离子在水溶液中可与CO2-3大量共存的是()A.Ca2+B.Ba2+C.Na+D.H+12.(2018·武汉高一检测)在强酸性无色透明溶液中,能大量共存的离子组是()A.NH+4、Mg2+、SO2-4、Cl-B.K+、OH-、NO-3、Fe3+C.Al3+、Cu2+、SO2-4、Cl-D.Na+、Ca2+、Cl-、CO2-313.某混合溶液中所含离子的浓度如表所示,则M可能为()A.Cl-B.Ba2+C.Na+D.Mg2+14.(2019·诸暨中学期末)某蓝色溶液中含有下列离子中的若干种:Cu2+、Na+、Ba2+、Cl-、NO-3、SO2-4,且各种离子的物质的量浓度相等。
1、下歹0电离方程式错误的是()D B a( OH) 2 =====Ba2+ +2OH2、离子方程式C 矿+ 2H + = H 2O + CQf 中的C 矿代表的物质可以是(A CaCOB 、NaHCOC 、NaCOD 、BaCO3、下歹0化学方程式中,不能用离子方程式 Ba"+SO 2 ====BaSOi A. Ba(NO) 2+HSO==BaSO 。
+2HNO B . BaCl 2+NaSO==BaSO 。
+2NaCl C. BaCORSO==BaSO 。
+HO+C2tD. BaCl 2+HSO==BaSCM +2HCl4. ------------------------------------------------------ 下歹0各组离子反应可用 Hf + OH HO 表小的是(A 、氧化铜与盐酸反应 O 2 +2H + ====H 2。
A NaHCQ ====Na* +H + +CQ 2B NaHSO 4 ====Na* +H + +SQ 2C MgCl 2 ====M&+ +2Cl A.氢氧化彻和硫酸 B.D.硫酸氢钠和氢氧化钠5、 下歹0离子方程式,书写正确的是(A 、 盐酸与碳酸彻反应 COB 、 硫酸铜溶液中滴加氢氧化彻溶液 BaC 、 硝酸银溶液中加入铜粉 Ag□铁与稀盐酸反应2Fe+6H氢氧化铁和盐酸 C.硝酸和氢氧化钠32-+2l4==COf +HO2++2OH+CiT+SQ 2==BaSOj +Cu(OH) J++Cu==Ct i +AgJ+==2FeT+3H fB、碳酸氢钠溶丁盐酸:HCO + H += H 2。
+ CQ fC、硫酸氢钠溶液与NaO船液混合:HSO + OH = H 2。
+ SO42口石灰石溶丁硝酸:CGT + 2H + = H 20 + CQ f7. 下列反应的离子方程式中,正确的是()A. 向硝酸银溶液中加盐酸Ag* + C「——AgClJB. 碳酸氢钙溶液跟盐酸反应:Ca(HC。
高一化学离子反应同步练习11.下列物质中,能够导电的电解质是()A.Cu丝B.熔融的MgCl2C.NaCl溶液D.蔗糖2.下列物质中,不能电离出酸根离子的是( )A.Na2S B.Ba(OH)2C.KMnO4D.KCl3.下列物质中导电能力最差的是()A.(NH4)2CO3溶液B.Fe丝C.食盐晶体D.熔融的Na2SO44.NaHSO4在水溶液中能够电离出H+、Na+、和SO42-。
下列对于NaHSO4的分类中不正确的是()A.NaHSO4是盐B.NaHSO4是酸式盐C.NaHSO4是钠盐D.NaHSO4是酸5.下列说法正确的是()A.固体氯化钠不导电,所以氯化钠是非电解质B.铜丝能导电,所以铜是电解质C.氯化氢水溶液能导电,所以氯化氢是电解质D.CO2的水溶液能导电,所以CO2是电解质6.电解质是指:;下列物质属电解质的是:;A.熔融的氯化钾B.干冰C.硫酸钡D.酒精E.铜片F.硫酸铜溶液G.硫酸H.氢氧化钙7.请从电离的角度概括出酸、碱、盐的本质酸;碱;盐。
8.写出下列物质的电离方程式:H2SO4—HNO3—Ca(OH)2—CuCl2—Al2(SO4)3—9.固体氯化钠中存在着钠离子(Na+)与氯离子(Cl-),为何固体氯化钠几乎不导电,而将其熔融或溶于水形成溶液就能导电,这是因为。
物质能导电,必须具有,金属能够导电是由于含有,电解质溶液导电是由于有,一般而言,温度对金属导体与电解质溶液导电能力的影响刚好相反,就此推知,温度越高,金属导体的导电能力,电解质溶液导电能力。
10.在某无色透明的酸性溶液中,能大量共存的离子组是()A.Na+、K+、SO42-、HCO3-B.Cu2+、K+、SO42-、NO3-C.Na+、K+、Cl-、NO3-D.Fe3+、K+、SO42-、Cl-参考答案:1.B 2.B 3.C 4.D 5.C 6.在水溶液里或熔融状态下能够导电的化合物ACGH 7.电离时生成的阳离子全部是氢离子的化合物叫做酸;电离时生成的阴离子全部是氢氧根离子的化合物叫做碱;电离生成金属阳离子(包括铵根离子)和酸根离子的化合物叫做盐8.H2SO4=2H++SO42- HNO3=H++NO3- Ca(OH)2= Ca 2++2OH-CuCl2=Cu2++2Cl-Al2(SO4)3=2 Al 3++3 SO42-9.固体氯化钠中尽管有阴阳离子,但没有处于自由移动状态,溶于水或熔融状态下,离子处于自由移动状态自由移动带电微粒自由电子自由移动的阴阳离子减弱增强10.C。
高一化学离子反应同步练习题高一化学离子反应练习题一、选择题1.下列物质中,能够导电的电解质是A .Cu 丝B .熔融的MgCl 2C .NaCl 溶液D .蔗糖2.下列物质的水溶液能导电,但属于非电解质的是A .HClOB . Cl 2C . NaHCO 3D . CO 23.下面关于电解质的叙述中错误的是A .在水溶液中或熔融状态下均不导电的化合物叫非电解质B .电解质、非电解质都指化合物而言,单质不属于此范畴C .电解质在水中一定能导电,在水中导电的化合物一定是电解质D .纯水的导电性很差,所以水不是电解质4、下列说法中不正确的是①将硫酸钡放入水中不能导电,所以硫酸钡是非电解质②氨溶于水得到的溶液氨水能导电,所以氨水是电解质③固态共价化合物不导电,熔融态的共价化合物可以导电④固态的离子化合物不导电,熔融态的离子化合物也不导电⑤强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 A .①④ B .①④⑤ C .①②③④ D .①②③④⑤5、能用H ++OH - = H 2O 表示的是 ..A .NaOH 溶液和CO 2的反应B .Ba(OH)2溶液和稀H 2SO 4的反应C .NaOH 溶液和盐酸反应D .氨水和稀H 2SO 4的反应 6、下列各组离子在水溶液中能大量共存的是 ...A .Na +、Ba 2+、Cl -、SO 42-B . Ca 2+、HCO 3-、C1-、K +C .Mg 2+、Ag +、NO 3-、Cl -D . H + 、Cl - 、Na + 、CO 32-7、在某无色透明的酸性溶液中,能共存的离子组是A .Na + 、K +、SO 42-、HCO 3-B .Cu 2+、K +、SO 42-、NO 3-C .Na +、 K +、Cl -、 NO 3-D .Fe 3+、K +、SO 42-、Cl -8、在强碱性的无色透明溶液中不可能大量共存的离子组是A .+2Mg、+Na 、-3NO 、-Cl B .+K 、+2Ba 、-Cl 、-3NO C .+Na 、-2S、-23CO 、+K D .+Na 、-Cl 、+K 、-4MnO9、在强酸性溶液中能大量共存的无色透明离子组是A .+K 、+Na 、-3NO 、-4MnO B .+2Mg 、+Na 、-Cl 、-24SOC .+K 、+Na 、-Br 、+2Cu D .+Na 、+2Ba、-OH 、-24SO10、能正确表示下列化学反应的离子方程式的是A .氢氧化钡溶液与盐酸的反应 OH -+H + = H 2OB .澄清的石灰水与稀盐酸反应 Ca(OH)2 + 2H + = Ca 2+ + 2H 2OC .铜片插入硝酸银溶液中 Cu + Ag + = Cu 2+ + AgD .碳酸钙溶于稀盐酸中 CaCO 3+2H +=Ca 2++H 2O +CO 2↑11、在下列化学方程式中,能够用离子方程式Ba 2++SO 42-=BaSO 4↓表示的是A .BaCl 2+K 2SO 4=BaSO 4↓+2KClB .BaCO 3+H 2SO 4 = BaSO 4↓+CO 2↑+H 2OC .Ba(NO 3)2+ H 2SO 4= BaSO 4↓+2H NO 3D .Ba(OH)2+ 2KHSO 4 = BaSO 4↓+K 2SO 4+2H 2O12、下列离子方程式正确的是A .稀42SO H 滴在铁片上:↑+=+++233262H Fe H FeB .稀盐酸滴在碳酸钙上:O H CO H CO 22232+↑=++-C .硫酸铜与氢氧化钡溶液混合:22)(2OH Cu OH Cu =+-+D .氧化铜与盐酸反应:O H Cu H CuO 222+=+++ 13、下列反应的离子方程式错误的是 A.碳酸氢钙溶液跟稀硝酸反应 HCO 3-+H +=H 2O+CO 2 B.饱和石灰水跟稀硝酸反应Ca(OH)2+2H +=Ca2++2H 2O C.向稀氨水中加入稀盐酸NH 3.H 2O+H +=NH 4++H 2O D.碳酸钙溶于醋酸中 CaCO 3+2H +=Ca 2++H 2O+CO 2 14、下列说法正确的是()A .难溶于水的电解质一定是弱电解质B .强电解质的水溶液导电能力一定比弱电解质的水溶液强C .乙醇(CH 3CH 2OH )能与水以任意比互溶,故它是强电解质D .强电解质在水溶液中全部电离成离子二、填空1、电解质是指在或下能够导电的。
第二节离子反应Ⅰ.学习重点:1.掌握电解质(强电解质和弱电解质)的含义2.掌握离子反应和离子方程式的含义3. 掌握离子反应发生的条件和离子方程式的书写方法Ⅱ.学习难点:离子方程式的书写方法Ⅲ.书写离子方程式易出现的错误分析强弱电解质不分,易溶与难溶不分例1.氢氧化铁与盐酸反应OH-+H+=H2O (错) 应为:Fe(OH)3+3H+=Fe3++3H2O (正确)例2.石灰石与盐酸反应CO32-+2H+=CO2↑+H2O (错)应为:CaCO3+2H+=Ca2++CO2↑+H2O (正确)例3.纯碱与醋酸反应CO32-+2H+=CO2↑+H2O (错) 应为:CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O(正确)2.没有注意反应事实例1.铁和稀硫酸反应2Fe+6H+=2Fe3++3H2↑(错)应为:Fe+2H+=Fe2++H2↑(正确)3.没有遵守质量守恒和电荷守恒例1.金属钠和水反应Na+2H2O=Na2OH+H2↑(错)应为:2Na+2H2O=2Na++2OH-+H2↑(正确)例2.铁粉放入硫酸铁溶液中Fe+Fe3+=2Fe2+(错) 应为:Fe+2Fe3+=3Fe2+(正确)4.系数化简时的错误例:硫酸与氢氧化钡溶液的反应H++SO42-+OH-+Ba2+=BaSO4↓+H2O (错)应为:2H++SO42-+2OH-+Ba2+=BaSO4↓+H2O (正确) 5.漏写离子将上一题写成Ba2++SO42-=BaSO4↓(错)6.没有参加反应的离子没有删除例:氯化钠和硝酸银溶液反应Na++Cl-+Ag++NO3-=AgCl ↓+Na++NO3-(错)应为:Cl+Ag+=AgCl↓7.不是溶液中的反应写出了离子方程式例:氯化钠固体和浓硫酸加强热制氯化氨H++Cl-强热HCl↑(错)该反应没有离子方程式Ⅳ.训练习题:一、选择题1.下列电离子方程式错误的是()A.NaHCO3=Na++H++CO32-B.NaHSO4=Na++H++SO42-C.H2SO4=2H++SO42-D.KClO3=K++Cl-+3O2-2.下列说法正确的是()A.CH3COOH与NaOH在相同条件下电离程度相等B.NaCl溶液能导电是因为溶液中有Na+和Cl-C.H2SO4在电流作用下在水中电离出H+和SO42-D.检验CO32-或HCO3-离子的方法是取少许样品加入盐酸,将产生的气体通入澄清石灰水3.下列离子方程式书写正确的是()A.碳酸钙与盐酸反应CO32-+2H+=CO2↑+H2O B.硫酸和氯化钡溶液反应Ba2++SO42-=BaSO4↓C.氢氧化钠和少量氢硫酸反应2OH-+H2S=S2-+H2O D.铁钉放入硫酸铜溶液中Fe+3Cu2+=2Fe3++3Cu4.下列物质的水溶液能导电而本身不是电解质的是()A.氨气B.硫酸C.二氧化碳D.硫酸钠5.不能用H++OH-=H2O表示的反应是()A.盐酸与氢氧化钾溶液反应B.稀硫酸与氢氧化钡溶液反应C.稀硝酸与氢氧化钠溶液反应D.硅酸与氢氧化钠溶液反应6.下列反应既是离子反应,又是氧化还原反应的是()A.二氧化硫与硫化氢作用生成硫和水B.二氧化硫与氢氧化钠溶液作用生成亚硫酸钠C.硫化氢通入氯化铁溶液中生成硫、氯化亚铁和盐酸D.Zn粒与稀硫酸反应制取氢气7.某无色溶液加入氯化钡溶液后有白色沉淀,再加稀硝酸沉淀不消失,则该溶液中()A.一定含有SO42-B.一定含有Ag+ C.至少含有SO42-或SO32-或Ag+ D.一定含有Ag+、SO42-8.下列各组溶液不加任何试剂就能鉴别的是()A.盐酸、氢氧化钠、酚酞B.氢氧化钠、氢氧化钡、硫酸C.硫酸、碳酸钠、氢氧化钠D.硫酸铜、盐酸、硫酸9.下列各组中两个溶液间的反应,均可用同一离子方程式表示的是()A.CH3COOH和Na2CO3与CH3COOH和NaHCO3 B.AgNO3和HCl与Ag2SO3和HClC.BaCl2和Na2SO4与Ba(OH)2与H2SO4D.KOH和CH3COONH4与Ba(OH)2与NH4Cl10.下列四种物质:Fe粉、石灰水、Na2CO3溶液、稀盐酸两两混合后,将发生的离子反应有()A.1个B.2个C.3个D.4个11.在某溶液中有K+、H+、SO42-、NO3-,则溶液中溶质的种类最多为()A.2种B.3种C.4种D.5种12.在酸性溶液中能大量共存而且为无色透明的溶液是()A.NH4+、Al3+、SO42-、NO3-B.K+、Na+、NO3-、SO32-C.K+、MnO4-、NH4+、NO3-D.Na+、K+、HOO3-、NO3-13.在碱性溶液中能大量共存且为无色透明的溶液是()A.K、Cl-、MnO4-、SO42-B.Na+、SiO32-、NO3-、CO32-C.Na+、NO3-、SO42-、HCO3-D.Na+、SO42-、S2-、Cl-14.和下列离子反应方程式相对应的化学方程式正确的是()A.Zn2++2OH-=Zn(OH)2↓ZnCO3+2NaOH=Zn(OH)2↓+Na2CO3B.Ba2++SO42-=BaSO4↓Ba(OH)2+H2SO4=BaSO4↓+2H2OC.Ag++Cl-=AgCl↓AgNO3+NaCl=AgCl↓+NaNO3D.Cu+2Ag+=Cu2++2Ag↓Cu+2AgCl=2Ag+CuCl215.只能表示一个化学反应的离子方程式的是()A.Cu(OH)2+2HCl=CuCl2+2H2O Cu(OH)2+2H+=Cu2++2H2OB. FeSO4+Ba(OH)2=Fe(OH)2↓+BaSO4↓Fe2++SO42-+Ba2++2OH-=Fe(OH)2↓+BaSO4↓C. Ba(OH)2+H2SO4=BaSO4↓+2H2O Ba2++2OH-+2H++SO42-=BaSO4↓+2H2OD.2HCl+FeS=Fe2++H2S↑2H+FeS=Fe2++H2S↑16.离子方程式Ba2++SO42-=BaSO4↑它表示①可溶性钡盐溶液与可溶性硫酸盐溶液之间的反应②氢氧化钡溶液与可溶性硫酸盐溶液之间的反应③稀硫酸与可溶性钡盐溶液之间的反应④氢氧化钡溶液与稀硫酸反应()A.①②B.①②④C.②③D.①②③17.对于离子以应H-+NH3=NH2-+H2↑的正确说法是()A.属于置换反应B.被氧化的是H-C.H2既是氧化产物又是还原产物D.每产生1个分子H2必转移2个电子18.在50g含1.17gNaCl和0.84g NaF溶液中滴入过量的AgNO3溶液,充分搅拌,静置,过滤、洗涤、干燥,称量得2.87g 固体,由此可以得出正确结论是()A.氯离子只有一部分参加反应B.氟离子只有一部分参加反应C.氟化钠与硝酸银在溶液中无沉淀生成D.氟化银难溶于水19.今有三个氧化还原反应:①2FeCl3+2KI=2 FeCl2+2KCl+I2②2FeCl2+Cl2=2FeCl3③2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O若某溶液中有Fe2+和I-共存,要氧化除去I-而又不影响Fe2+和Cl-。
可加入的试剂是()A.Cl2B.KMnO4C.FeCl3D.HCl 20.在xR2++yH++O2=MR3++nH2O的离子方程式中,对系数m和R3+的判断正确的是()A.m=4R3+是氧化产物B.m=yR3+是氧化产物C.m=2R3+是还原产物D.m=yR3+是还原产物二、填空题21.将BaCl2溶液分别滴入到K2SO4、稀H2SO4溶液中,均有产生,它们的离子方程式是,说明离子方程式不仅表示一定物质间的,而且表示了离子反应。
22.向CuSO4溶液中滴加NaOH溶液,溶液中离子的量减少,离子的量增加,离子的量没有变化,反应的离子方程式是。
23.现有①铁片②NaCl ③氨水④醋酸⑤酒精⑥盐酸⑦浓H2SO4 ⑧KOH ⑨蔗糖⑩H2S,其中属于电解质的是,属于非电解质的是,属于强电解质的是,属于弱电解质的是。
24.写出下列物质的电离方程式(1)NaHSO4______________________________________(2)NaHCO3(3)H2O(4)CH3COOH(5)H2SO4(6)Na2SO425.写出下列反应的化学方程式,属于离子反应的,写出离子方程式,属于氧化还原反应的标出电子转移的方向和数目(1)氢氧化钡与稀硫酸反应(2)碳酸钠溶液与盐酸反应(3)铁片插到硝酸汞溶液中(4)实验室制取氧气(5)实验室制取二氧化碳26.写出符合以下离子方程式的化学方程式各1个(1)CO2+2OH-=CO32-+H2O __________________________________________(2)HCO3-+H+=CO2↑+H2O_________________________________________(3)CaCO3+2H+=Ca2++CO2↑+H20 _________________________________________(4)Zn+Cu2+=Zn2++Cu _________________________________________(5)H++OH-=H2O _________________________________________27.完成下列离子方程式(给出物质的计量数不能改变)(1)()+2()+()+2()=BaSO4↓+2H2O(2)( )+Ca2++( )=CaCO3↓+()(3)Cu2++( )+Ba2++( )=BaSO4+Cu(OH)2↓(4)()+3H+=Fe3++( )三、推断题28.有A、B、C、D、E、F六种化合物,它们之间的反应关系如下所示:①A+B→C+E ②C+NaOH→蓝色沉淀D+F③D−→−△A+E ④F+Ba(NO3)2→白色沉淀+NaNO3 回答下列问题(1)写出它们的化学式:A B C D EF 。
(2)写出①②③④反应的化学方程式,属于离子反应的只写离子方程式①②③④29.有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成,为检验它们做了如下实验:(1)将固体混合物溶于水,搅拌后得无色透明溶液(2)往此溶液中滴加硝酸钡溶液,有白色沉淀生成(3)过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解,试判断:固体混合物中肯定有,肯定没有,可能有,对可能有的物质,可采用滤液中滴加溶液方法来检验。
四、实验题30.分别用一种试剂将下列物质中混入的少量杂质除去(括号内为混入的杂质)试剂HNO3(H2SO4)Cu(Fe)ZnSO4(CuSO4)NaCl(Na2CO3)31.一学生设计了如下实验方法分离NaCl和CaCl2两种固体混合物填空和回答下列问题(1)B物质是(写化学式)(2)按此实验方案分离得到的NaCl,经分析含有杂质,是因为上述方案中某一步设计有毛病,这一步的正确设计方案应是。