高三一轮复习《氯及化合物》教学案
- 格式:doc
- 大小:116.50 KB
- 文档页数:5

高三化学一轮复习学案9 氯及其重要化合物(课前案)一、氯气的性质1.物理性质:通常情况下氯气为色气体,有气味,比空气密度,能溶于水,毒性。
2.化学性质(1)与金属单质反应(除Au、Pt以外的所有金属)写出相应的化学方程式:铁在氯气中燃烧(产生色的烟)铜在氯气中燃烧(产生色的烟)钠在氯气中燃烧(产生色的烟)(2)与非金属单质的反应H2在Cl2中燃烧时产生色火焰,生成白雾。
化学方程式为。
H2和Cl2的混合气体在光照的条件下会发生剧烈反应而爆炸。
(3)与水反应:离子方程式为(4)与碱反应:实验室中常用NaOH溶液吸收多余的氯气,其化学方程式。
(5)与还原性物质反应(写出相应的离子方程式)①通入SO2的水溶液中②通入氢硫酸中③通入FeCl2溶液中④通入KI溶液中思考:干燥的液氯能否储存在钢瓶中?二、氯的重要化合物1.次氯酸(1)不稳定性:或条件时易分解,化学方程式为。
(新制饱和氯水应该保存在试剂瓶中。
)(2)弱酸性:属于一元弱酸,且比碳酸的酸性,电离方程式为。
(3)强氧化性,因为有强氧化性而具有。
2.次氯酸盐(1)强氧化性:ClO- 与S2- 、I-、Fe2+、SO32-等都因发生氧化还原反应而不能大量共存;可用做漂白剂。
(2)ClO- 容易水解,水解的离子方程式为。
3. 漂白粉(1)制取原理:。
有效成分为。
(2)漂白原理:。
所以必须保存。
思考:新制氯水、久置氯水、液氯的成分有何不同?新制氯水中通入硫化氢气体方程式:洁厕灵和84消毒液混用失效方程式:三、氯气的制备1.工业制法——电解法化学方程式为2.实验室制法①原理(化学方程式)(取消加热装置)KMnO4和浓盐酸反应方程式制取氯气:②装置:制取纯净干燥的氯气,除杂试剂依次是,。
收集方法:或尾气处理试剂。
Cl- 的检验:加酸化的溶液,若有产生,证明有Cl-存在。
四、卤素1.溴和碘单质物理性质的比较物理性质溴单质(Br2)碘单质(I2)颜色、状态溶解性和溶液颜色水中CCl4中特性易挥发易升华①.碘的特性:碘易升华,淀粉遇碘变蓝。




【高三】2021届高考化学第一轮氯及其化合物导学案复习第11讲:氯及其化合物[内容与分析]本节课复习的内容是氯及其化合物的性质与应用。
主要是通过氯气与单质的反应,氯气与水的反应氯气与碱的反应,但在其反应过程中应该记住反应的现象。
第二个问题就是关于氯气的制法上,它是一个气体的制备实验,是高考过程中的主要实验考查的方向,所以本节课是复习的重要内容。
应该重要的地方放在两个地方,这样就能加强这两个方面的训练。
[目的和分析]1.目标1.了解元素氯及其重要化合物的主要性质和应用。
2.了解氯元素单质及其重要化合物对环境质量的影响。
2.目标分析1.了解氯元素单质及其重要化合物的主要性质及应用。
就是指氯与单质的反应,氯与水的反应,氯与碱的反应,其应用主要是体现在氯与碱的反应中作为漂白液与漂***的制取。
2.了解元素氯及其重要化合物对环境质量的影响。
这意味着氯是有毒的,因此尾气必须在收集过程中被吸收,并作为一种物质产生。
【问题诊断分析】本节学生的难点在于复习过程中氯的计算,尤其是氯制备的实验问题,因为在这个过程中氯的计算中,氯化氢必须过量,因为这种物质是反应中的浓缩溶液。
因此,我们应该和学生们一起清楚地分析这个问题。
【教学条件支持】这门课主要是通过PPT,因为它可以加快复习速度,节省复习时间。
【复习过程】问题一:氯的结构和性质设计意图:结构决定性质。
学习物质的性质,首先要清楚他的结构。
师生活动:1。
氯的原子结构?氯元素位于第三周期第ⅶa族,其原子结构示意图为,氯原子最外层有7个电子易得到1个电子而形成氯离子,是活泼的非金属元素。
在自然界中以化合态形式存在。
2.氯气的物理性质?通常情况下,氯气是黄绿色,有刺激性气味的气体,密度比空气大,易溶于水,有毒,易液化。
推断:通常是解决特殊气体颜色问题的关键。
3.氯气的化学性质?(1)与金属的反应2na+cl2======2nacl(现象:黄色火焰,白烟)cu+cl2=cucl2 2fe+3cl2=2fecl3(2)与非金属反应H2+cl22hcl(现象:安静燃烧,火焰苍白)hcl溶于水形成盐酸,工业上利用此方法生产盐酸。
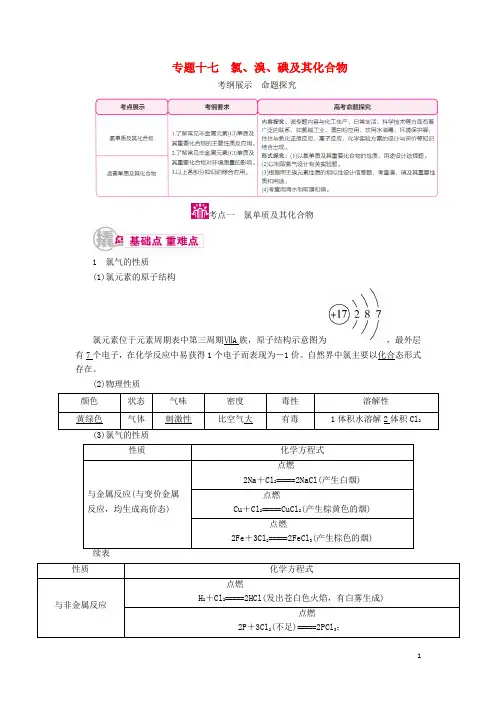
专题十七氯、溴、碘及其化合物考纲展示命题探究考点一氯单质及其化合物1 氯气的性质(1)氯元素的原子结构氯元素位于元素周期表中第三周期ⅦA 族,原子结构示意图为,最外层有7个电子,在化学反应中易获得1个电子而表现为-1价。
自然界中氯主要以化合态形式存在。
(2)物理性质学霸巧学卡(1)图解氯气的性质(2)Cl 2与变价金属反应,均生成高价态金属氯化物。
(3)氯气与水的反应中,氯气既作氧化剂又作还原剂:(4)常温下干燥的氯气或液氯均不与铁反应,故液氯通常储存在钢瓶中。
(5)Cl 2的用途:重要的化工原料,可用于制盐酸、漂白粉、含氯有机物等。
2 氯气的制法 (1)工业制法——电解法2NaCl +2H 2O=====通电2NaOH +H 2↑+Cl 2↑ (2)实验室制法①实验装置用强氧化剂(如KMnO4、K2Cr2O7、KClO3、MnO2等)氧化浓盐酸:②验满方法a.将湿润的淀粉碘化钾试纸靠近盛Cl2的瓶口,观察到试纸立即变蓝,则证明已集满。
b.将湿润的蓝色石蕊试纸靠近盛Cl2的瓶口,观察到试纸先变红后褪色,则证明已集满。
c.实验室制取Cl2时,也常常根据集气瓶中气体的颜色来判断是否集满。
学霸巧学卡(1)反应物的选择:必须用浓盐酸,稀盐酸与MnO2不反应,且随着反应的进行,浓盐酸变为稀盐酸时,反应停止,故盐酸中的HCl不可能全部参加反应。
(2)加热温度:不宜过高,以减少HCl挥发。
(3)尾气吸收:Cl2有毒,必须有尾气吸收装置,常用吸收剂为NaOH溶液或碱石灰,不用澄清石灰水,因澄清石灰水中Ca(OH)2浓度小,吸收慢且吸收不完全。
(4)实验结束后,先排出残留的Cl2,再拆卸装置,避免污染空气。
(5)Cl2在水中的溶解度不大,可不用防倒吸装置。
3 氯水的性质(1)氯水的成分分析氯水中存在三个平衡关系:①Cl2+H2+HClO。
++ClO-。
③H2++OH-。
(2)氯水的多重性质氯水的多种成分决定了它具有多重性质:①Cl2的强氧化性;②HCl的强酸性;③HClO的强氧化性、弱酸性;④Cl-的性质。

2015届高三化学一轮复习导学案No.18 编写人:周德功学生姓名:___________课题氯及其化合物考纲要求1、了解氯及其重要化合物的主要性质及应用。
2、了解氯及其重要化合物对环境质量的影响。
学习重难点氯及其化合物的主要性质及应用1、[2014·四川卷] 下列关于物质分类的说法正确的是( )A.金刚石、白磷都属于单质 B.漂白粉、石英都属于纯净物C.氯化铵、次氯酸都属于强电解质 D.葡萄糖、蛋白质都属于高分子化2、[2014·全国卷] N A表示阿伏伽德罗常数,下列叙述正确的是( )A.1 mol FeI2与足量氯气反应时转移的电子数为2N AB.2 L 0.5 mol·L-1硫酸钾溶液中阴离子所带电荷数为N AC.1 mol Na2O2固体中含离子总数为4N AD.丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6N A3、下列与含氯化合物有关的说法正确的是()A.HClO是弱酸,所以NaClO是弱电解质B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体C. HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物D.电解NaCl溶液得到22.4LH2(标准状况),理论上需要转移N A个电子4、[2014·天津卷] 实验室制备下列气体时,所用方法正确的是( )A.制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置B.制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体C.制乙烯时,用排水法或向上排空气法收集气体D.制二氧化氮时,用水或NaOH溶液吸收尾气5、[2014·江苏] 在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO 6、[2014.全国卷I] 化学与社会、生活密切相关。

2019年高考化学一轮复习精品资料【考试说明】1.了解氯元素单质及其重要化合物的主要性质及应用。
2.了解氯元素单质及其重要化合物对环境质量的影响。
3.能通过元素周期律和原子结构理论知识,认识卤族元素性质的相似性和递变性,了解氟、氯、溴、碘在物理性质和化学性质上的特殊性。
4.能利用卤素阴离子性质的差别进行物质的鉴别。
5.卤族元素与化工生产相结合的资源综合利用。
【命题规律】氯及其化合物是历届各地高考的热点之一。
其考查形式为:(1)以实验题型考查氯气的制备、净化、性质探究等;(2)结合氧化还原反应和化学反应原理考查氯的化合物的性质及制备等。
以选择题型和实验题型结合海水资源的综合利用考查溴、碘及其化合物的性质、制备等。
一、氯及其化合物的性质和应用1.氯气的物理性质颜色状态气味密度毒性溶解性1体积水溶解约黄绿色气体刺激性比空气大有毒2体积Cl2【特别提醒】实验室里闻有毒气体及未知气体气味的方法是用手在瓶口轻轻扇动,仅使极少量气体飘进鼻孔。
(如图所示)2.从氯的原子结构认识氯气的化学性质——氧化性――――――――→得1e-H 2,Fe ,I-(1)与金属反应:与变价金属反应生成高价金属氯化物。
①与铁反应:2Fe +3Cl 2=====点燃2FeCl 3。
②与铜反应:Cu +Cl 2=====点燃CuCl 2。
(2)与非金属反应 与H 2反应:H 2+Cl 2=====点燃或光照2HCl 。
现象—――→燃烧时安静燃烧,发出苍白色火焰,瓶口有白雾――→光照时剧烈反应,发生爆炸,瓶口有白雾(3)与还原性无机化合物反应:①与碘化钾溶液反应:Cl 2+2KI===2KCl +I 2。
②与SO 2水溶液反应:Cl 2+SO 2+2H 2O===H 2SO 4+2HCl 。
③与FeCl 2溶液反应:Cl 2+2FeCl 2===2FeCl 3。
3.从化合价的角度认识Cl 2的化学性质——歧化反应氯气与水或碱反应,氯的化合价既有升高又有降低,因而氯气既表现氧化性又表现还原性。

课型 课时 学科 高一化学备课时间教师姓名课 题氯及其化合物教学目标1、了解氯元素单质及其重要化合物的制备方法,掌握其主要性质及其应用;2、了解氯元素单质及其重要化合物对环境的影响;3、掌握氯气的实验室制法重难点:一.氯单质及其化合物的性质与应用;二.氯气的实验室制法;三.卤素的性质及卤素离子的检验教师活动学生活动【教学过程】考点一 氯单质及其化合物的性质与应用一、氯气的性质 1.氯气的物理性质颜色 气味 毒性 密度 特性 黄绿色强烈刺激性气味有毒比空气大易液化[注意] 实验室里闻有毒气体及未知气体气味的方法是用手在瓶口轻轻扇动,仅使极少量气体飘进鼻孔。
(如图所示)2.从氯的原子结构认识氯气的化学性质——氧化性(1)与金属反应:与变价金属反应生成高价金属氯化物。
①与铁反应:2Fe +3Cl 2=====点燃2FeCl 3。
②与铜反应:Cu +Cl 2=====点燃CuCl 2。
(2)与非金属反应与H 2反应:H 2+Cl 2=====点燃或光照2HCl 。
(3)与还原性无机化合物反应①与碘化钾溶液反应:Cl 2+2KI===2KCl +I 2。
②与SO 2水溶液反应:Cl 2+SO 2+2H 2O===H 2SO 4+2HCl 。
③与FeCl 2溶液反应:2FeCl 2+Cl 2===2FeCl 3。
3.从化合价的角度认识Cl 2的化学性质——歧化反应氯气与水或碱反应,氯的化合价既有升高又有降低,因而氯气既表现氧化性又表现还原性。
(1)与水反应氯气与水反应的化学方程式:Cl 2+H 2O HCl +HClO 。
(2)与碱(NaOH)反应反应的离子方程式:Cl 2+2OH -===Cl -+ClO -+H 2O 。
[注意] (1)Cl 2具有强氧化性,与变价金属反应时均生成高价态的金属氯化物,如FeCl 2不能由两种单质化合而成。
(2)干燥的Cl 2没有漂白性,但Cl 2能使湿润的有色布条褪色,起漂白作用的是HClO ,故不能用pH 试纸测量氯水的pH 。


卤素及其化合物Ⅰ.课标要求1.通过实验了解氯气及其重要化合物主要性质及在生产中应用。
2.认识氯气及其重要化合物对生态环境影响。
Ⅱ.考纲要求1.了解氯气及其重要化合物主要性质及在生产中应用。
2.了解氯气及其重要化合物对环境质量影响。
Ⅲ.教材精讲一、氯气性质及用途1.物理性质:常温下,氯气是黄绿色、有刺激性、能溶于水、比空气重、易液化有毒气体。
2.化学性质:氯气化学性质很活泼非金属单质。
〔1〕与金属反响〔与变价金属反响,均是金属氧化成高价态〕如:①2Na+Cl2 2NaCl〔产生白烟〕②Cu+Cl2CuCl2〔产生棕黄色烟〕③2Fe+3Cl22FeCl3〔产生棕色烟〕注:常温下枯燥氯气或液氯不与铁反响,所以液氯通常储存在钢瓶中。
〔2〕与非金属反响如:①H2+Cl22HCl〔发出苍白色火焰,有白雾生成〕——可用于工业制盐酸H2+Cl22HCl〔会发生爆炸〕——不可用于工业制盐酸②2P+3Cl22PCl3〔氯气缺乏;产生白雾〕2P+5Cl22PCl5〔氯气充足;产生白烟〕〔3〕与水反响:Cl2+H2O = HCl+HClO〔4〕与碱反响Cl2+2NaOH = NaCl+NaClO+H2O〔用于除去多余氯气〕2Cl2+2Ca(OH)2 = Ca(ClO)2+CaCl2+2H2O〔用于制漂粉精〕Ca(ClO)2+CO2+H2O = CaCO3↓+2HClO〔漂粉精漂白原理〕〔5〕与某些复原性物质反响如:①2FeCl2+Cl2 = 2FeCl3②2KI+Cl2 = 2KCl + I2〔使湿润淀粉-KI试纸变蓝色,用于氯气检验〕③SO2+Cl2+2H2O = 2HCl + H2SO4〔6〕与某些有机物反响如:①CH4+Cl2 CH3Cl + HCl〔取代反响〕②CH2=CH2+Cl2→ CH2ClCH2Cl〔加成反响〕3.氯水成分及性质氯气溶于水得黄绿色溶液----氯水。
在氯水中有少局部氯分子与水反响,Cl2 + H2O = HCl + HClO (次氯酸),大局部是以Cl2分子状态存在于水中。
非金属元素氯及其化合物知识梳理一、氯气1.氯气的物理性质氯气呈色有气味,毒,密度比空气易液化,能溶于水的气体。
2.氯气的化学性质( 活泼的非金属单质,是强氧化剂。
)(1)与金属的反应(写出钠、铁、铜在氯气中燃烧的化学方程式),,。
(室温下干躁Cl2与Fe不反应,所以液氯可以贮存在钢瓶中)(2)与H2的反应氯气能在氢气中安静地燃烧,发出色火焰。
氯气和氢气混合光照或点燃,能发生。
化学方程式为(3)与水的反应Cl2 + H2O ,离子方程式为。
【氯水】新制的氯水是黄绿色的液体,久置的氯水是无色。
氯水具有强酸性和强氧化性。
①写出氯水中存在的平衡。
②氯水中存在的粒子..,其中使氯水呈黄绿色的是;具有强氧化性、漂白性以及能杀菌消毒的是,该粒子不稳定见光易分解,化学方程式为。
③氯水的保存。
(4)与碱的反应Cl2 + NaOH =(常用与吸收多余的Cl2 )。
Cl2 + Ca(OH)2 =(工业制漂白精)【思考题】漂白液和漂白粉的有效成分是NaClO和Ca(ClO)2,它们能给水消毒的化学方程式为,暴露在空气中变质也是如此。
(5)与还原性物质的反应Cl2 + FeCl2 =Cl2 + H2S (HBr HI) =Cl2 + Na2SO3 =Cl2 + FeBr2=(6)与有机物的反应Cl2 + CH4 →Cl2 + C2H4 →3.氯气实验室制法(1)反应原理:MnO2 + 4HCl(浓) MnCl2+Cl2↑+2H2O。
离子方程式是:【讨论】说出C、D、E、F四个装置各起作用的原理是什么?4.氯气工业制法(用方程式表示)。
二、氯离子的检验方法:向待测溶液中滴加用稀硝酸酸化的硝酸银溶液,有白色沉淀生成,离子方程式是。
【实验探究】某溶液中含有SO42-和Cl-两种阴离子,试设计实验方案检验这两种离子。
三、卤族元素(一)卤族元素位于周期表的,包括等元素。
(二)相似性1.最外层都是个电子,常见的负化合价为价。
氯、溴、碘的正化合价为+1、+2、+3、+5、+7价。
2. 卤素都是活泼的,具有较强的性。
与水、碱溶液反应时,除氟气外均可发生卤素的自身氧化还原反应。
3.卤化氢为气体,溶与水,在潮湿空气中形成,水溶液都是挥发性的酸。
4. 卤素单质都有颜色。
卤化银见光分解。
(三)特性1.Br2是常温下唯一呈液态的非金属单质,易挥发,蒸气有毒。
保存液溴采用水封法。
2.I2单质易升华,淀粉遇I2变蓝;AgI可用与人工降雨,碘盐可防止甲状腺肿。
3.HClO4是常见含氧酸中最强酸,而HClO是氯的含氧酸中氧化性最强的酸。
4.F2、HF均腐蚀玻璃。
AgF易溶与水。
5.F2不能把氯、溴、碘从氢化物或盐溶液中置换出来,因发生2F2 + 2H2O = 4HF + O2常见考点考点1 物质的化学性质1.下列实验操作正确的是( )A.将氢氧化钠固体放在纸上称量B.用10ml量筒量取8.58ml蒸馏水C.制取氯气时,用二氧化锰与浓盐酸在常温下反应,并用排水集气法收集D.配制氯化铁溶液时,将一定量氯化铁溶解在较浓盐酸中,再用水稀释到所需浓度2.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。
实验室可通过以下反应制得ClO2:2KClO3 + H2C2O4 + H2SO4 = 2ClO2+ K2SO4 + 2 CO2+ 2 H2O下列说法正确的是( )A. KClO3在反应中得到电子B. ClO2是氧化产物C. H2C2O4在反应中被氧化D. 1mol KClO3参加反应有2mol电子转移3. 某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液,经测定ClO- 与ClO-3的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为( ) A. 21 :5 B. 11:3 C. 3:1 D. 4:14、在一定条件下,RO3n-和I-发生反应的离子方程式如下:RO3n- + 6I-+ 6H+=R-+3I2+3H2O(1)RO3n-中R元素的化合价是。
(2)R元素的原子最外层电子数是。
考点2 离子反应1.(09年广东化学·12)下列离子方程式正确的是A.向盐酸中滴加氨水:H++OH-=H2OB.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2OC.铜溶于稀硝酸:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2OD.Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+2.(09年江苏化学·9)下列化学实验事实及其解释都正确的是A.向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘B.向SO2水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸C.向0.1mol·L-1FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具有氧化性D.向2.0mL浓度均为0.1mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1 AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的K sp比AgI的K sp大3.(09年江苏化学·11)下列离子方程式与所述事实相符且正确的是A .漂白粉溶液在空气中失效:ClO -+CO 2+H 2O=HClO +HCO 3-B .用浓盐酸与MnO 2反应制取少量氯气:MnO 2+2H ++2Cl- △ Mn 2++Cl 2↑+2H 2O C .向NaAlO 2溶液中通入过量CO 2制Al(OH)3:AlO 2-+CO 2+2H 2O=Al(OH)3↓+HCO 3-D .在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na 2FeO 4:3ClO -+2Fe(OH)3=2FeO 42-+3Cl -+H 2O +4H +4.(09年宁夏理综·12)能正确表示下列反应的例子方程式是A .向次氯酸钙溶液通入过量CO 2:Ca 2++2ClO —+CO 2+H 2O =CaCO 3↓+2HClOB .向次氯酸钙溶液通入SO 2:Ca 2++2ClO —+SO 2+H 2O= CaSO 3↓+2HClOC .氢氧化钙溶液与碳酸氢镁溶液反应:HCO 3—+Ca 2++OH —=CaCO 3↓+H 2OD .在氯化亚铁溶液中加入稀硝酸:3Fe 2++4H ++NO 3—=3Fe 3++NO↑+2H 2O5、(上海高考题) 向 NaBr 、NaI 、Na 2SO 3混合溶液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是 (已知还原性SO 32- >I- ) ( )A.NaCl 、 Na 2SO 4B.NaCl 、NaBr 、Na 2SO 4C. NaCl 、 Na 2SO 4 、I 2D. NaCl 、NaI 、 Na 2SO 46、(江苏综合)在100ml 含等物质的量HBr 和H 2SO 3的溶液里通入0.01molCl 2,有一半Br -变为Br 2(已知Br 2能氧化H 2SO 3) 。
原溶液中HBr 和H 2SO 3的浓度都等于( )A.0.0075mol/LB.0.0018 mol/LC. 0.075 mol/LD.0.08 mol/L考点3 综合题1、(09年广东化学·9)下列浓度关系正确的是A .氯水中:c (Cl 2)=2 【c (ClO -)+c (Cl -)+C(HCl)】B .氯水中:c (Cl -)>c (H +)>c (OH -)>c (ClO -)C .等体积等浓度的氢氧化钠与醋酸混合:c (Na +)=c (CH 3COO -)D .Na 2CO 3溶液中:c (Na +)>c (CO 32-)>c (OH -)>c (HCO 3-)>c (H +)2、(09年全国理综卷I ·10)用0.1mol·L —1的盐酸滴定0.1mol·L —1的氨水,在滴定过程中不可能出现的结果是A .c (NH 4+)>c (Cl -),c (OH -)>c (H +)B .c (NH 4+)=c (Cl -),c (OH -)=c (H +)C .c (Cl -)>c (NH 4+),c (OH -)>c (H +)D .c (Cl -)>c (NH 4+),c (H +)>c (OH -)3、(09年广东文基·62)碘单质及其化合物具有重要应用。
下列说法正确的是A .12953I 与12753I 互为同位素 B .加碘食盐能使淀粉溶液变蓝C .从海带中提取I 2的过程只发生物理变化D .I 和Cl 是同族元素,HI 比HCl 稳定4、(09年山东理综·10)下列关于氯的说法正确的是A .Cl 2具有很强的氧化性,在化学反应中只能作氧化剂B .若3517Cl 、37 17若Cl 为不同的核素,有不同的化学性质学科C .实验室制备Cl 2,可用排放和食盐水集气法收集D .1.12LCl 2含有1.7N A 个质子(N A 表示阿伏伽德罗常数)5、(02上海)某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl 2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是A 、a 为正极,b 为负极;NaClO 和NaClB 、a 为负极,b 为正极;NaClO 和NaClC 、a 为阳极,b 为阴极;HClO 和NaClD 、a 为阴极,b 为阳极;HClO 和NaCl【课后练习】1.下列氯化物中,既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是( )A. CuCl 2B. FeCl 2C. FeCl 3D. AlCl 32. 氯水的漂白作用是通过 ( )A.中和作用 B. 氧化作用 C. 漂白粉分解 D. 还原作用3.漂白粉在空气中容易失效的原因是( )A.次氯酸不稳定,易分解 B. 氯化钙易潮解C.Ca(ClO)2易与盐酸反应 D. Ca(ClO)2易与空气中的CO2和H2O反应4.关于氯水的叙述正确的是( )A.氯水中只含Cl2和H2O分子B. 新制氯水可使红色石蕊试纸先变蓝后褪色C.光照氯水有汽泡冒出,该气体是Cl2D. 氯水放置数天后,pH值变小,几乎无漂白性5.检验氯化氢气体中是否混有氯气,可采用的方法是( )A.用干燥的蓝色石蕊试纸 B. 用干燥的有色布条C.将气体通入硝酸银溶液 D. 用湿润的淀粉碘化钾试纸6.为防止吸进氯气中毒,可以用浸有某种物质的水溶液的毛巾捂住鼻子。