酰化反应原理与实例解析
- 格式:doc
- 大小:1.76 MB
- 文档页数:27


乙酰苯胺的制备实验报告1. 实验目的本实验旨在通过对苯胺和乙酸的酰化反应,制备乙酰苯胺,并了解酰化反应的原理与条件。
2. 实验原理酰化反应是一种酸催化的化学反应,指的是酰基(-CO-R)与其他化合物反应生成酯。
本实验采用苯胺和乙酸在硫酸催化下的酰化反应。
反应方程式如下所示:苯胺 + 乙酸→ 乙酰苯胺 + 水3. 实验步骤3.1 材料准备•苯胺•乙酸•浓硫酸3.2 实验操作1.在实验室通风橱中,将100 mL圆底烧瓶称取苯胺(10 mL)。
2.加入一定量的浓硫酸(5 mL)。
3.加入适量的乙酸(10 mL)。
4.固定好烧瓶,并轻轻摇晃,使反应充分进行。
5.反应进行10分钟后,取出烧瓶,倒入冰水中进行冷却。
6.过滤得到白色固体。
7.用水洗涤固体并过滤。
8.将固体放入干燥器中,使其完全干燥。
9.称取干燥后的产物,记录质量。
4. 实验数据与结果经过实验操作,得到白色固体产物。
将产物称重,质量为X g。
5. 结果分析根据实验结果,通过苯胺和乙酸的酰化反应成功制备了乙酰苯胺。
产物质量的结果是实验成功的一个证明。
6. 总结与思考酰化反应是一种重要的有机合成反应,通过本实验,我们了解了酰化反应的原理与条件,并成功地制备了乙酰苯胺。
在实验过程中,我们对硫酸的用量要控制得当,过量的硫酸可能会导致产物的杂质增加。
同时,在反应进行时的搅拌也是重要的,它可以促进反应的进行。
未来的实验中,可以进一步改进实验条件,提高产物的纯度和产率。
7. 实验注意事项1.实验操作应在通风橱中进行,避免酸气对人体造成伤害。
2.实验中使用的玻璃仪器要注意轻拿轻放,避免破裂。
3.实验结束后,及时清理实验台和仪器设备,确保实验环境的整洁与安全。
以上为执行实验所得,文档中的所有内容都是根据用户提供的标题生成的,并不代表实际的实验过程或结果。


rh催化的不对称氢酰化全合成全文共四篇示例,供您参考第一篇示例:随着有机合成化学领域的不断发展,催化剂的设计和应用在现代有机合成中起着至关重要的作用。
铑(rhodium)催化的不对称氢酰化反应作为一种重要的手性合成方法,广泛应用于天然产物全合成和医药化学领域。
本文将介绍rh催化的不对称氢酰化全合成的原理、反应条件、机理以及一些代表性实例。
1. 催化原理不对称氢酰化是一种通过使用手性催化剂在不对称碳-碳双键处催化加成的反应,实现对手性酮或羧酸的构造。
在这一反应中,铑催化剂能够催化烯烃与甲酰氯在氢气的存在下发生对映选择性的氢化反应,生成手性醇或羧酸衍生物。
铑催化的不对称氢酰化反应不仅选择性高,而且反应底物范围广,可广泛应用于天然产物的全合成。
2. 反应条件(1)催化剂:铑(Rh)催化剂通常采用手性的膦配体配合物,如TPPTS、Josiphos等,以提高对映选择性。
(2)底物:反应底物通常是不对称的烯烃或烷酮,通过选择合适的配体和反应条件,可以获得高对映选择性的产物。
(3)氢源:气相氢气或溶解的氢气是不对称氢酰化反应的氢源,通过调节氢气的压力和反应温度,可以有效地控制反应的进行。
3. 反应机理铑催化的不对称氢酰化反应机理复杂,通常包括氢气的活化、氢化加成和脱氢等多个步骤。
在手性膦配体的配合下,铑催化剂可与底物形成配合物,然后活化氢气,催化底物与甲酰氯的反应进行,最终得到手性醇或羧酸产物。
4. 代表性实例铑催化的不对称氢酰化反应在有机合成领域得到了广泛的应用,例如在对马来酸八肽的全合成中,通过铑催化的不对称氢酰化反应成功合成了手性醇中间体,从而实现了对马来酸八肽的高效合成;在重要的抗癌药物诺维拉宁的全合成过程中,也采用了铑催化的不对称氢酰化反应,有效地实现了手性酮中间体的合成。
铑催化的不对称氢酰化全合成是一种重要的手性合成方法,具有高对映选择性、底物范围广、产物结构多样等优点,对于天然产物的合成以及医药化学领域具有重要的应用前景。






第四章酰化技术本章教学设计工作任务通过本章的学习及本课程实训,完成以下三个方面的工作任务:1、围绕典型产品的生产过程,完成以羧酸、羧酸酯为酰化剂制备酰胺类产品;2、围绕典型药品生产过程,完成以酸酐、酰氯为酰化剂生产酰胺类产品;3、围绕典型药物的生产过程,完成用羧酸法、酯交换法、酸酐法、酰氯法生产酯类产品。
学习目标1、掌握羧酸、羧酸酯、酸酐、酰氯酰化剂的特点、适用范围、使用条件及其N-酰化、酯化中的应用;2、掌握根据不同的被酰化物,正确选择酰化剂、反应条件的方法;3、掌握生产中操作及注意事项;4、掌握Friedel-Crafts酰化反应的基本原理、影响因素以及在药物合成中的应用,在生产中的应用及注意事项5、理解Hoesch反应、Gattermann反应、Vilsmeier反应的用途、适用条件及在药物合成中的应用;6、掌握活性亚甲基化合物α位C-酰化的原理、使用条件及在药物合成中的应用;7、了解新型酰化剂及其在医药科研、生产中的新技术与应用学时安排课堂教学10学时现场教学6学时实训项目项目一:对氯苯甲酰苯甲酸的制备项目二:扑热息痛的制备项目三:草酸二乙酯的制备学习目标● 掌握羧酸酰化剂、羧酸酯酰化剂的特点、适用范围、使用条件及其N-酰化中的应用; ● 掌握根据不同的被酰化物,正确选择酰化剂、反应条件的方法。
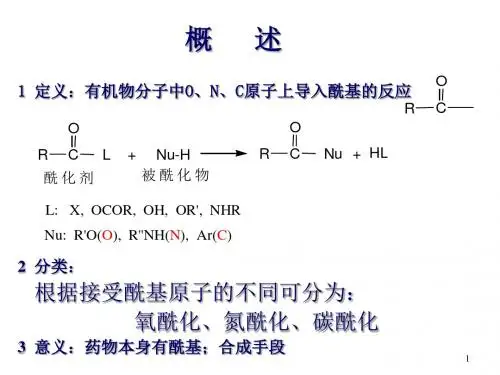
● 掌握生产中操作及注意事项● 了解新型酰化剂及其在医药科研、生产中的新技术与应用第四章 酰化技术第一节 概述一、酰化反应 1. 概念酰化反应就是指有机物分子中与氧、氮、碳、硫等原子相连的氢被酰基取代的反应。
酰基 就是指从含氧的有机酸、无机酸或磺酸等分子中脱去羟基后所剩余的基团。
2. 反应通式RZOR SOHZ(式中RCOZ 为酰化剂,Z 代表X,OCOR,OH,OR ˊ,NHR ″等;SH 为被酰化物,S 代表R ˊO 、R ″、Ar 等。
)二、常用酰化剂及其活性★1.常用酰化剂:羧酸、羧酸酯、酸酐、酰氯等酰化剂的活性规律:当酰化剂(RCOZ)中R 基相同时,其酰化能力随Z —的离去能力增大而增加(即酰化剂的酰化能力随离去基团的稳定性增加而增大)★常用酰化试剂的酰化能力强弱顺序:酰氯 >酸酐 > 羧酸酯 > 羧酸 > 酰胺三、酰化反应在化学制药中的应用永久性酰化 制备含有某些官能团的药物 保护性酰化第二节 N-酰化常用酰化剂:羧酸酰化剂、羧酸酯酰化剂、酸酐酰化剂与酰氯酰化剂 一、羧酸酰化剂 1、反应过程R C NR'R''O R C L O NR'R''R C LO R'R''NHH HL_★2、适用对象 羧酸就是弱的酰化试剂,一般适用于酰化活性较强的胺类。
3、反应条件及催化剂 (1)反应条件酸过量 为了加速反应,并使反应向生成酰胺的方向移动,必须使反应物之一过量,通常就是酸过量。
脱水 可用以下方法脱水高温熔融脱水酰化法 适用于稳定铵盐的脱水,例如苯甲酸与苯胺加热到225℃进行脱水,可制得N-苯甲酰苯胺。
反应精馏脱水法 主要用于乙酸与芳胺的N-酰化,例如,将乙酸与苯胺加热至沸腾,用蒸馏法先蒸出含水乙酸,然后减压蒸出多余的乙酸,即可得N-乙酰苯胺。
溶剂共沸脱水法 主要用于甲酸(沸点100.8℃)与芳胺的N-酰化反应。
(以上方法大多在较高温度下进行,因此,不适合热敏性酸或胺) (2)催化剂强酸作催化剂 适用于活性较强的胺类的酰化缩合剂作催化剂 适用于活性弱的胺类、热敏性的酸或胺类 常用的此类缩合剂有★DCC (Dicyclohexylcarbodiimide,二环己基碳二亚胺) DIC (Diisopropyl Carbodiimide,二异丙基碳二亚胺)等。
DCC 就是一个良好的脱水剂,以DCC 作脱水剂用羧酸直接酰化,条件温与,收率高,在复杂结构的酰胺、半合成抗生素及多肽的合成中有较多的应用。
CH 2OCONHCH 2COOHHOCH 2CHCOOC 2H 5NH 2DCC/HTFHOCH 2CHCOOC 2H 5NHCOCH 2NHCOOCH 2(83%)r.t.H (27)NHPh 3C NH Ph 3C CHCO (67%)DCCNS CH 3CH 3COOCH 2PhN S CH 3CH 3COOCH 2PhONSCONHCH 3CH 3COOHONSNH 2Me Me COOHORCOOHr.t.R二、羧酸酯酰化剂 反应过程R'O RCR C O 2R''C OH R C OR'O R''NH H 1.反应物活性(1)对于羧酸酯(RCOOR ˊ)位阻 若酰基中R 空间位阻大,则活性小 电性 有吸电子取代基则活性高,易酰化。
离去基团的稳定性 离去基团越稳定,则活性越高 (2)对于胺类胺的碱性 碱性越强,活性越高, 空间位阻 空间位阻越小,活性越高(3)羧酸二酯与二胺类化合物,如果反应后能得到稳定的六元环,则反应易发生。
如哌拉西林等青霉素药物中间体乙基-2,3-哌嗪二酮(6)催眠药苯巴比妥(Phenobarbital,7)等的合成。
C 2H 5NHCH 2CH 2NH 2NHN OO 2H 5(COOC 2H 5)250C 2H 5OH2(6 )C(COOC 2H 5)2C 2H 5PhO NH 2H 2N CC 2H 5Ph C NNC OOH H ( 7 )2.催化剂(1)强碱作催化剂 由于酯的活性较弱因此在反应中常用碱作为催化剂脱掉质子,以增加胺的亲核性。
用的碱性催化剂有醇钠或更强的碱,如NaNH2、n-BuLi 、LiAlH4、Na 等 (2)反应物胺作催化剂 过量的反应物胺也可起催化作用。
(3)催化剂的选择与反应物的活性有关 反应物活性越高,则可选用较弱的碱催化;反之,则需用较强的碱催化。
(4)在此类酰化反应中还可加入BBr3来提高酰化的收率。
CH 3COCH 2COOC 2H 5PhCH 2NH 2CH 3COCH 2CONHCH 2PhN S OOOHCOOCH 3CH3NH 2N(8)N S OOOHCONH CH 3NCOOC 2H 5COOC 2H 5NH 2ClCONH CONHClCl3.活性酯制备活性酯时主要考虑增加酯分子中离去基团的稳定性,以促使其离去CH 3COO CH 3CH 2O CH 3CH 2( 9 )PhCH 2COO NHRNRO NHR NR( 10)RCOOO 2N NO 2O 2N NO 2O( 11 )★4、生产实例(头孢噻肟酸的合成)N SH 2NC C ON OCH 3SSN +SOH 2N COOHCH 2OCOCH 33N SH 2NCC ONOCH 3N SOCOOH CH 2OCOCH 3H将7—ACA 、水、丙酮加入反应体系中,降温,加入三乙胺、活性酯,反应至7-ACA 基本消失后,加有机酸酸,有头孢噻肟酸沉淀生成。
操作注意事项(1)水与丙酮的配比 (2)三乙胺用量及滴加速度 (3)活性酯质量 (4)终点检测(5)有机酸的种类及用量 (6)温度控制 流程框图学习目标● 掌握酸酐酰化剂、酰氯酰化剂的特点、适用范围、使用条件及其N-酰化中的应用; ● 掌握根据不同的被酰化物,正确选择酰化剂、反应条件的方法。
● 掌握生产中操作及注意事项● 了解新型酰化剂及其在医药科研、生产中的新技术与应用第二节 N-酰化三、酸酐酰化剂 1、反应过程产品7-ACA 水 丙酮三乙胺 活性酯注: TLC 检测终点(RCO)2OR'R''H( ArNH 2 )酸或碱RCONR'R''( RCONHAr ) RCOOH★2、反应条件与催化剂酸酐 用量 一般略高于理论量的5~10%(不可逆),最常用的酸酐就是乙酸酐,通常在20~90℃可顺利进行反应(活性高)溶剂不另加溶剂 被酰化的胺与酰化产物熔点不太高时 非水惰性有机溶剂 被酰化的胺与酰化产物熔点较高时水 被酰化的胺与酰化产物易溶于水(乙酰化速度比乙酸酐的水解速度快) ★3、应用脂肪族酸酐主要用于较难酰化的胺类(酸酐酰化能力强)CH 3CH 2NHCH 2CH 2H 2SO 4CH 3CH 2NCH 2CH 23Ac 2O环状的酸酐为酰化剂时,制得二酰亚胺类化合物(高温)C OOO PhCH 2CHCOOH NH 2N CHCOOH CH 2PhC O O(95%)4、混合酸酐★特点反应活性更强 应用范围更广位阻大或离去基团离去能力强制备 混合酸酐由某些位阻大的羧酸与一些试剂作用制得★5、生产实例(1)头孢拉定的生产头孢拉定的合成就是以双氢苯甘氨酸(DHPC)为原料,成盐后经两次缩合制成混酐,再与7-ADCA 进行酰化反应,而后经水解、中与、结晶与精制等过程制得的。
反应过程(2)对硝基―α―乙酰氨基苯乙酮(氯霉素中间体)的制备 反应过程2O 2NONH 2·HCl + CH 3COONa +(CH 3CO)2O2O 2NONH COCH 3+ 2CH 3COOH + NaCl操作过程向乙酰化反应罐中加入母液加入乙酸酐,搅拌均匀后,先慢后快地加入38%~40%的乙酸钠溶液。
反应,测定反应终点 终点到达后,冷却 析出晶体,过滤、洗涤 甩干称重交缩合岗位滤液回收乙酸钠终点测定取少量反应液,过滤,往滤液中加入碳酸氢钠溶液中与至碱性,在40℃左右加热后放置15min,滤液澄清不显红色示终点到达,若滤液显红色或混浊,应适当补加乙酸酐与乙酸钠溶液,继续反应。
★反应条件及影响因素PH值PH过低,在酸的影响下反应物会进一步环合,PH过高,不仅游离的氨基酮会发生双分子缩合,而且乙酰化物也会发生双分子缩合。
加料次序与加乙酸钠的速度四、酰氯酰化剂酰氯性质活泼,很容易与胺反应生成酰胺反应为不可逆)反应过程RCOCl R'NH 2(ArNH2)RCONHR' (RCONHAr)HCl1.反应条件(1)加入碱性试剂以中与生成的氯化氢(防止氯化氢与胺反应成铵盐)中与生成的氯化氢可采用三种形式使用过量的胺反应加入有机碱(同时起到催化作用)加入无机碱(2)反应采用的溶剂常常根据所用的酰化试剂而定对于高级的脂肪酰氯由于其亲水性差,而且容易分解,应在无水有机溶剂如氯仿、乙酸、苯、甲苯、乙醚、二氯乙烷以及吡啶等中进行。
吡啶既可做溶剂,又可中与氯化氢,还能促进反应,但由于其毒性大,在工业上应尽量避免使用。
对于乙酰氯等低级的脂肪酰氯由于其反应速度快,反应可以在水中进行。
为了减少酰氯水解的副反应,常在滴加酰氯的同时,不断滴加氢氧化钠溶液、碳酸钠溶液或固体碳酸钠,始终控制反应体系的pH值在7~8左右对于芳酰氯芳酰氯的活性比低级的脂肪酰氯稍差,反应温度需要高一些,但一般不易水解,可以在强碱性水介质中进行反应。