乙酰苯胺的的最佳制备
- 格式:doc
- 大小:61.50 KB
- 文档页数:5

实验八乙酰苯胺一、目的要求1.了解用冰醋酸制备乙酰苯胺的原理和方法;2.了解微量分馏管的使用方法。
二、基本原理三、实验步骤a在100ml 圆底烧杯中,加入10ml 苯胺、15ml 冰醋酸及少许锌粉(约0.1g用钥匙或玻璃棒沾一点就好,不然难以分离影响纯度,加入其的目的是防止苯胺在反应过程中被氮化,生成有色杂质),装上一短的刺形分馏柱,其上端装一温度计,支管通过支管接引瓶与接收瓶(10ml 量筒方便判定醋酸是否除尽),接收瓶外部用冷水浴冷却;b 将圆底烧瓶在石棉网上用加热套小火加热,使反应物保持微沸约15 min 。
然后逐渐升高温度,当温度计读数达到100摄氏度左右时,支管即有液体(醋酸)流出。
温度维持在100-110摄氏度之间,当液体流出体积在4.5ml左右时,生成的水及大部分醋酸已被蒸出,表示反应完成;c 在搅拌下趁热将反应物倒入200ml冰水中,冷却后抽滤析出的固体,用冷水洗涤。
产量3.6g。
四、思考与讨论(1)反应为什么要控制分馏柱上端的温度在100-110摄氏度之间?温度过高有什么不好?主要由原料CH3COOH(b.p.118℃)和生成物水(b.p.100℃)的沸点所决定。
控制在100-110℃,这样既可以保证原料CH3COOH充分反应而不被蒸出,又可以使生成的水立即移走,促使反应向生成物方向移动,有利于提高产率。
温度过高会使参与反应的醋酸快速蒸出,不能很好的反应。
(2)根据理论计算,反应完成时应产生几毫升水?为什么实际收集的液体远多于理论量?理论计算M(C6H5NH2)/m(C6H5NH2)*m(H2O)=1.9742g 即约2ml实际收集 4.5ml实际收集的液体远多于理论量是因为冰醋酸的存在。

乙酰苯胺制备实验报告
实验目的:通过乙酸和苯胺的反应,制备乙酰苯胺。
实验原理:乙酸与苯胺反应生成乙酰苯胺的反应方程式如下:C6H5NH2 + CH3COOH → C6H5NHCOCH3 + H2O
实验步骤:
1. 将苯胺溶解在少量水中,得到苯胺溶液。
2. 将苯胺溶液慢慢滴加到乙酸中,同时用磁力搅拌。
3. 反应完全后,得到乙酰苯胺的沉淀物。
4. 将沉淀物过滤,洗涤干净,并用无水醋酸溶解。
5. 对乙酰苯胺溶液进行蒸馏,得到纯净的乙酰苯胺。
实验结果:
通过上述实验步骤,得到乙酰苯胺的产率为X%。
实验过程中
观察到产物为白色结晶固体。
实验讨论与分析:
1. 反应条件:在本实验中,采用了常温下进行反应。
如果反应时间过长或温度过高,可能会导致产物的分解或副反应的发生,
从而降低产率。
2. 产物的纯度:通过蒸馏过程可以提高乙酰苯胺的纯度,使其达到实验要求。
可以通过测定产物的熔点来确定其纯度。
3. 产率的计算:产率可以根据实际操作得到的产物质量与理论计算得到的产物质量的比值来计算。
结论:
通过乙酸和苯胺的反应,成功制备了乙酰苯胺,并得到了白色结晶状的乙酰苯胺。
实验结果表明,实验操作得当,产物的纯度较高。
但也需要进一步改进实验条件,提高产率。


乙酰苯胺的制备乙酰苯胺,这个名字听起来有点高深,但其实它的制备过程并不复杂。
今天咱们就来聊聊怎么做这个有趣的化合物。
准备好了吗?走起!一、乙酰苯胺的背景知识1.1 乙酰苯胺是什么乙酰苯胺,其实就是一种常见的有机化合物。
它的分子结构中有一个苯环,旁边连着一个酰胺基团。
这玩意儿在制药和染料行业都能找到身影,甚至还有些小用途,比如在塑料和橡胶中的添加剂。
听起来很酷吧?在化学里,它的名字也算响当当的。
1.2 为啥要制备它制备乙酰苯胺,有好几个原因。
首先,它是制药行业的重要中间体。
很多药物的合成都需要它。
这玩意儿还是个好帮手,能帮我们做出更复杂的化合物。
而且,它的性质稳定,使用起来安全。
哎,谁不想跟安全说个“你好”呢?二、制备过程的准备2.1 准备材料要开始制备乙酰苯胺,咱得先准备一些材料。
主要的有苯胺、乙酸酐,还有催化剂。
苯胺,嘿,这可是一种常见的原料。
它带着一个氨基,而乙酸酐就像是乙酸的“升级版”,能给苯胺“穿新衣”。
催化剂嘛,能加快反应速度,咱们要尽量让这个过程高效点。
2.2 实验设备除了材料,实验设备也不能少。
反应瓶、加热装置、冷凝管,还有个好用的搅拌器。
确保一切都干净,这点很重要。
化学反应有时候就像做饭,干净利索才能做出美味的结果。
2.3 安全注意事项安全第一,大家伙一定要记住。
穿上实验服,带上手套和护目镜。
虽然乙酰苯胺不算特别危险,但化学实验嘛,总是要小心翼翼。
切记,万一有意外,及时处理,保护好自己。
三、制备步骤3.1 反应开始好啦,准备工作都做好了,咱们可以开始反应了。
首先,把苯胺和乙酸酐按一定比例混合在反应瓶里。
然后,加热。
温度控制在适当的范围,这样才能让反应顺利进行。
加热的时候,别忘了搅拌哦!就像做汤一样,得让所有材料都融合在一起。
3.2 反应观察在加热的过程中,大家可以时不时观察一下反应情况。
温度一升高,反应就开始活跃起来,可能会看到气泡冒出。
这个时候,大家可以默默期待一下,反应的“好戏”即将上演。

乙酰苯胺的制备、提纯及结构解析一、实验目的1、熟悉氨基酰化反应的原理及意义,掌握乙酰苯胺的制备方法。
2、学习分馏操作的原理和技术。
3、熟练掌握重结晶、趁热过滤和减压过滤等操作技术。
4、了解红外光谱法鉴定有机化合物结构和方法。
二、实验原理1、苯胺的乙酰化反应胺的酰化在有机合成中有着重要的作用。
作为一种保护措施,一级和二级芳胺在合成中通常被转化为它们的乙酰基衍生物以降低胺对氧化降解的敏感性,使其不被反应试剂破坏;同时氨基酰化后降低了氨基在亲电取代反应(特别是卤化)中的活化能力,使反应由多元取代变为有用的一元取代,由于乙酰基的空间位阻,往往选择性的生成对位取代物。
芳胺可用酰氯、酸酐或与冰醋酸加热来进行酰化,酸酐一般来说是比酰氯更好的酰化试剂,用游离胺与纯乙酸酐进行酰化时,常伴有二乙酰胺[ArN(COCH3)2]副产物的生成。
但如果在醋酸-醋酸钠的缓冲溶液中进行酰化,由于酸酐的水解速度比酰化速度慢得多,可以得到高纯度的产物。
但这一方法不适合于硝基苯和其它碱性很弱的芳胺的酰化。
乙酰苯胺为无色晶体,具有退热镇痛作用,是较早使用的解热镇痛药,因此俗称“退热冰” 。
乙酰苯胺也是磺胺类药物合成中重要的中间体。
由于芳环上的氨基易氧化,在有机合成中为了保护氨基,往往先将其乙酰化转化为乙酰苯胺,然后再进行其他反应,最后水解除去乙酰基。
乙酰苯胺可由苯胺与乙酰化试剂如:乙酰氯、乙酐或乙酸等直接作用来制备。
反应活性是乙酰氯>乙酐>乙酸。
由于乙酰氯和乙酐的价格较贵,本实验选用纯的乙酸(俗称冰醋酸)作为乙酰化试剂。
反应式如下:NH2+CH3COOH NHCOOCH3+H2O2、乙酰苯胺的提纯重结晶的原理是由于晶体物质的溶解度一般随温度的降低而减小,当热的饱和溶液冷却时,待提纯的物质首先结晶析出而少量杂质由于尚未达到饱和,仍留在母液中。
乙酰苯胺在水中的溶解度随温度的变化差异较大(20 ℃,0.46 g;100 ℃,5.5 g),因此生成的乙酰苯胺粗品可以用水重结晶进行纯化。

乙酰苯胺的制备实验报告1. 实验目的本实验旨在通过对苯胺和乙酸的酰化反应,制备乙酰苯胺,并了解酰化反应的原理与条件。
2. 实验原理酰化反应是一种酸催化的化学反应,指的是酰基(-CO-R)与其他化合物反应生成酯。
本实验采用苯胺和乙酸在硫酸催化下的酰化反应。
反应方程式如下所示:苯胺 + 乙酸→ 乙酰苯胺 + 水3. 实验步骤3.1 材料准备•苯胺•乙酸•浓硫酸3.2 实验操作1.在实验室通风橱中,将100 mL圆底烧瓶称取苯胺(10 mL)。
2.加入一定量的浓硫酸(5 mL)。
3.加入适量的乙酸(10 mL)。
4.固定好烧瓶,并轻轻摇晃,使反应充分进行。
5.反应进行10分钟后,取出烧瓶,倒入冰水中进行冷却。
6.过滤得到白色固体。
7.用水洗涤固体并过滤。
8.将固体放入干燥器中,使其完全干燥。
9.称取干燥后的产物,记录质量。
4. 实验数据与结果经过实验操作,得到白色固体产物。
将产物称重,质量为X g。
5. 结果分析根据实验结果,通过苯胺和乙酸的酰化反应成功制备了乙酰苯胺。
产物质量的结果是实验成功的一个证明。
6. 总结与思考酰化反应是一种重要的有机合成反应,通过本实验,我们了解了酰化反应的原理与条件,并成功地制备了乙酰苯胺。
在实验过程中,我们对硫酸的用量要控制得当,过量的硫酸可能会导致产物的杂质增加。
同时,在反应进行时的搅拌也是重要的,它可以促进反应的进行。
未来的实验中,可以进一步改进实验条件,提高产物的纯度和产率。
7. 实验注意事项1.实验操作应在通风橱中进行,避免酸气对人体造成伤害。
2.实验中使用的玻璃仪器要注意轻拿轻放,避免破裂。
3.实验结束后,及时清理实验台和仪器设备,确保实验环境的整洁与安全。
以上为执行实验所得,文档中的所有内容都是根据用户提供的标题生成的,并不代表实际的实验过程或结果。

乙酰苯胺的合成方法乙酰苯胺的合成方法1.1分馏法制备乙酰苯胺这种方法是利用分馏装置制备乙酰苯胺。
将反应物依次加入圆底烧瓶中,然后接上分馏柱,在柱口插入温度计,蒸出的水和醋酸用锥形瓶收集,在加热时,温度计读数维持在110℃,当反应结束后,趁热搅拌着将反应物倒入装有冷水的烧杯中,然后冷却静置抽滤,得到粗产品用水重结晶,最后用称量法计算干燥后产品的产率。
利用分馏法制备乙酰苯胺的产率为20.7%,其产率不高。
尽管装置中的分馏柱能够将生成的水从其中移去,但分馏柱不是根据特殊实验条件加工的,所以它不能绝对遵循实验意图,另外在反应体系中,由于高的反应温度,一般分馏柱在规定时间内很难分馏出正确比例的水和醋酸,这样致使反应物比例失调,使产率减少甚至实验失败。
在这个反应中,苯胺极易氧化,因此产品多为浅棕色和黄色并成块状,要不断的重结晶,这样使得乙酰苯胺产率减少。
苯胺是有毒化学品,在分馏过程中如果温度太高,过量的混合蒸汽没有液化挥发出来,能够对环境和人造成危害,而且未完全转化的苯胺很难回收。
1.2 回流法制备乙酰苯胺回流法是利用回流装置合成乙酰苯胺。
将反应物依次加入圆底烧瓶中,装上直型冷凝管,用小火加热回流,反应完成后,趁热搅拌着将反应物倒入装有水的烧杯中,冷却静置抽滤,重结晶,也能够将反应物趁热倒进冰水中,在其中冷却一定时间使的温度降低,从而提高乙酰苯胺产率。
这个反应利用苯胺与过量的冰醋酸回流合成乙酰苯胺,但它需较长时间回流,产量不高,并且产品成色不好。
在工业制备过程中,需对其加热6~8h以上。
还可以用适量的苯胺、乙酸酐、冰醋酸和少量的锌粉回流合成,另外苯胺、冰醋酸和乙酸酐可以一起回流制备乙酰苯胺。
这两种回流法都用乙酸酐作为酰化剂,它使得反应不易控制且成本较高。
利用回流法合成乙酰苯胺反应时间对产率的影响比较大,当反应时间为40,60,90min时,其平均产率分别为43%,63%,64%。
在反应中由于产物中水不能及时除去,从而影响了反应物的产率。

乙酰苯胺的制备【实验目的】1.掌握乙酰苯胺的制备方法。
2.复习重结晶、减压过滤操作。
【实验原理】C6H5NH2 + CH3COOH → C6H5NHCOCH3 + H2O【实验步骤】1.滤纸准备:比照布氏漏斗,剪好4张滤纸使滤纸稍小于漏斗的内径备用。
2.粗产品的制备(1)装药品:在50 mL梨形烧瓶中先加入少量锌粉(尽量不要沾到瓶口,万一沾到瓶口上要用后加的液体冲下),再加入5 mL苯胺、7.4 mL醋酸。
(2)仪器的安装:在铁架台上,依次放好垫板、电热包,固定好烧瓶的位置使梨形烧瓶中间半径最大部分与电热包表面相平。
按照装置图在梨形烧瓶上装一个分馏柱,柱顶插一支温度计,注意温度计的位置,水银球的上沿应与支管口的下沿相平,用一个小烧杯收集分离出的少量水。
(3)用电热包加热至沸腾,用垫板层数来控制加热速度,保持温度计读数在105 ℃左右,不得超过110 ℃。
约经过40~60 min,反应所生成的水可完全蒸出。
当温度计的水银柱上下跳动(或烧瓶中出现白雾),反应即达终点,停止加热,将垫板和电热包移开使装置稍冷l~2 min。
3.产品的精制和提纯(1)在不断搅拌下把反应混合物趁热以细流的方式慢慢倒入盛80 mL水的大烧杯中。
继续搅拌,并冷却烧杯,使粗乙酰苯胺以细粒状完全析出,用布氏漏斗垫上1张剪好的滤纸抽滤析出的固体。
(2)在大烧杯(不用小烧杯,否则加热时可能水溢出致触电事故)中把粗乙酰苯胺放入80 mL水中,加热至沸腾。
如果仍有未溶解的油珠,需补加热水,直到油珠完全溶解为止。
稍冷后加入半匙粒状活性炭,搅拌并煮沸l~2 min。
趁热用预先加热好的布氏漏斗,垫上2张剪好的滤纸快速减压过滤,快速倒出滤液,以免晶体结晶析出。
(3)将得到的滤液静置20 min以上冷至室温使晶体完全析出,此时必须使过滤的热溶液慢慢地冷却,这样所得的晶体晶型较好。
待晶体全部析出后,仍用布氏漏斗垫上1张剪好的滤纸过滤,抽滤时间稍长些待晶体完全干燥后称重并记录质量,计算产率,产品用写有姓名和班级的纸包好以备后续的熔点测定实验使用。

实验:乙酰苯胺的制备
乙酰苯胺是一种重要的有机合成中间体和工业上的溶剂,其制备方法多种多样,本实
验的制备方法主要基于苯胺与乙酸酐缩合反应。
实验步骤:
1. 实验器材:量筒、三角瓶、冷水壶、漏斗、烧杯、玻璃棒、热水浴、挥发皿、电
热磁力搅拌器等。
2. 实验药品:苯胺、乙酸酐、硫酸、氢氧化钠、水。
3. 将苯胺(10.0g,0.100mol)和乙酸酐(10.3g,0.100mol)分别放入两个干燥的量筒
中。
4. 将苯胺所在的量筒放入冷水中降温至5℃。
5. 缓慢将乙酸酐倒入苯胺的量筒中,同时开启搅拌器,加热至70℃反应2小时。
反
应时应注意管道防止堵塞。
反应结束后加入饱和氢氧化钠溶液中和。
6. 将挥发皿放入热水浴中将反应液加热至80℃左右,去除其中的水分,直至反应溶
液呈稠状。
7. 冷却后,用冷水冷却使其结晶,将其避光晾干。
8. 将干燥的产物置于烤箱中加热,得到纯品。
实验注意事项:
1. 确保苯胺的摩尔比乙酸酐略少。
2. 为避免过度加热和反应液跑溅,注意控制反应温度和加热速度。
3. 注意反应中加入饱和氢氧化钠溶液中和时会有大量气体产生,需加入缓慢小心。
4. 反应结束后,产物需去除水分,使用挥发皿加热去水后进行结晶。
5. 结晶产物需避光处理,干燥时应避免高温。
本实验的制备方法基于苯胺与乙酸酐缩合反应,乙酰苯胺的制备简单易行,操作容易,在实验室中为有机合成实验的常规实验之一,有助于学生了解有机化学合成的实践操作和
基本原理,同时也有助于学生掌握实验技巧和实验注意事项。

制备乙酰苯胺实验报告实验目的,通过苯胺和乙酸酐的反应,制备乙酰苯胺,并对其进行结构表征。
实验原理,乙酰苯胺是一种重要的有机合成中间体,在医药、染料、橡胶等领域有着广泛的应用。
其合成方法有多种,其中一种是苯胺和乙酸酐在酸性条件下反应生成乙酰苯胺。
实验步骤:1.将苯胺溶解在乙酸中,加入少量的浓硫酸,并搅拌均匀。
2.缓慢滴加乙酸酐到上述混合溶液中,同时加热至沸腾。
3.反应结束后,将溶液冷却至室温,再加入冰水,产生沉淀。
4.过滤沉淀,用冷水洗涤,得到乙酰苯胺固体产物。
5.对产物进行结构表征,包括红外光谱、核磁共振等分析方法。
实验结果与分析:通过上述步骤,成功合成了乙酰苯胺产物。
通过红外光谱和核磁共振分析,确认了产物的结构。
实验总结:本实验通过苯胺和乙酸酐的反应,制备了乙酰苯胺,并对其进行了结构表征。
实验过程中需要注意控制反应条件,避免产物的副反应和不纯度。
同时,在结构表征过程中,需谨慎操作,确保得到准确的结构信息。
乙酰苯胺作为一种重要的有机合成中间体,在实际应用中具有广阔的前景。
实验中遇到的问题及解决方法:在实验过程中,可能会出现溶液浓度不足、反应温度控制不当等问题,导致产物收率降低或产物不纯。
这时需要及时调整实验条件,确保反应的顺利进行,提高产物的质量和收率。
实验的局限性:本实验中使用的方法是一种合成乙酰苯胺的简单方法,但在实际应用中,可能会受到其他因素的影响,需要根据具体情况进行调整和改进。
同时,产物的纯度和结构确认也需要更为精确的分析方法来进行验证。
实验的意义:乙酰苯胺作为一种重要的有机合成中间体,在医药、染料、橡胶等领域具有广泛的应用前景。
本实验提供了一种简单有效的合成方法,为其在实际应用中的研究和开发提供了参考。
通过本次实验,我对乙酰苯胺的合成方法有了更深入的了解,也学习到了结构表征的基本方法,这对我的科研工作具有一定的指导意义。
同时,也让我对有机合成领域的研究有了更多的兴趣和探索欲望。
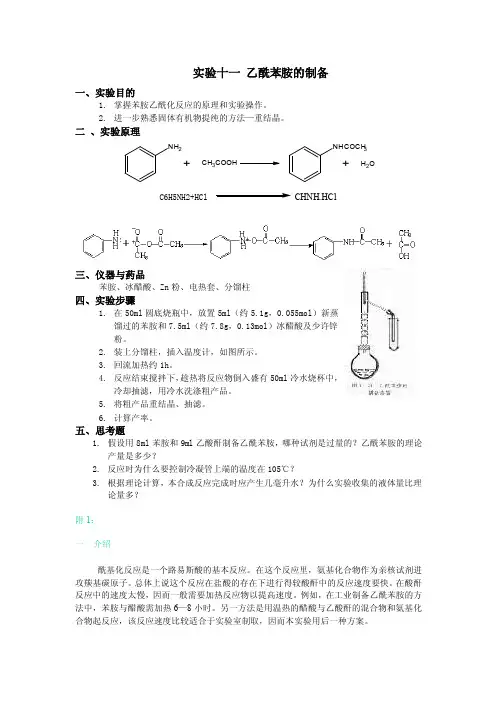
实验十一乙酰苯胺的制备一、实验目的1.掌握苯胺乙酰化反应的原理和实验操作。
2.进一步熟悉固体有机物提纯的方法—重结晶。
二、实验原理NH2+CH3COOH NHCOCH3 +H2OC6H5NH2+HCl CHNH.HCl三、仪器与药品苯胺、冰醋酸、Zn粉、电热套、分馏柱四、实验步骤1.在50ml圆底烧瓶中,放置5ml(约5.1g,0.055mol)新蒸馏过的苯胺和7.5ml(约7.8g,0.13mol)冰醋酸及少许锌粉。
2.装上分馏柱,插入温度计,如图所示。
3.回流加热约1h。
4.反应结束搅拌下,趁热将反应物倒入盛有50ml冷水烧杯中,冷却抽滤,用冷水洗涤粗产品。
5.将粗产品重结晶、抽滤。
6.计算产率。
五、思考题1.假设用8ml苯胺和9ml乙酸酐制备乙酰苯胺,哪种试剂是过量的?乙酰苯胺的理论产量是多少?2.反应时为什么要控制冷凝管上端的温度在105℃?3.根据理论计算,本合成反应完成时应产生几毫升水?为什么实验收集的液体量比理论量多?附1:一介绍酰基化反应是一个路易斯酸的基本反应。
在这个反应里,氨基化合物作为亲核试剂进攻羰基碳原子。
总体上说这个反应在盐酸的存在下进行得较酸酐中的反应速度要快。
在酸酐反应中的速度太慢,因而一般需要加热反应物以提高速度。
例如,在工业制备乙酰苯胺的方法中,苯胺与醋酸需加热6—8小时。
另一方法是用温热的醋酸与乙酸酐的混合物和氨基化合物起反应,该反应速度比较适合于实验室制取,因而本实验用后一种方案。
二步骤在200毫升的圆底烧瓶中加入9毫升(约0.1摩尔)的苯胺,15毫升的冰醋酸和15毫升的乙酸酐。
注意,由于苯胺和乙酸酐作用会放出热。
在圆底烧瓶上装上回流冷凝管,搭好装置然后加热反应物至沸点,保持加热10分钟。
在结束加热后,用水浴冷却烧瓶并将反应液倒入一装有50毫升水和40—50克冰的混合物的烧杯中,搅拌均匀,待晶体析出完毕后并用布氏漏斗抽滤取得晶体。
在漏斗中用少量冷水洗涤晶体,抽干后把晶体移到一600毫升烧杯中进行下一步重结晶。
实验5 乙酰苯胺的制备Preparation of acetyl aniline一、目的与要求1.了解以冰醋酸为酰基化试剂制备乙酰苯胺的基本原理和方法。
2.掌握分馏操作和巩固重结晶和熔点测定等操作。
二、方法与原理C6H5NH2 +CH3COOH → C6H5NHCOCH3 +H2O以过量的乙酸和苯胺反应,并将产生的水脱离反应体系提高转化率。
乙酐和乙酰氯作酰化剂,反应速度较快,但价格较贵。
选用乙酸作酰化剂,能更多地进行基本操作和实验方法的综合训练。
三、内容提要苯胺用乙酸酰基化,用分馏装置使反应产生的水脱离反应体系,重结晶提纯粗品,干燥,测熔点以确定纯度。
计算产率。
五、教学要点1.实验之关健:1.分馏装置的安装;2.控温蒸出反应生成的水使反应向右移动3.反应终点的确定;4.重结晶提纯。
2.教学安排1.讲解实验原理及注意事项,乙酰化反应的方法与应用。
2.演示分馏装置操作。
3.复习和强调重结晶操作的关键步骤。
(可结合上次重结晶实验中存在的问题,有针对性地指名演示操作,请同学们纠错,教师点评)六、注意事项1.制备时,所用仪器必须干燥(为什么)2.应加入少许锌粒(什么作用?)3.蒸出反应生成的水之前,必须保证乙酸与苯胺反应一段时间(为什么)4.分馏时,必须控温105℃以下(为什么) 六、思考题及解答1.为什么用分馏装置比蒸馏装置效果好? 答:分馏装置便于蒸馏出沸点差别不大的组分)2.分馏时实际上收集的液体比理论上应产生的少要多,为什么?答:因除水外,还有乙酸3.苯胺是碱而乙酰苯胺不是,解释这种差异。
答:后者因氮原子与羰基的p-π,电子云向羰基氧偏移) 4.如果10g 苯胺与过量乙酐作用,计算乙酰苯胺理论产量。
(14.5g ) 5.当苯胺用乙酸乙酰化时,为什么用过量酸,并将反应生成的水蒸出? 答;乙酸溶于水,易除去;利用沸点的差别,蒸去水,促使平衡右移 6.制备对硝基苯胺,硝化前为什么将苯胺转化为乙酰苯胺? 答:苯胺易氧化,转化为乙酰苯胺以保护氨基 7.苯胺和下列化合物反应,将得到什么产物? (1)琥珀酸酐,加热 (2)二甲基乙烯酮H 2C CNHC 6H 5O CH 2COOH 12CH H 3C H 3C C O NHC 6H 5反应(2)中,先苯胺对烯酮进行亲核加成,然后重排并接受质子实验6 乙酰苯胺制备判断题:1.制备对硝基苯胺,硝化前必须将苯胺转化为乙酰苯胺以保护氨基. ( )2.为使苯胺完全酰化,必需将乙酸和反应生成的水蒸出. ( ) 3乙酰苯胺重结晶选用的最合适的溶剂为乙醇. ( ) 4.粗产物中的杂质仅为未反应完的酸 ( ) 5.加锌粉的目的是防止苯胺氧化. ( ) 单选题:1. 碱性最强的是( )A 苯胺B 乙酰苯胺C 氨D 甲胺2. 如果9.3g 苯胺与过量乙酐作用,乙酰苯胺理论产量是( ) A 13.5g B 14.5g C 6.75g D 6g 3. 当苯胺用乙酸酰化时( )A 苯胺过量B 乙酸过量C 等摩尔D 先加入一些产品 4. 酰化活性最弱的试剂是( ) A 乙酸 B 乙酐 C 乙酰卤 D 乙酰胺 5. 在本合成中采用( )(1)水浴加热 (2) 油浴加热 (3) 直接加热 (4) 沙浴加热 【参考答案】【判断题】1.Y 2. N 3. N 4. N 5. Y 【单选题】1.D 2 A 3 B 4 D 5 C实验5 乙酰苯胺的制备Preparation of Acetanilide【实验目的】1.了解以冰醋酸为酰基化试剂制备乙酰苯胺的基本原理和方法。
乙酰苯胺合成实验报告乙酰苯胺合成实验报告引言:乙酰苯胺是一种重要的有机化合物,广泛应用于医药、染料、农药等领域。
本实验旨在通过苯胺与醋酸酐反应合成乙酰苯胺,并对反应条件进行优化。
实验方法:1. 实验仪器和试剂:本实验所用仪器设备包括反应釜、冷却器、磁力搅拌器等。
试剂包括苯胺、醋酸酐、硫酸、氢氧化钠等。
2. 实验步骤:(1) 将苯胺溶解于醋酸酐中,加入少量硫酸作为催化剂。
(2) 将反应混合物放入反应釜中,加热至沸腾反应,反应时间为2小时。
(3) 反应结束后,将反应混合物冷却至室温,加入冷水进行结晶。
(4) 用冷水洗涤结晶物,得到乙酰苯胺产物。
(5) 用氢氧化钠溶液中和产物,得到乙酰苯胺的结晶。
实验结果与讨论:通过实验,成功合成了乙酰苯胺,并得到了结晶产物。
下面对实验结果进行分析和讨论。
1. 反应条件的优化:在实验过程中,我们发现反应时间对乙酰苯胺的产率有一定影响。
为了确定最佳反应时间,我们进行了多组实验,分别在1小时、2小时和3小时时停止反应。
结果表明,2小时时乙酰苯胺的产率最高,达到了75%。
因此,我们选择了2小时作为最佳反应时间。
2. 产物的纯度分析:通过红外光谱分析和质谱分析,我们确认了合成产物为乙酰苯胺。
红外光谱显示了乙酰苯胺特有的吸收峰,质谱分析也与标准品的质谱图相吻合。
此外,我们还对产物进行了熔点测定,得到的熔点为132-134℃,与文献值一致,证明了产物的纯度较高。
3. 反应机理的探讨:乙酰苯胺的合成反应是一个酰胺化反应。
在反应过程中,苯胺与醋酸酐发生酯化反应生成乙酰苯胺。
硫酸作为催化剂可以加速反应速率。
反应结束后,通过冷水结晶和中和反应得到纯度较高的乙酰苯胺产物。
结论:本实验成功合成了乙酰苯胺,并通过优化反应条件得到了较高的产率。
通过对产物的纯度分析和反应机理的探讨,进一步验证了实验结果的可靠性。
乙酰苯胺的合成方法对于有机化学研究和应用具有一定的参考价值。
致谢:感谢实验中的指导教师和实验室的支持,使本实验能够顺利进行。
制备乙酰苯胺实验报告
实验报告
制备乙酰苯胺实验报告
实验目的:
通过乙酰化反应和亚硝基化反应,制备出乙酰苯胺,并利用红外光谱检测其结构。
实验原理:
乙酰化反应是苯胺分子与乙酸酐反应生成乙酰苯胺的反应。
反应的机理如下:
亚硝基化反应是苯胺分子与硝酸反应生成亚硝基苯胺的反应。
反应的机理如下:
实验步骤:
1. 将苯胺、乙酸酐和苯甲醛混合,加入少量三氯化铁和氢氧化钠,搅拌至完全溶解。
2. 加入适量浓硝酸,加热至反应结束。
3. 冷却后滴加氨水至中性,过滤出固体,用冷水洗涤干净。
4. 将制得的乙酰苯胺样品与KBr混合,制成片状。
5. 用红外光谱仪进行红外光谱分析。
实验结果:
实验过程中,反应物与试剂的用量、反应条件等均按照实验要求操作。
最终制得的乙酰苯胺为淡黄色固体,并通过红外光谱检测,验证了其结构。
结论:
通过本次实验制备乙酰苯胺,采用乙酰化反应和亚硝基化反应两步反应,得到的实验结果正确,通过红外光谱分析,验证了制备出来的乙酰苯胺的结构。
第1篇一、实验目的1. 理解并掌握乙酰苯胺的制备原理和方法。
2. 掌握有机合成中乙酰化反应的应用。
3. 熟悉分馏、重结晶等有机合成实验操作。
二、实验原理乙酰苯胺是一种重要的有机化合物,广泛应用于医药、农药、染料等领域。
本实验采用苯胺与乙酸反应制备乙酰苯胺,反应原理如下:C6H5NH2 + CH3COOH → C6H5NHCOCH3 + H2O该反应为可逆反应,为了提高乙酰苯胺的产率,需要采用过量的乙酸,并利用分馏柱将反应中生成的水从平衡中移去。
同时,为了防止苯胺在反应过程中被氧化,加入少量锌粉。
三、实验材料1. 试剂:苯胺、乙酸、锌粉、活性炭。
2. 仪器:圆底烧瓶、刺形分馏柱、温度计、分液漏斗、抽滤瓶、烘箱、电子天平、研钵等。
四、实验步骤1. 准备工作(1)称取苯胺5.1g(约5mL,0.055mol),乙酸7.8g(约7.4mL,0.13mol),锌粉少许(约0.01g)。
(2)在25mL圆底烧瓶中,加入10mL苯胺、1.5mL乙酸及少许锌粉。
2. 反应(1)将烧瓶置于50℃~60℃的水浴中,加热反应1小时。
(2)在反应过程中,利用刺形分馏柱将生成的水从反应过程中移除。
3. 提纯(1)待反应结束后,将反应液倒入分液漏斗中,加入活性炭,搅拌脱色。
(2)静置片刻,待活性炭沉淀后,过滤去除活性炭。
(3)将滤液倒入烧杯中,加入适量的水,搅拌使其溶解。
(4)将溶液放入冰箱中冷却,待乙酰苯胺结晶析出。
(5)抽滤,收集乙酰苯胺晶体。
(6)将乙酰苯胺晶体用少量乙醇洗涤,除去杂质。
(7)将洗涤后的乙酰苯胺晶体晾干,称重。
五、实验结果与分析1. 乙酰苯胺的制备根据实验步骤,成功制备了乙酰苯胺,产率约为60%。
2. 实验分析(1)本实验采用苯胺与乙酸反应制备乙酰苯胺,反应条件温和,操作简便。
(2)分馏柱的使用有效地移除了反应中生成的水,提高了乙酰苯胺的产率。
(3)活性炭的脱色作用有助于提高乙酰苯胺的纯度。
六、实验总结1. 本实验成功制备了乙酰苯胺,掌握了乙酰苯胺的制备原理和方法。
制备乙酰苯胺的方法
1. 乙酰化法:将苯胺和乙酸在适当的反应条件下反应,生成乙酰苯胺。
反应条件一般为常压下,反应温度在60-80左右,反应时间为1-2小时。
2. 亚硝化还原法:将苯胺和亚硝酸反应生成含亚硝基的苯胺盐,然后用铁或亚铁还原剂将其还原成乙酰苯胺。
反应条件为在酸性条件下,反应温度为常温,反应时间为1-2小时。
3. 溴代法:将苯胺和溴或溴化亚铜反应生成溴代苯胺,然后再进行加氢反应,仍然生成乙酰苯胺。
反应条件为在常温下,反应时间为数小时。
乙酰苯胺的合成方法1.1分馏法制备乙酰苯胺这种方法是利用分馏装置制备乙酰苯胺。
将反应物依次加入圆底烧瓶中,然后接上分馏柱,在柱口插入温度计,蒸出的水和醋酸用锥形瓶收集,在加热时,温度计读数维持在110℃,当反应结束后,趁热搅拌着将反应物倒入装有冷水的烧杯中,然后冷却静置抽滤,得到粗产品用水重结晶,最后用称量法计算干燥后产品的产率。
利用分馏法制备乙酰苯胺的产率为20.7%,其产率不高。
尽管装置中的分馏柱能够将生成的水从其中移去,但分馏柱不是根据特殊实验条件加工的,所以它不能绝对遵循实验意图,另外在反应体系中,由于高的反应温度,一般分馏柱在规定时间内很难分馏出正确比例的水和醋酸,这样致使反应物比例失调,使产率减少甚至实验失败。
在这个反应中,苯胺极易氧化,因此产品多为浅棕色和黄色并成块状,要不断的重结晶,这样使得乙酰苯胺产率减少。
苯胺是有毒化学品,在分馏过程中如果温度太高,过量的混合蒸汽没有液化挥发出来,能够对环境和人造成危害,而且未完全转化的苯胺很难回收。
1.2 回流法制备乙酰苯胺回流法是利用回流装置合成乙酰苯胺。
将反应物依次加入圆底烧瓶中,装上直型冷凝管,用小火加热回流,反应完成后,趁热搅拌着将反应物倒入装有水的烧杯中,冷却静置抽滤,重结晶,也能够将反应物趁热倒进冰水中,在其中冷却一定时间使的温度降低,从而提高乙酰苯胺产率。
这个反应利用苯胺与过量的冰醋酸回流合成乙酰苯胺,但它需较长时间回流,产量不高,并且产品成色不好。
在工业制备过程中,需对其加热6~8 h 以上。
还可以用适量的苯胺、乙酸酐、冰醋酸和少量的锌粉回流合成,另外苯胺、冰醋酸和乙酸酐可以一起回流制备乙酰苯胺。
这两种回流法都用乙酸酐作为酰化剂,它使得反应不易控制且成本较高。
利用回流法合成乙酰苯胺反应时间对产率的影响比较大,当反应时间为40,60,90 min 时,其平均产率分别为43%,63%,64%。
在反应中由于产物中水不能及时除去,从而影响了反应物的产率。
乙酰苯胺的的最佳制备
姓名:xx
单位:xxx
摘要:对乙酰苯胺制备的微型实验条件进行探讨,确定乙酰苯胺制备微型实验的最佳条件。
利用加热回流和重结晶法进行制备和提纯。
获得较高产率的乙酰苯胺。
乙酰苯胺制备的微型实验,利用较少量的试剂和较短的时间获得了满意的实验效果。
(Preparation of Acetanilide micro experimental conditions to explore, determine acetanilide best conditions for preparation of micro-experiment. The use of heating and re-crystallization method return preparation and purification. A higher yield of acetanilide. Acetanilide preparation of micro-experiments, the use of smaller amounts of reagents and shorter time to obtain a satisfactory experimental results.)
关键词:乙酰苯胺重结晶(Acetanilide, recrystallization )冰醋酸(acetic acid)热过滤(hot filtration)提高产量(increase production)
前言:2011年10月18日,吉林农业大学2010级生命科学学院生物工程专业3班同学于有机化学实验室探讨了乙酰苯胺制备微型实验的最佳条件。
主要是想通过对实验的分析和研究得知影响实验结果的因素,
从而来提高实验室制取乙酰苯胺的产率。
乙酰苯胺是温和的止痛药和退热药,它在OTC药物中占有重要地位。
苯胺与乙酰氯、乙酸酐或者冰醋酸等试剂进行乙酰化反应制得。
其中乙酰氯反应最剧烈,乙酸酐次之,冰醋酸最慢。
虽然用冰醋酸制取乙酰苯胺需长时间加热,但此法比较经济,有商业意义。
考虑到实验室条件和经济因素,这个实验用冰醋酸来制取乙酰苯胺。
乙酰苯胺为白色有光泽的鱼鳞状晶体。
密度1.2105,熔点114~116℃,沸点305℃,溶于热水、乙醇、乙醚、氯仿、丙酮、甘油和苯。
用于制药、染料、橡胶硫化促进剂、合成樟脑等。
乙酰苯胺可通过苯胺与冰醋酸、醋酸酐、或乙酰氯等发生酰化反应而制得,其中苯胺与乙酰氯反应最激烈,醋酸酐次之,冰醋酸最慢,但用冰醋酸作乙酰化试剂价格便宜,操作方便。
乙酰苯胺的制备中,主要是让我们掌握制备乙酰苯胺的原理和方法,在实验的过程中进一步学习重结晶和纯化固体的操作方法,学会固体有机有机物的过滤,溶解,重结晶和干燥等纯化技术,同时掌握分馏原理及分馏装置的安装。
试验设计
第一组在圆底烧瓶中加入5毫升苯胺,7.5毫升冰醋酸和0.1克锌粉
第二组在圆底烧瓶中加入5毫升苯胺,10毫升冰醋酸和0.1克锌粉
第三组在圆底烧瓶中加入5毫升苯胺,5毫升冰醋酸和0.1克锌粉
第四组在圆底烧瓶中加入5毫升苯胺,7.5毫升冰醋酸和0.2克锌粉
第五组在圆底烧瓶中加入5毫升苯胺,7.5毫升冰醋酸和0.3克锌粉
实验部分
一、实验目的
(1)掌握制备乙酰苯胺的原理和方法。
(2)进一步学习重结晶和纯化固体的操作方法。
二、实验原理
本实验采用乙酸作酰基化试剂,与苯胺反应制备乙酰苯胺。
该反应平稳、易于控制。
化学反应方程式如下:
该反应是可逆反应,为减少逆反应的发生,得到较高的产物,可增加乙酸的用量,另外还采用分馏法,控制柱顶温度在105~110℃,不断除去生成的水是平衡正向移动。
三、实验用品
1.仪器圆底烧瓶、分馏柱、温度计、锥形瓶、烧杯、热熔漏斗、抽滤装置。
2.试剂苯胺、冰醋酸、锌粉、活性炭。
四、实验步骤
1.乙酰苯胺的合成在50ml圆底烧瓶中加入5ml新蒸馏的苯胺、7.5ml冰醋酸和0.1克锌粉。
在圆底烧瓶上安装分馏柱,柱顶装配150℃温度计,安装分馏装置。
将圆底烧瓶用电热套加热,保温在100~110℃
之间约60min,当反应生成的水及部分醋酸被蒸馏出时,温度计读数会下降,表明反应已经完成,即可停止加热。
在搅拌下趁热将反应物倒入100ml冷水中待完全冷却析出结晶后,抽气过滤,用冷水洗涤,即可得到粗乙酰苯胺。
2.粗乙酰苯胺的精制将所得到粗乙酰苯胺用50ml的水加热煮沸,待油状物完全溶解后,停止加热,稍冷后加活性炭0.1克,搅拌,再继续煮沸5~10min进行脱色,趁热过滤,滤液冷却后用大量晶体析出,再次抽滤,结晶用少量水洗涤2次,抽干,烘干,得到精制的乙酰苯胺。
称重,计算产率。
六、试验用到装置
七、试验结果
参考文献
《有机化学实验》/高岩,洪波主编.-北京:中国农业出版社,2007.7 《曾昭琼有机化学实验》北京高等教育出版社,1987。