(完整版)高中有机化学重要知识点详细整理,推荐文档
- 格式:pptx
- 大小:429.33 KB
- 文档页数:10


高中有机化学知识点总结一、有机化学基础1. 有机化合物的定义- 含有碳原子的化合物(除碳的氧化物、碳酸、碳酸盐等) - 碳原子的成键特性:碳原子可以形成四个共价键2. 碳的杂化- sp杂化:线性分子,如乙炔- sp^2杂化:平面三角形分子,如乙烯- sp^3杂化:四面体分子,如甲烷3. 有机化合物的命名- 烷烃的命名规则- 烯烃和炔烃的命名规则- 芳香烃的命名规则- 官能团的命名优先级4. 同分异构体- 构型异构:分子的三维结构不同- 立体异构:分子的空间排列不同二、有机化学反应类型1. 取代反应- 核式取代反应- 亲电取代反应- 亲核取代反应2. 加成反应- 马可尼科夫规则- 极性加成规则- 共轭加成3. 消除反应- 醇的脱水反应- 卤代烃的消除反应4. 氧化反应和还原反应- 有机化合物的氧化状态 - 氧化剂和还原剂的使用5. 重排反应- 卡宾重排- 烷基迁移三、官能团化学1. 卤代烃- 卤代反应- 卤代烃的亲核取代反应2. 醇和酚- 醇的官能团反应- 酚的酸性和反应性3. 醛和酮- 羰基的极性- 醛和酮的加成反应- 氧化和还原反应4. 羧酸和其衍生物- 羧酸的性质和反应- 酸酐、酯和酰胺的合成和水解5. 胺- 胺的命名和结构- 胺的酸碱性- 胺的反应四、生物分子化学1. 糖类- 单糖的结构和性质- 多糖的合成和水解2. 脂类- 脂肪酸和甘油的酯化反应- 磷脂的结构和功能3. 蛋白质- 氨基酸的结构和性质- 肽键的形成- 蛋白质的结构层次4. 核酸- 核苷酸的结构- DNA和RNA的合成和功能五、有机合成策略1. 逆合成分析- 目标分子的分解- 合成途径的设计2. 绿色化学原则- 原子经济性- 减少副产品和废物3. 催化剂的应用- 均相催化和非均相催化- 生物催化剂的使用六、实验技术和安全1. 有机化学实验的基本操作- 溶解、加热、冷却、萃取- 蒸馏和分馏2. 有机化合物的鉴定- 熔点和沸点的测定- 红外光谱、核磁共振和质谱3. 实验室安全- 个人防护装备的使用- 化学品的储存和处理- 应急处理措施以上总结了高中有机化学的主要知识点,涵盖了有机化学的基础理论、各类反应类型、官能团化学、生物分子化学、有机合成策略以及实验技术和安全。

高中有机化学知识点归纳和总结(完整版)一、同系物结构相似,在分子组成上相差一个或若干个CH 2原子团的物质物质。
同系物的判断要点:1、通式相同,但通式相同不一定是同系物。
2、组成元素种类必须相同3、结构相似指具有相似的原子连接方式,相同的官能团类别和数目。
结构相似不一定完全相同,如CH 3CH 2CH 3和(CH 3)4C ,前者无支链,后者有支链仍为同系物。
4、在分子组成上必须相差一个或几个CH 2原子团,但通式相同组成上相差一个或几个CH 2原子团不一定是同系物,如CH 3CH 2Br 和CH 3CH 2CH 2Cl 都是卤代烃,且组成相差一个CH 2原子团,但不是同系物。
5、同分异构体之间不是同系物。
二、同分异构体化合物具有相同的分子式,但具有不同结构的现象叫做同分异构现象。
具有同分异构现象的化合物互称同分异构体。
1、同分异构体的种类:⑴ 碳链异构:指碳原子之间连接成不同的链状或环状结构而造成的异构。
如C 5H 12有三种同分异构体,即正戊烷、异戊烷和新戊烷。
⑵ 位置异构:指官能团或取代基在在碳链上的位置不同而造成的异构。
如1—丁烯与2—丁烯、1—丙醇与2—丙醇、邻二甲苯与间二甲苯及对二甲苯。
⑶ 异类异构:指官能团不同而造成的异构,也叫官能团异构。
如1—丁炔与1,3—丁二烯、丙烯与环丙烷、乙醇与甲醚、丙醛与丙酮、乙酸与甲酸甲酯、葡萄糖与果糖、蔗糖与麦芽糖等。
⑷ 其他异构方式:如顺反异构、对映异构(也叫做镜像异构或手性异构)等,在中学阶段的信息题中屡有涉及。
各类有机物异构体情况:⑴ C n H 2n +2:只能是烷烃,而且只有碳链异构。
如CH 3(CH 2)3CH 3、CH 3CH(CH 3)CH 2CH 3、C(CH 3)4 ⑵ C n H 2n :单烯烃、环烷烃。
如CH 2=CHCH 2CH 3、CH 3CH=CHCH 3、CH 2=C(CH 3)2、 、⑶ C n H 2n -2:炔烃、二烯烃。
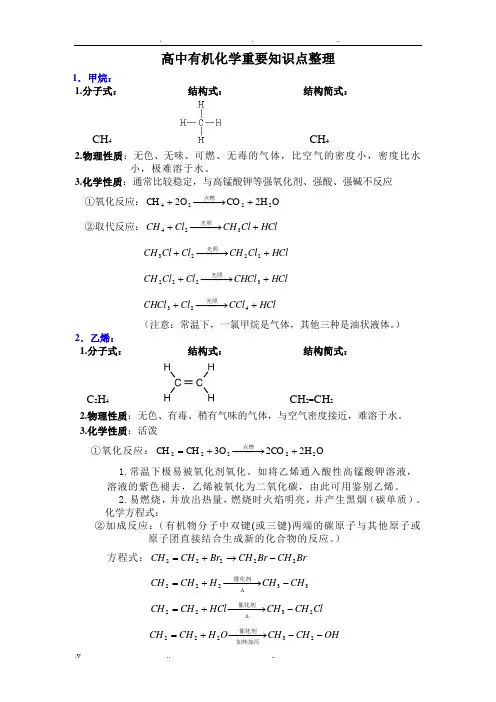
高中有机化学重要知识点整理1.甲烷:1.分子式: 结构式: 结构简式:CH 4 CH 42.物理性质:无色、无味、可燃、无毒的气体,比空气的密度小,密度比水小,极难溶于水。
3.化学性质:通常比较稳定,与高锰酸钾等强氧化剂、强酸、强碱不反应①氧化反应:O H 2CO O 2CH 2224+−−→−+点燃②取代反应:HCl Cl CH Cl CH +−−→−+324光照HCl Cl CH Cl Cl CH +−−→−+2223光照 HCl CHCl Cl Cl CH +−−→−+3222光照 HCl CCl Cl CHCl +−−→−+423光照(注意:常温下,一氯甲烷是气体,其他三种是油状液体。
)2.乙烯:1.分子式: 结构式: 结构简式:C 2H 4 CH 2=CH 22.物理性质:无色、有毒、稍有气味的气体,与空气密度接近,难溶于水。
3.化学性质:活泼①氧化反应:O H 2CO 2O 3CH CH 22222+−−→−+=点燃1.常温下极易被氧化剂氧化。
如将乙烯通入酸性高锰酸钾溶液,溶液的紫色褪去,乙烯被氧化为二氧化碳,由此可用鉴别乙烯。
2.易燃烧,并放出热量,燃烧时火焰明亮,并产生黑烟(碳单质)。
化学方程式: ②加成反应:(有机物分子中双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应。
)方程式:Br CH Br CH Br CH CH 22222-→+=33222CH CH H CH CH -−−→−+=∆催化剂Cl CH CH HCl CH CH 2322-−−→−+=∆催化剂OH CH CH O H CH CH --−−→−+=23222加热加压催化剂③加聚反应:−−→−=催化剂22CH nCH n 22]CH CH [-3.乙炔1.分子式: 结构式: 结构简式: C 2H 2 H - C ≡ C - H CH ≡CH2.物理性质:纯乙炔为无色无味的易燃、有毒气体。


高中有机化学知识点归纳和总结(完整版)一、同系物结构相似,在分子组成上相差一个或若干个CH 2原子团的物质物质。
同系物的判断要点:1、通式相同,但通式相同不一定是同系物。
2、组成元素种类必须相同3、结构相似指具有相似的原子连接方式,相同的官能团类别和数目。
结构相似不一定完全相同,如CH 3CH 2CH 3和(CH 3)4C ,前者无支链,后者有支链仍为同系物。
4、在分子组成上必须相差一个或几个CH 2原子团,但通式相同组成上相差一个或几个CH 2原子团不一定是同系物,如CH 3CH 2Br 和CH 3CH 2CH 2Cl 都是卤代烃,且组成相差一个CH 2原子团,但不是同系物。
5、同分异构体之间不是同系物。
二、同分异构体化合物具有相同的分子式,但具有不同结构的现象叫做同分异构现象。
具有同分异构现象的化合物互称同分异构体。
1、同分异构体的种类:⑴ 碳链异构:指碳原子之间连接成不同的链状或环状结构而造成的异构。
如C 5H 12有三种同分异构体,即正戊烷、异戊烷和新戊烷。
⑵ 位置异构:指官能团或取代基在在碳链上的位置不同而造成的异构。
如1—丁烯与2—丁烯、1—丙醇与2—丙醇、邻二甲苯与间二甲苯及对二甲苯。
⑶ 异类异构:指官能团不同而造成的异构,也叫官能团异构。
如1—丁炔与1,3—丁二烯、丙烯与环丙烷、乙醇与甲醚、丙醛与丙酮、乙酸与甲酸甲酯、葡萄糖与果糖、蔗糖与麦芽糖等。
⑷ 其他异构方式:如顺反异构、对映异构(也叫做镜像异构或手性异构)等,在中学阶段的信息题中屡有涉及。
各类有机物异构体情况:⑴ C n H 2n +2:只能是烷烃,而且只有碳链异构。
如CH 3(CH 2)3CH 3、CH 3CH(CH 3)CH 2CH 3、C(CH 3)4 ⑵ C n H 2n :单烯烃、环烷烃。
如CH 2=CHCH 2CH 3、CH 3CH=CHCH 3、CH 2=C(CH 3)2、 、⑶ C n H 2n -2:炔烃、二烯烃。

有机化学重要知识点归纳一、重要的物理性质1.有机物的溶解性(1)难溶于水的有:各类烃、卤代烃、硝基化合物、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。
(2)易溶于水的有:低级的[一般指N(C)≤4]醇、(醚)、醛、(酮)、羧酸及盐、氨基酸及盐、单糖、二糖。
(它们都能与水形成氢键)。
(3)具有特殊溶解性的:①乙醇是一种很好的溶剂,既能溶解许多无机物,又能溶解许多有机物,所以常用乙醇来溶解植物色素或其中的药用成分,也常用乙醇作为反应的溶剂,使参加反应的有机物和无机物均能溶解,增大接触面积,提高反应速率。
例如,在油脂的皂化反应中,加入乙醇既能溶解NaOH,又能溶解油脂,让它们在均相(同一溶剂的溶液)中充分接触,加快反应速率,提高反应限度。
②苯酚:室温下,在水中的溶解度是9.3g(属可溶),易溶于乙醇等有机溶剂,当温度高于65℃时,能与水混溶,冷却后分层,上层为苯酚的水溶液,下层为水的苯酚溶液,振荡后形成乳浊液。
苯酚易溶于碱溶液和纯碱溶液,这是因为生成了易溶性的钠盐。
③乙酸乙酯在饱和碳酸钠溶液中更加难溶,同时饱和碳酸钠溶液还能通过反应吸收挥发出的乙酸,溶解吸收挥发出的乙醇,便于闻到乙酸乙酯的香味。
④有的淀粉、蛋白质可溶于水形成胶体..。
蛋白质在浓轻金属盐(包括铵盐)溶液中溶解度减小,会析出(即盐析,皂化反应中也有此操作)。
但在稀轻金属盐(包括铵盐)溶液中,蛋白质的溶解度反而增大。
⑤线型和部分支链型高聚物可溶于某些有机溶剂,而体型则难溶于有机溶剂。
*⑥氢氧化铜悬浊液可溶于多羟基化合物的溶液中,如甘油、葡萄糖溶液等,形成绛蓝色溶液。
2.有机物的密度(1)小于水的密度,且与水(溶液)分层的有:各类烃、一氯代烃、氟代烃、酯(包括油脂)(2)大于水的密度,且与水(溶液)分层的有:多氯代烃、溴代烃(溴苯等)、碘代烃、硝基苯3.有机物的状态[常温常压(1个大气压、20℃左右)](1)气态:①烃类:一般N(C)≤4的各类烃注意:新戊烷[C(CH3)4]亦为气态②衍生物类:一氯甲烷(CH3Cl,沸点为-24.2℃)氟里昂(CCl2F2,沸点为-29.8℃)氯乙烯(CH2==CHCl,沸点为-13.9℃)甲醛(HCHO,沸点为-21℃)氯乙烷(CH3CH2Cl,沸点为12.3℃)一溴甲烷(CH3Br,沸点为3.6℃)四氟乙烯(CF2==CF2,沸点为-76.3℃)甲醚(CH3OCH3,沸点为-23℃)*甲乙醚(CH3OC2H5,沸点为10.8℃)*环氧乙烷(,沸点为13.5℃)(2)液态:一般N(C)在5~16的烃及绝大多数低级衍生物。

高中有机化学知识点总结一、重要的物理性质1.有机物的溶解性(1)难溶于水的有:各类烃、卤代烃、硝基化合物、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。
(2)易溶于水的有:低级的[一般指N(C)≤4]醇、(醚)、醛、(酮)、羧酸及盐、氨基酸及盐、单糖、二糖。
(它们都能与水形成氢键)。
二、重要的反应1.能使溴水(Br2/H2O)褪色的物质(1)有机物①通过加成反应使之褪色:含有、—C≡C—的不饱和化合物②通过取代反应使之褪色:酚类注意:苯酚溶液遇浓溴水时,除褪色现象之外还产生白色沉淀。
③通过氧化反应使之褪色:含有—CHO(醛基)的有机物(有水参加反应)注意:纯净的只含有—CHO(醛基)的有机物不能使溴的四氯化碳溶液褪色④通过萃取使之褪色:液态烷烃、环烷烃、苯及其同系物、饱和卤代烃、饱和酯(2)无机物①通过与碱发生歧化反应3Br2 + 6OH- == 5Br- + BrO3- + 3H2O或Br2 + 2OH- == Br- + BrO- + H2O②与还原性物质发生氧化还原反应,如H2S、S2-、SO2、SO32-、I-、Fe2+2.能使酸性高锰酸钾溶液KMnO4/H+褪色的物质1)有机物:含有、—C≡C—、—OH(较慢)、—CHO的物质苯环相连的侧链碳上有氢原子的苯的同系物(但苯不反应)2)无机物:与还原性物质发生氧化还原反应,如H2S、S2-、SO2、SO32-、Br-、I-、Fe2+3.与Na反应的有机物:含有—OH、—COOH的有机物与NaOH反应的有机物:常温下,易与含有酚羟基...、—COOH的有机物反应加热时,能与卤代烃、酯反应(取代反应)与Na2CO3反应的有机物:含有酚.羟基的有机物反应生成酚钠和NaHCO3;含有—COOH的有机物反应生成羧酸钠,并放出CO2气体;含有—SO3H的有机物反应生成磺酸钠并放出CO2气体。
与NaHCO3反应的有机物:含有—COOH、—SO3H的有机物反应生成羧酸钠、磺酸钠并放出等物质的量的CO2气体。

高中有机化学知识点归纳和总结(完整版)一、同系物结构相似,在分子组成上相差一个或若干个CH 2原子团的物质物质。
同系物的判断要点:1、通式相同,但通式相同不一定是同系物。
2、组成元素种类必须相同3、结构相似指具有相似的原子连接方式,相同的官能团类别和数目。
结构相似不一定完全相同,如CH 3CH 2CH 3和(CH 3)4C ,前者无支链,后者有支链仍为同系物。
4、在分子组成上必须相差一个或几个CH 2原子团,但通式相同组成上相差一个或几个CH 2原子团不一定是同系物,如CH 3CH 2Br 和CH 3CH 2CH 2Cl 都是卤代烃,且组成相差一个CH 2原子团,但不是同系物。
5、同分异构体之间不是同系物。
二、同分异构体化合物具有相同的分子式,但具有不同结构的现象叫做同分异构现象。
具有同分异构现象的化合物互称同分异构体。
1、同分异构体的种类:⑴碳链异构:指碳原子之间连接成不同的链状或环状结构而造成的异构。
如C 5H 12有三种同分异构体,即正戊烷、异戊烷和新戊烷。
⑵位置异构:指官能团或取代基在在碳链上的位置不同而造成的异构。
如1—丁烯与2—丁烯、1—丙醇与2—丙醇、邻二甲苯与间二甲苯及对二甲苯。
⑶异类异构:指官能团不同而造成的异构,也叫官能团异构。
如1—丁炔与1,3—丁二烯、丙烯与环丙烷、乙醇与甲醚、丙醛与丙酮、乙酸与甲酸甲酯、葡萄糖与果糖、蔗糖与麦芽糖等。
⑷其他异构方式:如顺反异构、对映异构(也叫做镜像异构或手性异构)等,在中学阶段的信息题中屡有涉及。
各类有机物异构体情况:⑴C n H 2n +2:只能是烷烃,而且只有碳链异构。
如CH 3(CH 2)3CH 3、CH 3CH(CH 3)CH 2CH 3、C(CH 3)4 ⑵C n H 2n :单烯烃、环烷烃。
如CH 2=CHCH 2CH 3、CH 3CH=CHCH 3、CH 2=C(CH 3)2、 、⑶C n H 2n -2:炔烃、二烯烃。

催化剂加热、加压有机化学知识点归纳一、有机物的结构与性质1、官能团的定义:决定有机化合物主要化学性质的原子、原子团或化学键。
2、常见的各类有机物的官能团,结构特点及主要化学性质(1)烷烃A) 官能团:无 ;通式:C n H 2n +2;代表物:CH 4B) 结构特点:键角为109°28′,空间正四面体分子。
烷烃分子中的每个C 原子的四个价键也都如此。
C) 物理性质:1.常温下,它们的状态由气态、液态到固态,且无论是气体还是液体,均为无色。
一般地,C1~C4气态,C5~C16液态,C17以上固态。
2.它们的熔沸点由低到高。
3.烷烃的密度由小到大,但都小于1g/cm^3,即都小于水的密度。
4.烷烃都不溶于水,易溶于有机溶剂 D) 化学性质:①取代反应(与卤素单质、在光照条件下) , ,……。
②燃烧 ③热裂解C 16H 34 C 8H 18 + C 8H 16④烃类燃烧通式:O H 2CO O )4(H C 222y x y x t x +++−−−−→−点燃⑤烃的含氧衍生物燃烧通式: O H 2CO O )24(O H C 222y x z y x z y x +-++−−−−→−点燃E) 实验室制法:甲烷:3423CH COONa NaOH CH Na CO +→↑+注:1.醋酸钠:碱石灰=1:3 2.固固加热 3.无水(不能用NaAc 晶体) 4.CaO :吸水、稀释NaOH 、不是催化剂(2)烯烃:A) 官能团:;通式:C n H 2n (n ≥2);代表物:H 2C=CH 2 B) 结构特点:键角为120°。
双键碳原子与其所连接的四个原子共平面。
CH 4 + Cl 2CH 3Cl + HCl 光CH 3Cl + Cl 2CH 2Cl 2 + HCl 光CH 4 + 2O 2CO 2 + 2H 2O 点燃CH 4C + 2H 2高温 隔绝空气C=C 原子:—X原子团(基):—OH 、—CHO (醛基)、—COOH (羧基)、C 6H 5— 等化学键: 、—C ≡C — C=C 官能团CaO △催化剂C) 化学性质:①加成反应(与X 2、H 2、HX 、H 2O 等)②加聚反应(与自身、其他烯烃) ③燃烧 ④氧化反应 2CH 2 = CH 2 + O 2 2CH 3CHO⑤烃类燃烧通式:O H 2CO O )4(H C 222y x y x y x +++−−−−→−点燃 D) 实验室制法:乙烯:CH 3CH 2OH CH 2CH 2浓H 2SO 4+↑H 2O 170℃注:1.V 酒精:V 浓硫酸=1:3(被脱水,混合液呈棕色)2. 排水收集(同Cl2、HCl )控温170℃(140℃:乙醚) 3.碱石灰除杂SO2、CO2 4.碎瓷片:防止暴沸E) 反应条件对有机反应的影响:CH 2=CH -CH 3+HBr CH 3CHCH 3Br(氢加在含氢较多碳原子上,符合马氏规则)CH 2=CH -CH 3+HBrCH 3-CH 2-CH 2-Br (反马氏加成)F )温度不同对有机反应的影响:CH 2CH CH CH 280℃CH 2CH CH CH 2Br Br+ Br 2CH 2CH CH CH 260℃CH 2CHCH CH 2BrBr + Br 2(3)炔烃:A) 官能团:—C≡C— ;通式:C n H 2n —2(n ≥2);代表物:HC≡CHB) 结构特点:碳碳叁键与单键间的键角为180°。

高中化学有机化学知识点总结(全)高中化学有机化学知识点总结
1. 有机化学的定义
有机化学是研究有机物的性质、结构、合成和反应规律的科学。
有机物主要由碳元素构成,并且通常含有氢、氧、氮、硫等其他元素。
2. 有机化合物的命名
有机化合物的命名遵循一定的命名规则。
常见的命名体系包括IUPAC命名法和通用命名法,其中IUPAC命名法是最常用的。
3. 有机化合物的结构
有机化合物的结构可以用结构式、分子式和谱图表示。
结构式
可以分为平面结构式和立体结构式,分子式表示化合物由哪些元素
组成,谱图可以提供有机化合物的结构信息。
4. 有机化合物的性质
有机化合物具有很多特点,包括燃烧性、溶解性、稳定性、化
学反应性等。
这些性质往往与有机化合物的结构密切相关。
5. 有机化合物的合成
有机化合物的合成方法多种多样,包括酯的酸催化缩合、卤代
烷的卤化反应、醇的脱水反应等。
不同的合成方法可以达到不同的
合成目的。
6. 有机化合物的反应
有机化合物的反应种类繁多,主要包括取代反应、加成反应、
消除反应、重排反应等。
这些反应可以改变有机化合物的结构和性质。
7. 有机化合物的分类
有机化合物可以按照功能团、碳骨架、化学性质等方面进行分类。
常见的有机化合物类别包括烃类、醇类、酮类、醛类、酯类等。
8. 重要的有机化合物
有机化学中存在许多重要的化合物,例如乙醇、甲烷、乙烯、
甲苯等。
这些化合物在工业生产和日常生活中都有广泛的应用。
以上是高中化学有机化学的知识点总结,希望对你有帮助!。
有机化学主要考点第一部分 烃一、烷烃。
通式C n H n 2+2能发生取代反应,例如CH 4+Cl 2 光 CH 3Cl +HCl 。
(条件:C12、Br 2、光照) 二、烯烃。
通式:C n H n 2 二烯烃通式为C n H 22-n 官能团: C=C (碳碳双键)、CH 2=CH 2六个原子共面。
性质:①氧化反应:烯烃能使KM n O 4(H +)的紫红色褪去。
②加成反应:烯烃能使溴的四氯化碳红棕色褪去。
(或溴水)CH 2=CH 2+B 2r →③加聚反应:烯烃能发生加聚反应。
例如:n CH 2=CH 2催化剂[2-CH 2]n三、炔烃。
通式:C n H 22-n HC ≡CH 四个原子共直线,官能团:-C ≡C-性质:与烯烃的性质类似,比如能发生 ①氧化反应 ②加成反应 ③加聚反应 四、芳香烃。
苯和苯的同系物的通式:C n H 62-n (n ≥6) 分子中12个原子共平面。
苯的性质:①取代反应 +B 2r (l ))(Fe 催 –B r +HB r (B 2r 的水溶液不发生此反应)+HO-NO 242SO H 浓 -NO 2+H 20 (也叫硝化反应)②加成反应: +3H苯的同系物的性质,比如甲苯3CH ①氧代反应:能使KMn O 4(H+)溶液褪色②取代反应33HONO220第二部分 烃的衍生物一、卤代烃。
(官能团-B r )性质:①取代反应(水解反应)C 2H 5-B r 2H 5-OH+HB r 或C 2H 5B r +N a 2H 5OH +N a B r 。
②消去反应:C 2H 5 B r + N a 2H 4(CH 2= CH 2)+ N a B r +H 2O或写成:C 2H 5 B 2=CH 2 +HB r二、醇。
官能团:-OH 饱和一元醇的通式:C n H 22+n O 。
饱和x 元醇的通式:C n H 22+n O x 性质:①(催化)氧化反应:2CH 3CH 2OH +O 23CHO +2H 2O (醇的特征:“-CH 2OH ”)②消去反应:C 2H 52= CH 2 +H 2O③酯化反应:C 2H 5OH+CH 3COOH 42SO H 浓 +H 2O C 2H 5OOCCH 3(先写水,避免漏掉) ④与N a 反应。
高中有机化学基础知识点归纳小结一、重要的物理性质1.有机物的溶解性(1)难溶于水的有:各类烃、卤代烃、硝基化合物、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。
(2)易溶于水的有:低级的 [一般指 N(C ) ≤ 4]醇、(醚)、醛、(酮)、羧酸及盐、氨基酸及盐、单糖、二糖。
(它们都能与水形成氢键)。
二、重要的反应1.能使溴水( Br /H O)褪色的物质22( 1)有机物① 通过加成反应使之褪色:含有、— C≡ C—的不饱和化合物② 通过取代反应使之褪色:酚类注意:苯酚溶液遇浓溴水时,除褪色现象之外还产生白色沉淀。
③ 通过氧化反应使之褪色:含有— CHO (醛基)的有机物(有水参加反应)注意:纯净的只含有— CHO(醛基)的有机物不能使溴的四氯化碳溶液褪色④ 通过萃取使之褪色:液态烷烃、环烷烃、苯及其同系物、饱和卤代烃、饱和酯( 2)无机物① 通过与碱发生歧化反应3Br 2 + 6OH -== 5Br -+ BrO 3- +3H2O 或 Br 2 + 2OH -== Br - +BrO - + H2O② 与还原性物质发生氧化还原反应,如2-、 SO2、 SO32-、 I-2+ H2S、 S、Fe2.能使酸性高锰酸钾溶液KMnO4/H+ 褪色的物质1)有机物:含有、— C≡C—、— OH(较慢)、— CHO 的物质苯环相连的侧链碳上有氢原子的苯的同系物(但苯不反应)2)无机物:与还原性物质发生氧化还原反应,如2-、 SO2、 SO32---2+ H 2S、 S、 Br、 I、 Fe3.与 Na 反应的有机物:含有— OH、— COOH 的有机物与 NaOH 反应的有机物:常温下,易与含有酚羟基、— COOH 的有机物反应...加热时,能与卤代烃、酯反应(取代反应)与 Na2CO3反应的有机物:含有酚羟基的有机物反应生成酚钠和NaHCO 3;.含有— COOH 的有机物反应生成羧酸钠,并放出CO2气体;含有— SO3H 的有机物反应生成磺酸钠并放出CO2气体。