气体的制取专题复习
- 格式:ppt
- 大小:604.50 KB
- 文档页数:14
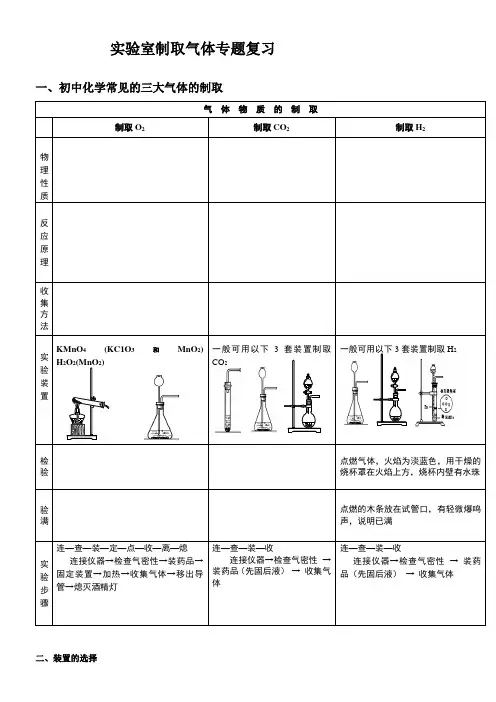
实验室制取气体专题复习一、初中化学常见的三大气体的制取气体物质的制取制取O2制取CO2制取H2物理性质反应原理收集方法实验装置KMnO4 (KC1O3和MnO2)H2O2(MnO2)一般可用以下3套装置制取CO2一般可用以下3套装置制取H2检验点燃气体,火焰为淡蓝色,用干燥的烧杯罩在火焰上方,烧杯内壁有水珠验满点燃的木条放在试管口,有轻微爆鸣声,说明已满实验步骤连—查—装—定—点—收—离—熄连接仪器→检查气密性→装药品→固定装置→加热→收集气体→移出导管→熄灭酒精灯连—查—装—收连接仪器→检查气密性→装药品(先固后液)→ 收集气体连—查—装—收连接仪器→检查气密性→ 装药品(先固后液)→ 收集气体二、装置的选择(1)发生装置:由及决定:①反应物是固体,需加热,制气体时则用的发生装置。
②反应物是固体与液体,不需要加热,制气体时则用的发生装置。
1、要根据实际情况选择(a)(b)(c)(d)四种装置。
装置(a)的特点:,适用于制取少量的气体;容易造成气体泄漏,增加药品不太方便。
装置(b)的特点:。
装置(c)的特点:。
装置(d)的特点:。
(2)收集方法:由气体的及决定:①、气体不溶或难溶于水、不与水反应用收集CO只能用法收集②、密度比空气大(或相对分子质量>29)用向排空气法CO2只能用排空气法收集③、密度比空气小(或相对分子质量<29)用向排空气法A B C D E(3)多功能瓶:气体的密度大于空气密度,用法收集,规则:常见实例:气体的密度小于空气密度,用法收集,规则:常见实例:气体气体不溶或难溶于水,用法收集,规则:常见实例:三、课后巩固练习:1、(2011河南)某研究性学习小组欲利用下列装置进行相关气体制取的探究,请你分析并填空。
(1)写出图中仪器a、b的名称a___________________,b_____________________。
(2)实验室制取二氧化碳的化学方程式是__________________________________。

【教案】专题复习——气体的性质与制取第一章:气体的性质一、教学目标:1. 让学生了解气体的基本性质,如无色、无味、无臭等。
2. 让学生掌握气体的物理性质,如密度、溶解性等。
3. 让学生了解气体的化学性质,如可燃性、氧化性等。
二、教学内容:1. 气体的基本性质2. 气体的物理性质:密度、溶解性3. 气体的化学性质:可燃性、氧化性三、教学方法:1. 采用讲解法,让学生了解气体的基本性质。
2. 采用实验法,让学生观察气体在不同条件下的物理性质。
3. 采用案例分析法,让学生了解气体在化学反应中的化学性质。
四、教学步骤:1. 讲解气体的基本性质,如无色、无味、无臭等。
2. 进行实验,观察气体在不同条件下的物理性质,如密度、溶解性。
3. 分析气体在化学反应中的化学性质,如可燃性、氧化性。
五、课后作业:1. 总结气体的基本性质、物理性质和化学性质。
2. 举例说明气体在实际生活中的应用。
第二章:气体的制取一、教学目标:1. 让学生了解常见气体的制取方法。
2. 让学生掌握实验室制取气体的原理。
3. 让学生学会正确操作实验室制取气体的设备。
二、教学内容:1. 常见气体的制取方法2. 实验室制取气体的原理3. 实验室制取气体的设备及操作三、教学方法:1. 采用讲解法,让学生了解常见气体的制取方法。
2. 采用实验法,让学生观察实验室制取气体的原理。
3. 采用操作演示法,让学生学会正确操作实验室制取气体的设备。
四、教学步骤:1. 讲解常见气体的制取方法,如排水法、分解法等。
2. 进行实验,观察实验室制取气体的原理。
3. 演示实验室制取气体的设备及操作,让学生进行实际操作练习。
五、课后作业:1. 总结常见气体的制取方法。
2. 分析实验室制取气体的原理。
3. 复习实验室制取气体的设备及操作。
六章:气体的收集与储存一、教学目标:1. 让学生了解气体的收集方法,如排水法、排空气法等。
2. 让学生掌握气体的储存方法,如气瓶储存、真空储存等。
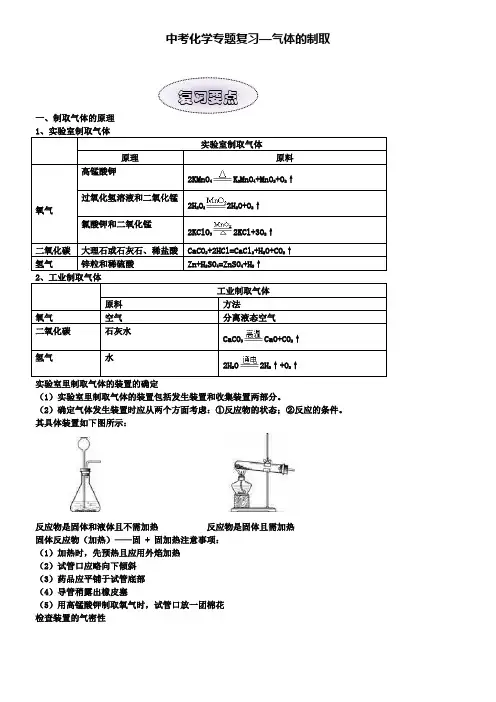
中考化学专题复习—气体的制取一、制取气体的原理 1、实验室制取气体实验室制取气体原理原料氧气高锰酸钾2KMnO 4K 2MnO 4+MnO 2+O 2↑ 过氧化氢溶液和二氧化锰 2H 2O 22H 2O+O 2↑ 氯酸钾和二氧化锰2KClO 32KCl+3O 2↑二氧化碳 大理石或石灰石、稀盐酸 CaCO 3+2HCl=CaCl 2+H 2O+CO 2↑ 氢气 锌粒和稀硫酸Zn+H 2SO 4=ZnSO 4+H 2↑2、工业制取气体工业制取气体 原料方法 氧气 空气 分离液态空气 二氧化碳 石灰水 CaCO 3CaO+CO 2↑ 氢气水 2H 2O2H 2↑+O 2↑实验室里制取气体的装置的确定(1)实验室里制取气体的装置包括发生装置和收集装置两部分。
(2)确定气体发生装置时应从两个方面考虑:①反应物的状态;②反应的条件。
其具体装置如下图所示:反应物是固体和液体且不需加热 反应物是固体且需加热 固体反应物(加热)——固 + 固加热注意事项: (1)加热时,先预热且应用外焰加热 (2)试管口应略向下倾斜 (3)药品应平铺于试管底部(4)导管稍露出橡皮塞(5)用高锰酸钾制取氧气时,试管口放一团棉花 检查装置的气密性复习要点用手微热冒气泡;注入水液面不下降;向右推导管口冒气泡;向右推长颈漏斗内的液面上升(2)确定气体收集装置时主要考虑:①气体的密度;②气体在水中的溶解性。
(3)具体装置如下:当收集气体的密度比空气的密度小时,可用向下排空气法;当收集气体的密度比空气的密度大时,可用向上排空气法;当收集不易溶于水、不与水反应的气体,可用排水法。
气体收集装置注意事项:1、气体与空气密度的比较,可 其相对分子质量,空气的平均相对分子质量为29,则密度比空气大;若小于29,则密度比空气小。
2、用排水法收集气体时应把导管放在集气瓶口。
3、当使用排水法收集时,需要当气泡连续均匀冒出时,再收集。
4、用排空气法收集时,应该把导管伸到集气瓶底部,便于排尽空气。

气体的制取专题复习课教案教学目标:1知识与技能(1)学会根据反应物的状态和反应条件选择气体发生装置;(2)学会根据气体性质选择气体收集装置;(3)掌握实验室制取氧气、二氧化碳的发生和收集装置。
2. 过程与方法(1)通过对基础知识的复习,培养学生分析问题,探索问题和灵活运用知识的能力;(2)通过对知识的拓展,拓宽学生的知识面,培养学生综合分析、解决问题的能力。
3. 情感态度与价值观(1)培养学生交流,合作学习的良好习惯;(2)培养学生实事求是,运用科学的原理解决问题的良好的科学素养;(3)通过学习中找规律,规律中体验成功,进而体会到化学学习的乐趣。
教学重点:气体制备的思路和方法。
教学难点:气体制取装置的选择。
教学方法:讨论、交流、归纳、练习教学过程:引入:我们前面复习完了实验室基本操作,今天我们要复习初中化学的所有气体制备,从而掌握制取气体的一般方法。
问题:现在老师手中有许多制取并收集气体的装置,同学们用我手中的装置拼装实验室制取氧气和二氧化碳的装置。
活动:学生完成制取氧气、二氧化碳气体的制取装置的拼接问题:1、你的一套装置用的是什么原理制取氧气和二氧化碳气体的,请说明2、实验室制取氧气的原理是什么?制取二氧化碳的原理又是什么呢?请写出一、发生装置1、选择依据:反应物的状态和反应条件2、常见类型⑴固体皿气体(固体可以是一种也可以是多种)⑵ 固体+液体(不加热)—气体(都是液体也可以) 问题:在上述装置中总共出现了几种收集气体的方法,选择的依据分别是什么二、收集方法1、依据:气体的溶解性和密度大小2、常见方法⑴排水法⑵向上排空气法⑶向下排空气法(气体无毒且不和空气中的成分反应)绘图1:发生装置的类型和选择依据【现学现用】课堂练习一:1、下图是实验室中用于制取和 收集气体的装置图。
(1)若用B 装置制氧气,b 中 的装的物质 __________________________(2) 甲烷是密度小于空气、难溶于水的气体,实验室用加热无水醋酸钠和碱石灰的固体混合物制取甲烷。


初三化学中考气体的制备专项复习(知识点+真题)一、气体发生装置的类型1.固固加热装置:适用于单种或者多种固体混合进行加热反应。
(1)检查装置的气密性的方法:将导管的一端浸入水槽中,用手紧握试管外壁,若水中导管口有气泡冒出,松开手后,导管口出现一段水柱,则气密性良好。
(2)试管略向下倾斜的原因:防止冷凝水倒流,炸裂试管。
(3)实验前先将试管进行预热的目的:使试管受热均匀,防止爆裂。
(4)伸入试管中的导气管不能太长的原因:便于气体导出,若导气管伸入太长则不利于气体的导出。
(5)加热高锰酸钾制取氧气时试管口放一团棉花的原因:防止高锰酸钾粉末堵塞导管。
(6)用排水法收集气体时,先把导管从水槽中移出再熄灭酒精灯的原因:防止水槽中的水倒流入试管,使试管炸裂。
2.固液不加热装置:适用于固体和液体常温下的反应。
(1)简易装置①检查装置的气密性的方法:将导管的一端浸入水槽中,用手紧握试管外壁,若水中导管口有气泡冒出,松开手后,导管口出现一段水柱,则气密性良好。
②适用范围:适用于制取少量气体。
(2)长颈漏斗类型的装置①检查装置的气密性的方法:用弹簧夹夹住橡皮管,往长颈漏斗中加水,长颈漏斗下端形成一段水柱,并且一段时间后不下降,则气密性良好。
②装置优点:方便随时添加液体药品。
③长颈漏斗下端管口要伸到液面底下的原因:形成液封,防止生成的气体从长颈漏斗逸出。
(3)带有有空塑料板的装置①检查装置的气密性的方法:用弹簧夹夹住橡皮管,往长颈漏斗中加水,长颈漏斗下端形成一段水柱,并且一段时间后不下降,则气密性良好。
②装置优点:可以控制反应的发生和停止。
③长颈漏斗下端管口要伸到液面底下的原因:形成液封,防止生成的气体从长颈漏斗逸出。
(4)封液漏斗型的装置①检查装置的气密性的方法:用弹簧夹夹住橡皮管,打开分液漏斗活塞,若分液漏斗下端出现稳定的水柱(水不往下流),则气密性良好。
②装置优点:便于控制反应速率。
3.固液(液液)加热装置:适用于固体(液体)和液体加热下的反应。


气体制取专题复习一、气体的制取—— ①装置的选择A B C D E发生装置的选择:选择依据是由反应物的状态和条件决定的 (1)如A装置可适用于制取气体;B 、C 、D 、E 装置可适用于 制取气体。
(2)比较装置的优点:C 与B 相比优点在于 :D 与B 相比优点在于 :E 与B 相比优点在于 。
收集装置的选择:选择依据:气体性质装置类型排水法 向上排气法 向下排气法示意图气体性质难溶或微溶于水、不与水发生反应的气体 密度大于空气不与空气中的物质发生反应 密度小于空气、不与空气中的物质发生反应 例 ②装置气密性检查:(1)普通装检查置气密性的方法是:先把导管浸入水中,然后再用手握紧试管,如果导管口有气泡冒出,证明气密性良好(2)C 装置检查气密性的方法是:先往锥形中加水浸没长颈漏斗下端,然后夹上止水夹,再往长颈漏斗中加一定量的水,静止一会,如果漏斗液面没下降,证明气密性良好。
③气体的除杂(净化):气体除杂的原则: (1)不减少被净化的气体的量; (2)不引入新的杂质气体的干燥:干燥通过干燥剂来实现。
常用的干燥剂:酸性干燥剂(浓硫酸):不能用来干燥碱性气体;中性干燥剂(无水氯化钙):能干燥大部分气体;碱性干燥剂 (生石灰、固体NaOH 、碱石灰):不能用来干燥酸性气体。
④多用途装置1、如果是洗涤(或干燥)气体时长管进,短管出 ( 长进短出);2、排水法收集气体先把瓶装满水,短管进气,长管出水 ( 短进长出);3、排空气法收集气体①气体密度比空气大 长管进,短管出( 长进短出)②气体密度比空气小 短管进,长管出( 短进长出)4、与量筒合起来可测量气体的体积(气体从b 进a 出,瓶中一般充满水或某种饱和溶液);5、可作安全瓶,连接在发生装置之后,防止倒吸二、三大气体的制取原理O2的制取:①________________________②_______________________________③_______________________________CO2的制取:__________________ _________________H2的制取:__________ _________________________巩固练习1、下列装置操作图不能用于检查气密性的是( )2、右下图装置,有贮气、洗气等多种用途。
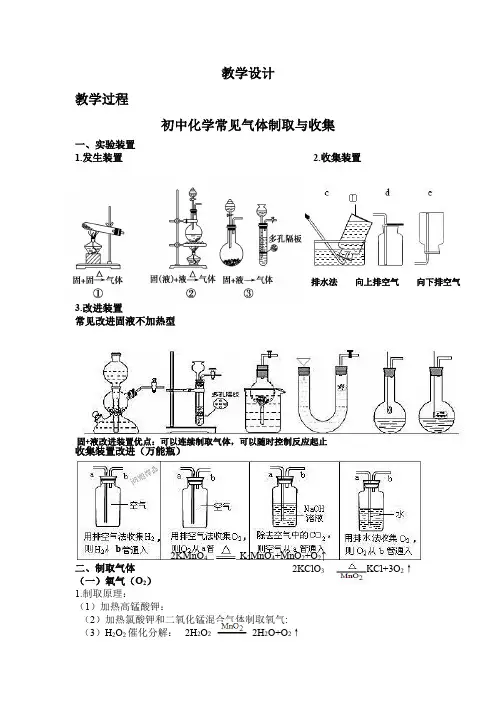
教学设计教学过程初中化学常见气体制取与收集一、实验装置1.发生装置2.收集装置3.改进装置常见改进固液不加热型收集装置改进(万能瓶)二、制取气体 (一)氧气(O 2)1.制取原理:(1)加热高锰酸钾:(2)加热氯酸钾和二氧化锰混合气体制取氧气:(3)H 2O 2催化分解: 2KMnO 4 K 2MnO 4+MnO 2+O 2↑ 2KClO 3 2KCl+3O 2↑排水法 向上排空气 向下排空气固+液改进装置优点:可以连续制取气体,可以随时控制反应起止 2H 2O 22H 2O+O 2↑ b注意:CuSO 4也可作为该反应催化剂2.气体收集:⑴排水法:因为氧气不易溶于水。
⑵向上排空气法:因为氧气密度比空气略大。
3.检验方法:用带火星的木条伸入集气瓶内,如果木条复燃,说明带瓶内的气体是氧气。
4.验满方法:⑴用向上排空气法收集时,用带火星的木条伸入集气瓶口,如果木条复燃,说明集气瓶内的氧气已满;⑵用排水法收集时,当气泡从瓶外冒出时,说明该瓶内的氧气已满。
(二)二氧化碳(CO 2)1.制取原理:稀盐酸和碳酸钙反应:(速率适中) 注意:⑴不能用浓盐酸代替稀盐酸,因为浓盐酸易挥发,使制得的CO 2不纯(混有氯化氢气体);⑵不能用稀硫酸代替稀盐酸,因为稀硫酸与CaCO 3反应生成微溶于水的硫酸钙覆盖在大理石(或石灰石)的表面,阻止反应的进行;⑶不能用Na 2CO 3 或CaCO 3代替大理石(或石灰石),因为Na 2CO 3与稀盐酸的反应速度太快,不便于收集。
2.收集方法:只能用向上排空气法(因为CO 2密度大于空气且能溶于水并能于水反应,)3.检验方法:通入澄清石灰水中,使澄清石灰水变浑浊。
原理:Ca(OH)2+CO 2==CaCO 3↓(白色)+H 2O4.验满方法:用燃着的木条伸入集气瓶口,如果木条熄灭,说明集气瓶内的CO 2已满。
(三)氢气(H 2)1.制取原理:Zn+H 2SO 4==H 2↑+ZnSO 4(置换反应)2.收集方法:(1)排水法:氢气不溶于水(2)向下排空气法:氢气密度小于空气3.氢气验纯:用小试管收集氢气.用拇指堵住试管口,管口朝下,移近酒精灯火焰,点燃试管里的氢气.点火后,如果听到的是尖锐的爆鸣声,表示氢气不纯,需要重新收集进行检验;听到“噗”的声音,表明收集的氢气是纯净的。