2013化学竞赛预赛(省级初赛)复习题 1大字版
- 格式:pdf
- 大小:603.20 KB
- 文档页数:12

第27届中国化学奥林匹克(初赛)试题及解答第1题(12分) 写出下列化学反应的方程式1-1 加热时,三氧化二锰与一氧化碳反应产生四氧化三锰。
1-2 将KCN加入到过量的CuSO4水溶液中。
1-3 在碱性溶液中,Cr2O3和K3Fe(CN)6反应。
1-4 在碱性条件下,Zn(CN)42-和甲醛反应。
1-5 Fe(OH)2在常温无氧条件下转化为Fe3O4。
1-6 将NaNO3粉末小心加到熔融的NaNH2中,生成NaN3(没有水生成)。
1-1 3Mn2O3+CO=2Mn3O4+CO22分1-2 4CN-+2Cu2+=2CuCN+(CN)2 2分1-3 Cr2O3+6Fe(CN)63-+10OH-=2CrO42-+6Fe(CN)64-+5H2O 2分1-4 Zn(CN)42-+4H2CO+4H2O=4 HOCH2CN+Zn(OH) 42- 2分1-5 3Fe(OH)2=Fe3O4+H2+2H2O 2分1-6 NaNO3+3NaNH2=NaN3+NH3+3NaOH 2分第2题(23分) 简要回答或计算2-1 Bi2Cl82-离子中铋原子的配位数为5,配体呈四角锥型分布,画出该离子的结构并指出Bi 原子的杂化轨道类型。
Bi2Cl82-的结构:2-或2-或ClClClCl2-2分ClClBiCl ClCl2-杂化轨道类型:sp3d2 1分2-2在液氨中,Eθ(Na+/Na)=-1.89V,Eθ(Mg2+/Mg)=-1.74V,但可以发生Mg置换Na的反应:Mg+2NaI=MgI2+2Na,指出原因。
MgI2在液氨中难溶。
1分2-3将Pb加到氨基钠的液氨溶液中,先生成白色沉淀Na4Pb,随后转化为Na4Pb9(绿色)而溶解。
在此溶液中插入两块铅电极,通直流电,当1.0 mol 电子通过电解槽时,在哪个电极(阴极或阳极)上沉积出铅?写出沉积铅的量。
阳极1分9/4mol 1分2-4下图是某金属氧化物的晶体结构示意图。

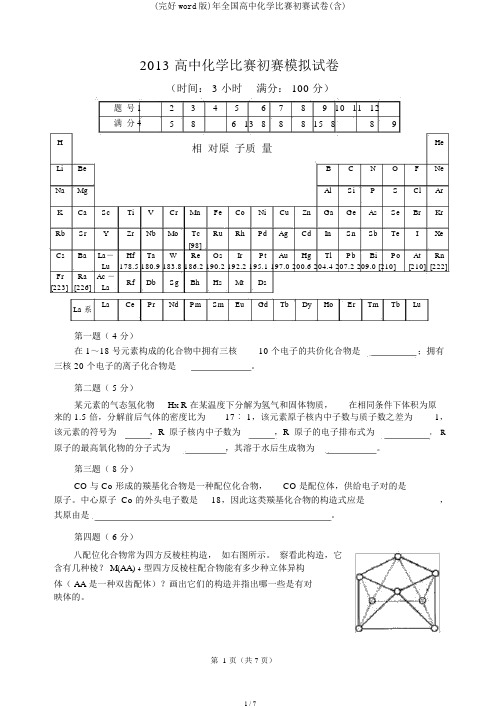
2013 高中化学比赛初赛模拟试卷(时间: 3 小时满分: 100 分)题号123456789 10 11 12满分458 6 13 888 15 889H相对原子质量He Li Be B C N O F NeNa Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br KrRb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe[98]Cs Ba La-Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn Lu178.5 180.9 183.8 186.2 190.2 192.2 195.1 197.0 200.6 204.4 207.2 209.0 [210][210][222] Fr Ra Ac -Rf Db Sg Bh Hs Mt Ds[223][226]LaLa Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Tb Lu La 系第一题( 4 分)在 1~18 号元素构成的化合物中拥有三核10 个电子的共价化合物是;拥有三核 20 个电子的离子化合物是。
第二题( 5 分)某元素的气态氢化物H X R 在某温度下分解为氢气和固体物质,在相同条件下体积为原来的 1.5 倍,分解前后气体的密度比为17︰ 1,该元素原子核内中子数与质子数之差为1,该元素的符号为,R原子核内中子数为,R原子的电子排布式为,R 原子的最高氧化物的分子式为,其溶于水后生成物为。
第三题( 8 分)CO 与 Co 形成的羰基化合物是一种配位化合物,CO 是配位体,供给电子对的是______原子。
中心原子 Co 的外头电子数是18,因此这类羰基化合物的构造式应是____________,其原由是。
第四题( 6 分)八配位化合物常为四方反棱柱构造,如右图所示。


格式修改:全选,取消斜体;删除该段文字。
恢复原文档格式。
2013年辽宁省高中学生化学竞赛预赛试题(时间90分钟,共100分)一、选择题(本题包括9小题,每小题3分,共27分。
每小题只有一个....选项符合题意。
) 1.下列说法正确的是A .食醋的主要成份是乙酸,医用酒精的浓度通常是95 % B .食品包装袋、食物保鲜膜等材料的主要成份是聚氯乙烯 C .淀粉、纤维素和油脂都属于天然高分子化合物D .食物的酸碱性与化学上所指溶液的酸碱性不同,蛋白质属于酸性食物233NF 3+H 2O → NO +HNO 3+HF 。
下列有关该反应的说法正确的是 A .NF 3是氧化剂,H 2O 是还原剂B .NF 3是极性分子,在潮湿空气中泄漏会看到红棕色气体C .若生成1 mol HNO 3,转移4N A 个电子5.汽车上的催化转化器,可将尾气中的主要污染物转化成无毒的物质,反应为:2NO (g )+2CO (g )N 2(g )+2CO 2(g ) △H=-746.6 kJ/mol 。
某温度时,用气体传感器测得不同时间的NO 和CO 的浓度如下表:...A .该反应转化较快,具有现实意义B .催化转化器在冬季时对废气转化的效率比夏季更高C .在该温度下,反应的平衡常数K=10000D .2 s 末的平均反应速率为v (NO )=3.75×10-4 mol ·L -1·s -16.某稀硫酸和稀硝酸的混合溶液100 mL ,若向其中加入铜粉,最多可溶解19.2 g 铜粉。
若向其中加入铁粉,最多可溶解22.4 g ,已知硝酸只被还原为NO 气体,气体的物质的量随铁粉质量增加的变化如下图所示。
下列说法不正确...的是A .C 点溶液中的阳离子主要为Fe 2+B .原溶液中硫酸的浓度为1 mol/LC .BC 段的反应为:Fe +2H +=== Fe 2++H 2↑D .OA 段的反应为:Fe +4H ++NO 3-=== Fe 3++NO ↑+2H 2O7 6 A .C 14H 30 B .C 17H 36 C .C 20H 42 D .C 26H 54 8.向含有0.2 mol KOH 和0.1 mol Ca (OH )2的溶液中持续地通入CO 2气体,当通入气体的体积为6.72 L (标准状况)时立即停止,则在这一过程中,溶液中离子的物质的量n 和通入CO 2的体积V 的关系示意图正确的是(气体的溶解忽略不计)9.香花石(Hsianghualite )是中国地质学家发现的第一种世界新矿物,由元素周期表前20号主族元素中的6种组成,其化学式可表示为X 3Y 2(ZWR 4)3T 2。

第 1 页 共4 页 2013年全国初中学生化学素质和实验能力竞赛 (第二十三届天原杯)初赛试题(广东赛区)答题卷市_______ 县区_______ 学校______________ 班级______ 学号____ 姓名___________第一部分 (共100分)一.选择题(本大题包括14小题,每小题2分,共28分) 题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 答案答案二、填空题(本大题包括5小题,共20分)15.(4分)(1) (2) (3) (4) 16.(4分)(1) (2) (3) 17.(3分)18.(5分)(1)①)①② (2)___ _ 19.(4分)(1) (2) (3) 三、(本大题包括2小题,共16分)20.(8分)(1) W X Y Z (2) 21.(8分)【练习】 【讨论】 【小结】 【应用】( )( )( ) 四、(本大题包括2小题,共22分)22.(13分)根据如图所示装置,结合所学知识回答下列问题。
根据如图所示装置,结合所学知识回答下列问题。
(1)写出图中标号的仪器名称:①)写出图中标号的仪器名称:① ,②,② ; (2)①实验室用高锰酸钾制取氧气,应选用的发生装置是 (填字母),发生反应题 号 一 二 三 四 五 六 总 分 得 分 评卷人的化学方程式是的化学方程式是,实验时该装置试管口应放一团棉花,其目的是应放一团棉花,其目的是; ②制氧时,小明同学未能收集到两瓶氧气,其可能的原因有②制氧时,小明同学未能收集到两瓶氧气,其可能的原因有 (填序号); A .没有塞紧橡皮塞.没有塞紧橡皮塞 B .试管口没有放棉花.试管口没有放棉花C .没有及时更换收集第二瓶.没有及时更换收集第二瓶D .加热前已将集气瓶灌满水倒立于水槽中.加热前已将集气瓶灌满水倒立于水槽中 (3)①实验室用大理石和稀盐酸反应制取CO 2,应选择的发生装置是,应选择的发生装置是 (填字母)。
2013年福建省高中学生化学竞赛预赛试题第1题(10分)I2和S2O32-间发生的是一个速率快、定量进行的反应,常用在分析化学中。
1-1 写出化学反应离子方程式;1-2 通常该反应在近中性条件下进行,为什么?1-3 若把I2液滴入S2O32-液,即使在碱性液(pH≈11)中,也能发生定量反应。
为什么?1-4 硫代硫酸钠在药剂中常用作解毒剂,可解卤素单质(如Cl2)、重金属离子(如Hg2+)及氰化钾中毒。
写出化学反应方程式。
第2题(10分)元素A在n=5,l=0的轨道上有一个电子,它的次外层l=2的轨道上电子处于全充满状态;元素B与A在同一周期,若A、B的简单离子混合则有难溶于水的黄色沉淀AB生成;黄色沉淀AB可溶于氰化钾溶液,再加入含有C的简单阴离子溶液后又有黑色沉淀生成,该黑色沉淀可溶于硝酸,并产生乳白色沉淀、同时放出刺激性气体。
2-1 写出元素A、B、C的价层电子构型;2-2 A、B、C各处于第几周期第几族?2-3 写出题目中涉及到的化学反应的离子方程式。
第3题(10分)在地球的电离层中,可能存在以下离子:ArCl+、OF+、NO+、PS+、SCl+。
3-1 说明这些离子中心原子的杂化方式;3-2 预测哪一种离子最稳定?哪一种离子最不稳定?说明理由。
第4题(10分)氮是最常见的元素,其化合物用途十分广泛,回答下列问题: 4-1 为什么在N 3-离子中,两个N-N 键的键长相等,而在HN 3中却不相同?4-2 CO 与N 2是等电子体,具有完全相同的分子轨道和一些类似的性质,但为什么CO 和金属形成配合物要比N 2容易?4-3 氮气常用作保护气体,其中所含的微量氧可通入连二亚硫酸钠的碱性溶液除去。
写出化学反应方程式。
4-4 实验室中NH 4NO 3热分解制得的N 2O 中混有少量NO ,如何使用简单的方法除去?并写出化学反应方程式。
4-5 NaNO 3和NaNO 2均为白色固体,如何鉴别?并写出化学反应的离子方程式。
2013年化学竞赛预选试题(卷)说明:可能用到的相对原子质量:H—1 C—12 N—14 O—16 S—32 Cl—35.5 Na—23 Al—27K—39 Ca—40 Mn—55 Fe——56 Cu—64 Zn—65 Ag—108 Ba—137考试时间:120分钟第Ⅰ卷(选择题,共40分)一、选择题(本题包括20个小题,每小题2分,共40分。
每小题有1个或2个选项符合题意。
若有两个答案的错1 个不得分,漏选1个扣1 分。
)1.古诗词是古人为我们留下的宝贵精神财富。
下列诗句中只涉及物理变化的是A.野火烧不尽,春风吹又生B.春蚕到死丝方尽,蜡炬成灰泪始干C.只要功夫深,铁杵磨成针D.爆竹声中一岁除,春风送暖入屠苏2.实验室使用大理石和盐酸反应制取的CO2是不纯净的,为证明该气体中含有多种物质,所用的试剂及使用顺序正确的是A.无水硫酸铜、硝酸银溶液、石灰水B.浓硫酸、氢氧化钠溶液、石灰水C.硝酸银溶液、石灰水、无水硫酸铜D.氯化钙、石蕊试液、水3.由石灰石、水、苏打为原料制取烧碱的过程中,未发生的化学反应类型是A.分解反应B.化合反应C.置换反应D.复分解反应4.下列实验中所选用的仪器或操作合理的是A.用托盘天平称量5.85g氯化钠晶体B.用酸式滴定管量取25.00mL酸性高锰酸钾C.用湿润pH试纸测定某H2SO4溶液的pHD.用瓷坩埚(含有二氧化硅)灼烧碳酸钠晶体5.“绿色绿色是将反应物全部转化为期望的产物,使原子的利用率达到100%,以昼减少有害物质生成的化学工艺理念。
下列符合“绿色化学”要求的是A.湿法冶铜:Fe+CuSO4=FeSO4+CuB.高炉炼铁:Fe2O3+3CO=2Fe+3CO2C.制氧气:2KMnO4△K2MnO4+MnO2+O2↑D.用乙烯(C2H4)为原料制取乙二醇(C2H6O2):C2H4+H2O2→C2H6O26.下列说法中,你认为科学的是A. 臭氧在一定条件下能转化为有毒气体B.多吃腌制食品能防癌C.生理盐水含食盐的量越高越好D.活性炭可以制作冰箱的除味剂7.同学们在做实验时发现,将镁条放入某CuCl2溶液中,镁条表面有气泡产生。
2013年全国初中学生化学素质和实验能力竞赛 赛区预赛试卷〔时间:120分钟,总分为:100分〕可能用到的相对原子质量:H —1 C —12 N —14 O —16 Na —23 Mg —24 Al —27 Si —28 S —32 Cl —35.5 Ca —40 Cu —64 Ag —108一、选择题〔此题包括20个题,每题1分,共20分。
每题只有一个....选项符合题意〕 1. 化学家提出将燃料进展循环的构想:燃料燃烧产物 燃料 ,这样既可解决能源问题,又能消除污染。
如此上述两个转化过程A ①为物理变化,②为化学变化B ①② 均为化学变化C ①为化学变化,②为物理变化D ①② 均为物理变化2 近期雾霾天气笼罩了我国许多地方。
如下做法不利于...遏制雾霾产生的是 A 取消传统的元宵焰火晚会 B 大力开展火力发电C 加大城市绿化、园林建设D 积极推行油品的升级3 如下物质能在PH=13的无色溶液量共存的是A CuSO 4、FeCl 3 、 NaNO 3 、MgSO 4B H 2SO 4 、HCl 、 AgNO 3、KMnO 4C NaNO 3、NaCl 、 K 2CO 3、K 2SO 4D BaCl 2 、KNO 3 、 (NH 4)2SO 4 、NaOH4、为防治酸雨,可将造纸厂回收的碱白泥〔主要成分是碳酸钙和氢氧化钠〕掺进煤中进展“固硫〞。
在该过程中不可能...发生的化学反响有 A CaCO 3 高温 CaO + CO 2 ↑ B 2NaOH + SO 2 ==== Na 2SO 3 + H 2OC CaO + SO 2 高温 CaSO 3D CaCO 3+ 2NaOH====Ca(OH) 2 + Na 2CO 35 化学与人类的衣、食、住、行密切相关。
如下说确的是A 科学家用纳米线织出碳纳米管布料,碳纳米管属于有机高分子材料B 烩面美味营养,因为面条和瘦肉中富含蛋白质,蔬菜中富含维生素C 郊游后的自行车经清洗后需要晾晒并在链条上涂油等,目的是防止自行车生锈D 用石灰乳粉刷过的墙日久变硬,是因为水分的蒸发而留下固体氢氧化钙的缘故 6 水是最重要的溶剂,如下说确的是A 增大压强和降低温度均可增大气体在水中溶解的体积B 将KNO 3 、Ca(OH) 2的饱和溶液降温后仍是饱和溶液C将蔗糖、食盐溶于水后,溶质均以分子形式存在D室温下,将1gCaO 投入到90g 水中所得溶质的质量分数为1%7 如下图像分别与各选项中的说法相对应〔图中 和 分别表示不同的原子〕, 其中不正确的答案是A可能是题号一 二 三 四 总分 得分题号1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 答案 ①燃烧 ②太阳能或生物能氧化物 B 可能是金属C 一定是混合物D包含组成元素一样的不同物质8肉毒碱〔C7H15NO3〕是一种具有多种生理功能的物质,如下关于它的说法不正确的答.....案是..A 该物质中含有臭氧〔O3〕B 氢元素的质量分数大于氮元素的质量分数C 相对分子质量是161D 碳、氢、氮、氧四种元素的质量比是84:15;14:489 金属M可与CuCl2溶液反响反响:M + CuCl2===MCl2+Cu ,如下说法不正确的答案是.......A 该反响属于置换反响B 金属Mn不可能是铝C 反响前后M的化合价发生改变D 反响后溶液的质量一定增大10 过氧化氢分子中含有“过氧基〞的结构〔如右图方框局部〕故可用来杀菌消毒。
2013化学竞赛预赛复习题1.本试卷共8页,共四道大题,35个小题,满分80分,考试时间100分钟。
2.在试卷和答题卡上准确填写学校名称、班级、姓名和考号。
3.试题答案一律填涂或书写在答题卡上,在试卷上作答无效。
4.考试结束,将本试卷、答题卡和草稿纸一并交回。
可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Mg 24 K 39 Mn 55一、选择题(每小题只有一个选项符合题意。
共25个小题,每小题1分,共25分)1.自来水的生产过程主要包括以下流程,其中发生化学变化的是2.空气的成分中,体积分数约占78%的是A.氮气 B.氧气 C.二氧化碳 D.稀有气体3.地壳中含量最多的元素是A.铝 B.铁 C.氧 D.硅4.决定元素化学性质的主要是原子的A.质子数B.中子数C.电子数D.最外层电子数5. 一壶水烧开后,壶盖被顶开,这是因为A.水分子变大了B.水分解成氢气和氧气C.水由液态变成气态,体积膨胀D.构成物质的粒子数目增多6.下列物质中,含有氧分子的是A.O2 B.H2O C.CO2 D.SO27.下图所示的化学实验基本操作中,正确的是A.倾倒液体 B.称量固体 C.检查气密性 D.加热液体8.酒精灯的火焰太小时,将灯芯拨得松散些,可使火焰更旺。
其原理是A.降低可燃物的着火点B.提高可燃物的着火点C.增加空气中氧气含量D.增大可燃物与空气的接触面积9. 下列物质的主要成分属于氧化物的是A.钻石(C) B.食盐(NaCl) C.水晶(SiO2) D.钟乳石(CaCO3)10.酸化的CrO3为橙红色,遇酒精变成绿色,可用于判断司机是否酒后驾车。
CrO3中Cr 的化合价为A.+3 B.+6 C.-3 D.-611.下列各组气体中,不能用燃着的木条区分的是A.氧气和空气 B.二氧化碳和氮气C.甲烷和空气 D.一氧化碳和二氧化碳12.在元素周期表中钼元素的相关信息如图所示,下列说法正确的是A.元素符号为MOB.属于非金属元素C.原子核内质子数为42D.相对原子质量为95.96g13.下列反应中,属于化合反应的是A.4P +5O2 点燃2P2O5 B.2HgO △2Hg + O2↑C.C + 2CuO 高温2Cu + CO2↑D.2HCl + CuO CuCl2 + H2O14.下列实验的主要现象描述正确的是A.木炭在空气中燃烧,发出白光B.红磷在氧气中燃烧,产生白色烟雾C.蜡烛在氧气中燃烧,产生水和二氧化碳D.铁丝在氧气中燃烧,火星四射,生成黑色固体15.下列化学用语所表述的意义不正确的是A. Mg2+——1个镁离子B. 2H——2个氢元素C. 2H2O——2个水分子D. CuO——氧化铜16.下列有关描述不正确的是A. 进入山洞时用火把照明B. 清理沼气池前做灯火实验C. 人体缺铁元素会导致贫血D. 天然气泄漏,立即关闭阀门并打开门窗17.下列情况:①煤燃烧;②工业废气任意排放;③燃放鞭炮;④燃油汽车排放的尾气;⑤氢能源汽车排放的尾气。
2013化学竞赛(省级初赛)复习题1第Ⅰ卷不定项选择题1、下列说法正确的是A、16O2与18O2互为同位素B、32S与36S的核外电子排布方式相同C、通过化学变化可以实现O2与O3的相互转化D、3He中有2个质子和1个中子2、下列说法正确的是A、常温常压下,F2是无色无味的有毒气体B、实验室中,氢氟酸可以保存在塑料瓶中C、工业上常用电解NaF溶液的方法生产F2D、CaF2与浓硫酸共热是实验室制备HF气体的常用方法3、下列说法正确的是A、制造计算机芯片的主要半导体材料是硅B、2B铅笔芯的主要成分是石墨粉和黏土C、生物固氮指的是植物叶片对N2的吸收作用D、二氧化硫能漂白纸张,是因为二氧化硫具有弱氧化性4、下列说法正确的是A、未擦干的小刀在火上烘烤,表面变蓝,是因为生成了Fe3O4B、O3、Cl2、H2O2都能杀菌,是因为它们都能使菌体蛋白质变性C、银器在空气中变暗,是因为6Ag+SO2 = Ag2S+2Ag2OD、铜器在空气中久置,表面产生绿色物质,是因为有碱式碳酸铜生成5、下列说法正确的是A、维生素C具有还原性,在人体内起抗氧化作用B、糖类、蛋白质、油脂都属于有机高分子化合物C、煤经气化和液化两个物理变化过程,可成为清洁燃料D、聚酯纤维和光导纤维都是新型无机非金属材料6、下列说法正确的是A、氯水中含有的分子只有HClO、HCl、Cl2、H2O四种B、氨水中含有的含氮粒子只有NH3、NH3·H2O、三种C、液态氯化氢中含有的含氯粒子只有HCl、两种D、稀醋酸溶液中不存在CH3COOH分子7、如下图,按照原子核外电子的排布方式的差异,将元素周期表分成s区、p区、d区、ds区、f区等五个区。
下列说法正确的是A、稀土元素都位于f区,碱土金属都位于s区B、Hg和Au都位于ds区,Br和Bi都位于p区C、位于s区的元素都是金属元素D、原子最外层电子数是1的元素都位于s区8、下列离子能在同一溶液中一定不能大量共存的是A、、、、B、、、、C、、、、D、、、、9、24 mL硫化氢在30 mL氧气中燃烧,同温同压下生成SO2的体积为A、24 mLB、30 mLC、20 mLD、18 mL10、下图是进行四项实验所用的实验装置。
其中正确的是A、装置①:铁丝在氧气中燃烧B、装置②:用澄清石灰水吸收H2S气体C、装置③:向碳酸钙粉末中滴加稀盐酸D、装置④:用浓盐酸和KMnO4固体制备氯气11、N2H4与NH3的关系类似于H2O2与H2O的关系。
下列推断正确的是A、N2H4的热稳定性比NH3强B、N2H4最多能结合两个质子生成C、N2H4的还原性比NH3强D、N2H4是由分子构成的物质12、谷胱甘肽(C10H17O6N3S)是生物体内一种重要的三肽化合物,它彻底水解只得到谷氨酸(C5H9O4N)、甘氨酸(C2H5O2N)和半胱氨酸(C3H x O y NS)三种氨基酸。
那么x2+y2的值为A、9B、13C、26D、5313、质量为m的镁条在空气中燃烧,生成MgO和Mg3N2。
将燃烧产物溶于60 mL浓度为73 g/L的盐酸中,中和过量的盐酸恰好用去浓度为20 g/L的NaOH 溶液20 mL。
然后向溶液中加入过量NaOH溶液,加热使NH3全部逸出,再用稀盐酸吸收逸出的气体,测得稀盐酸增重0.17 g。
则镁条的质量m为A、0.6 gB、1.2 gC、3.6 gD、3.8 g14、下图分别表示了原子A和离子的原子结构示意图。
非金属元素C的原子的最外层电子数等于原子序数的3倍。
下列说法正确的是A、元素A和元素C位于同一主族B、化合物HCO3是元素C的一种含氧酸C、B的单质既能与盐酸反应,又能与NaOH溶液反应D、通常情况下,元素A的最高价氧化物是由分子构成的物质15、下表中的数据,是使1个双原子分子断裂成2个原子时消耗的能量:分子Cl2Br2I2H2HF HCl HBr HI 能量() 4.04 3.21 2.51 7.24 9.44 7.18 6.08 4.95 根据表中的信息,能分析得出的结论是A、2H2与2Cl2反应生成4HCl时,放出的能量为B、2HBr分解为H2和Br2时,吸收的能量为C、2H形成H2时,放出的能量为D、由于,因此HF比HI稳定16、酸脱水形成的物质叫做酸酐。
如SO3是H2SO4的酸酐,(CH3CO)2O是醋酸的酸酐。
下列说法正确的是A、HNO3的酸酐是NO2B、右图能大致表示草酸的酸酐的分子结构C、不存在即是酸酐又是金属氧化物的物质D、无机含氧酸的酸酐都能溶于水形成相应的酸17、大气中CO2浓度升高导致的温室效应,可能改变土壤水分状况和矿质元素的含量。
为探究有关生态因子变化对植物的影响,有人用同一环境中生长的两种植物,在其他条件都适宜的情况下作了模拟实验,测得如表所示的实验数据:项目植物物种二氧化碳浓度538 μg/g二氧化碳浓度817 μg/g 不施加磷肥施加磷肥不施加磷肥施加磷肥光合速率*A 95.92 164.56 159.28 255.64B 60.28 297.44 238.92 687.28 蒸腾比率**A 3.42 5.79 5.43 9.44B 0.61 1.61 1.74 5.13*植物单位面积的叶片,在单位时间内,通过光合作用消耗的CO2的质量,单位为μg∙m∙s**植物消耗单位质量的水,通过光合作用消耗的CO2的质量,单位为μg∙g下列分析错误的是A、升高CO2浓度和施加磷肥都能促进两种植物的光合作用B、两种CO2浓度下,施加磷肥对B光合作用的促进作用都比A明显C、干旱对A光合作用的影响大于BD、两种植物光合作用的最适CO2浓度都大于538 μg/g18、 ℃时,饱和KCl溶液的密度为1.174 g/cm3,浓度为0.298 g/mL。
下列说法正确的是A、25 ℃时,饱和KCl溶液的浓度大于0.298 g/mLB、 ℃时,饱和KCl溶液的质量分数为25.4 %C、 ℃时,密度小于1.174 g/cm3的KCl溶液一定是不饱和溶液D、保持温度不变,将KCl溶液蒸发掉部分水,溶液的密度一定增大19、取化学式为MZ的黄色化合物与足量碳粉混合均匀后平铺在硬质玻璃管A中,在B中加入足量澄清石灰水。
实验开始时,缓缓通入N2,过一段时间后加热A,观察到A中有熔融物产生,B中产生白色混浊。
待反应完全后,停止加热,继续通入N2至A冷却,此时A中有银白色金属产生。
下列说法正确的是A、元素Z一定是氧元素B、停止加热前,必须断开A、B间的导管,否则会发生倒吸C、从B中排出的气体无需进行尾气处理即可排入大气D、实验所需的N2可以用NaNO3溶液与NH4Cl溶液反应制备20、将一定量NaOH溶液分成两等份。
一份用pH = 2的一元酸HA的溶液中和,恰好完全中和时消耗HA溶液的体积为V1;另一份用pH = 2的一元酸HB 的溶液中和,恰好完全中和时消耗HB溶液的体积为V2。
下列说法正确的是A、若V1>V2,说明HA的酸性比HB强B、若V1<V2,说明HB是强酸,HA是弱酸C、若V1 = V2,说明HA、HB都是强酸D、钠盐NaA和NaB的溶液一定都显碱性2013化学竞赛预赛(省级初赛)复习题1第Ⅱ卷填空作图题21、有以下实验方案:①将乙醇、浓硫酸共热产生的气体通入酸性KMnO4溶液,检验其中是否含有乙烯;②只用水一种试剂鉴别硝酸铵、氢氧化钠、硫酸钡、硝酸铜、过氧化钠五种固体;③只用KSCN溶液检验FeCl2溶液是否因氧化而变质;④用甲酸和浓硫酸共热制备CO,并用向下排空气法收集;⑤用托盘天平称取25.20 g氯化钠粉末。
其中合理的实验方案的序号是22、现提供以下试剂:四氧化三铁、稀硫酸、双氧水、稀硝酸、高锰酸钾溶液、碘化钾溶液、硫氰化钾溶液、水。
试从中选用部分试剂,设计实验证明四氧化三铁中的铁元素以+2、+3两种价态存在。
分4步写出实验操作步骤实验操作12323、物质A(MnSO4·4H2O)的质量为5.352 g,溶于水后能与30.00 mL高锰酸钾溶液B恰好完全反应。
5.00 mL溶液B又恰好与10 mL浓度为142 g/L 的硫酸亚铁铵溶液在酸性条件下完全反应。
则A、B反应后生成的含锰化合中Mn的化合价为24、铀有3种核素:、、,这三种核素互称为,其中制造原子弹的原料和核反应堆的燃料。
能捕获中子发生裂变,并再次释放出中子:中含有个中子,位于第周期、第族。
在盛有放射性物品的容器上,应贴有的标志是(选择填空:a、b、c、d、e)25、已知物质A~F有下图所示的转化关系:构成A的粒子为10电子分子;1个C分子中含有3对共用电子;F是工业生产某种强酸的重要中间产物。
构成D的分子的空间结构为(选择填空:a、b、c、d)反应①的化学方程式为。
反应②的化学方程式为,该反应在工业上的用途是。
实验室制备F的方法是26、氢原子光谱中,帕邢系谱线的波长λ满足()其中,为不小于4的正整数,。
当时,帕邢系谱线的波长为,其真空中的传播频率为Hz27、实验室中可以用无水硫酸铜检验水的存在。
无水硫酸铜吸湿性很强,因此无水硫酸铜需要现用现制。
实验室一般有以下两种制备方法: 甲在坩埚中灼烧五水硫酸铜晶体至变白色 乙 向五水硫酸铜晶体中加入浓硫酸,一段时间后过滤,并用乙醇洗净方法甲需要的实验仪器有坩埚、三角架、表面皿、 ;若灼烧时间过长,固体会变黑色,原因是 。
方法乙中,浓硫酸体现了 性;对无水乙醇洗涤液进行再生的方法是 。
用制得的无水硫酸铜检验H 2O 2中是否含有水时,发现有无色气泡产生,可能的原因是 28、半导体材料InAs 具有下左图所示的晶体结构:InAs 晶体中,与每个 等距且最近的 的个数是 。
在元素周期表中,In 位于第 周期、第 族,含有66个中子的In 原子的核素符号是 。
在上右图中画出 的原子结构示意图29、某种有机物X 仅由两种元素组成,其中碳元素的质量分数为70.6 %。
在光照条件下,X 与一定量的Cl 2反应,共得到9种含氯分子,其中有7种是五原子分子。
有机物X 的化学式为 。
在产生的9种含氯分子中,碳元素的质量分数最高的一种分子的化学式为 ,含有两个氯原子的分子的化学式为,氯元素的质量分数最高的一种分子的化学式为30、下左图是金刚烷分子中碳原子的分布状况。
若沿着图中箭头方向,从下向上观察,看得的图像如上右图视角A所示。
若某人观察到上右图视角B所示的图像,在上左图中画出所有可能的观察方向31、工业上用锂辉石(主要成分是LiAlSi2O6,含少量Mg、Ca杂质元素)生产Li2CO3的主要工艺为:①将研细的锂辉石用93 %~98 %的浓硫酸在3 ℃浸取,过滤后得到滤液A和滤渣B;②用石灰乳调节滤液A的pH至11,再加入少量Na2CO3溶液,过滤得到滤液C和滤渣D;③向滤液C中加入饱和Na2CO3溶液,过滤后用热水洗涤,得到Li2CO3粗品。