高2020届高2017级高三二轮复习资料第一方案课件第一篇 热点6 2
- 格式:ppt
- 大小:648.00 KB
- 文档页数:11
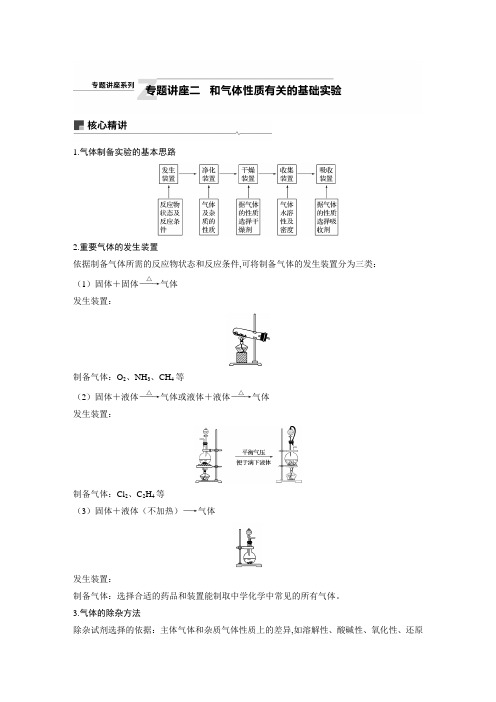
1.气体制备实验的基本思路2.重要气体的发生装置依据制备气体所需的反应物状态和反应条件,可将制备气体的发生装置分为三类:(1)固体+固体――→△气体发生装置:制备气体:O 2、NH 3、CH 4等(2)固体+液体――→△气体或液体+液体――→△气体发生装置:制备气体:Cl 2、C 2H 4等(3)固体+液体(不加热)―→气体发生装置:制备气体:选择合适的药品和装置能制取中学化学中常见的所有气体。
3.气体的除杂方法除杂试剂选择的依据:主体气体和杂质气体性质上的差异,如溶解性、酸碱性、氧化性、还原性、可燃性。
除杂原则:(1)不损失主体气体;(2)不引入新的杂质气体;(3)在密闭装置内进行;(4)先除易除的气体。
一般可从以下几个方面考虑:①易溶于水的杂质可用水吸收;②酸性杂质可用碱性物质吸收;③碱性杂质可用酸性物质吸收;④水分可用干燥剂吸收;⑤能与杂质反应生成沉淀或可溶性的物质,也可用作吸收剂。
4.气体的干燥、净化装置当CO2中混有O2杂质时,应选用上述Ⅰ~Ⅳ中的Ⅳ装置除O2,除杂试剂是Cu粉。
5.气体的收集方法6.尾气处理的原因和方法(1)原因:有些气体有毒或有可燃性,任其逸散到空气中,会污染空气或者引发火灾、爆炸等灾害。
(2)处理方法:一般根据气体的相关性质,使其转换为非气态物质或无毒物质,如酸性有毒气体用碱溶液吸收,可燃性气体用点燃等措施。
7.常见气体的检验(1)可燃性气体的检验(2)酸性气体的检验(3)强氧化性气体的检验8.根据原理选择装置有以下三种实验装置A B C用下列实验原理制取常见气体,请选择相应的上述装置。
(1)2Na2O2+2H2O===4NaOH+O2↑_______________________________________________。
(2)2H 2O 2=====MnO 22H 2O +O 2↑_______________________________________________________。




第一单元化学反应中的热效应[考试标准] 1.化学反应中的热量:①化学反应中能量转化的主要形式(b)。
②吸热反应和放热反应(a)。
③从化学反应中的反应物的总能量与生成物的总能量变化理解反应中的热效应(b)。
④化学键的断裂和形成与反应中能量变化的关系(c)。
⑤热化学方程式的书写(b)。
⑥利用热化学方程式进行简单计算(c)。
⑦合理利用化石燃料,提高燃料燃烧效率的方法(a)。
2.化学反应中的热效应:①反应热(a)。
②焓变的涵义(a)。
③焓变与键能的关系(c)。
④中和热的测定(b)。
⑤标准燃烧热的概念(a)。
⑥热值的概念(a)。
⑦盖斯定律及其简单计算(b)。
考点一焓变、热化学方程式1.反应热(焓变)(1)定义:在恒压条件下进行的反应的热效应。
符号:ΔH。
单位:kJ·mol-1或kJ/mol。
(2)表示方法吸热反应:ΔH>0;放热反应:ΔH<0。
(3)产生原因化学反应过程中旧键断裂吸收的能量与新键形成放出的能量不相等,故化学反应均伴随着能量变化。
(4)常见的放热反应和吸热反应放热反应:①可燃物的燃烧;②酸碱中和反应;③大多数化合反应;④金属跟酸的置换反应;⑤物质的缓慢氧化;⑥铝热反应等。
吸热反应:①大多数分解反应;②盐的水解;③Ba(OH)2·8H2O与NH4Cl反应;④碳和水蒸气、C和CO2的反应等。
2.反应热的本质3.热化学方程式(1)概念表示参加反应物质的量和反应热的关系的化学方程式。
(2)意义表明了化学反应中的物质变化和能量变化。
如:2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ·mol-1表示:2 mol氢气和1 mol氧气反应生成2 mol液态水时放出571.6 kJ的热量。
(3)热化学方程式的书写要求①注明反应的温度和压强(25 ℃、101 kPa下进行的反应可不注明)。
②注明反应物和生成物的状态:固态(s)、液态(l)、水溶液(aq)、气态(g)。

“陷阱”的设置与突破1.从气体摩尔体积的使用条件及物质所处的状态设置“陷阱”正误判断,正确的打“√”,错误的打“×”。
(1)常温常压下,22.4 L Cl2中含有的分子数为N A(×)(2)标准状况下,5.6 L CO2气体中含有的氧原子数为0.5N A(√)(3)标准状况下,22.4 L N2和H2的混合气体中有N A个原子(×)(4)标准状况下,2.24 L乙醇中碳氢键的数目为0.5N A(×)(5)标准状况下,11.2 L N2O4与22.4 L NO2中所含的氧原子数均等于2N A(×)(6)标准状况下,2.24 L氨水中含有NH3分子数为0.1N A(×)破题方法重“两看”,突破陷阱2.从物质的量(或质量)与状况方面设置陷阱如:设置一些与计算无关的干扰条件,如给出非标准状况下的气体的物质的量或质量,干扰正确判断。
正误判断,正确的打“√”,错误的打“×”(1)常温常压下,3.2 g O2所含的原子数为0.2N A(√)(2)标准状况下,80 g SO3中含有3N A个氧原子(√)(3)室温下,1 mol CH4中含有5N A个原子(√)(4)常温常压下,1 mol CO2与SO2的混合气体中含氧原子数为2N A(√)破题方法排“干扰”,突破陷阱(1)物质的量或质量与物质所处状况无关。
(2)物质的量或质量确定时,物质所含的粒子数与温度、压强等外界条件无关。
3.从特殊物质的组成与结构上设置陷阱正误判断,正确的打“√”,错误的打“×”(1)1 mol乙烯分子中含有的碳氢键数为4N A(√)(2)氢原子数为0.4N A的CH3OH分子中含共价键数为0.4N A(×)(3)2.0 g H218O与D2O的混合物中所含中子数为N A(√)(4)7.8 g Na2O2中含有的阴离子数为0.1N A(√)(5)78 g苯中含有碳碳双键的数目为3N A(×)(6)将0.1 mol FeCl3溶于水中形成胶体,含有胶体粒子的数目为0.1N A(×)破题方法记“组成”,突破陷阱(1)记最简式相同的物质,如NO2和N2O4,乙烯和丙烯(C3H6)等,如:质量相同的乙烯和丙烯所含的原子数、电子数均相等。