高一化学必修二第一章第二节化学能与电能
- 格式:doc
- 大小:333.00 KB
- 文档页数:11

高一化学必修二第一章第二节化学能与电能一、能源的分类1、一次能源:______________的能源。
2、二次能源:一次能源经过______、______得到的能源。
二、化学能转化为电能1、化学能通过燃烧转化为电能火电(1)能量转化过程:化学能____________________(2)能量转化的关键步骤:__________________是化学能转化为电能的关键。
2、原电池(1)实验探究实验装置实验现象铜片:______________锌片:______________电流表:________________结论有______产生,装置中______转化为____(2)原电池:将__________转化为________的装置。
(3)工作原理:锌失去电子,作______极,发生的反应为________,电子通过导线流向铜片,溶液中的____在Cu片上得电子生成____,铜片作____,发生的反应为________。
(4)反应本质:原电池反应的本质是__________。
(5)原电池的构成条件①具有__________的两个电极;②能自发进行的氧化还原反应;③电极间____________;④电解质溶液。
(6)原电池的正、负极判断负极正极电极材料活泼性____的金属活泼性____的金属或能导电的______电子流动方向电子____极电子____极电解质溶液中离子定向移动方向____离子移向的极____离子移向的极发生的反应____反应____反应反应现象电极溶解电极______或有________知识点一一次能源与二次能源1、能源可分为一次能源和二次能源,自然界以现成形式提供的能源称为一次能源,需依靠其他能源的能量间接制取的能源称为二次能源。
据此判断下列叙述正确的是()A、天然气是二次能源B、石油是二次能源C、电能是一次能源D、水力是一次能源2、下列叙述不正确的是()A、根据一次能源和二次能源的划分标准,氢气为二次能源B、电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源C、火力发电是将燃料中的化学能直接转化为电能的过程D、在火力发电时,化学能转化为热能的过程实际上是氧化还原反应发生的过程,伴随着能量的变化知识点二原电池的构成3、下列装置能构成原电池的是()4、某原电池工作时总的反应为Zn+Cu2+===Zn2++Cu,该原电池的组成可能是()A、Zn为正极,Cu为负极,CuCl2溶液作电解质溶液B、Cu为正极,Zn为负极,稀H2SO4作电解质溶液C、Cu为正极,Zn为负极,CuSO4溶液作电解质溶液D、Fe为正极,Zn为负极,ZnSO4溶液作电解质溶液知识点三原电池的工作原理5、下面是四个化学反应,你认为理论上不可用于设计原电池的化学反应是()A、2Al+2NaOH+2H2O===2NaAlO2+3H2↑B、2H2+O22H2OC、Mg3N2+6H2O===3Mg(OH)2+2NH3↑D、CH4+2O2―→CO2+2H2O6、将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是()①两烧杯中铜片表面均无气泡产生②甲中铜片是正极,乙中铜片是负极③两烧杯中溶液的c(H+)均减小④产生气泡的速率甲比乙慢⑤甲中SO向Zn片移动,H+向Cu片移动⑥乙中电流从Cu 片流向Zn片⑦甲乙两烧杯中Cu片的质量均不变A、①②③B、③⑤⑦C、④⑤⑥D、②③④⑤⑦知识点四原电池原理的应用7、一学生欲通过实验判断X、Y、Z、W四块金属的活泼性,做了如下实验并得结论:当X、Y组成原电池时,Y为负极;当Z、W组成原电池时,W为正极;W能从含Y离子的盐溶液中置换出单质Y,据此可知它们的活泼性顺序是()A、Z>W>X>YB、X>Y>Z>WC、X>Y>W>ZD、Z>W>Y>X8、某金属能和盐酸反应生成氢气,该金属与锌组成原电池时,锌作为负极,则该金属可能为()A、铝B、铜C、锡D、硅练基础落实1、对于原电池的电极名称叙述有错误的是()A、发生氧化反应的为负极B、正极为电子流入的一极C、比较不活泼的金属为负极D、电流的方向由正极到负极2、下面是四个化学反应,你认为理论上不可用于设计原电池的化学反应是()A、Zn+Ag2O+H2O===Zn(OH)2+2AgB、Pb+PbO2+2H2SO4===2PbSO4+2H2OC、Zn+CuSO4===Cu+ZnSO4D、C+CO22CO3、茫茫黑夜中,航标灯为航海员指明了方向。




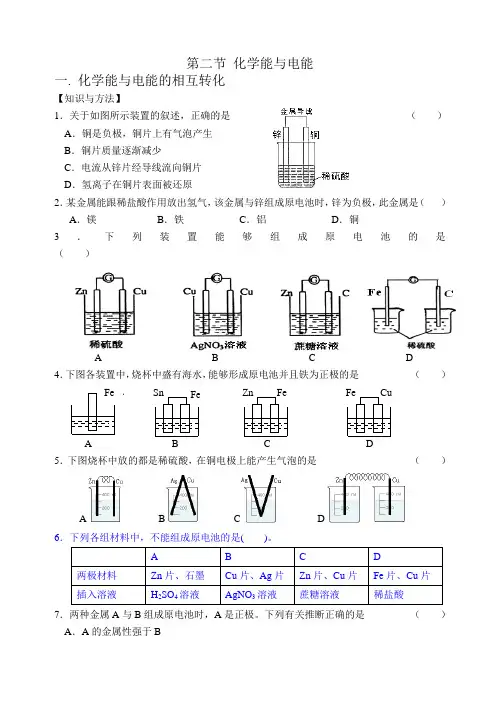
第二节 化学能与电能一. 化学能与电能的相互转化【知识与方法】1.关于如图所示装置的叙述,正确的是 ( )A .铜是负极,铜片上有气泡产生B .铜片质量逐渐减少C .电流从锌片经导线流向铜片D .氢离子在铜片表面被还原2.某金属能跟稀盐酸作用放出氢气,该金属与锌组成原电池时,锌为负极,此金属是( )A .镁B .铁C .铝D .铜3.下列装置能够组成原电池的是 ( )A B C D4( )A 5.下图烧杯中放的都是稀硫酸,在铜电极上能产生气泡的是 ( ) ABC D6.下列各组材料中,不能组成原电池的是( )。
7.两种金属A 与B 组成原电池时,A 是正极。
下列有关推断正确的是 ( )A .A 的金属性强于BB.A电极上发生的反应是还原反应C.电子不断由A电极经外电路流向B电极D.A在金属性活动顺序表中一定排在氢前面8.X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X表面有Z析出,X与Y组成原电池时,Y为负极。
X、Y、Z三种金属的活动性顺序为()A.X>Y>Z B.X>Z>Y C.Y>X>Z D.Y>Z>X9.如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是()A.a为负极,是铁片,烧杯中的溶液为硫酸B.a为正极,是碳棒,烧杯中的溶液为硫酸C.b为负极,是铁片,烧杯中的溶液为硫酸铜溶液D.b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液10.化学能转化为电能的关键是氧化还原反应。
原电池是一种的装置。
在原电池中,一般来说,较活泼的金属发生反应,是极,活泼性较差的金属极上发生反应,是极。
电子的流动方向是从极到极;电流方向是从极到极。
电解质溶液中阳离子向极移动,阴离子向极移动。
11.某学习小组针对化学能转化为电能,进行如下实验:(1)将锌片放入盛有稀硫酸溶液的烧杯中发生化学反应的离子方程式为:Zn+2H+=Zn2++H2↑,烧杯中溶液温度会升高,说明该反应实现了化学能转化为_______能。



高中化学必修二-化学能与电能高中化学必修二化学能与电能在我们的日常生活中,电能无处不在,从照明的电灯到驱动的电动车,从通讯的手机到娱乐的电视,电能已经成为了我们生活中不可或缺的一部分。
那么,电能是如何产生的呢?这就不得不提到化学能与电能之间的奇妙转化。
化学能,简单来说,就是物质发生化学反应时所释放或吸收的能量。
而电能,则是电荷定向移动所形成的能量。
当这两种能量相互转化时,就为我们的现代生活带来了极大的便利。
要理解化学能与电能的转化,首先我们要了解原电池。
原电池是将化学能转化为电能的装置。
它的构成要件包括两个不同的电极、电解质溶液以及形成闭合回路。
比如说铜锌原电池,锌片和铜片分别作为两个电极,硫酸溶液作为电解质溶液。
在这个装置中,锌片比铜片更活泼,所以锌片会失去电子,发生氧化反应,成为原电池的负极。
电子会通过导线流向铜片,铜片这边则发生还原反应,氢离子得到电子生成氢气。
这样,电子的定向移动就形成了电流,从而实现了化学能向电能的转化。
原电池的工作原理其实就是氧化还原反应。
在氧化还原反应中,有物质失去电子,同时有物质得到电子。
原电池巧妙地利用了这种电子的转移,将化学能转化为了电能。
那么,原电池有哪些实际应用呢?首先,在日常生活中,我们使用的干电池就是一种常见的原电池。
干电池里面有锌筒作为负极,石墨棒作为正极,氯化铵和二氧化锰等物质作为电解质。
另外,在汽车中使用的蓄电池也是一种原电池。
在充电时,电能转化为化学能储存起来;在放电时,化学能又转化为电能供汽车使用。
除了原电池,我们还经常听到燃料电池这个词。
燃料电池是一种高效、环保的能源转化装置。
它的燃料可以是氢气、甲烷等,氧化剂通常是氧气。
在燃料电池中,燃料在负极发生氧化反应,氧化剂在正极发生还原反应,从而产生电能。
与传统的燃烧能源方式相比,燃料电池具有很多优点。
它的能量转化效率高,而且产生的废弃物少,对环境更加友好。
化学能转化为电能的过程中,还有一些关键的因素需要考虑。
人教版高一化学科目化学能与电能教材分析一、教材分析1、教材的地位及其作用本节教材是人教版化学必修2第二章第二节的教学内容,是电化学中的重要知识。
初中化学已经从燃料的角度初步学习了“化学与能源”的一些知识,在选修模块“化学反应原理”中,将从科学概念的层面和定量的角度比较系统深入地学习化学反应与能量。
该节内容既是对初中化学相关内容的提升与拓展,又为选修“化学反应原理”奠定必要的基础。
该节分为两课时教学,本课为第一课时。
通过本课的学习,能使学生清楚地认识原电池的工作原理和构成条件,初步形成原电池的概念,并能够写出电极反应式和电池反应方程式。
生活在现代社会,学生对“电”有着丰富而又强烈的感性认识。
当学生了解了化学反应中能量转化的原因,并感受了探究化学能与热能的相互转化过程之后,会对化学能与电能之间的转化问题产生浓厚的兴趣。
正是基于学生的这种心理特征,教材开始的几个设问,把学生带进了“化学能与电能之间相互转化”研究之中。
从能量转换角度看,本节课程内容是对前一节课中“一种能量转化为另一种能量,能量也是守恒的;化学能是能量的一种形式,它同样可以转化为其他形式的能量,如热能和电能等”论述的补充和完善。
从反应物之间电子转移角度看,原电池概念的形成是氧化还原反应本质的拓展和应用;从思维角度看,“将化学能直接转化为电能”的思想,是对“化学能→热能→机械能→电能”思维方式的反思和突破。
本节教材设置了大量的探究教学素材,富有深刻的自主探究教学思想内涵。
首先,原电池概念引入的演示实验2-4为探究教学创设了问题情景,当学生观察到“铜片上产生气泡”这一反常的实验现象时,产生认知的冲突,就会情不自禁地提出一系列问题,产生强烈的探索欲望,并提出各种各样的假设,试图用原有的认知结构去“同化”;学生根据实验现象,经过严密的逻辑推理,得出相关结论,实现认知的“顺应”;当学生理解原电池的原理后,教材又设置了一个“科学探究”和“思考与交流”栏目,让学生自己探究讨论归纳出“组成原电池的条件”,实现认知结构的“发展”;同时,课本插图“水果电池”,是本课时探究教学内容的“迁移”,实现知识的应用和延伸。
第二章 化学反应与能量第二节 化学能与电能第1课时 化学能转化为电能一、能源的分类1.一次能源:______________的能源。
2.二次能源:一次能源经过______、______得到的能源。
二、化学能转化为电能1.化学能通过燃烧转化为电能——火电(1)能量转化过程:化学能――→燃烧______――→蒸汽________――→发电机______(2)能量转化的关键步骤:__________________是化学能转化为电能的关键。
2.原电池 (1)实验探究 实验装置实验现象 铜片:______________锌片:______________电流表:________________结论 有______产生,装置中______转化为____(3)工作原理:锌失去电子,作______极,发生的反应为________,电子通过导线流向铜片,溶液中的____在Cu 片上得电子生成____,铜片作____,发生的反应为________。
(4)反应本质:原电池反应的本质是__________。
(5)原电池的构成条件①具有__________的两个电极;②能自发进行的氧化还原反应;③电极间____________;④电解质溶液。
(6)原电池的正、负极判断负极 正极电极材料 活泼性____的金属 活泼性____的金属或能导电的______电子流动方向 电子____极 电子____极电解质溶液中离子定向移动方向 ____离子移向的极 ____离子移向的极发生的反应 ____反应 ____反应反应现象 电极溶解 电极______或有________知识点一 一次能源与二次能源1.能源可分为一次能源和二次能源,自然界以现成形式提供的能源称为一次能源,需依靠其他能源的能量间接制取的能源称为二次能源。
据此判断下列叙述正确的是( )A .天然气是二次能源B .石油是二次能源C .电能是一次能源D .水力是一次能源2.下列叙述不正确的是( )A .根据一次能源和二次能源的划分标准,氢气为二次能源B .电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源C .火力发电是将燃料中的化学能直接转化为电能的过程D .在火力发电时,化学能转化为热能的过程实际上是氧化还原反应发生的过程,伴随 着能量的变化知识点二 原电池的构成3.下列装置能构成原电池的是( )4.某原电池工作时总的反应为Zn +Cu 2+===Zn 2++Cu ,该原电池的组成可能是( )A .Zn 为正极,Cu 为负极,CuCl 2溶液作电解质溶液B .Cu 为正极,Zn 为负极,稀H 2SO 4作电解质溶液C .Cu 为正极,Zn 为负极,CuSO 4溶液作电解质溶液D .Fe 为正极,Zn 为负极,ZnSO 4溶液作电解质溶液知识点三 原电池的工作原理5.下面是四个化学反应,你认为理论上不可用于设计原电池的化学反应是( )A .2Al +2NaOH +2H 2O===2NaAlO 2+3H 2↑B .2H 2+O 2=====点燃2H 2OC .Mg 3N 2+6H 2O===3Mg(OH)2+2NH 3↑D .CH 4+2O 2―→CO 2+2H 2O6.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( ) ①两烧杯中铜片表面均无气泡产生②甲中铜片是正极,乙中铜片是负极③两烧杯中溶液的c (H +)均减小④产生气泡的速率甲比乙慢⑤甲中SO 2-4向Zn 片移动,H +向Cu 片移动⑥乙中电流从Cu 片流向Zn 片⑦甲乙两烧杯中Cu 片的质量均不变A .①②③B .③⑤⑦C .④⑤⑥D .②③④⑤⑦知识点四 原电池原理的应用7.一学生欲通过实验判断X 、Y 、Z 、W 四块金属的活泼性,做了如下实验并得结论: 当X 、Y 组成原电池时,Y 为负极;当Z 、W 组成原电池时,W 为正极;W 能从含Y 离子的盐溶液中置换出单质Y ,据此可知它们的活泼性顺序是( )A .Z >W >X >YB .X >Y >Z >WC .X >Y >W >ZD .Z >W >Y >X8.某金属能和盐酸反应生成氢气,该金属与锌组成原电池时,锌作为负极,则该金属可能为( )A .铝B .铜C .锡D .硅 练基础落实1.对于原电池的电极名称叙述有错误的是( )A .发生氧化反应的为负极B .正极为电子流入的一极C .比较不活泼的金属为负极D .电流的方向由正极到负极2.下面是四个化学反应,你认为理论上不可用于设计原电池的化学反应是( )A .Zn +Ag 2O +H 2O===Zn(OH)2+2AgB .Pb +PbO 2+2H 2SO 4===2PbSO 4+2H 2OC .Zn +CuSO 4===Cu +ZnSO 4D .C +CO 2=====高温2CO3.茫茫黑夜中,航标灯为航海员指明了方向。
航标灯的电源必须长效、稳定。
我国科技工作者研制出以铝合金、Pt-Fe 合金网为电极材料的海水电池。
在这种电池中( ) ①铝合金是正极 ②铝合金是负极 ③海水是电解液 ④铝合金电极发生还原反应A .②③B .②④C .①②D .①④4.下列烧杯中盛放的都是稀硫酸,在铜电极上能产生气泡的是( )5. 如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a 极上有大量气泡生成,则以下叙述正确的是( )A .a 为负极,是铁片,烧杯中的溶液为硫酸B .b 为负极,是铁片,烧杯中的溶液为硫酸铜溶液C .a 为正极,是碳棒,烧杯中的溶液为硫酸D .b 为正极,是碳棒,烧杯中的溶液为硫酸铜溶液练方法技巧——原电池正、负极及电极反应的判断6.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd(OH)2+2Ni(OH)2Cd+2NiO(OH)+2H2O由此可知,该电池放电时的负极材料是()A.Cd(OH)2B.Ni(OH)2C.Cd D.NiO(OH) 7.据报道,美国正在研究用锌电池取代目前广泛使用的铅蓄电池,锌电池具有容量大、污染少等优点,其电池反应为2Zn+O2===2ZnO,其原料为锌粉、电解液和空气。
则下列叙述正确的是()A.锌为正极,空气进入负极B.负极反应为Zn-2e-===Zn2+C.正极发生氧化反应D.电解液是酸溶液题号 1 2 3 4 5 6 7答案8.有甲、乙两位学生均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6 mol·L-1 H2SO4溶液中,乙同学将电极放入6 mol·L-1 的NaOH溶液中,如下图所示。
(1)写出甲池中正极的电极反应式:正极:____________________________________________________________。
(2)写出乙池中负极的电极反应式和总反应的离子方程式:负极:________________________________________________________________。
总反应的离子方程式:______________________________________________。
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强(填写元素符号)。
(4)由此实验,可得到如下哪些正确结论?()A.利用原电池反应判断金属活动顺序时应注意选择合适的介质B.镁的金属性不一定比铝的金属性强C.该实验说明金属活动顺序表已过时,已没有实用价值D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析(5)上述实验也反过来证明了“直接利用金属活动顺序表判断原电池中的正负极”这种做法________(可靠或不可靠)。
如不可靠,请你提出另一个判断原电池正负极的可行实验方案_________________________________________________________________________________________________________________________________ ________________________________________________________________________ (如可靠,此空可不填)。
第二节化学能与电能第1课时化学能转化为电能基础落实一、1.直接从自然界取得2.加工转换充电放电二、1.(1)热能机械能电能(2)燃烧(氧化还原反应)2.(1)从上到下:有气泡逸出溶解指针发生偏转电流化学能电能(2)化学能电能(3)负氧化反应H+H2正极还原反应(4)氧化还原反应(5)①活动性不同③形成闭合回路(6)从左到右,从上到下:较强较弱非金属流出流入阴阳氧化还原增重气泡放出对点训练1.D2.C[火力发电的能量转化:化学能→热能→机械能→电能。
]3.B[原电池的构成条件:①两个活泼性不同的电极,②插入电解质溶液,③形成闭合回路。
]4.C[Zn失电子则Zn应为负极;Cu2+得电子则Cu2+为电解质溶液中的阳离子。
] 5.C[可设计成原电池的化学反应必须是氧化还原反应。
]6.B7.D[X、Y组成原电池Y为负极,则活泼性:Y>X;Z、W组成原电池,W为正极,则活泼性:Z>W,W能从含Y离子的溶液中置换出Y单质,则活泼性:W>Y,综上,则活泼性顺序为Z>W>Y>X。
]8.C[该金属在金属活动顺序表中应在氢前锌后,故选C。
]课后作业1.C[原电池中相对活泼的金属为负极,不活泼的为正极,C项错误;负极发生氧化反应,正极发生还原反应,A项正确;原电池工作时,外电路中电子由负极流出,由正极流入,电流方向与电子流动方向相反,B、D项正确。
]2.D[D是吸热的氧化还原反应,反应过程中吸收能量,不能设计为原电池。
]3.A[分析航标灯的电源结构,活泼金属铝合金作负极,相对不活泼金属Pt-Fe合金作正极,电解液是海水;铝合金作负极发生的是氧化反应,故①④错误,②③正确。
] 4.A[由题给装置图知,A、B、C形成原电池,由于金属活动顺序表中Cu、Ag排在H的后面,而Zn排在H的前面,故A中有气体产生。
]5.C[Fe、C形成的原电池中,负极铁失去电子,变成+2价的亚铁离子,由于a极上有大量气泡生成,所以正极(C)电极反应:2H++2e-===H2↑,a为正极,是碳棒;b为负极,是铁片;电解质溶液为硫酸。
]6.C[根据镍镉可充电电池放电的反应原理Cd+2NiO(OH)+2H2O===Cd(OH)2+2Ni(OH)2,Cd被氧化生成Cd(OH)2,NiO(OH)被还原生成Ni(OH)2,即Cd发生氧化反应,是失去电子的物质,NiO(OH)发生还原反应,是得到电子的物质,所以,Cd为负极,NiO(OH)为正极,即电池的负极材料是Cd,C项正确。