2017年中考化学知识点大全:金属资源的保护和利用
- 格式:doc
- 大小:29.00 KB
- 文档页数:1

课题三金属资源的利用和保护第二课时金属资源的保护一教学目标:(一)知识与技能:1、了解金属锈蚀的条件和防止金属生锈的简单方法。
2、了解金属资源的保护方法。
3、知道废弃金属对环境的污染,认识回收金属的重要性。
(二)过程与方法:1、从探究与讨论中,学生学会查阅资料,收集资料,自我思考,通过实验得出结论从而上升到理论的方法。
2、通过与大家的讨论交流,让学生学会如何更好的与同学进行合作交流。
(三)情感态度与价值观:1、增强热爱祖国的情感,树立为民族振兴、社会进步学习化学的志向,使学生体会学习化学的价值;2、保持和增强对生活中化学现象的好奇心和探究欲,培养学习化学的兴趣,树立珍惜资源、爱护环境、合理使用化学物质的观念。
二学情分析:学生在日常生活中都接触过金属,也见过许多金属腐蚀的现象,但却未探究过属腐蚀的条件以及如何防护金属。
我们将通过本节课的学习激发学生的探究欲和好奇心三教材分析:1、本节的主要内容:金属的腐蚀和防护,以及金属资源的保护等,既有知识、技能方面的内容,又有环境意识和资源意识等情感领域的内容。
关于金属资源的保护,教材中首先以图示的方法给出了一些矿物可供开采的年限,形象地说明了金属矿物资源是有限的,以及金属资源保护的重要性。
教材中简要地介绍了废旧金属的回收利用、合理开采矿物等保护金属资源的措施。
2、本节的作用和地位:一方面使得学生懂得金属资源的短缺和金属在生活中的重要性,另一方面,学生在探究的过程中通过收集材料、查阅资料、讨论交流等具体探究活动培养学生的良好学习习惯和学习方法。
3、本节重点:第二部分“金属资源的保护”,重点是有关铁的锈蚀以及防护的“活动与探究”内容。
该活动与探究内容包括提出问题、设计实验并实施、讨论、得出结论、对结论进行应用等多个步骤,对培养学生的创新精神和解决实际问题的能力具有较大的价值。
五、教学评价:本课题的知识内容学生较为熟悉,但应用丰富的素材引导学生感知熟悉学习的对象,从生活经验出发,引出课题,激发学生的兴趣,让学生用科学家的身份来研究铁为什么生锈、在什么条件下易生锈、如何防止铁生锈等,从而感受到“身边处处有化学”。

7(2017·庆阳中考)自2011年我省实施找矿战略行动以来,在铜、铅、锌、金、铁、铌、钽等金属方面取得找矿新成果。
下列关于铁、锌、铜三种金属及其合金的说法不正确...的是A.铁在潮湿的空气中易生锈B.可以用铁桶盛放硫酸铜溶液C.可以用稀硫酸鉴别锌与铜的金属活动性强弱D.黄铜(铜与锌的合金)的硬度大于纯铜B 点拨:A.铁在潮湿的空气中易生锈,故正确。
B.铁会与硫酸铜反应生成硫酸亚铁和铜,所以不能用铁桶盛放硫酸铜溶液,故错误。
C.稀硫酸和锌能发生反应,和铜不能发生反应,所以可以鉴别锌与铜的金属活动性强弱,故正确。
D.黄铜属于铜的合金,合金要比组成成分金属的硬度大,故错误。
13(2017·宿迁中考)人类社会的发展离不开金属.(1)钢铁的锈蚀主要是铁与空气中的氧气和水蒸气(或O2和H2O)等物质发生化学反应的结果;(2)在空气中,铝的表明易生成致密的氧化膜,氧化膜的主要成分是Al2O3(写化学式);(3)某同学取少量工厂废液[溶质是AgNO3、Cu(NO3)2],向其中加入一定量的金属锌,反应结束后,发现溶液仍然是蓝色.据此推断,反应后溶液中一定含有的溶质是硝酸铜和硝酸锌[或Cu(NO3)2和Zn(NO3)2].13(2017·六盘水中考)(4分)已知A~H均为初中化学常见的物质。
其中A、C是组成元素相同的气体,且c能产生温室效应;B为红棕色,是赤铁矿的主要成分;F是紫红色金属;H是蓝色沉淀。
根据如图所示的转化关系(图中反应条件均已略去),请回答:(l )写出物质B 的化学式:_________。
(2)写出序号对应的化学方程式:①_________。
②_________。
(3)反应③的基本反应类型是_________。
13.(1)Fe 2O 3;(2)①3CO+Fe 2O 32Fe+3CO 2;②Fe+CuCl 2=FeCl 2+Cu/Fe+Cu(NO 3)2=Fe(NO 3)2+Cu ;(3)复分解反应。


课题3金属资源的利用和保护一、常见的矿石:赤铁矿(主要成分是Fe2O3 )磁铁矿(主要成分是Fe3O4)菱铁矿(主要成分是FeCO3 )硫铁矿(主要成分是FeS2 )黄铜矿(主要成分是CuFeS2)辉铜矿(主要成分是Cu2S)铝土矿(主要成分是Al2O3)二、铁的冶炼(原料:铁矿石、焦炭、石灰石、空气)注意事项:1,先通CO后加热。
2,实验结束后先停止加热,后停止通CO。
3,装置连接盛有澄清石灰水的试管的作用:检验生成气体CO2;吸收反应后剩余CO中的CO2,以便于CO的尾气处理。
4,CO有毒,要进行尾气处理。
5,CO点燃前必须验纯,否则易引起爆炸。
高温Fe2O3 + CO === Fe + CO2现象:玻璃管内粉末由红色逐渐变黑,澄清石灰水变浑浊。
三、工业炼铁:⑴原理:焦炭在高温条件下跟O2反应生成CO, CO作还原剂,在高温条件下把铁矿石中的铁还原出来。
四、金属资源保护1铁生锈的条件铁+水+氧气2防止铁锈蚀的主要措施:①保持钢铁表面的清洁干燥。
②镀金属保护层:如镀锡、镀锌、镀铬等;白铁皮镀锌,马口铁镀锡,钢圈镀铬、镍。
③涂非金属保护层:如喷涂油漆、涂防锈油、在脸盆、杯子表面烧涂搪瓷、用橡胶或塑料包在钢铁表面。
④形成氧化膜保护层:枪套上形成四氧化三铁、锯条上的烤蓝。
⑤在钢铁里加入金属或非金属形成耐腐蚀合金:如不锈钢(加Cr、Ni)怎样保护金属资源1、防止金属的腐蚀,2、金属的回收利用,3、合理地开采矿物,4、寻找金属的代用品。
除铁锈:用稀盐酸、稀硫酸三、含杂质的反应物或生成物的有关计算1、某钢铁厂每天需消耗5000t含氧化铁76%的赤铁矿石,该厂理论上可以日产Fe98%的生铁多少t(课本17页)纯物质的质量分数(纯度)=纯物质的质量/不纯物质的质量*100% 注意计算格式(解,设,答)练习1下列有关金属的说法中,正确的是()A.生铁、不锈钢都是纯铁 B.铜在潮湿的空气中也不会生锈C.钢铁制品表面涂油是为了更加美观 D.铝合金硬度大、密度小,用于飞机制造2.“垃圾是放错了位置的资源”,应该分类回收。
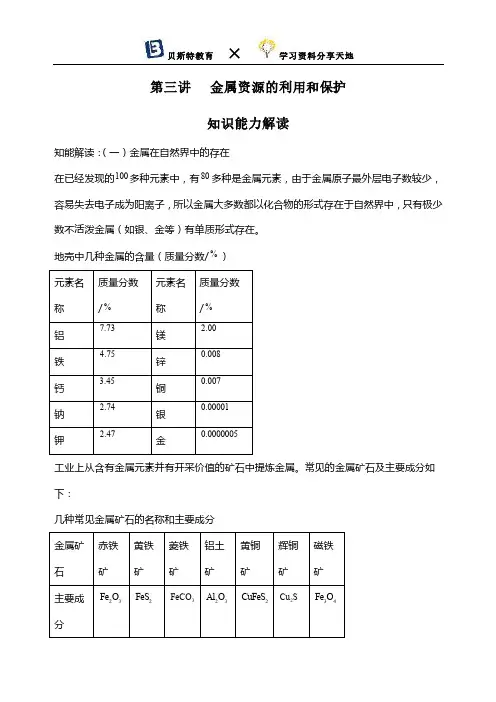
第三讲金属资源的利用和保护知识能力解读知能解读:(一)金属在自然界中的存在在已经发现的100多种元素中,有80多种是金属元素,由于金属原子最外层电子数较少,容易失去电子成为阳离子,所以金属大多数都以化合物的形式存在于自然界中,只有极少数不活泼金属(如银、金等)有单质形式存在。
地壳中几种金属的含量(质量分数/%)工业上从含有金属元素并有开采价值的矿石中提炼金属。
常见的金属矿石及主要成分如下:几种常见金属矿石的名称和主要成分知能解读:(二)铁的冶炼1.炼铁实验(1)原理:在高温条件下,用还原剂一氧化碳把铁从铁矿石里还原出来。
232Fe O 3CO 2Fe 3CO ++高温(2)实验室模拟炼铁实验装置:如图所示。
(3)步骤:①检查装置的气密性;②将氧化铁放入玻璃管中央,固定装置;③先点燃右端酒精灯;④给玻璃管通入CO 气体;⑤给氧化铁加热;⑥停止加热;⑦停止通CO 气体;⑧熄灭右端酒精灯。
速学巧记:一氧化碳还原氧化铁实验步骤可简化为:一氧化碳早出晚归,酒精喷灯迟到早退;前者颠倒会爆炸,后者颠倒要氧化。
(4)现象:红棕色粉末逐渐变为黑色,澄清石灰水变浑浊。
注意:①实验开始时要先通入一氧化碳,再加热,以排净玻璃管中的空气,以免加热时发生爆炸。
②实验结束时,应先停止加热,继续通CO 至冷却到室温,防止生成的高温的铁再次被氧化。
③由于CO 有毒,不能直接排放到空气中,否则会污染空气,因此装置中右端的酒精灯所起的作用是点燃未反应的一氧化碳气体。
2.工业炼铁的原料和设备(1)原料:铁矿石→提供铁元素;焦炭→燃烧提供热量,产生CO 作还原剂;石灰石→除去铁矿石中的杂质,使之成为炉渣;空气→提供氧元素。
(2)炼铁的高炉内发生的化学反应:由下至上依次为22C O CO +点燃、2CO C 2CO +高温、2323CO Fe O 2Fe 3CO ++高温。
(3)设备:高炉。
(4)产品:生铁,即含碳量为2%~4.3%的铁合金。

金属资源的利用和保护(基础)【学习目标】1.知道一些常见的金属(铁)等矿物;掌握炼铁的原理及有关含杂质物质的化学方程式的计算。
2.了解防止金属生锈的简单方法,知道废弃金属对环境的污染,认识回收金属的重要性。
【要点梳理】要点一、几种常见的金属矿物1.地球上的金属资源广泛存在于地壳和海洋中,除金、银等少数很不活泼的金属有单质形式存在外,其余都以化合物的形式存在。
2.几种常见的金属矿物的名称和主要成分见下表:金属矿物赤铁矿黄铁矿菱铁矿铝土矿黄铜矿辉铜矿主要成分Fe2O3FeS2FeCO3Al2O3CuFeS2Cu2S【要点诠释】1.金属元素在地壳中的含量由大到小:铝铁钙、钠钾镁。
2.工业上把能用来提炼金属的矿物叫做矿石。
在自然条件下,铁、铝等金属无单质存在,因为这些金属的活动性较强,会与氧气、水等作用生成化合物。
3.人类最先使用铜,而后铁,使用铝只有一百多年的历史,主要与三种金属的化学性质、冶炼难易有关。
要点二、工业炼铁工业上冶炼铁的原料、主要反应原理、主要设备见下表:(高清课堂《金属资源的利用和保护》一)原料铁矿石、焦炭、石灰石等主要反应原理在高炉中焦炭的作用是提供热量(碳和氧气反应生成二氧化碳,放热),二氧化碳和碳反应生成还原剂一氧化碳。
C+CO22COFe2O3 + 3CO2Fe + 3CO2主要设备高炉【要点诠释】1.铁矿石冶炼成铁是一个复杂的过程。
(1)在高炉中焦炭的作用是提供热量和生成还原剂一氧化碳。
C+O2CO2 (放热反应)C+CO22CO(2)石灰石的作用是除SiO2等杂质,将矿石中的SiO2转化为炉渣CaSiO3。
CaCO3CaO+CO2↑CaO+ SiO2CaSiO3(3)冶炼过程中的主要化学方程式:C+O2CO2 C+CO22CO Fe2O3 + 3CO2Fe + 3CO22.高炉炼出的铁是生铁,主要成分是铁,还含有C、P、S等元素,所以生铁是铁和其它元素的合金。
要点三、一氧化碳还原氧化铁的实验探究1.实验装置:2.反应的化学方程式(炼铁的原理):Fe2O3+3CO2Fe+3CO23.实验步骤:(1)检查装置的气密性。



8.3 金属资源的利用和保护1、金属在自然界中的存在(1)金属在自然界中的存在●在发现的100多种元素中,有80多种是金属元素。
●金属资源广泛地存在于地壳和海洋中。
●除少数很不活泼的金属如金、银等有单质形式存在外,其余都以化合物的形式存在。
●金属元素在地壳中的含量由高到低的顺序:铝>铁>钙>钠>钾。
(2)常见的金属矿石 名称赤铁矿黄铁矿 菱铁矿 铝土矿 黄铜矿 辉铜矿 磁铁矿 主要成分 Fe 2O 3FeS 2FeCO 3Al 2O 3CuFeS 2Cu 2SFe 3O 4★冶炼金属时选择矿石应遵循的原则:所需提炼金属的含量高;矿石在冶炼过程中对环境污染小;冶炼途径尽可能简便。
2、一氧化碳还原氧化铁(1)实验原理232CO 3Fe 2CO 3O Fe ++高温(2)实验步骤 ●检查装置气密性。
●将氧化铁放入玻璃试管中央。
●先点燃右侧酒精灯。
●再通入CO 气体。
●给Fe 2O 3加热。
●停止加热●待玻璃管冷却后停止通入CO 。
●盖灭右侧酒精灯。
(3)实验现象:红棕色粉末逐渐变为黑色;生成的气体能使澄清石灰水变浑浊;尾气燃烧并产生蓝色火焰。
(4)涉及的化学方程式左侧酒精喷灯处:232CO 3Fe 2CO 3O Fe ++高温试管中:O H CaCO OH Ca CO 2322+↓=+)( 右侧酒精灯处:22CO 2O CO 2点燃+ (5)注意事项●先通CO 的目的:排出装置内的空气,以免加热时CO 与空气混合,可能会发生爆炸。
●实验完毕后继续通入CO 直到玻璃试管冷却的目的:防止氧化铁被还原成铁后,在较高的温度下重新被氧化。
●尾气处理的目的:因为CO 气体有毒,所以尾气中的CO 气体要经过点燃处理或收集备用,防止污染空气。
3、工业炼铁(1)原料:铁矿石、焦炭、石灰石和空气 (2)设备:炼铁高炉(3)原理:在高温条件下,利用CO 从铁的氧化物将铁还原出来。
(4)化学方程式●以赤铁矿为原料,主要反应为:232CO 3Fe 2CO 3O Fe ++高温 ●以磁铁矿为原料,主要反应为:243CO 4Fe 3CO 4O Fe ++高温●焦炭的作用→提供热量:22CO O C 点燃+ →提供还原剂:CO 2CO C 2高温+(5)产品:生铁(含碳量为2%~4.3%的铁合金,不是纯铁)。

【高中化学】金属资源的保护和利用
1、铁的冶炼
(1)原理:在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石里还原出来。
3co+fe2o3高温2fe+3co2
(2)原料:铁矿石、焦炭、石灰石、空气
常用的铁矿石存有磁铁矿(主要成分就是fe3o4)、赤铁矿(主要成分就是fe2o3)
2、铁的锈蚀
(1)铁锈蚀的条件就是:铁与o2、水碰触(铁锈的主要成分:fe2o3•xh2o)
(铜生铜绿的条件:铜与o2、水、co2接触。
铜绿的化学式:cu2(oh)2co3)
(2)避免铁制品锈蚀的措施:
①保持铁制品表面的清洁、干燥
②表面涂抹保护膜:例如涂油、刷漆、电镀、烤蓝等
③制成不锈钢
(3)铁锈很结石,无法制约里层的铁稳步与氧气、水蒸气反应,因此铁制品可以全部被破损。
因而铁锈应当及时除去。
(4)而铝与氧气反应生成致密的氧化铝薄膜,从而阻止铝进一步氧化,因此,铝具有很好的抗腐蚀性能。
3、金属资源的维护和利用:①避免金属腐蚀
保护金属资源的途径:②回收利用废旧金属
③合理采矿矿物
④寻找金属的代用
意义:节约金属资源,增加环境污染。

2017年中考化学知识点大全:金属资
源的保护和利用
金属资源的保护和利用
考点一、铁的冶炼
1、原理:在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石里还原出来。
3CO + Fe2O3= 2Fe + 3CO2
2、现象:红色粉末逐渐变为黑色,产生的气体能使澄清的石灰水变浑浊。
3、书上图8-20需注意:
①先通CO再加热的目的:排出装置内的空气,以免加热时CO与空气混合,可能会发生爆炸。
②实验完毕后继续通入CO的目的;防止氧化铁被还原成铁后,在较高的温度下重新被氧化
③尾气的处理:因为CO有毒,所以尾气中的CO气体要经过处理,变成无毒的气体。
可点燃使其生成无毒的二氧化碳气体。
4、原料:铁矿石、焦炭、石灰石、空气
常见的铁矿石有磁铁矿(主要成分是Fe3O4 )、赤铁矿(主要成分是Fe2O3 )
5、石灰石的作用:除去铁矿石中的二氧化硅
考点二、含杂质化学反应的计算
含杂质的物质质量与纯物质质量的转化:
纯物质的质量=含杂质的物质质量×纯物质的纯度
考点三、铁的锈蚀
(1)铁生锈的条件是:铁与O2、水接触(铁锈的主要成分:Fe2O3·XH2O)
(铜生铜绿的条件:铜与O2、水、CO2接触。
铜绿的化学式:Cu2(OH)2CO3)
(2)防止铁制品生锈的措施:。