BCA法测蛋白浓度
- 格式:doc
- 大小:35.50 KB
- 文档页数:2


bca法测蛋白浓度BCA法测蛋白浓度蛋白是生物体内重要的基本组成成分之一,对于研究生物学过程和疾病机制具有重要意义。
因此,精确测定蛋白的浓度是科学研究和实验室工作中不可或缺的一环。
BCA(巴拉洛蓝试剂法)是一种常用的方法,用于测定蛋白的浓度。
BCA法的原理是利用从蛋白质中提取的巴拉洛蓝试剂与蛋白质中的草酰基残基反应,生成一种特征性的紫色化合物。
这种紫色化合物具有吸收波长在562 nm附近的特定特性,在分光光度计中可以被测量和定量。
通过测量样品溶液与标准溶液之间色度的差异,可以推算出样品中蛋白质的浓度。
对于使用BCA法测定蛋白浓度的实验,我们首先需要制备标准曲线。
标准曲线通常由一系列已知浓度的蛋白标准品组成。
这些标准品的浓度应该覆盖预期测定样品中蛋白质浓度的范围。
在实验中,我们将标准品与巴拉洛蓝试剂混合,反应后进行分光光度计测量,得到吸光度值。
然后,我们可以根据标准品的浓度和吸光度值,绘制标准曲线。
在制备好标准曲线后,我们可以开始测定样品的蛋白浓度。
样品可以是含有未知浓度蛋白质的溶液,也可以是纯化后的蛋白样品。
将样品与巴拉洛蓝试剂混合反应后,使用分光光度计测量吸光度值。
然后,通过标准曲线中得到的浓度和吸光度值,可以计算出样品中的蛋白质浓度。
BCA法测定蛋白浓度具有许多优点。
首先,该方法对于大多数蛋白质具有较高的灵敏度,可以检测到低至约0.5μg/mL的蛋白浓度。
其次,BCA法与传统的Lowry法相比,具有更好的线性范围和较少的蛋白质干扰物。
此外,BCA法操作简便,批量测定时效率高。
然而,BCA法也存在一些局限性。
巴拉洛蓝试剂在高浓度蛋白质样品中可能会受到一些脂类、糖类和有机溶剂的干扰。
此外,某些酸性蛋白质和还原剂也可能影响BCA法的准确性。
因此,在进行蛋白质浓度测定时,需要根据实际情况选择适当的方法和试剂。
总结而言,BCA法是一种常用且可靠的方法,用于测定蛋白质的浓度。
通过制备标准曲线和测定样品的吸光度值,可以准确计算出样品中的蛋白浓度。

BCA(bicinchonininc acid)与二价铜离子的硫酸铜等其他试剂组成的试剂,混合一起即成为苹果绿,即BCA工作试剂。
在碱性条件下,BCA与蛋白质结合时,蛋白质将Cu2+还原为Cu+,一个Cu+螯合二个BCA分子,工作试剂由原来的苹果绿形成紫色复合物,最大光吸收强度与蛋白质浓度成正比。
【操作】标准曲线的绘制:取试管七支、编号,按下表操作:【计算】(一)绘制标准曲线。
(二)以测定管吸光度值,查找标准曲线,求出待测血清中蛋白质浓度(g/L)。
(三)再从标准管中选择一管与测定管光密度相接近者,求出待测血清中蛋白质浓度(g/L)。
【优缺点】(一) 操作简单,快速,45分钟内完成测定,比经典的Lowary法快4倍且更加方便;(二) 准确灵敏,试剂稳定性好,BCA试剂的蛋白质测定范围是20-200μg/ml,微量BCA测定范围在μg/ml。
(三) 经济实用,除试管外,测定可在微板孔中就进行,大大节约样品和试剂用量;(四) 抗试剂干扰能力比较强,如去垢剂,尿素等均无影响【器材】(一) 7220型分光光度计(二)恒温水浴箱(三)中试管7支(四)枪式移液管【试剂】1、试剂A:1%BCA二钠盐2%无水碳酸钠%酒石酸钠%碳酸氢钠混合调PH值至。
2、试剂B:4%硫酸铜。
3、 BCA工作液:试剂A 100ml +试剂B 2ml混合。
4、蛋白质标准液:用结晶牛血清白蛋白根据其纯度用生理盐水配制成ml的蛋白质标准液。
(纯度可经凯氏定氮法测定蛋白质含量而确定)5、待测样品:用双缩脲测定法的样品稀释而成。
此法测定蛋白质浓度,近些年被科研工作者广泛选用。
目前BCA法的试剂盒市面有售。
总之,虽然蛋白质含量的测定方法很多,但是,还没有一个完美的方法。
在选择测定方法时,可根据实验要求和实验室条件决定。

bca法测蛋白浓度
BCA(双硫键巯基蛋白比色法)法是一种常用于测量蛋白质浓度的方法。
BCA 法基于蛋白质中含有的缩二肽键(双硫键)的比色反应原理,其测定范围广泛,准确性高,被广泛应用于生物化学、分子生物学和生物医学等领域。
BCA法的原理是将要测定蛋白质样品与碱式铜离子(Cu2+)和BCA试剂在碱性条件下反应生成蓝色络合物,其最大吸收波长为562nm。
蛋白质浓度与络合物的吸光度呈线性关系,通过测定吸光度可以计算出蛋白质的浓度。
在使用BCA法进行蛋白质浓度测定时,首先准备一系列已知浓度的蛋白质标准溶液作为参照,常用的标准蛋白质有牛血清白蛋白(BSA)或牛球蛋白等。
然后将待测蛋白样品与BCA试剂按照一定比例混合,在60-70°C的水浴中加热反应20-30分钟,使络合物完全形成。
冷却后,用分光光度计测定吸光度,并根据标准曲线反推出待测样品的蛋白质浓度。
BCA法在实验室中被广泛应用于测定多种类型的蛋白质样品,包括纯化的蛋白质、蛋白质混合物、细胞裂解液和组织提取物等。
它具有操作简单、准确性高、灵敏度好和重复性良好等优点。
总之,BCA法是一种常用的蛋白质浓度测定方法,通过测定蛋白质样品与BCA 试剂反应生成的络合物的吸光度,可以准确计算出蛋白质的浓度。
该方法广泛应用于科研、生产和临床领域,对于研究蛋白质特性、克隆和表达蛋白质等具有重要意义。
(字数:327)。

bca法测蛋白浓度标准曲线
bca法测蛋白浓度原理:在碱性环境中,蛋白质与cu2+络合并将cu2+还原成
cu1+(biuretreaction)。
bca与cu1+结合形成稳定的紫蓝色复合物,在nm处有高的光吸收值并与蛋白质浓度成正比,可测定蛋白质浓度。
因为蛋白质是细胞中最重要的含氮生物大分子之一,承担着各种生物功能。
有关bca法测蛋白浓度的相关操作:1、按试剂盒说明书配置bca工作液。
2、完全溶解蛋白质标准品,加到96孔板的蛋白标准品孔中,按照说明书要求对标品进行梯度释,加入bca工作液,用酶标仪测定其吸光度。
3、以样品浓度为x轴,吸光度为y轴,绘制标准曲线。
4、待测样品中加入bca工作液,测定吸光度,带入标准曲线中,计算样品浓度。
除了bca法测蛋白浓度外,还有其他方法可以测试蛋白浓度。
1、考马斯亮蓝法(bradford)法原理:考马斯亮蓝g-(coomassiebrilliantblueg-)测定蛋白质含量属于染料结合法的一种。
在游离状态下呈红色,最大光吸收在nm。
当它与蛋白质结合后变为青色,蛋白质-色素结合物在nm波长下有最大光吸收。
其光吸收值与蛋白质含量成正比,因此可用于蛋白质的定量测定,是一种常用的微量蛋白质快速测定方法。
2、斐林—酚试剂(lowry)法:斐林(folin)-酚试剂法结合了双缩脲试剂和酚试剂与蛋白质的反应,其中包括两步反应:第一步是在碱性条件下,与铜试剂作用生成蛋白质-铜络合物。
第二步是此络合物将磷钼酸、磷钨酸试剂还原,生成磷钼蓝和磷钨蓝的深蓝色混合物,颜色深浅与蛋白含量成正相关,在nm波长下有最大光吸收。
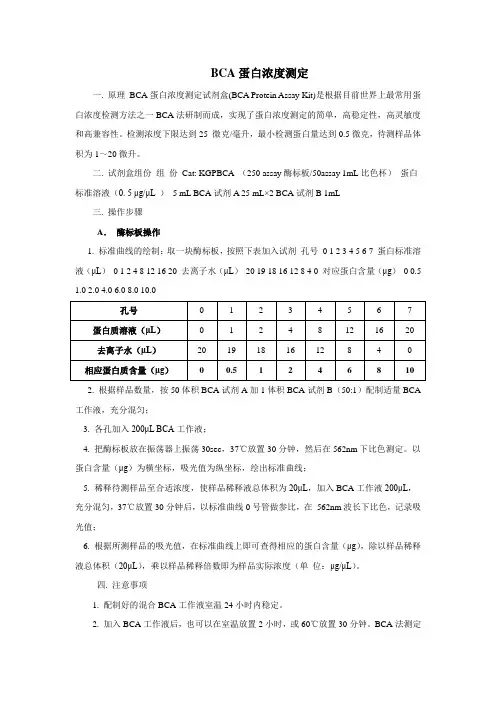
BCA蛋白浓度测定一. 原理BCA蛋白浓度测定试剂盒(BCA Protein Assay Kit)是根据目前世界上最常用蛋白浓度检测方法之一BCA法研制而成,实现了蛋白浓度测定的简单,高稳定性,高灵敏度和高兼容性。
检测浓度下限达到25 微克/毫升,最小检测蛋白量达到0.5微克,待测样品体积为1~20微升。
二. 试剂盒组份组份Cat: KGPBCA (250 assay酶标板/50assay 1mL比色杯)蛋白标准溶液(0. 5 μg/μL ) 5 mL BCA试剂A 25 mL×2 BCA试剂B 1mL三. 操作步骤A.酶标板操作1. 标准曲线的绘制:取一块酶标板,按照下表加入试剂孔号0 1 2 3 4 5 6 7 蛋白标准溶液(μL)0 1 2 4 8 12 16 20 去离子水(μL)20 19 18 16 12 8 4 0 对应蛋白含量(μg)0 0.5 1.02.0 4.0 6.0 8.0 10.02. 根据样品数量,按50体积BCA试剂A加1体积BCA试剂B(50:1)配制适量BCA 工作液,充分混匀;3. 各孔加入200μL BCA工作液;4. 把酶标板放在振荡器上振荡30sec,37℃放置30分钟,然后在562nm下比色测定。
以蛋白含量(μg)为横坐标,吸光值为纵坐标,绘出标准曲线;5. 稀释待测样品至合适浓度,使样品稀释液总体积为20μL,加入BCA工作液200μL,充分混匀,37℃放置30分钟后,以标准曲线0号管做参比,在562nm波长下比色,记录吸光值;6. 根据所测样品的吸光值,在标准曲线上即可查得相应的蛋白含量(μg),除以样品稀释液总体积(20μL),乘以样品稀释倍数即为样品实际浓度(单位:μg/μL)。
四. 注意事项1. 配制好的混合BCA工作液室温24小时内稳定。
2. 加入BCA工作液后,也可以在室温放置2小时,或60℃放置30分钟。
BCA法测定蛋白浓度时,吸光度会随着时间的延长不断加深。

迪信泰检测平台
BCA蛋白浓度检测
BCA蛋白浓度检测(BCA assay)是根据吸光值可以推算出蛋白浓度。
碱性条件下,蛋白将Cu2+还原为Cu+,Cu+与BCA试剂形成紫颜色的络合物,两分子BCA螯合一
个Cu+。
将该水溶性复合物在562nm处的吸收值,与标准曲线对比,即可计算待测
蛋白的浓度。
常用浓度的去垢剂SDS,Triton X-100,Tween不影响检测结果,但
受螯合剂(EDTA,EGTA)、还原剂(DTT,巯基乙醇)和脂类的影响。
实验中,若发现样品稀释液或裂解液本身背景值较高,可试用Bradford蛋白浓度测定试剂盒。
迪信泰检测平台采用生化法(BCA蛋白浓度检测)对蛋白含量进行测定,实现对蛋
白含量高效、精准的测定。
此外,我们还提供其他蛋白含量的检测方法,以满足您的不同需求。
生化法(BCA蛋白浓度检测)测定蛋白含量样本要求:
1. 请确保样本量大于0.2g或者0.2mL。
周期:2~3周。
项目结束后迪信泰检测平台将会提供详细中英文双语技术报告,报告包括:
1. 实验步骤(中英文)。
2. 相关参数(中英文)。
3. 图片。
4. 原始数据。
5. BCA蛋白浓度检测蛋白含量信息。
迪信泰检测平台可根据需求定制其他物质测定方案,具体可免费咨询技术支持。

bca测蛋白浓度原理BCA测蛋白浓度原理。
BCA蛋白定量法(Bicinchoninic Acid Assay)是一种用于测定蛋白质浓度的方法,它是通过将蛋白质与BCA试剂中的铜离子在碱性条件下形成紫色螯合物,然后通过比色法来测定螯合物的光密度,从而间接反映蛋白质的浓度。
BCA法相对于传统的Lowry法和Bradford法,具有灵敏度高、线性范围广、对常见干扰物质的抗干扰能力强等优点,因此在生物化学和分子生物学领域得到了广泛的应用。
BCA测蛋白浓度的原理主要包括以下几个方面:1. 蛋白质与BCA试剂的反应。
BCA试剂是由硫代巯基双胺(DTT)、碱性氢氧化钠、蛋白质还原剂(如硫代巯基乙酸钠)和BCA螯合剂(如双肌酮)组成的。
在碱性条件下,蛋白质与BCA试剂中的铜离子结合形成紫色螯合物,螯合物的光密度与蛋白质的浓度成正比。
因此,通过测定螯合物的光密度,可以间接测定蛋白质的浓度。
2. 比色法测定蛋白质浓度。
BCA法测定蛋白质浓度的关键在于比色法。
在螯合物形成后,可以利用紫外-可见分光光度计测定螯合物的光密度,进而计算出蛋白质的浓度。
BCA法对于常见的蛋白质(如牛血清白蛋白)有很好的线性响应,因此可以通过标准曲线来准确测定未知样品的蛋白质浓度。
3. 干扰物质对测定的影响。
在进行BCA测蛋白浓度时,一些干扰物质可能会影响测定结果。
例如,一些还原剂、螯合剂和胶体物质都可能对BCA法的测定结果产生干扰。
因此,在进行测定时,需要对可能的干扰物质进行充分的考虑,并采取相应的措施来减小干扰的影响。
总的来说,BCA测蛋白浓度的原理是基于蛋白质与BCA试剂中的铜离子在碱性条件下形成紫色螯合物,然后利用比色法测定螯合物的光密度来间接测定蛋白质的浓度。
在进行测定时,需要注意干扰物质对测定结果的影响,以及采取相应的措施来减小干扰的影响。
BCA法作为一种快速、灵敏、准确的蛋白质浓度测定方法,在生物化学和分子生物学领域得到了广泛的应用。
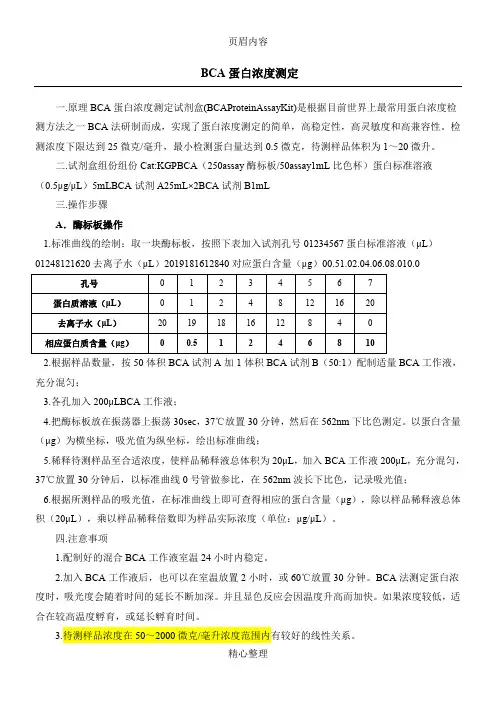
BCA蛋白浓度测定
一.原理BCA蛋白浓度测定试剂盒(BCAProteinAssayKit)是根据目前世界上最常用蛋白浓度检测方法之一BCA法研制而成,实现了蛋白浓度测定的简单,高稳定性,高灵敏度和高兼容性。
检测浓度下限达到25微克/毫升,最小检测蛋白量达到0.5微克,待测样品体积为1~20微升。
二.试剂盒组份组份Cat:KGPBCA(250assay酶标板/50assay1mL比色杯)蛋白标准溶液
(0.5μg/μL)5mLBCA试剂A25mL×2BCA试剂B1mL
)
工作液,
积(20μL),乘以样品稀释倍数即为样品实际浓度(单位:μg/μL)。
四.注意事项
1.配制好的混合BCA工作液室温24小时内稳定。
2.加入BCA工作液后,也可以在室温放置2小时,或60℃放置30分钟。
BCA法测定蛋白浓度时,吸光度会随着时间的延长不断加深。
并且显色反应会因温度升高而加快。
如果浓度较低,适合在较高温度孵育,或延长孵育时间。
3.待测样品浓度在50~2000微克/毫升浓度范围内有较好的线性关系。
4.BCA法测定蛋白浓度不受绝大部分样品中的化学物质的影响,可以兼容样品中高达5%的SDS,5%的TritonX-100,5%的Tween20,60,80。
但受螯合剂和略高浓度的还原剂的影响,需确保EDTA低于10mM,无EGTA,二硫苏糖醇低于1mM,β-巯基乙醇低于1mM.不适用BCA法时建议使用Bradford蛋白浓度测定试剂盒。
5.操作时要带手套。
五、储存
BCA试剂A和BCA试剂B室温保存,蛋白标准液-20℃冻存。
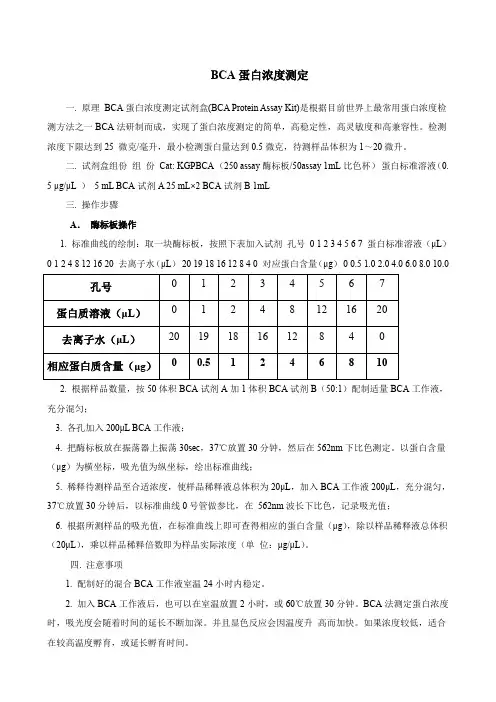
BCA蛋白浓度测定一. 原理BCA蛋白浓度测定试剂盒(BCA Protein Assay Kit)是根据目前世界上最常用蛋白浓度检测方法之一BCA法研制而成,实现了蛋白浓度测定的简单,高稳定性,高灵敏度和高兼容性。
检测浓度下限达到25 微克/毫升,最小检测蛋白量达到0.5微克,待测样品体积为1~20微升。
二. 试剂盒组份组份Cat: KGPBCA (250 assay酶标板/50assay 1mL比色杯)蛋白标准溶液(0.5 μg/μL )5 mL BCA试剂A 25 mL×2 BCA试剂B 1mL三. 操作步骤A.酶标板操作1. 标准曲线的绘制:取一块酶标板,按照下表加入试剂孔号0 1 2 3 4 5 6 7 蛋白标准溶液(μL)0 1 2 4 8 12 16 20 去离子水(μL)20 19 18 16 12 8 4 0 对应蛋白含量(μg)0 0.5 1.02.0 4.0 6.0 8.0 10.02. 根据样品数量,按50体积BCA试剂A加1体积BCA试剂B(50:1)配制适量BCA工作液,充分混匀;3. 各孔加入200μL BCA工作液;4. 把酶标板放在振荡器上振荡30sec,37℃放置30分钟,然后在562nm下比色测定。
以蛋白含量(μg)为横坐标,吸光值为纵坐标,绘出标准曲线;5. 稀释待测样品至合适浓度,使样品稀释液总体积为20μL,加入BCA工作液200μL,充分混匀,37℃放置30分钟后,以标准曲线0号管做参比,在562nm波长下比色,记录吸光值;6. 根据所测样品的吸光值,在标准曲线上即可查得相应的蛋白含量(μg),除以样品稀释液总体积(20μL),乘以样品稀释倍数即为样品实际浓度(单位:μg/μL)。
四. 注意事项1. 配制好的混合BCA工作液室温24小时内稳定。
2. 加入BCA工作液后,也可以在室温放置2小时,或60℃放置30分钟。
BCA法测定蛋白浓度时,吸光度会随着时间的延长不断加深。

BCA蛋白浓度测定2017.8.18一. 原理BCA蛋白浓度测定试剂盒(BCA Protein Assay Kit)是根据目前世界上最常用蛋白浓度检测方法之一BCA法研制而成,实现了蛋白浓度测定的简单,高稳定性,高灵敏度和高兼容性。
检测浓度下限达到25 微克/毫升,最小检测蛋白量达到0.5微克,待测样品体积为1~20微升。
二. 试剂盒组份组份Cat: KGPBCA (250 assay酶标板/50assay 1mL比色杯)蛋白标准溶液(0. 5 μg/μL) 5 mL BCA试剂A 25 mL×2 BCA试剂B 1mL三. 操作步骤A.酶标板操作1. 标准曲线的绘制:取一块酶标板,按照下表加入试剂孔号0 1 2 3 4 5 6 7 蛋白标准溶液(μL)0 1 2 4 8 12 16 20 去离子水(μL)20 19 18 16 12 8 4 0 对应蛋白含量(μg)0 0.5 1.02.0 4.0 6.0 8.0 10.02. 根据样品数量,按50体积BCA试剂A加1体积BCA试剂B(50:1)配制适量BCA 工作液,充分混匀;3. 各孔加入200μL BCA工作液;4. 把酶标板放在振荡器上振荡30sec,37℃放置30分钟,然后在562nm下比色测定。
以蛋白含量(μg)为横坐标,吸光值为纵坐标,绘出标准曲线;5. 稀释待测样品至合适浓度,使样品稀释液总体积为20μL,加入BCA工作液200μL,充分混匀,37℃放置30分钟后,以标准曲线0号管做参比,在562nm波长下比色,记录吸光值;6. 根据所测样品的吸光值,在标准曲线上即可查得相应的蛋白含量(μg),除以样品稀释液总体积(20μL),乘以样品稀释倍数即为样品实际浓度(单位:μg/μL)。
四. 注意事项1. 配制好的混合BCA工作液室温24小时内稳定。
2. 加入BCA工作液后,也可以在室温放置2小时,或60℃放置30分钟。
BCA法测定蛋白浓度时,吸光度会随着时间的延长不断加深。
bca法测蛋白浓度BCA法测蛋白浓度概述:蛋白质是生命体内的基本组成部分,其浓度的准确测定对于生物学、医学和生物化学研究具有重要意义。
BCA法(双硫苏糖蓝法)是一种常用于测定蛋白质浓度的方法。
本文将详细介绍BCA法的原理、步骤和注意事项。
一、原理:BCA法利用氧化还原反应将蛋白质样品中的蛋白质还原至游离状态的关键二硫键。
然后,游离态的关键二硫键将与BCA试剂发生氧化反应,在碱性条件下生成紫色的蛋白-BCA络合物。
络合物的光吸收峰位于562nm,其吸光度与样品中蛋白质的浓度呈线性关系。
二、步骤:1. 准备工作a. 样品制备:将待测样品加入适量的缓冲液中,使样品的浓度在标定曲线的线性范围内。
b. BCA试剂制备:按照说明书的要求配制BCA试剂。
c. 标准曲线制备:使用一系列已知浓度的标准蛋白样品制备标准曲线。
2. 反应体系的组装a. 吸光度测定:使用分光光度计在562nm波长下检测BCA 试剂的吸光度。
b. 反应液制备:将待测样品和BCA试剂按比例混合均匀。
3. 反应条件的控制a. 温度:在37℃下孵育反应液,反应时间不少于30分钟。
b. pH值:控制反应液的pH值在9-11之间。
c. 光线:在反应过程中避免阳光直射。
4. 吸光度测定和计算a. 孵育结束后,使用分光光度计在562nm波长下测定吸光度。
b. 根据标准曲线,计算出样品中蛋白质的浓度。
三、注意事项:1. 样品的制备应避免受到其他物质的干扰。
2. BCA试剂的配制和保存应按照说明书的要求进行。
3. 反应条件的控制对于测定结果的准确性至关重要。
4. 在吸光度测定中,应确保波长和光程一致,避免光线过强或过弱。
5. 实验操作过程中要注意个人防护和实验室安全。
结论:BCA法是一种简便、准确、可靠的测定蛋白质浓度的方法。
它可以应用于各种生物和化学研究中,为科学研究提供有力支持。
通过合理操作和条件控制,我们可以得到准确的蛋白质浓度信息,为后续实验提供参考依据。
BCA法检测蛋白浓度1、目的:测定收集液中蛋白浓度2、方法:在碱性环境下蛋白质与Cu2+络合并将Cu2+还原成Cu1+。
BCA与Cu1+结合形成稳定的紫蓝色复合物,在562nm处有高的光吸收值并与蛋白质浓度成正比,据此可测定蛋白质浓度。
3、设备:⑴光密度测定仪(比色计或酶标仪、微板比色仪),工作波长562nm 或在520-600nm之间。
⑵1000uL、200uL、20uL、2uL移液枪各一把和枪头若干⑶EP管架一个4、组成与储存:(1)A液BCA Reagent 100 ml,4ºC保存;(2) B液Cu2+ Reagent 2.5 ml,4ºC保存;(3) BSA standard 5mg/ml 1ml,-20ºC冻存。
1年内有效5、实验步骤5.1标准曲线的绘制标准蛋白的稀释:稀释10倍(10uL)即:10uL的标准蛋白+90uL的生理盐水1 2 3 4 5 6 7 8 Pr01248121620NaCl2019181612840单位:uL5.2配制BCA工作液A液:B液=50:15.3关于UC细胞收集液的稀释原液×2030KD除杂透过液×43KD 超滤浓缩液×45.4上样取稀释后的待测液20uL+BCA工作液200uL于96孔板内置于37摄氏度烘箱30min后待测。
5.5检测详见仪器操作规程6、注意事项6.1蛋白质与WR工作溶液反应形成的颜色复合物,在37ºC、30min 或25ºC室温反应过夜时稳定性佳。
在37ºC30min或25ºC室温反应12小时,严格来讲形成的颜色复合物尚未达到终点,通常每10min OD562值升高约2.3%。
然而,在这一时间内通常可以测定约30管,测定精度不受明显影响。
6.2 BCA法在样品含有脂类物质时将明显提高光吸收值。
蛋白样品中EDTA或葡萄糖浓度大于10mM不能使用BCA方法。
BCA法检测蛋白浓度
96孔板:1、配制BCA 工作液: 根据标准品和样品数量,按50 体积试剂A,1 体积试剂 B 配制适量BCA 工作液,充分混匀。
2、将蛋白标准品按0, 1, 2, 4, 6,8, 10 微升加到96 孔板的蛋白标准品孔中,加灭菌双蒸水补足到10 微升;取10 微升待测样品加入96 孔板。
每个测定要做2-3 个平行.
3、向带测样品孔和蛋白标准品孔中加入200 微升BCA 工作液(即样品与工作液的体积比为1:20)混匀。
4、37℃温浴30min。
冷取至室温。
5、酶标仪562nm 波长下测定吸光度。
6、制作标准曲线,从标准曲线中求出样品浓度。
注意事项:1、反应颜色的深浅除了与样品的蛋白质浓度相关外,还与反应的温度有关。
如果样品的浓度较高(>50μg/ml),反应温度一般采用37 度。
如果样品蛋白质的浓度较低(<50μg),反应的温度为60℃,该温度下,色氨酸、酪氨酸和肽键得到充分氧化,大大提高检测灵敏度。
2、该方法检测的蛋白质浓度范围20μg-500μg/ml;当蛋白浓度<20ug/ml 时,推荐60℃温浴,并将蛋白液:工作液的比例调至1:8 进行测定(增强法)可以检测到5ug/ml。
试剂A 和B 在室温的稳定期至少1 年以上。
标准蛋白液保存在-20℃,短期则4℃保存。
注:标准BSA 蛋白浓度为1mg/ml。
bca测蛋白浓度原理
BCA(bicinchoninic acid)法是一种常用的蛋白质浓度测定方法。
该方法的原理是基于蛋白质与巴氏碱性柠檬酸铜络合物(BCA-Cu2+)反应产生紫色底物的特性。
在测定中,首先将待测蛋白溶液与BCA试剂(含有NaOH、CuSO4和BCA)混合。
随后,这些试剂与蛋白质中的蛋白质络合物发生反应。
在碱性条件下,氧化还原反应发生,使得BCA-Cu2+络合物还原为蓝色的BCA-Chelate复合物。
这种反应是比较特异的,只有在蛋白质存在的情况下才会发生。
为了测定蛋白质浓度,通常会制备一系列蛋白质标准曲线。
这些标准曲线是通过已知浓度的蛋白溶液使用BCA法测定得到的。
通过比较待测蛋白样本与标准曲线上的反应颜色,可以确定样本中的蛋白质浓度。
最后,使用分光光度计测定反应体系中的吸光度,并使用标准曲线来计算待测样本中蛋白质的浓度。
通常情况下,吸光度与蛋白质浓度呈线性关系,因此可以准确计算出待测样本的蛋白质浓度。
总的来说,BCA法通过蛋白质与BCA试剂的化学反应,产生紫色复合物,然后通过比色测定反应体系中的吸光度,最后使用标准曲线计算出待测样本中蛋白质的浓度。
【目的】:掌握BCA法测定蛋白质浓度的原理。
【原理】:
BCA(bicinchonininc acid)与二价铜离子的硫酸铜等其他试剂组成的试剂,混合一起即成为苹果绿,即BCA工作试剂。
在碱性条件下,BCA与蛋白质结合时,蛋白质将Cu2+还原为Cu+,一个Cu+螯合二个BCA分子,工作试剂由原来的苹果绿形成紫色复合物,最大光吸收强度与蛋白质浓度成正比。
【操作】
标准曲线的绘制:取试管七支、编号,按下表操作:
【计算】
(一)绘制标准曲线。
(二)以测定管吸光度值,查找标准曲线,求出待测血清中蛋白质浓度(g/L)。
(三)再从标准管中选择一管与测定管光密度相接近者,求出待测血清中蛋白质浓度(g/L)。
【优缺点】
(一) 操作简单,快速,45分钟内完成测定,比经典的Lowary法快4倍且更加方便;
(二) 准确灵敏,试剂稳定性好,BCA试剂的蛋白质测定范围是20-200μg/ml,微量BCA测定范围在0.5-10μg/ml。
(三) 经济实用,除试管外,测定可在微板孔中就进行,大大节约样品和试剂用量;
(四) 抗试剂干扰能力比较强,如去垢剂,尿素等均无影响
【器材】
(一)7220型分光光度计
(二)恒温水浴箱
(三)中试管7支
(四)枪式移液管
【试剂】
1、试剂A:1%BCA二钠盐
2%无水碳酸钠
0.16%酒石酸钠
0.4%氢氧化钠
0.95%碳酸氢钠
混合调PH值至11.25。
2、试剂B:4%硫酸铜。
3、BCA工作液:试剂A 100ml +试剂B 2ml混合。
4、蛋白质标准液:用结晶牛血清白蛋白根据其纯度用生理盐水配制成1.5mg/ml的蛋白质标准液。
(纯度可经凯氏定氮法测定蛋白质含量而确定)
5、待测样品:用双缩脲测定法的样品稀释而成。
此法测定蛋白质浓度,近些年被科研工作者广泛选用。
目前BCA法的试剂盒市面有售。
总之,虽然蛋白质含量的测定方法很多,但是,还没有一个完美的方法。
在选择测定方法时,可根据实验要求和实验室条件决定。
(此文档部分内容来源于网络,如有侵权请告知删除,文档可自行编辑修改内容,
供参考,感谢您的配合和支持)。