1 备案资料封面
- 格式:doc
- 大小:13.00 KB
- 文档页数:1

申请备案提供资料表注:以下材料须A4纸打印、胶装装订,封面须注明公司名称、公司联系人姓名、联系电话。
以下任何材料均不可出现具体采购单位名称及项目名称,以备长期使用。
一、必备资信材料(格式参照附件):1、备案申请表(左上角加盖企业公章)2、企业营业执照(三证合一带营业执照即可、未办理三证合一的营业执照、税务登记(国税、地税证)、组织机构代码证均需提供)3、授权备案事宜委托书(法人备案仅需提供身份证明)4、印鉴表(将单位行政章、合同章、财务章盖在1张白纸上,要求原印鉴,复印无效)5、开户许可证6、行业相关证书(没有可不提供)7、企业承诺书备注:以上材料中2、5、6备案时必须出示原件审核通过后予以退还,复印件加盖公章装订于所提供的资料内,其余项须均装订原件。
二、辅助资信材料(企业可根据自身情况选择性提供):1、引进设备的准入中国市场的批准单2、引进设备国内代理授权书3、国家级新产品、新技术认定书4、产品安全、环保合格证5、企业资信等级证书(银行出具)6、产品样图及价格目录7、会计事务所出具的审计报告8、房产证明(房屋产权证或租房协议)9、技术人员学历及取得的相关认证备注:若企业在外地无法提供原件的,可提供有效复印件,有效复印件有两种情形:1、在复印件上加盖发证机关的印鉴2、复印件在当地公证部门进行过公证1、备案申请表霍尔果斯政府采购供应商登记备案申请表注:币种——人民币、美元、欧元、日元、港元、新台币等;企业注册级别——国家级、省市级、区县级企业的性质——国家、集体、民营、有限责任公司、合资企业、股份制企业2、企业营业执照(三证合一附营业执照即可、未办理三证合一的须附营业执照、税务登记(国税、地税证)、组织机构代码证等相关证件):注:备案时需出示原件,审核完予以退还。
3、授权备案事宜委托书:法定代表人授权委托书本授权书声明:注册于(地区的名称)的(公司名称),在下面签字的法人代表(姓名、职务),代表本公司授权在下面签字的(被授权人的姓名)为本公司的合法代理人,就霍尔果斯经济开发区政府采购中心备案事宜,以本公司的名义处理一切与之有关的事务。

铜仁市•上品雅园1#、2#楼质量监督报建共()册,第()册施工单位:铜仁市碧江区第二建筑工程公司日期:年月日铜仁市•上品雅园1#、2#楼安全监督报建施工单位:铜仁市碧江区第二建筑工程公司日期:年月日共()册,第()册质量监督报建资料目录1、规划许可证2、勘察、设计、施工、监理、检测单位资质证3、施工图审查批准文件4、施工单位项目部成立文件5、施工单位项目人员的资格6、施工单位项目部质保体系7、监理单位项目部成立文件8监理单位项目部人员资格9、监理单位项目部的质保体系10、施工、监理合同11、工程质量承诺书12、施工组织设计及专项方案13、监理规划细则质量监督报建资料目录1、施工单位资质证2、施工单位项目部成立文件3、施工单位项目人员的资格4、施工单位项目部质保体系5、施工合同6、工程质量承诺书7、施工组织设计及专项方案安全监督报建资料目录1、贵州省建筑工程施工安全监督备案登记表2、贵州省建筑工程施工安全监督交底告知书;3、施工单位、监理单位营业执照、资质证书和安全生产许可证;4、施工合同和监理合同副本;5、施工单位、监理单位项目部成立文件、组成人员名单及社保缴纳证明,建设单位项目负责人、现场代表名单;6、施工单位项目负责人、专职安全员资格证、上岗证及安全生产考核合格证、特种作业人员上岗证,监理单位项目总监、安全监理资格证、上岗证;7、安全、文明施工措施费用三方监管协议、支付使用计划及拨付缴存回单复印件;8项目施工人员意外伤害保险费缴纳凭证;9、施工现场使用的机械设备型号、数量及检验合格证;10、施工组织设计及专项安全施工方案;11、安全生产管理制度及各种安全技术操作规程,施工安全事故应急救援预案;12、安全监理规划和安全监理实施细则;安全监督报建资料目录1、施工单位营业执照、资质证书和安全生产许可证2、施工合同3、施工单位项目部成立文件、组成人员名单及社保缴纳证明4、施工单位项目负责人、专职安全员资格证、上岗证及安全生产考核合格证、特种作业人员上岗证5、安全、文明施工措施费用三方监管协议、支付使用计划及拨付缴存回单复印件6、项目施工人员意外伤害保险费缴纳凭证7、施工组织设计及专项安全施工方案8安全生产管理制度及各种安全技术操作规程,施工安全事故应急救援预案。

第一类医疗器械备案凭证佛山市顺德区荣富医疗器械有限公司:根据相关法规要求,对你单位第一类医疗器械:手动病床予以备案,备案号:粤顺械备20150026号。
日期:2015年6月29日第一类医疗器械备案信息表备案号:粤顺械备20150026号备案人名称佛山市顺德区荣富医疗器械有限公司备案人组织机构代码67524534-8备案人注册地址佛山市顺德区均安镇星槎村上力路1号生产地址佛山市顺德区均安镇星槎村上力路1号代理人/代理人注册地址/产品名称手动病床型号/规格RF-HB131C,RF-HB132C,RF-HB133C,RF-HB134C,RF-HB135C,RF-HB121C ,RF-HB121C-B,RF-HB122C,RF-HB123C,RF-HB123C-B,RF-HB124C,RF-HB125C,RF-HB126,RF-HB127C,RF-HB111,RF-HB111C,RF-HB112,RF-HB113C,RF-HB114C,RF-HB115C,RF-HB101,RF-HB102,RF-HB103,RF-HB201,RF-HB202,RF-HB211,RF-HB212,RF-HB221,RF-HB222C,RF-HB231,RF-HB241,RF-HB242,RF-HB243,RF-HB244,RF-HB152C,RF-WB21,RF-WB22,RF-WB23,RF-WB31C,RF-WB32C。
产品描述病床采用碳钢、不锈钢或塑钢材料制造。
基本配置为床架、床头板、床尾板、背板、腿板、床脚、护栏、手动操纵部件(手动病床)。
预期用途病床供病员作检查、诊断、疗养、骨科牵引、对危重病人进行抢救、监护及治疗以及妇科诊断、产妇分娩或施行一般产科手术用。
备注备案单位备案日期:2015年6月29日和日期变更情况。

附件1第一类医疗器械备案资料要求及说明一、备案资料(一)第一类医疗器械备案表(二)关联文件1.境内备案人提供:企业营业执照副本或事业单位法人证书的复印件。
委托其他企业生产的,应当提供受托企业资格文件(营业执照副本复印件)、委托合同和质量协议复印件。
2.境外备案人提供:(1)境外备案人企业资格证明文件:境外备案人注册地所在国家(地区)公司登记主管部门或医疗器械主管部门出具的能够证明境外备案人存续且具备相应医疗器械生产资格的证明文件;或第三方认证机构为境外备案人出具的能够证明境外备案人具备相应医疗器械生产资格的证明文件。
(2)境外备案人注册地或生产地所在国家(地区)医疗器械主管部门出具的准许该产品上市销售的证明文件。
备案人注册地或生产地所在国家(地区)未将该产品作为医疗器械管理的,备案人需提供相关文件,包括备案人注册地或者生产地所在国家(地区)准许该产品上市销售的证明文件。
未在境外备案人注册地或生产地所在国家(地区)上市的创新医疗器械可以不提交。
(3)境外备案人在中国境内指定代理人的委托书、代理人承诺书,代理人营业执照副本复印件。
(三)产品技术要求产品技术要求应按照《医疗器械产品技术要求编写指导原则》编制,主要包括医疗器械成品的可进行客观判定的功能性、安全性指标和检测方法。
(四)产品检验报告产品检验报告应为产品全性能自检报告或委托检验报告,检验的产品应当具有典型性。
检验报告后随附产品实物照片。
产品实物照片应当包括拆除所有内外包装后的样品实物照片,以及内外包装实样照片。
多个型号规格的,提供典型产品的照片。
(五)产品说明书及最小销售单元标签设计样稿说明书和标签应当符合《医疗器械说明书和标签管理规定》《体外诊断试剂说明书编写指导原则》等相关要求,说明书中产品性能应当与产品技术要求中的相应内容一致。
进口产品应当提交境外政府主管部门批准或者认可的说明书原文及其中文译本。
(六)生产制造信息对生产过程相关情况的概述。
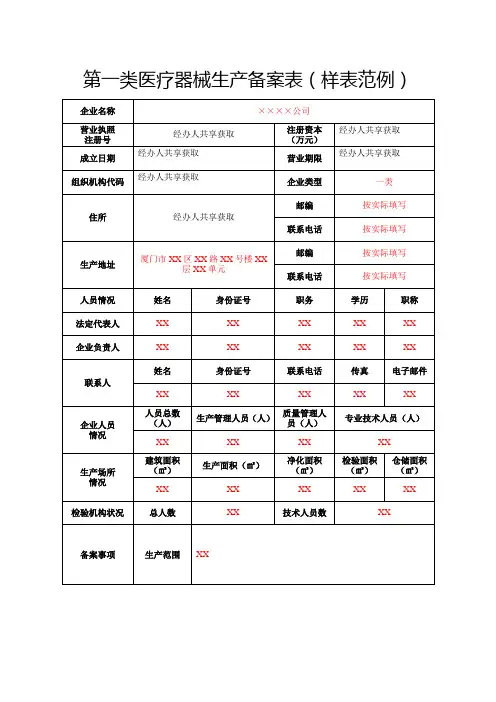
第一类医疗器械生产备案表(样表范例)
填表说明:1.本表按照实际内容填写,不涉及的可缺项。
其中,企业名称、营业执照注册号、住所、法定代表人、注册资本、成立日期、营业期限等按照营业执照内容填写。
2.本表生产范围应当按照国家食品药品监督管理部门发布的第一类医疗器械产品目录和相应体外诊断试剂分类子目录中规定的管理类别、分类编码和名称填写。
3、表格中涉及营业执照登记信息,申请人只需填写“企业名称”和“统一社会信用代码”,其余信息通过数据共享补充。
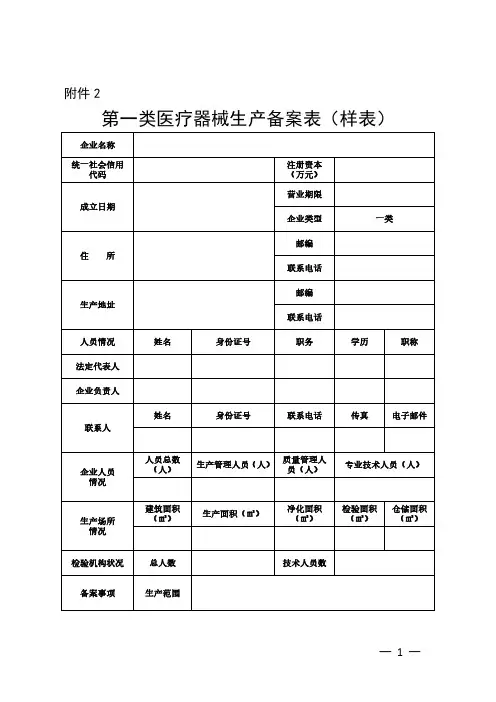
附件2
第一类医疗器械生产备案表(样表)企业名称
统一社会信用
代码注册资本(万元)
成立日期
营业期限
企业类型一类
住所
邮编
联系电话
生产地址
邮编
联系电话
人员情况姓名身份证号职务学历职称法定代表人
企业负责人
联系人
姓名身份证号联系电话传真电子邮件
企业人员情况人员总数
(人)
生产管理人员(人)
质量管理人
员(人)
专业技术人员(人)
生产场所情况建筑面积
(㎡)
生产面积(㎡)
净化面积
(㎡)
检验面积
(㎡)
仓储面积
(㎡)
检验机构状况总人数技术人员数
备案事项生产范围
—1—
生产产品列表
序号产品名称产品备案号备注
本企业承诺所提交的全部备案资料真实有效,并承担一切法律责任。
同时,保证按照法律法规的要求从事医疗器械生产活动。
法定代表人(签字)(企业盖章)
年月日
填表说明:1.本表按照实际内容填写,不涉及的可缺项。
其中,企业名称、统一社会信用代码、住所、法定代表人、注册资本、成立日期、营业期限等按照营业执照内容填写。
2.本表生产范围应当按照国家药品监督管理部门发布的第一类医疗器械产品目录和相
应体外诊断试剂分类子目录中规定的分类编码和名称填写。
—2—
第一类医疗器械生产备案凭证(样本)
—3—。


2021年一类医疗器械-隔离衣、手术衣产品备案资料(全套)21页备案号:第一类医疗器械备案表市场监督管理局制产品名称 备案人:(产品分类名称): 隔离衣 有限责任公司填表说明1.本表用于进口和境内第一类医疗器械、体外诊断试剂备案。
2•要求填写的栏目内容应使用中文、打印完整、清楚、不得空白,无相关内容处应填写“/”。
因备案表格式所限而无法填写完整时,请另附附件。
3.备案时应一并提交含有备案表内容(含附件)的电子文档(EXcel形式)。
4•境内医疗器械、体外诊断试剂只填写备案人名称、注册地址和生产地址中文栏。
进口医疗器械、体外诊断试剂备案人名称、注册地址和生产地址中文栏自行选择填写。
进口医疗器械产品名称(体外诊断试剂为产品分类名称,以下同)中文栏必填。
5•如系统支持,则进口医疗器械产品名称、备案人名称、注册地址和生产地址原文栏必填,原文填写内容应与备案人注册地址或生产地址所在国家(地区)医疗器械主管部门出具的允许产品上市销售的证明文件中载明内容和文种一致。
6.境内医疗器械备案人应填写组织机构代码。
7.进口医疗器械产品名称、备案人名称、注册地址和生产地址英文栏必填。
如原文非英文,英文内容必须与原文一致。
8.所填写各项内容应与所提交备案材料内容相对应。
9.产品类别及分类编码应根据医疗器械分类规则和医疗器械分类目录、第一类医疗器械产品目录、第一类体外诊断试剂分类子目录等相关文件填写。
10.备案人、代理人注册地址栏填写备案人和代理人企业营业执照等相关证明性文件上载明的注册地址。
11 •备案人、代理人所在地系指备案人和代理人注册地址所在国家(地区)或省(区、市)。
12.如有其他需要特别加以说明的问题,请在本表“其他需要说明的问题”栏中说明。
应附资料产品风险分析资料产品技术要求产品检验报告临床评价资料生产制造信息产品说明书及最小销售单元标签设计样稿证明性文件符合性声明其他需要说明的问题备案人/代理人(签章)日期:2020年2月1日d d d d d d d d2021年一类医疗器械-隔离衣、手术衣产品备案资料(全套)21页产品技术要求隔离衣医疗器械产品技术要求编号:隔离衣1 •产品型号/规格及其划分说明型号:按隔离衣结构分为I连身式和II分身式;规格:按照隔离衣尺寸分为160、165、170、175、180、185。

张掖市食品药品监督管理局经营一类医疗器械登记备案一次性告知书登记备案条件依据:《甘肃省食品药品监督管理局医疗器械经营管理规定》。
条件:具有与经营规模相适应的经营场所和仓储条件,并能保证经营产品的质量。
有固定的营业场所,且与经营规模相适应,兼营企业须设置经营医疗器械的专区或专柜。
单一经营避孕套的质量管理人员须高中以上学历,经营其它产品的质量管理人员须中专以上学历或有专业技术职称企业必须有保证医疗器械质量安全的管理体系。
时间:备案资料齐全,申请后五个工作日内审查。
《备案证》有效期限为5年。
届满需继续经营的,须在有效期届满前1个月重新备案登记备案提交资料1、医疗器械经营企业登记备案表2、《医疗器械经营企业许可证申请表》1式2份(含有企业情况、质量人员及设备情况表);3、拟经营品种目录4、法定代表人、企业负责人、质量管理人员个人简历;5、法定代表人、企业负责人、质量管理人员身份证、学历证书、技术职称证书复印件;6、从业人员花名册;7、从业人员健康证明、考核证书;8、企业组织机构、质量管理机构职能框图;9、医疗器械质量管理文件(制度、档案)目录;10、企业经营场所、仓库方位图、平面布局图;11、营业执照、药品经营许可证、GSP证书或企业名称预先核准书复印件;12、房屋租赁合同及产权证明;13、聘任文件14、声明、保证。
备注:以上资料A4纸打(复)印,目录应当按实际增减,部分文件仅提供了参考格式。
全部资料制作完成后应装订成册并编目。
经营一类医疗器械登记备案资料单位:****二0一二年月日一类医疗器械经营登记备案资料目录1.企业登记备案申请书 (1)2.拟经营品种目录 (2)3.企业法定代表人个人简历 (3)4.企业法定代表人身份证复印件 (3)5.企业法定代表人学历证书、技术职称证书复印件 (3)6.企业法定代表人考核证书 (3)7.企业负责人个人简历 (3)8.企业负责人身份证复印件 (3)9.企业负责人学历证书、技术职称证书复印件 (3)10.企业负责人考核证书 (3)11.质量负责人个人简历 (3)12.质量负责人身份证复印件 (3)13.质量负责人学历证书、技术职称证书复印件 (3)14.质量负责人考核证书 (3)15.从业人员花名册 (3)16.从业人员健康证明和考核证书 (3)17.企业组织机构、质量管理机构职能框图 (3)18.医疗器械质量管理制度、档案目录 (3)19.企业经营场所、仓库方位图、平面布局图 (3)20.企业名称预先核准通知书或《药品经营许可证》、《GSP认证证书》、《工商营业执照》复印件 (3)21.房屋租赁合同及产权证明 (3)22.聘任或任命文件23.声明、保证 (3)24.现场检查通知书(药监局提供) (3)25.现场检查记录表(药监局提供) (3)26.医疗器械经营企业登记备案表 (3)27.医疗器械经营企业备案证复印件(药监局提供) (3)医疗器械经营企业登记备案表医疗器械经营企业备案证申请书申请人:邓有涛联系人:邓胡涛电话:申请事项:核发换发申报日期:2012年月日受理部门:张掖市食品药品监督管理局受理日期:年月日填报说明1、本申请书除签字部分外,均用计算机打印。

档号档案馆(室)号缩微号城建档案案卷题名:广德县廉租房26#楼建设单位竣工备案资料建设单位:广德县建设委员会设计单位:安徽中联建筑设计院施工单位:宁国市中恒建设工程有限公司建设时间:2008年12月开工,2009年10月竣工工程地点:广德县红旗小区本工程共1卷,本卷为第1卷,本卷共153张保管期限:密级:城市建设档案卷内目录档号档案馆(室)号缩微号城建档案案卷题名:广德县廉租房26#楼监理单位竣工备案资料建设单位:广德县建设委员会设计单位:安徽中联建筑设计院施工单位:宁国市中恒建设工程有限公司建设时间:2008年12月开工,2009年10月竣工工程地点:广德县红旗小区本工程共1卷,本卷为第1卷,本卷共83张保管期限:密级:城市建设档案卷内目录档号档案馆(室)号缩微号城建档案案卷题名:广德县廉租房26#楼单位竣工备案资料建设单位:广德县建设委员会设计单位:安徽中联建筑设计院施工单位:宁国市中恒建设工程有限公司建设时间:2008年12月开工,2009年10月竣工工程地点:广德县红旗小区本工程共6卷,本卷为第1卷,本卷共201张保管期限:密级:城市建设档案卷内目录档号档案馆(室)号缩微号城建档案案卷题名:广德县廉租房26#楼单位竣工备案资料建设单位:广德县建设委员会设计单位:安徽中联建筑设计院施工单位:宁国市中恒建设工程有限公司建设时间:2008年12月开工,2009年10月竣工工程地点:广德县红旗小区本工程共6卷,本卷为第2卷,本卷共107张保管期限:密级:城市建设档案卷内目录档号档案馆(室)号缩微号城建档案案卷题名:广德县廉租房26#楼单位竣工备案资料建设单位:广德县建设委员会设计单位:安徽中联建筑设计院施工单位:宁国市中恒建设工程有限公司建设时间:2008年12月开工,2009年10月竣工工程地点:广德县红旗小区本工程共6卷,本卷为第3卷,本卷共122张保管期限:密级:城市建设档案卷内目录档号档案馆(室)号缩微号城建档案案卷题名:广德县廉租房26#楼单位竣工备案资料建设单位:广德县建设委员会设计单位:安徽中联建筑设计院施工单位:宁国市中恒建设工程有限公司建设时间:2008年12月开工,2009年10月竣工工程地点:广德县红旗小区本工程共6卷,本卷为第4卷,本卷共72张保管期限:密级:城市建设档案卷内目录档号档案馆(室)号缩微号城建档案案卷题名:广德县廉租房26#楼单位竣工备案资料建设单位:广德县建设委员会设计单位:安徽中联建筑设计院施工单位:宁国市中恒建设工程有限公司建设时间:2008年12月开工,2009年10月竣工工程地点:广德县红旗小区本工程共6卷,本卷为第5卷,本卷共124张保管期限:密级:城市建设档案卷内目录档号档案馆(室)号缩微号城建档案案卷题名:广德县廉租房26#楼单位竣工备案资料建设单位:广德县建设委员会设计单位:安徽中联建筑设计院施工单位:宁国市中恒建设工程有限公司建设时间:2008年12月开工,2009年10月竣工工程地点:广德县红旗小区本工程共6卷,本卷为第6卷,本卷共269张保管期限:密级:城市建设档案卷内目录备考表。

第一类医疗器械备案申请资料模板第一类医疗器械备案申请资料模板申请类型:第一类医疗器械备案产品名称:医用xxxxxx备案人:xxxxx制药有限责任公司资料目录备案号:1第一类医疗器械备案表产品名称(产品分类名称):备案人: XXXXXXXX制药有限责任公司XXX市食品药品监督管理局制(国家食品药品监督管理总局制)填表说明1.本表用于进口和境内第一类医疗器械、体外诊断试剂备案。
2.要求填写的栏目内容应使用中文、打印完整、清楚、不得空白,无相关内容处应填写“∕”。
因备案表格式所限而无法填写完整时,请另附附件。
3.备案时应一并提交含有备案表内容(含附件)的电子文档(Excel形式)。
4.境内医疗器械、体外诊断试剂只填写备案人名称、注册地址和生产地址中文栏。
进口医疗器械、体外诊断试剂备案人名称、注册地址和生产地址中文栏自行选择填写。
进口医疗器械产品名称(体外诊断试剂为产品分类名称,以下同)中文栏必填。
5.如系统支持,则进口医疗器械产品名称、备案人名称、注册地址和生产地址原文栏必填,原文填写内容应与备案人注册地址或生产地址所在国家(地区)医疗器械主管部门出具的允许产品上市销售的证明文件中载明内容和文种一致。
6.境内医疗器械备案人应填写组织机构代码。
7.进口医疗器械产品名称、备案人名称、注册地址和生产地址英文栏必填。
如原文非英文,英文内容必须与原文一致。
8.所填写各项内容应与所提交备案材料内容相对应。
9.产品类别及分类编码应根据医疗器械分类规则和医疗器械分类目录、第一类医疗器械产品目录、第一类体外诊断试剂分类子目录等相关文件填写。
10.备案人、代理人注册地址栏填写备案人和代理人企业营业执照等相关证明性文件上载明的注册地址。
11.备案人、代理人所在地系指备案人和代理人注册地址所在国家(地区)或省(区、市)。
12.如有其他需要特别加以说明的问题,请在本表“其他需要说明的问题”栏中说明。
注:填表前,请详细阅读填表说明安全风险分析报告产品名称:医用冷敷贴1. 医用冷敷贴预期用途用于物理退热、冷敷理疗。