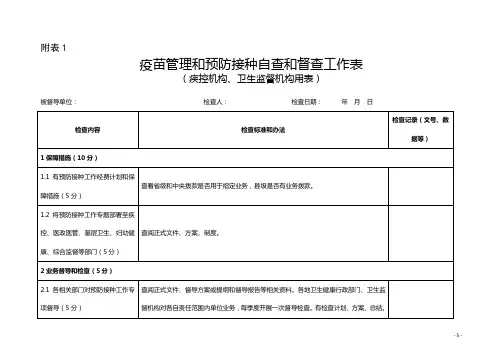
疫苗管理及预防接种专项检查表
- 格式:doc
- 大小:77.00 KB
- 文档页数:3
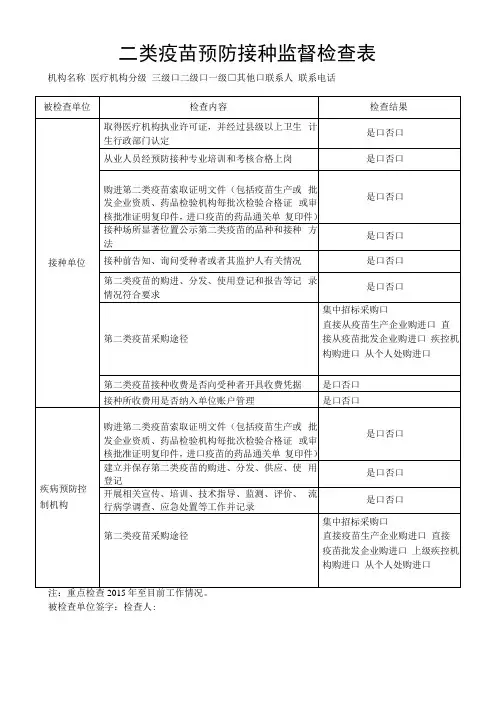
二类疫苗预防接种监督检查表机构名称医疗机构分级三级口二级口一级□其他口联系人联系电话
注:重点检查2015年至目前工作情况。
被检查单位签字:检查人:
二类疫苗预防接种监督检查汇总表
县
章
A设区的市级以上疾病预防控制机构违反本条例规定,直接向接种单位供应第二类疫苗的;B未依照规定建立并保存疫苗购进、分发、供应记录的;
C未依照规定建立并保存真实、完整的疫苗接收或者购进记录的;D未在其接种场所的显著位置公示疫苗的品种和接种方法的;
E医疗卫生人员在接种前.,未依照本条例规定告知、询问受种者或者其监护人有关情况的;F实施预防接种的医疗卫生人员未依照规定填写并保存接种记录的;
G未依照规定对接种疫苗的情况进行登记并报告的;H从不具有疫苗经营资格的单位或者个人购进第二类疫苗的;
I接种疫苗未遵守预防接种工作规范、免疫程序、疫苗使用指导原则、接种方案的;J发现预防接种异常反应或者疑似预防接种异常反应,未依照规定及时处理或者报告的;
K擅自进行群体性预防接种的;L未经卫生主管部门依法指定擅自从事接种工作的。
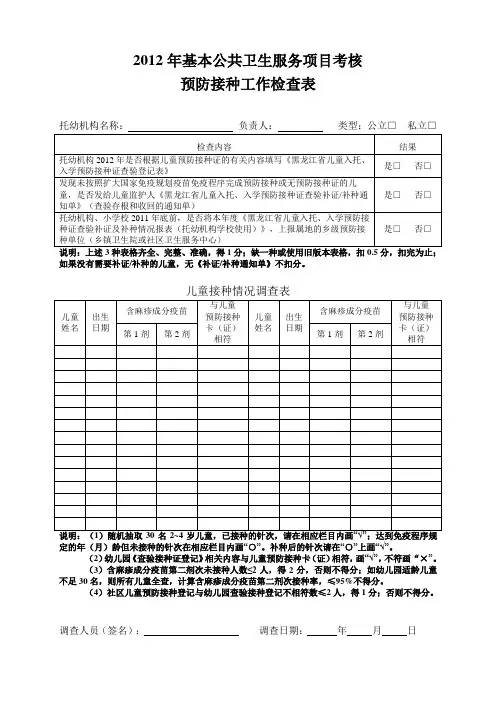
2012年基本公共卫生服务项目考核
预防接种工作检查表
托幼机构名称:负责人:类型:公立□ 私立□
如果没有需要补证/补种的儿童,无《补证/补种通知单》不扣分。
儿童接种情况调查表
定的年(月)龄但未接种的针次在相应栏目内画“○”。
补种后的针次请在“○”上画“√”。
(2)幼儿园《查验接种证登记》相关内容与儿童预防接种卡(证)相符,画“√”,不符画“×”。
(3)含麻疹成分疫苗第二剂次未接种人数≤2人,得2分,否则不得分;如幼儿园适龄儿童不足30名,则所有儿童全查,计算含麻疹成分疫苗第二剂次接种率,≤95%不得分。
(4)社区儿童预防接种登记与幼儿园查验接种登记不相符数≤2人,得1分;否则不得分。
调查人员(签名):调查日期:年月日。
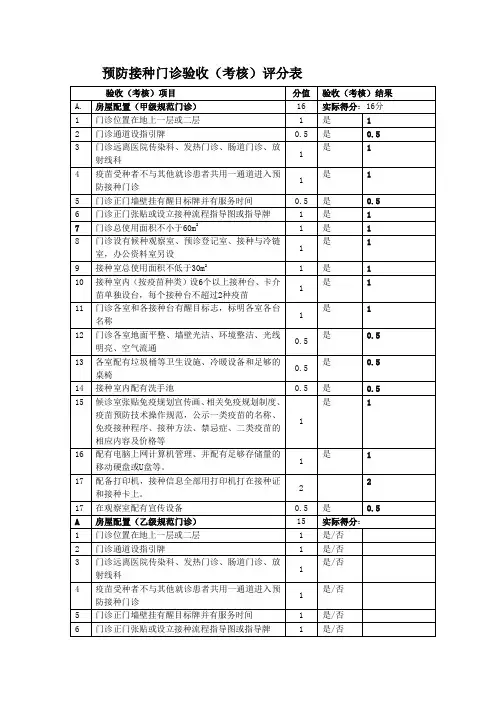

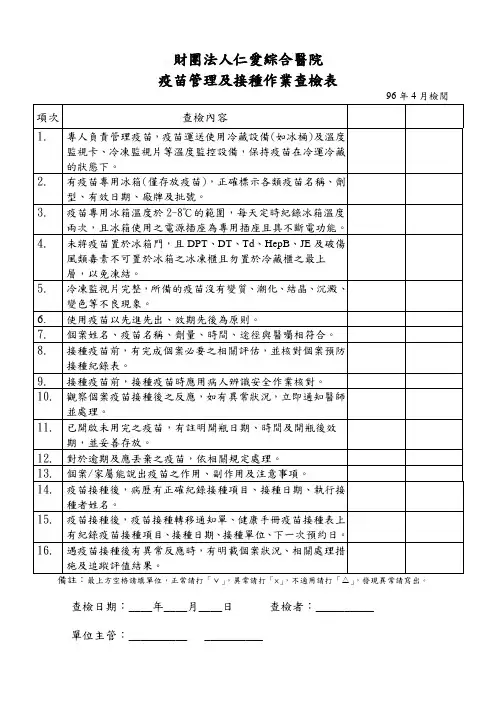
表1预防接种工作规范管理自查表(市、县级疾控机构使用)单位名称:市县(区)调查日期:疫苗贮存运输管理1、疾病预防控制机构有从事疫苗管理的专业技术人员对疫苗储存、运输设施设备进行管理和维护?●疫苗管理人员须专职。
疫苗管理人员是专职还是兼职?●需要掌握疫苗管理等相关知识,是否具备?●是否有疫苗储存运输设施设备档案和疫苗储存、运输管理制度是□否□是□否□是□否□是□否□2、疫苗接收●是否存留由药品检验机构依法签发的生物制品每批检验合格或者审核批准证明复印件,并加盖企业印章⏹对于进口的生物制品,还要有通关单复印件,并加盖企业印章是□否□是□否□●对于每一批次疫苗,疫苗企业需提供疫苗相关资料(包括疫苗名称、生产企业、供货(发送)单位、数量、批号、有效期、启运时间、到达时间、启运时疫苗储存温度和环境温度、到达时的疫苗储存温度和环境温度、运输过程中的温度(变化)、运输工具名称和接送疫苗人员签名),是否完整?是□否□●验收人员要逐项核实疫苗运输的设备、时间、温度记录等资料,并对疫苗品种、剂型、批准文号、数量、规格、批号、有效期、供货单位、生产厂商等内容进行验收,做好记录。
⏹如有任何一项漏填,即为未逐项核实,并做注明是□否□每一批疫苗是否均符合疫苗接收要求?(查看每批疫苗批签发及及所有提供的相关资料是否齐全)是□否□2014年以来共接收疫苗批,能做到有批签发复印件、疫苗企业提供疫苗相关资料全面、库管能逐项审核批,有批资料不全(注释说明哪一项不合要求)是□否□3、疫苗贮存和登记●查看疫苗库存,各种疫苗是否按要求存放●疫苗贮存温度◆脊灰疫苗(-20℃~8℃)◆麻疹疫苗(-20℃~8℃)◆乙脑减毒活疫苗(2℃~8℃)◆麻疹风疹疫苗(2℃~8℃)◆麻疹风疹腮腺炎疫苗(2℃~8℃)◆甲肝疫苗(2℃~8℃)◆无细胞百白破疫苗(2℃~8℃)◆白破疫苗(2℃~8℃)◆卡介苗(2℃~8℃)◆乙肝疫苗(2℃~8℃)是□否□是□否□是□否□是□否□是□否□是□否□是□否□是□否□是□否□是□否□◆A群流脑疫苗(2℃~8℃)◆A+C群流脑疫苗(2℃~8℃)◆乙脑灭活疫苗(2℃~8℃)◆其它疫苗(参照药典或说明书)●疫苗品种、批号是否分类码放⏹是否不同疫苗分开放置⏹是否相同批号疫苗放置在一起,⏹是否相同效期的疫苗放置在一起●疫苗间、疫苗与冷库或冰箱壁间是否要留有一定间隙◆冷库中,疫苗间留有间隔,疫苗与库壁间留有间隔◆使用冰衬冰箱储存疫苗时,注意应将卡介苗、脊灰疫苗和麻疹疫苗存放在底部,并将百白破疫苗、白破疫苗和乙肝疫苗放在接近冰箱顶部,不可将冷藏保存的疫苗放在距冰箱底部15cm内的地方,以免冻结。


附件三预防接种工作相关表格表2-1 国家免疫规划疫苗计划报表(各级通用)表2-2 第二类疫苗计划报表(各级通用)表2-3 疫苗出入库登记表(参考格式)表3-1 冷链设备档案表表3-2 冷链设备温度记录表表3-3 疫苗运输温度记录表表4-1 预防接种证(参考格式)表4-2 预防接种卡(参考格式)表4-3 新生儿首剂乙肝疫苗和卡介苗接种记录单表5-1 疑似预防接种异常反应个案报告卡表5-2 群体性疑似预防接种异常反应登记表表5-3 疑似预防接种异常反应个案调查表表5-4 预防接种异常反应调查诊断书表6-1 国家免疫规划疫苗常规接种情况报表(各级通用)表6-2 第二类疫苗预防接种情况报表(各级通用)表9-1 人口情况报表(各级通用)表9-2 接种单位档案表表2-1 ______年国家免疫规划疫苗计划报表(各级通用) 省 市 县 乡(镇、街道)总人口数: 出生率: ‰ 流动人口调整系数: %疫 苗目标人口数规格接种剂数损耗系数预计年底库存数计划数(剂)乙肝疫苗3卡介苗1脊灰灭活疫苗1脊灰减毒活疫苗3百白破疫苗4白破疫苗1麻风疫苗1麻腮风疫苗1A群流脑多糖疫苗2A群C群流脑多糖疫苗2乙脑减毒活疫苗2乙脑灭活疫苗4甲肝减毒活疫苗1甲肝灭活疫苗2填写说明:①目标人口数=总人口数×出生率×流动人口调整系数;②“流动人口调整系数”以1为基数,根据人口流动情况估算对目标年龄组的调整系数;③“规格”单位:疫苗为剂/支或粒;④预计库存数:包括本级和下级报告的预计库存数填报日期: 年 月 日 填报单位(盖章): 填报人:表2-2 第二类疫苗计划报表(各级通用)省 市 县 乡(镇、街道),接种单位:疫苗计划数(剂次)疫苗计划数(剂次)乙肝疫苗流感疫苗白破疫苗23价肺炎多糖疫苗百白破疫苗肺炎结合疫苗麻风疫苗出血热疫苗麻腮疫苗钩体疫苗麻腮风疫苗炭疽疫苗风疹疫苗狂犬病疫苗腮腺炎疫苗伤寒疫苗乙脑减毒活疫苗布病疫苗乙脑灭活疫苗鼠疫疫苗A群C群流脑多糖疫苗霍乱疫苗A群C群流脑结合疫苗森林脑炎疫苗ACYW135流脑疫苗脊灰灭活疫苗甲肝减毒活疫苗戊肝疫苗甲肝灭活疫苗百白破IPV和Hib五联疫苗甲乙肝疫苗百白破Hib四联疫苗Hib疫苗流脑Hib联合疫苗水痘疫苗EV71疫苗轮状病毒疫苗填报日期: 年 月 日 填报单位(盖章): 填报人:表2-3 疫苗出入库登记表(参考格式)疫苗名称: 生产企业: 批号: 疫苗属性:1第一类 2第二类 剂型:1液体 2冻干 3丸剂 4 其他规格: 剂/支或粒 有效日期: 年 月 日 批准文号:批签发合格证明编号: 进口通关单编号:日期出入库类型来源/去向单位入库数(支/粒)出库数(支/粒)库存数(支/粒)对方单位经手人本单位经手人备注填写说明:①疫苗按品种、生产企业和批号管理;②“出入库类型”:领取/购进、下级退回、下发/售出、报废、退回上级;③“来源/去向单位”:入库为来源单位,出库为去向单位;④批号按疫苗标明的实际批号填写;⑤表格的具体形式可根据需要调整,但应包含以上内容。

新冠病毒疫苗接种记录质控检查表数据收集
- 检查表格是否包含以下信息:
- 受种人姓名
- 受种人身份证号码
- 受种人性别
- 受种人年龄
- 接种日期
- 接种疫苗名称
- 接种剂量
- 接种部位
- 接种医生姓名
- 接种医院名称
数据完整性
- 检查每个字段是否填写完整,没有遗漏信息。
- 确保受种人身份证号码无误,可以进行验证。
- 确认接种日期是否准确记录,没有错误日期。
- 确认接种剂量是否正确填写。
- 确认接种部位是否准确记录。
数据一致性检查
- 检查同一受种人的多次接种记录是否一致。
- 确认同一疫苗在不同记录中的剂量是否一致。
数据安全性
- 确保数据记录受到适当的保护措施。
- 检查是否有未经授权的访问或修改记录的行为。
异常数据处理
- 检查是否有不符合规定的数据填写。
- 确保不合规数据得到及时处理和纠正。
以上内容是新冠病毒疫苗接种记录质控检查表的要点,请在记录质控过程中仔细按照以上要求进行检查和核对,以确保数据的准确性和完整性。

医疗机构疫苗使用检查记录表1. 检查记录表概述本文档旨在记录医疗机构对疫苗使用情况进行的检查。
通过记录疫苗的采购、储存、管理和接种等情况,确保疫苗的安全性和有效性。
以下是医疗机构疫苗使用检查记录表的详细内容。
2. 疫苗采购检查2.1 采购合规性检查- [ ] 采购疫苗的供应商是否具备合法资质。
- [ ] 采购合同是否明确规定了疫苗的品种、规格、数量及价格。
- [ ] 采购的疫苗是否符合国家相关标准。
2.2 疫苗储存检查- [ ] 疫苗储存设施是否符合相关要求,如温度、湿度等。
- [ ] 疫苗储存设施是否定期检修和维护。
- [ ] 疫苗储存过程中是否严格遵循标准操作程序。
3. 疫苗管理检查3.1 疫苗档案管理- [ ] 疫苗档案是否完整,包括疫苗品种、规格、批号、有效期等信息。
- [ ] 疫苗档案是否进行定期更新和核对。
- [ ] 疫苗过期或损坏的处理情况是否符合相关规定。
3.2 疫苗台账管理- [ ] 疫苗台账是否建立,并详细记录疫苗的接收、发放和损耗情况。
- [ ] 疫苗台账的管理责任人是否有明确。
4. 疫苗接种检查4.1 接种操作规范性检查- [ ] 接种过程中是否有专人负责,操作是否规范。
- [ ] 接种前是否核对疫苗的品种、规格和有效期。
- [ ] 接种后是否及时记录相应信息,如时间、剂量等。
4.2 接种后异常反应处理检查- [ ] 对于接种后出现的异常反应,是否按照规定进行处理和报告。
- [ ] 异常反应处理和报告的记录是否完整和及时。
5. 检查结果和整改措施5.1 检查结果记录- [ ] 对各项检查内容的结果进行记录,包括合格、不合格和待整改等情况。
5.2 整改措施- [ ] 针对不合格和待整改的情况,明确整改责任人和整改时间,并制定相应的整改措施和计划。
结论本检查记录表旨在帮助医疗机构规范疫苗的使用和管理流程,确保疫苗的安全和有效性。
通过定期进行检查和整改,提高疫苗使用的合规性和质量。
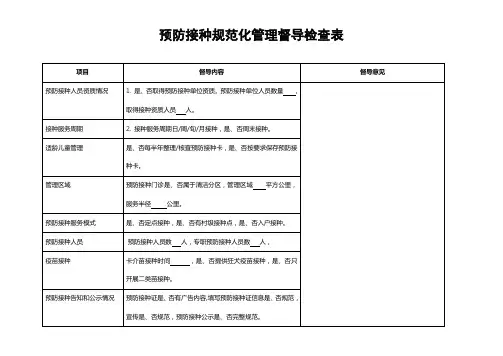
田东县疫苗状况专项检查表
检查
查内检查结果
检容
项目是否
1、能否向疫苗生产公司、疫苗批发公司讨取每批检验合格或许审批同意
证明复印件并加盖公司印章。
2、能否成立真切完好的购进、散发、供给记录。
3、能否在发前核查制品的包装质量、生产单位、生产同意文号、生产批
一号、出厂日期、有效日期、进货渠道、书面登记。
、渠道管理4、能否成立并保留完好的接收、购进记录。
5、能否对切合接种条件的受种者填写并保留接种记录。
6、能否对小孩实行接种时检验预防接种证并记录。
7、单位或个人能否私自进行集体性预防接种。
8、接种单位接种第一类疫苗不得收取任何花费。
二、疫苗冷链管理
1. 冰箱数台、冷藏包数个;现有冷链设施能否知足工作需求。
2.能否有专人管理冷链设施。
3.能否成立冷链设施档案。
4.疫苗能否在规定的温度下储藏。
5、能否对储藏疫苗的温度进行监测和记录。
6、能否依据《疫苗储藏和运输管理规范》的要求展开温度监测。
7、疫苗储存能否合理。
8、冰箱内能否有杂物。
9、一、二类疫苗领发及使用记录:记录能否齐备。
10、二类疫苗能否使用县CDC供给。
11、能否有报废疫苗,怎样处理:
被检查单位(盖印):检查单位:(盖印)负责人:检查人员:
年月日年月日。
附件1
疫苗管理及预防接种专项检查表
机构名称:联系人:
注:疾病预防控制机构同时具有接种单位资质的(同时勾选其他),应在接种单位中同时计数并检查其中内容。
被检查单位签字(盖章):检查人:、
检查日期:年月日检查日期:年月日
附件2
疫苗管理及预防接种专项检查汇总表
(州、市)单位名称(盖章):
填表人:联系电话:填表日期:审核人:单位负责人:附件3
疫苗管理及预防接种专项检查案件查处汇总表
(州、市)单位名称(盖章):
注:疾病预防控制机构同时具有接种单位资质的,应在接种单位中同时计数。
填表人:联系电话:填表日期:审核人:单位负责人:。
这份检查表帮助医生或护士为您或您的子女确定最合适的接种疫苗计划表。
这份检查表帮助医生或护士为您或您的子女确定最合适的接种疫苗计划表。
要接种疫苗的人如果有以下情况,请告诉医生或护士:• 今天不舒服• 患了使免疫力下降的疾病(例如:白血病、癌症、感染艾滋病病毒/艾滋病、严重联合免疫缺陷病) ,正在接受会降低免疫力的治疗(例如:口服可的松、强的松等类固醇药物,放射性治疗,化学治疗)• 对任何疫苗有过严重过敏反应• (对任何东西)有任何严重过敏反应• 在过去一个月的期间内,接种过任何疫苗• 曾注射过免疫球蛋白,或接受过任何血液产品,或在过去一年的期间内接受过全血输血• 正在怀孕• 计划要怀孕或预期成为父母• 是新生婴儿的父母、祖父母或照顾者• 有格林-巴利综合症的病史• 是孕期少于32周的早产婴儿,或者出生时体重少于2000克的婴儿• 是有过肠套叠的婴儿,或者因先天性异常而有发生肠套叠倾向的婴儿• 患慢性疾病• 有出血性功能障碍• 脾脏功能不正常• 与因患病而免疫力下降的人同住(如患白血病、癌症、感染艾滋病病毒/艾滋病的人),或者与正在接受会降低免疫力的治疗的人同住(例如:口服可的松、强的松等类固醇药物,接受放射性治疗,化学治疗的人)• 是原住民以及/或者托勒斯海峡岛民• 计划进行旅行• 因职业或生活方式等因素,而需要接种疫苗接种任何疫苗之前,医生或护士会问您:• 是否理解向您提供的有关接种疫苗的资料?• 是否需要更多信息,以确定是否应接种疫苗?• 是否携带了您/您子女的接种疫苗记录?取得有关您或您子女的接种疫苗的个人记录是很重要的。
如果您没有取得这些记录,请要求医生或护士给您一份。
在您或您子女每次接种疫苗的时候,请携带这些记录让医生或护士填写。
子女入托儿中心、入幼稚园、或入学都可能需要提供这些记录。
有关详情,请联系您的医生或当地市政府。
有关详情,请联系您的医生或当地市政府。
摘自《澳大利亚接种疫苗手册》2013年第10版。
附件1
疫苗管理及预防接种专项检查表
机构名称:联系人:
注:疾病预防控制机构同时具有接种单位资质的(同时勾选其他),应在接种单位中同时计数并检查其中内容。
被检查单位签字(盖章):检查人:、检查日期:年月日检查日期:年月日
- 1 -
附件2
疫苗管理及预防接种专项检查汇总表
(州、市)单位名称(盖章):
- 2 -
填表人:联系电话:填表日期:审核人:单位负责人:
附件3
疫苗管理及预防接种专项检查案件查处汇总表
(州、市)单位名称(盖章):
填表人:联系电话:填表日期:审核人:单位负责人:
- 3 -。