腐蚀热力学动力学讲义
- 格式:ppt
- 大小:9.95 MB
- 文档页数:88




第4章腐蚀动⼒学第四章电化学腐蚀动⼒学-1§4—1 电化学腐蚀速度与极化从热⼒学出发所建⽴起来的电位——pH图只能说明⾦属被腐蚀的趋势,但是在实际中需要解决的问题是腐蚀速度。
⼀. 腐蚀速度。
腐蚀速度的表⽰⽅法有三种。
1. 重量法:⽤腐蚀前后重量变化(只⽤均匀腐蚀,⾦属密度相同)增重法:V+ =(W1-W0)/S0t (g/m2h)失重法:V-=(W0-W1)/S0t (g/m2h)式中:W0——式样原始重量。
W1——腐蚀后的重量(g,mg)S0——经受腐蚀的表⾯积(m2) t——经受腐蚀的时间(⼩时)2. 腐蚀深度法(均匀腐蚀时,⾦属密度不同)可⽤此法表⽰。
D深=V±/d =(W1-W0)/S0td (mm/年) 式中d为⾦属密度⼒学(或电阻)性能变化法。
(适⽤于晶间腐蚀,氢腐蚀等)Kσ=(σbo-σbˊ)/σbo×100% K R =(R1-R0)/R0×100%σbo,R0——式样腐蚀前的强度和电阻σbˊ,R1——式样腐蚀后的强度和电阻3. ⽤阳极电流密度表⽰V¯=Icorr×N/F =3.73*10¯4 Icorr×N (g/m2h)F——法拉第常数96500KN——⾦属光当量=W/n =⾦属原⼦量/⾦属离⼦价数⼆. 极化上⼀章讨论了⾦属电化学腐蚀的热⼒学倾向,并未涉及腐蚀速度和影响腐蚀速度的因素等⼈们最为关⼼的问题。
电化学过程中的极化和去极化是影响腐蚀速度的最重要因素,研究极化和去极化规律对研究⾦属的腐蚀与保护是很重要的。
⾦属受腐蚀的趋势⼤⼩是由其电极电位决定的,将两块不同⾦属置于电解质中,两个电极电位之差就是腐蚀原动⼒。
但是这个电位差数值是不稳定的,当电极上有电流流过时,就会引起电极电位的变化。
这种由于有电流流动⽽造成电极电位变化的现象称为电极的极化。
电极的极化是影响腐蚀速度的重要因素之⼀。
(⼀)极化现象。





第四章电化学腐蚀动力学-1§4—1 电化学腐蚀速度与极化从热力学出发所建立起来的电位——pH图只能说明金属被腐蚀的趋势,但是在实际中需要解决的问题是腐蚀速度。
一. 腐蚀速度。
腐蚀速度的表示方法有三种。
1. 重量法:用腐蚀前后重量变化(只用均匀腐蚀,金属密度相同)增重法:V+ =(W1-W0)/S0t (g/m²h)失重法:V=(W0-W1)/S0t (g/m²h)式中:W0——式样原始重量。
W1——腐蚀后的重量(g,mg)S0——经受腐蚀的表面积(m²) t——经受腐蚀的时间(小时)2. 腐蚀深度法(均匀腐蚀时,金属密度不同)可用此法表示。
D深=V±/d =(W1-W0)/S0td (mm/年) 式中d为金属密度力学(或电阻)性能变化法。
(适用于晶间腐蚀,氢腐蚀等)Kσ=(σbº-σbˊ)/σbº×100% K R =(R1-R0)/R0×100%σbº,R0——式样腐蚀前的强度和电阻σbˊ,R1——式样腐蚀后的强度和电阻3. 用阳极电流密度表示V¯=Icorr×N/F =3.73*10¯4 Icorr×N (g/m²h)F——法拉第常数96500KN——金属光当量=W/n =金属原子量/金属离子价数二. 极化上一章讨论了金属电化学腐蚀的热力学倾向,并未涉及腐蚀速度和影响腐蚀速度的因素等人们最为关心的问题。
电化学过程中的极化和去极化是影响腐蚀速度的最重要因素,研究极化和去极化规律对研究金属的腐蚀与保护是很重要的。
金属受腐蚀的趋势大小是由其电极电位决定的,将两块不同金属置于电解质中,两个电极电位之差就是腐蚀原动力。
但是这个电位差数值是不稳定的,当电极上有电流流过时,就会引起电极电位的变化。
这种由于有电流流动而造成电极电位变化的现象称为电极的极化。

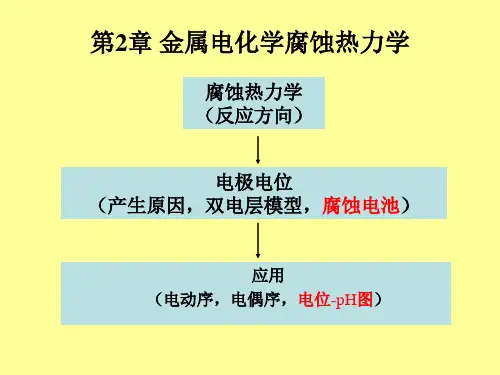
第2章腐蚀热力学2.1 腐蚀倾向的热力学判据在自然环境和许多腐蚀介质中,除个别贵金属(Au,Pt等)外,绝大多数金属在热力学上是不稳定的,有自动发生腐蚀的倾向。
在一定的外界条件下,这些金属从金属状态自发地转变为离子状态,生成相应的氧化物、硫化物或有关的盐类。
从这个意义上讲,金属腐蚀是冶金的逆过程。
为什么大多数金属有自发腐蚀的倾向?为什么不同金属在不同介质中的腐蚀倾向不同?如何用热力学方法判断金属的腐蚀倾向及程度呢?自然界一切自发过程都是有方向性的,都有从自由能高的状态向自由能低的状态转变的趋势。
例如,热总是从高温物体自动传向低温物体,直到两物体的温度一致;水总是从高处自动流向低处,直到水位相等;电流总是从高电位处自动流向低电位处,直到电位差为零;溶液中的溶质总是从高浓度处自动向低浓度处扩散,直到浓差为零。
对于化学反应,同样存在着自发进行的方向和限度问题。
例如,锌片浸在稀的硫酸铜溶液中,将自动发生取代反应,生成铜和硫酸锌溶液,其逆反应不能自发进行,除非用电解的方法,从外界对它做功。
可见,不管是自发的物理过程还是化学变化,它们都有一定的方向和限度。
它们都是不可逆过程。
每一自发过程都有导致其变化的原因,即自发过程的推动力。
如温差、水位差、浓度差、电位差、化学位差等。
自发过程的方向就是使这些差值减小的方向,限度就是这种差值的消失。
对于金属腐蚀和大多数化学反应来说,一般是在恒温、恒压的敞开体系条件下进行的。
这种情况下,通常用吉布斯(Gibbs)自由能判据来判断反应的方向和限度。
即在等温等压条件下:(ΔG)T,p < 0 自发过程;(ΔG)T,p = 0 平衡状态;(ΔG)T,p > 0 非自发过程。
(2-1)(ΔG)T,p表示等温等压下,过程或反应的自由能变化△G只取决于始态和终态,与过程或反应的途径无关。
用它可作为过程或反应能否自发进行的统一衡量标准。
就是说,在等温等压条件下,若体系的自由能减小,则该过程可自发进行,若体系的自由能减到了最小,则体系达到了平衡状态,若体系的自由能增大,则该过程不能自发进行。
第 2 章 腐蚀热力学2.1 腐蚀倾向的热力学判据 在自然环境和许多腐蚀介质中,除个别贵金属(Au ,Pt 等) 外,绝大多数金属在热力学上是不稳定的,有自动发生腐蚀的倾向。
在一定的外界条件下,这些金属从金属状态自发地转 变为离子状态,生成相应的氧化物、硫化物或有关的盐类。
从这个意义上讲,金属腐蚀是冶 金的逆过程。
为什么大多数金属有自发腐蚀的倾向 ?为什么不同金属在不同介质中的腐蚀倾向不同 ?如何用热力学方法判断金属的腐蚀倾向及程度呢 ?自然界一切自发过程都是有方向性的,都有从自由能高的状态向自由能低的状态转变的 趋势。
例如,热总是从高温物体自动传向低温物体,直到两物体的温度一致;水总是从高处 自动流向低处,直到水位相等;电流总是从高电位处自动流向低电位处,直到电位差为零; 溶液中的溶质总是从高浓度处自动向低浓度处扩散,直到浓差为零。
对于化学反应,同样存 在着自发进行的方向和限度问题。
例如, 锌片浸在稀的硫酸铜溶液中, 将自动发生取代反应, 生成铜和硫酸锌溶液,其逆反应不能自发进行,除非用电解的方法,从外界对它做功。
可见,不管是自发的物理过程还是化学变化,它们都有一定的方向和限度。
它们都是不 可逆过程。
每一自发过程都有导致其变化的原因,即自发过程的推动力。
如温差、水位差、 浓度差、电位差、化学位差等。
自发过程的方向就是使这些差值减小的方向,限度就是这种 差值的消失。
对于金属腐蚀和大多数化学反应来说,一般是在恒温、恒压的敞开体系条件下进行的。
这种情况下, 通常用吉布斯 (Gibbs) 自由能判据来判断反应的方向和限度。
即在等温等压条件 下:(△ G T , p 表示等温等压下,过程或反应的自由能变化△或反应的途径无关。
用它可作为过程或反应能否自发进行的统一衡量标准。
就是说,在等温 等压条件下,若体系的自由能减小,则该过程可自发进行,若体系的自由能减到了最小,则 体系达到了平衡状态,若体系的自由能增大,则该过程不能自发进行。