炔烃
- 格式:doc
- 大小:41.50 KB
- 文档页数:2

炔烃1.炔烃:为分子中含有碳碳三键的碳氢化合物的总称,其官能团为碳-碳三键(C≡C),分子通式为CnH2n-2,是一种不饱合的碳氢化合物。
2.炔烃物理性质炔烃的熔沸点低,密度小,难溶于水,易溶于有机溶剂。
简单的炔烃的熔点、沸点,密度均比具有相同碳原子数的烷烃或烯烃高一些.不易溶于水,易溶于乙醚、苯、四氯化碳等有机溶剂中。
炔烃可以和卤素、氢、卤化氢、水发生加成反应,也可发生聚合反应。
工业中乙炔被用来做焊接时的原料。
在正炔烃的同系列中,C2~C4的炔烃是气体,C5~C15的是液体,C15以上的是固体。
炔烃的熔点和沸点也随着碳原子数目的增加而增高。
(注:乙炔不纯时,含有H2S,PH3杂质气体,有臭味)3炔烃化学性质炔烃的化学活性比烯烃弱。
炔烃的官能团是--C≡C--,其化学性质与烯烃有不少相似之处,例如能发生加成、氧化和聚和反应等。
(1)氧化反应炔烃能使高锰酸钾和浓溴水褪色(2)加成反应①加氢:R-C≡C-R'+2H2→RCH2CH2R'CH3≡CCH3+H2→CH3-CH=CH-CH3(顺式)CH3≡CCH3+Na+NH3(l)→CH3-CH=CH-CH3(反式)②加卤素:R-C≡CH可生成相应的卤代烯和卤代烷③加卤化氢:R-C≡CH+HX→R-CX=CH2R-CX=CH2+HX→R-CX2-CH3(3)聚合反应炔会发生聚合反应:炔会发合成苯:3HC≡CH→(苯环)4.乙炔:俗称风煤、电石气,最简单的炔烃,是炔烃化合物系列中体积最小的一员,主要作工业用途,特别是烧焊金属方面。
乙炔在室温下是一种无色、极易燃的气体。
纯乙炔是无臭的,但工业用乙炔由于含有硫化氢、磷化氢等杂质,而有一股大蒜的气味。
分子式CH≡CH,化学式C2H2,电子式:H:C:::C:H ,C-C键中间是六个点,分两列,每列三个—H:C:::C:H ,分子空间构型为直线型非极性分子。
5.乙炔的物理性质纯乙炔为无色无味的易燃、有毒气体。


炔烃1.基本性质 1.1概述1.定义 分子里有碳碳三键的不饱和链烃叫做炔烃。
2.通式 C n H 2n-2(n ≥2) ,炔烃与二烯烃、环烯烃为同分异构体(类别异构)。
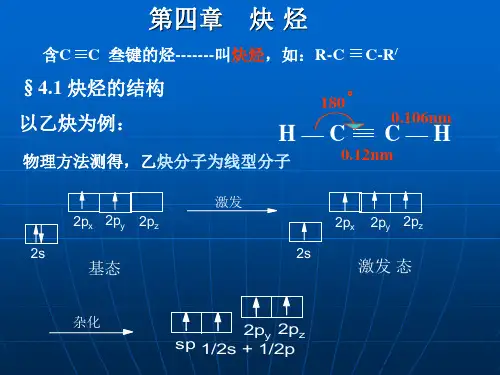
3.乙炔(1)结构:分子式C2H2,结构式为H -C ≡C -H ,直线型分子,键角180°。
(2)物理性质:纯净的乙炔是无色、无臭气体,比空气轻,微溶于水,易溶于有机溶剂。
(3)乙炔的实验室制法: 4.炔烃通性(1)随着碳原子数的增加,熔沸点逐渐升高,相对密度逐渐增大。
(2)碳原子数小于或等于4的炔烃,在常温下均为气体,其他的炔烃为液体或固体。
(3)炔烃不溶于水,易溶于有机溶剂。
2.性质应用2.1乙炔的实验室制法 (1)化学反应原理CaC 2+2H 2O −−→HC ≡CH ↑+Ca(OH)2 说明:碳化钙(CaC 2)属于离子型碳化物,它遇水可水解,即碳化钙中的钙离子跟H 2O 中的OH -生成氢氧化钙,伴随产生的H+与碳化物中的碳负离子结合成相应的烃。
即CaC 2+2H -OH −−→HC ≡CH ↑+Ca(OH)2 同理:ZnC 2+2H -OH −−→HC ≡CH ↑+Z n (O H )2 Al 4C 3+12H -OH −−→3CH 4↑+Al(OH)2 (2)仪器装置设计从物质的状态、反应条件等方面看,以电石跟水反应制备乙炔气体的反应属于“固+液−−−→常温气”的类型,与实验室中以Zn 和H2SO4稀溶液制备H2的反应类型相同。
因此,制乙炔气体可采用“制氢简易装置”。
(3)实验操作步骤设计该实验与大多数制备实验相似,操作步骤为:连接各仪器为整套装置;检验装置的气密性;将化学药品加到各仪器中去;使反应物混合;收集气体。
(4)应注意的问题①由于CaC 2与H 2O 的反应太剧烈,即便是CaC 2与H 2O 蒸气接触,它们也能顺利地反应,反应又是放热的,所以实验中要获得平稳的乙炔气流,主要措施有:a.以饱和NaCl 溶液代替水;b.通过分液漏斗向广口瓶中加水(或饱和NaCl 溶液)时,要慢、要少。

114第六章 炔烃分子中含有碳碳叁键的烃叫做炔烃。
碳碳叁键可位于碳链中的任意位置。
开链炔烃的分子通式为C n H 2n-2 。
碳碳叁键位于碳链一端的炔烃称之为单取代或末端炔烃。
6.1 炔烃的结构与烯烃的碳碳双键相比,炔烃的碳碳叁键经历了不同的杂化。
在此杂化过程中,碳的2s 轨道和三个2p 轨道中的一个进行杂化。
每个杂化轨道含有1/2 s 轨道和1/2 p 轨道的成分。
这些杂化轨道称之为sp 轨道。
由于sp 轨道的s 成分增加,乙炔中碳氢键的极性比乙烷和乙烯中的大很多。
乙烯的pK a 值大约在44,而乙炔的pK a 值大约在25,所以末端炔烃在一些特定的情况下,可以当成弱酸,尽管酸性甚至比水还弱很多。
碳碳叁键是两个sp 杂化的碳原子相互之间形成的。
碳原子中的两个sp 杂化轨道沿一轴线呈180 o 伸展 ,该轴线与非杂化的2p x 和2p y 轨道垂直。
当两个sp 杂化碳原子相互靠近时,sp-sp σ 键形成,于是每个碳原子其它两个p 轨道之间就以肩并肩方式重叠,形成两个相互垂直的π键,如图6.1所示。
因此,乙炔C 2H 2是一个线形分子,四个原子都排布在同一条直线上。
由于此线形特性,环状炔烃至少含有十个碳原子才能消除过多的张力。
此外,围绕炔烃叁键部分的电子云密度要比乙烷、乙烯大得多。
与烯烃类似,炔烃容易与亲电试剂相互作用。
(a)(b)图6.1 乙炔的模型(a )乙炔 sp 杂化示意图(b)乙炔的电子云结构模型乙炔碳碳叁键的长度为120pm,键能大约是836 kJ/mol,所以碳碳叁键是已知的键能最大,键长最短的碳碳键。
表格6.1 乙烷,乙烯,乙炔的共价键参数乙烷乙烯乙炔C-C 键键能(KJ) 368 607 836C-C 键长度(pm) 154 134 120C-H 键键能(KJ) 410 444 506C-H键长度(pm) 110 108 106 很明显可以看出(836-368) 并不是(607-368)的两倍,而且实验结果表明,要打开乙炔中的π键需要大约318 KJ/mol的能量,而对于乙烯需要268KJ/mol,所以我们可以得到结论,炔烃与亲电试剂的反应比烯烃与亲电试剂的反应要迟钝。




炔烃炔烃是分子中含有碳碳叁键的烃,炔烃比相应的烯烃少两个氢原子,通式为C n H2n-2。
1 炔烃的异构和命名乙炔是最简单的炔烃,分子式为C2H2,构造式为HC ≡ CH。
根据杂化轨道理论,乙炔分子中的碳原子以sp杂化方式参与成键,两个碳原子各以一条sp杂化轨道互相重叠形成一个碳碳σ键,每个碳原子又各以一个sp轨道分别与一个氢原子的1s轨道重叠,各形成一个碳氢σ键。
此外,两个碳原子还各有两个相互垂直的未杂化的2p轨道,其对称轴彼此平行,相互“肩并肩”重叠形成两个相互垂直的π键,从而构成了碳碳叁键。
两个π键电子云对称地分布在碳碳σ键周围,呈圆筒形。
乙炔分子中π键的形成及电子云分布其它炔烃中的叁键,也都是由一个σ键和两个π键组成的。
现代物理方法证明,乙炔分子中所有原子都在一条直线上,碳碳叁键的键长为0.12 nm,比碳碳双键的键长短,这是由于两个碳原子之间的电子云密度较大,使两个碳原子较之乙烯更为靠近。
但叁键的键能只有836.8 kJ•mol -1,比三个σ键的键能和(345.6 kJ•mol -1 × 3)要小,这主要是因为p轨道是侧面重叠,重叠程度较小所致。
乙炔分子的立体模型。
由于叁键的几何形状为直线形,叁键碳上只可能连有一个取代基,因此炔烃不存在顺反异构现象,炔烃异构体的数目比含相同碳原子数目的烯烃少。
Kekule 模型 Stuart模型乙炔的立体模型示意图2 炔烃的结构炔烃的系统命名法与烯烃相同,只是将“烯”字改为“炔”字。
例如:CH3C≡CH CH3C≡CCH3(CH3)2CHC≡CH丙炔 2-丁炔 3-甲基-1-丁炔分子中同时含有双键和叁键的化合物,称为烯炔类化合物。
命名时,选择包括双键和叁键均在内的碳链为主链,编号时应遵循最低系列原则,书写时先烯后炔。
CH3-CH=CH-C≡CH CH2=CH-CH=CH-C≡CH 3-戊烯-1-炔 1,3-己二烯-5-炔双键和叁键处在相同的位次时,应使双键的编号最小。
炔烃分子中含有碳碳叁键的烃叫做炔烃,它的通式是Cn H2n-2。
炔烃的异构和命名乙炔和丙炔都没有异构体。
从丁炔开始有构造异构现象。
炔烃的构造异构现象也是由于碳链不同和叁键位置不同所引起的,但由于在碳链分支的地方,不可能有叁键存在,所以炔烃的构造异构体比碳原子数目相同的烯烃少些。
例如,丁烯有三个构造异构体,而丁炔只有两个:由于叁键碳上只可能连有一个取代基,因此炔烃不存在顺反异构现象。
戊炔有三个构造异构体,它也比戊烯的构造异构体数目(五个)少。
炔烃的系统命名法与烯烃相似,即以包含叁键在内的最长的碳链为主链,按主链的碳原子数命名为某炔,代表参键位置的阿拉伯数字,以取最小的为原则而置于名词之前,侧链基团则作为主链上的取代基来命名。
较简单的炔烃,也可以把它们看作是乙炔的衍生物,而用乙炔衍生物命名法来命名。
例如:从上例中可以看出,含有双键的炔烃在命名时,一般先命名烯再命名炔,碳链编号以表示双键与叁键位置的两个数字之和取最小的为原则,例如应命名为 3-戊烯-1-炔,而不命名为 2-戊烯-4-炔。
炔烃的结构炔烃的结构特征是分子中具有碳碳叁键。
可以以乙炔的结构为例,说明叁键的结构。
请研究下面的模型。
X光衍射和电子衍射等物理方法测定,乙炔分子是一个线形分子,四个原子都排布在同一条直线上。
成键碳原子的价电子层应满足八个电子的要求,乙炔的两个碳原子共用了三对电子,所以碳碳之间的键应当用叁键来代表。
量子化学的研究结果表明,在乙炔分子中,每个碳原子与另外两个原子(一个氢原子和另一个碳原子)结合成键时,使用了两个相同的sp杂化轨道(由一个s轨道和一个p轨道组合而成)。
已知烷烃中一个碳原子的四个sp3杂化轨道所组成的。
键是指向四面体四个顶角的四个键;由烯烃双键同一碳原子的三个sp2杂化轨道组成的。
键是在平面上指向三角形三个顶角的三个键;由炔烃叁键一个碳原子上的两个sp杂化轨道所组成的σ键则是在同一直线上方向相反的两个键。
这就是乙炔分子所以成为直线分子的原由。
炔烃名词解释
炔烃是一类有机化合物,其分子中含有碳-碳三键。
由于其分
子结构的特殊性质,炔烃具有独特的性质和应用。
炔烃可以分为两类:单炔和多炔。
单炔是指分子中只含有一个炔键,如乙炔(C2H2),丙炔(C3H4)等。
多炔则是指分子
中含有多个炔键,如二炔丁烷(C4H6),三炔丙烷(C6H8)等。
炔烃具有高度反应活性,可以进行多种化学反应。
其中,最常见的反应是加成反应,即炔烃中的碳-碳三键被破坏,与其他
原子或分子发生反应,形成新的化学键。
炔烃还可以发生聚合反应,多个炔烃分子相互结合形成长链或支链状化合物。
由于炔烃分子中碳-碳三键的存在,炔烃具有较高的能量密度,可以作为高效的燃料。
乙炔(C2H2)是一种常用的工业燃料,可以用于金属切割和焊接等工艺。
此外,炔烃还可以用于有机合成反应中的底物或试剂,如乙炔可以与溴反应得到二溴乙烷,二溴乙烷又可以与乙醇反应得到乙基乙炔醚等。
炔烃在有机合成中扮演着重要的角色。
总之,炔烃是一类含有碳-碳三键的有机化合物,具有高反应
活性和多种应用。
《炔烃》(第二章第1节)教学设计
一、教学内容分析
教学目标
知识与技能:使学生了解乙炔的分子组成和分子结构特点,掌握乙炔重要的化学性质和主要用途。
过程和方法:培养学生的空间想象能力,观察能力和知识迁移能力。
态度与情感:激发学生兴趣,培养严谨求实的科学态度及理论联系实际的优良品质。
课题内容分析
本节的主要内容是乙炔的结构、乙炔的实验室制法、物理性质、化学性质。
本节是在学习了烷烃、烯烃之后学习的第三类烃,也是必修2中没有出现的一类烃。
在本节教学中一方面要充分利用在学习烷烃和烯烃时掌握的知识与方法,二是要注意通过对比分析找出炔烃与烷烃、烯烃在结构、性质方面的异同,形成较完整的脂肪烃知识网络。
乙炔的结构和化学性质及其相互关系是本节教学的主线,在教学中,要充分利用化学实验、现代教育技术等手段,通过探索推理、比较分析、归纳总结,使学生掌握知识的同时提高分析问题能力。
教学重点乙炔的结构和化学性质
教学手段多媒体电脑平台与CAI课件球棍模型实验用品。
教学难点炔烃的结构
教学方法比较发现法、探索推理法、演绎总结法
课时1课时
二、教学过程设计
点评:
1、本节内容是以探究学习模式为主线设计的。
利用对比对析法,从结构上预测乙炔
的化学性质,进而实验方案和装置选择,实验证明,归纳总结,最后迁移到炔烃。
条理清晰,结构和环节分明,学生活动内容充实。
2、在开头很注重教学氛围的营造,激发了学生学习的欲望。
3、媒体使用设计恰当,有利于教学辅助。
4、在本教学设计中多次运用对比手法,在结构和性质方面都与烷和烯作了对比,建
议在课堂小节这一环节中中增加烷烃、烯烃、炔烃的性质对比表,更有利于学生
形成知识网络体系。