杂化轨道理论简介
- 格式:pdf
- 大小:3.62 MB
- 文档页数:23
杂化轨道理论按照共价键的成键过程中,一个原子有几个未成对电子,通常只能和几个自旋相反的电子形成共价键,所以在共价分子中,每个原子形成共价键的数目是一定,这就是共价键的“饱和性”.如HF而不是H2F。
C原子的电子排布式是1s22s22p2,从轨道表示式看出只有两个未成对电子,只能形成两个共价键,但甲烷CH4分子中形成四个共价键,形成的每个共价键相同且键角是109.50,怎么解释?为解决这一矛盾,鲍林提出了杂化轨道理论.一.杂化轨道理论简介原子在形成分子时,为了增强成键能力,使分子的稳定性增加,趋向于将不同类型的原子轨道重新组合成能量、形状和方向与原来不同的新原子轨道;这种重新组合称为杂化;杂化后的原子轨道称为杂化轨道.【注意】(1)只有能量相近的轨道才能相互杂化。
(2)形成的杂化轨道数目等于参加杂化的原子轨道数目。
(轨道数不变)(3)杂化轨道成键能力大于原来的原子轨道(成键能力提高),因为杂化轨道的形状变成一头大一头小了,用大的一头与其他原子的轨道重叠,重叠部分显然会增大。
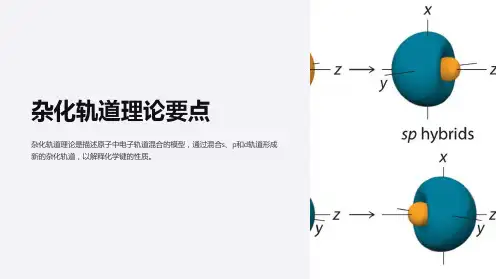
二.杂化轨道类型1. sp3 杂化原子形成分子时,同一原子中能量相近的一个ns轨道与三个np轨道进行混合组成四个新的原子轨道称为sp3 杂化轨道.当碳原子与4个氢原子形成甲烷分子时,碳原子的2s 轨道和3个2p 轨道这4个轨道会发生混杂,混杂时保持轨道总数不变,得到4个能量相等、成分相同的sp3杂化轨道,夹角109 28′,如图所示:2. sp2 杂化同一个原子的一个ns 轨道与两个np 轨道进行杂化组合为sp 2杂化轨道。
sp 2杂化:三个夹角为120°的平面三角形杂化轨道BF 3分子形成3. sp 杂化同一原子中ns-np 杂化成新轨道:一个s 轨道和一个p 轨道杂化组合成两个新的sp 杂化轨道。
夹角为180°的直线形杂化轨道BeCl 2分子形成。

轨道杂化理论
轨道杂化理论,又称占据轨道杂化理论,是化学领域中著名的理论,它有助于研究原
子核中子核与电子之间的相互作用。
轨道杂化理论揭示了原子在不同状态下的构造,它可
以帮助人们了解化学性质,特别是分子的稳定性。
轨道杂化理论的基本思想是将原子轨道分为占据轨道和空置轨道。
原子的放射性是由
吸收能量而完成的,这涉及到电子从高能带跃迁到低能带的过程。
在这个过程中,邻近的
模式之间发生杂化,即高能轨道中的电子会跑进低能轨道中,同时低能轨道中的电子也会
跑进高能轨道中。
这种杂化现象导致了原子核中电子的混和,从而形成了电子的构型。
通过轨道杂化理论,可以绘制出原子的轨道排列,从而说明其稳定性。
由于原子在低
能轨道中的电子较多,称为芝加莱轨道,芝加莱轨道的分子极其稳定,因此叫做芝加莱分子。
此外,轨道杂化理论还可以解释原子电荷数及其配位数之间的关系。
在化学反应中,
遵循六电价定律,即原子与原子之间的电子转移都需要满足一定的条件,这些条件都可以
由轨道杂化理论来描述。
轨道杂化理论普遍应用于现代物理化学研究,它是一种能够准确模拟原子核中子核与
电子相互作用的理论模型。
这种理论对于研究化学反应有很大的帮助,能够帮助人们较好
的了解化学性质,特别是分子的稳定性,更有助于理解化学反应的遵循六电价定律的原因。

杂化轨道解释
杂化轨道是指原子中的各个电子轨道(s、p、d等)在化学键
形成过程中重新排列和重新组合形成的一系列新的轨道。
原子中的电子在形成化学键时,会发生轨道重叠,电子会重新排列在空间中形成新的轨道,这些轨道被称为杂化轨道。
杂化轨道的形成可以通过薛定谔方程进行计算。
在计算过程中,原子的电子云会被重新组合成一些新的轨道,这些新的轨道与原来的轨道具有不同的性质和形状。
最常见的杂化轨道包括sp、sp²和sp³轨道。
例如,在形成氨分子(NH₃)的化学键时,氮原子的一个2s
轨道和三个2p轨道会发生杂化,形成四个新的sp³杂化轨道,这四个轨道平面形成一个四面体。
杂化轨道的形成可以解释很多分子的几何结构和化学性质。
通过杂化轨道的探讨,可以帮助我们理解分子中原子之间的键合和空间排列。
杂化轨道理论在化学中得到广泛应用,是解释分子结构和反应机理的重要工具。

轨道杂化理论
轨道杂化理论是一种用来解释物质由粒子状态转变为分子状态的理论。
它是由德国物理学家马克斯·冯·霍夫曼提出的,于1924年发表在英国物理学会上。
轨道杂化理论被认为是后来分子物理学发展的基础,它提出了电子能级交换的概念,即电子能级混合时产生的能量可以被用来维持分子结构。
轨道杂化理论主要是描述电子态之间的相互作用。
它认为,原子核和外电子是分子的两个重要组成部分,电子能级的混合可以使分子稳定,并使每个分子的总能量达到最小值。
因此,当原子核和外电子相互作用时,电子能级就会发生混合,从而产生了分子状态。
轨道杂化理论在分子物理学中发挥了重要作用,它提出了电子能级混合的概念,而这种混合是分子稳定的关键。
轨道杂化理论还为研究分子物理学和化学提供了基础,从而可以在不同的分子结构中找到最佳的组合,这对于研究各种化学反应都有重要意义。
轨道杂化理论是一种重要的理论,它用来解释物质从粒子状态转变为分子状态的过程,而这也是形成分子的基础。
它为化学反应和物理学研究提供了一种新的方法,也为人类提供了更多的知识和发现。



杂化轨道理论在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化,产生的新轨道叫做杂化轨道。
1基本介绍杂化轨道理论(hybrid orbital theory)是1931年由鲍林(Pauling L)等人在价键理论的基础上提出,它实质上仍属于现代价键理论,但是它在成键能力、分子的空间构型等方面丰富和发展了现代价键理论。
核外电子在一般状态下总是处于一种较为稳定的状态,即基态。
而在某些外加作用下,电子也是可以吸收能量变为一个较活跃的状态,即激发态。
在形成分子的过程中,由于原子间的相互影响,单个原子中,具有能量相近的两个能级中,具有能量较低的能级的一个或多个电子会激发而变为激发态,进入能量较高的能级中去,即所谓的跃迁现象,从而新形成了一个或多个能量较高的能级。
此时,这一个或多个原来处于较低能量的能级的电子所具有的能量增加到与原来能量较高的能级中的电子相同。
这样,这些电子的轨道便混杂在一起,这便是杂化,而这些电子的状态也就是所谓的杂化态。
用化学语言讲,杂化轨道理论从电子具有波动性、波可以叠加的观点出发,认为一个原子和其他原子形成分子时,中心电子所用的电子轨道不是原来纯粹的s轨道或p轨道,而是若干不同类型、能量相近的电子轨道经叠加混杂、重新分配轨道的能量和调整空间伸展方向,组成了同等数目的能量完全相同的新的电子轨道——杂化轨道,以满足化学结合的需要。
这一过程称为电子轨道的杂化。
2基本要点只有最外电子层中不同能级中的电子可以进行轨道杂化,且在第一层的两个电子不参与反应。
不同能级中的电子在进行轨道杂化时,电子会从能量低的层跃迁到能量高的层,并且杂化以后的各电子轨道能量相等又高于原来的能量较低的能级的能量而低于原来能量较高的能级的能量。
当然的,有几个原子轨道参加杂化,杂化后就生成几个杂化轨道。
杂化轨道成键时,要满足原子轨道最大重叠原理。
杂化后的电子轨道与原来相比在角度分布上更加集中,从而使它在与其他原子的原子轨道成键时重叠的程度更大,形成的共价键更加牢固。



轨道杂化理论
杂化轨道理论是一种科学理论。
在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化,产生的新轨道叫做杂化轨道。
1、某原子在成键时,在键合原子的作用下,同一原子中不同类型能量相近的原子轨道可能改变原有的状态,混杂起来并重新组合成一组有利于成键的新轨道(即杂化轨道)。
这一过程称为原子轨道的杂化,简称杂化。
2 、同一原子中能量相近的n 个原子轨道,组合后只能得到n 个杂化轨道。
例如,同一原子的一个ns 轨道和一个npx轨道,只能杂化成两个sp杂化轨道。
这两个sp杂化轨道的形状一样,但其角度分布最大值在x轴上的取向相反。
3 、杂化轨道比原来未杂化的轨道成键能力强,形成的化学键键能大,使生成的分子更稳定。
由于成键原子轨道杂化后,轨道角度分布图的形状发生了变化,形成的杂化轨道一头大一头小。
大的一头与别的原子成键时电子云可以得到更大程度的重叠,所以形成的化学键比较牢固。
杂化轨道理论简介思考:写出碳原子的核外电子排布图,思考为什么碳原子与氢原子结合形成CH4,而不是CH2 ?一.杂化轨道理论1.概念:在形成分子时,在外界条件影响下若干不同类型能量相近的原子轨道混合起来,重新组合成一组新轨道的过程叫做原子轨道的杂化,所形成的新轨道就称为杂化轨道。
2.杂化条件:(1)参与参加杂化的各原子轨道能量要相近(同一能级组或相近能级组的轨道);(2)只有在形成分子的过程中才能会发生杂化。
3、杂化轨道特点(1)杂化轨道前后轨道总数不变,形状发生改变,一头大,一头小,杂化后各轨道能量相同。
(2)杂化轨道成键时同样遵循互斥理论,满足化学键间排斥力最小,故杂化轨道之间在空间内尽可能远离,呈立体对称结构。
(3)杂化轨道只能用于形成σ键或者用来容纳未参与成键的孤电子对。
未参与杂化的P轨道可用于形成π键。
(4)一个轨道不管有没有电子,只要符合杂化的条件就可能参与杂化。
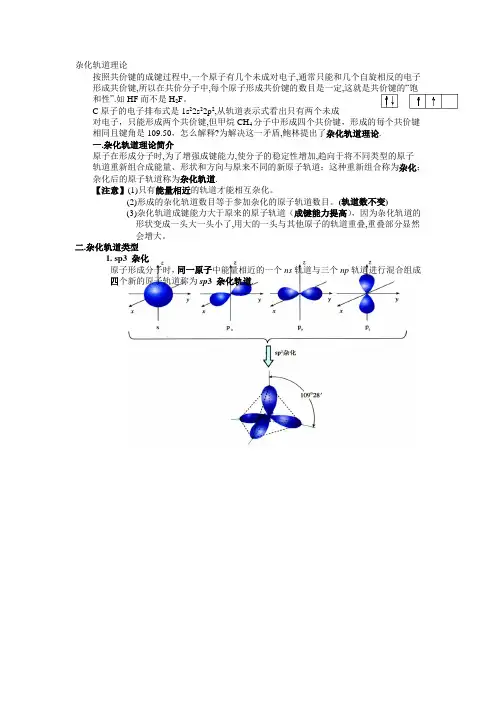
4、杂化轨道形成过程(1)sp3杂化sp3杂化:1个s 轨道与3个p 轨道进行的杂化,形成4个sp3 杂化轨道。
每个sp3杂化轨道的形状也为一头大,一头小,含有1/4 s 轨道和3/4 p 轨道的成分每两个轨道间的夹角为109 °28,。
空间构型为正四面体型。
价层电子对数为4的中心原子采用sp3杂化方式(2)sp2杂化sp2杂化:1个s 轨道与2个p 轨道进行的杂化,形成3个sp2 杂化轨道。
每个sp2杂化轨道的形状也为一头大,一头小,含有1/3 s 轨道和2/3 p 轨道的成分,每两个轨道间的夹角为120°,呈平面三角形。
例:用杂化轨道理论分析乙烯的杂化类型及分子空间构型?杂化轨道只能形成σ键或容纳未参与成键的孤电子对,不能形成π键;未参与杂化的p轨道可用于形成π键。
例:苯环的结构1.苯环中的碳均是以sp2杂化成夹角为1200三个sp2杂化轨道.2.苯环中六个碳之间形成6个σ键,每个碳与氢形成1个σ键.3.苯环中六个碳中未杂化的P轨道彼此形成一个大π键.4.形成大π键比一般的π键更稳定,因此苯环体现特殊的稳定性(3)sp杂化sp杂化:1个s 轨道与1个p 轨道进行的杂化,形成2个sp杂化轨道。
杂化轨道理论杂化轨道在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化,产生的新轨道叫做杂化轨道。
目录基本介绍价键理论的论证相关种类几种杂化轨道之后的分子空间形态编辑本段基本介绍分子的空间结构可以通过X射线衍射,电子衍射等实验手段进行测定。
为了解决许多分子构型的理论分析和实验不符的矛盾,更好的解释分子的实际空间构型和稳定性,1931年由鲍林等人在价键理论的基础上提出了杂化轨道理论。
杂化轨道理论就是:在形成分子的过程中,由于原子间的相互影响,若干类型不同而能量相近的原子轨道相互混杂,sp3杂化重新组合成一组能量相等,成分相同的新轨道,这一过程称为杂化。
经过杂化而形成的新轨道叫做杂化轨道,杂化轨道与其他原子轨道重叠时形成σ共价键。
原子在形成分子的过程中,为了使所成化学键强度更大,更有利于体系能量的降低,总趋向于将原来的原子轨道进一步线性组合,以形成新的原子轨道。
编辑本段价键理论的论证价键理论对共价键的本质和特点做了有力的论证,但它把讨论的基础放在共用一对电子形成一个共价键上,在解释许多分子、原子的价键数目及分子空间结构时却遇到了困难。
例如C原子的价电子是2s22p2,按电子排布规律,2个s电子是已配对的,只有2个p电子未成对,而许多含碳化合物中C都呈4价而不是2价,可以设想有1个s电子激发到p轨道去了。
那么1个s轨道和3个p轨道都有不成对电子,可以形成4个共价键,但s和p的成键方向和能量应该是不同的。
而实验证明:CH4分子中,4个C-H共价键是完全等同的,键长为114pm,键角为109°28'。
BCl3,BeCl2,PCl3等许多分子也都有类似的情况。
为了解释这些矛盾,1928年鲍林(Pauling)提出了杂化轨道概念[1],丰富和发展了的价键理论。
他根据量子力学的观点提出:在同一个原子中,能量相近的不同类型的几个原子轨道在成键时,可以互相叠加重组,成为相同数目、能量相等的新轨道,这种新轨道叫杂化轨道。