单核细胞的分离
- 格式:pdf
- 大小:232.75 KB
- 文档页数:24

人外周血单个核细胞的采集、分离和保存标准全文共四篇示例,供读者参考第一篇示例:人外周血单个核细胞(Peripheral Blood Mononuclear Cells, PBMCs)的采集、分离和保存是在医学研究和临床诊断中非常重要的步骤。
PBMCs是一类具有免疫功能的细胞,包括淋巴细胞、单核细胞和浆细胞,能够在机体的免疫应答中发挥重要作用。
为了保证试验结果的准确性和可靠性,对PBMCs的采集、分离和保存必须按照相应的标准进行操作。
一、采集1. 选择合适的采集方法:一般常用的采集方法包括静脉抽血和手指取血等,静脉抽血常用于采集较多血液量的情况,手指取血则适用于采集少量血液的情况。
2. 确保采集操作标准化:在采集PBMCs的过程中,应该遵守严格的消毒和无菌操作规程,以防止细菌和病毒的污染。
3. 采集完整的血液样本:为了确保PBMCs的纯度和稳定性,应该尽量避免气泡和血细胞破损导致的RNA降解等情况。
二、分离1. 使用适当的分离方法:一般常用的PBMCs分离方法包括密度梯度离心和磁珠分选等,密度梯度离心适用于分离较大量的PBMCs,磁珠分选则适用于分离特定类型的细胞。
2. 选择合适的分离液:密度梯度离心中一般使用的分离液包括Ficoll和Percoll等,磁珠分选中则需要选择特定的磁珠标记物。
3. 保证分离效率和纯度:在PBMCs的分离过程中,应该确保细胞的分离效率和纯度,避免细胞的损失和杂质的混入。
三、保存1. 选择合适的保存条件:PBMCs的保存条件包括温度、储存液和容器等要素,应该选择适合PBMCs存活的条件进行保存。
2. 快速冻存PBMCs:为了避免细胞的降解和失活,应该在采集和分离PBMCs后尽快将其冻存。
3. 定期监测保存效果:在存储PBMCs的过程中,应该定期监测PBMCs的存活率和纯度,以确保PBMCs的质量和稳定性。
对于人外周血单个核细胞的采集、分离和保存,在操作的过程中应该严格按照相应的标准进行,以确保PBMCs的质量和稳定性,为后续的研究和临床应用提供可靠的基础。

分离单个核细胞的临床意义单个核细胞是一类白细胞,也被称为单核细胞或巨噬细胞。
它们起着免疫反应和炎症调节的重要作用。
单个核细胞的数量和活性可以在不同的疾病状态下发生变化,因此临床上对单个核细胞的观察和分离具有重要的诊断和治疗意义。
本文将探讨单个核细胞的临床意义,并讨论其在不同疾病中的作用和应用。
1.免疫系统疾病:单个核细胞可以产生和释放多种细胞因子,如肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)和白介素-6(IL-6),这些细胞因子能够调节免疫反应和炎症过程。
在炎症性肠病、类风湿关节炎和支气管哮喘等疾病中,单个核细胞的数量和活性明显增加。
因此,观察和分离单个核细胞可以帮助评估免疫系统的功能状态,指导治疗方案的选择和调整。
2.感染性疾病:在感染过程中,单个核细胞发挥着重要的作用。
它们能够捕获和摧毁细菌、病毒和真菌等病原体,并激活免疫反应以阻止病原体的进一步传播。
单个核细胞的数量和功能的改变可以反映感染的严重程度和预后。
通过观察和分离单个核细胞,可以评估感染的类型、严重程度和抗菌治疗的效果,从而及时调整治疗方案。
3.自身免疫性疾病:自身免疫性疾病是由免疫系统错误地攻击和破坏自身组织而引起的疾病。
单个核细胞在这些疾病的发病机制中起着重要的作用。
它们能够识别和清除自身免疫反应中的异常细胞,并减少炎症反应。
在类风湿关节炎、系统性红斑狼疮和硬皮病等自身免疫性疾病中,单个核细胞的数量和活性明显改变。
通过观察和分离单个核细胞,可以帮助评估疾病的活动程度和预后,并指导治疗策略的选择。
4.肿瘤:单个核细胞在肿瘤的发生和发展中发挥着复杂的作用。
在早期肿瘤中,单个核细胞可以通过清除异常细胞和抑制肿瘤细胞的生长来抑制肿瘤的发展。
然而,在晚期肿瘤中,单个核细胞可以通过产生抗炎因子和抗肿瘤因子来促进肿瘤的生长和转移。
观察和分离单个核细胞可以帮助评估肿瘤的免疫状态和预后,并为肿瘤免疫治疗提供指导。
综上所述,单个核细胞在临床上具有重要的诊断和治疗意义。

外周血单个核细胞的分离及其寿命外周血单个核细胞的分离(Separation of mononuclear cell in peripheral blood)外周血单个核细胞外周血单个核细胞(Peripheral blood mononuclear cell,PBMC)即外周血中具有单个核的细胞,包括淋巴细胞和单核细胞。
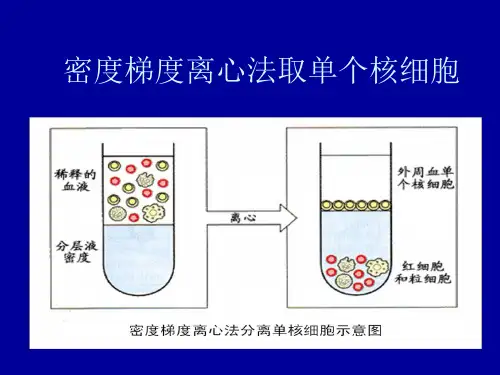
体外检测淋巴细胞首先要分离外周血单个核细胞,目前主要的分离方法是Ficoll-hypaque(葡聚糖-泛影葡胺)密度梯度离心法,因为血液中各有形成分的比重存在差异,因此得以分离。
红细胞和粒细胞密度大于分层液,同时因红细胞遇到Ficoll而凝集成串钱状而沉积于管底。
血小板则因密度小而悬浮于血浆中,唯有与分层液密度相当的单个核细胞密集在血浆层和分层液的界面中,呈白膜状,吸取该层细胞递经洗涤高心重悬。
本法分离单个核细胞纯度可达95%,淋巴细胞约占90%~95%,细胞获得率可达80%以上,其高低与室温有关,超过25℃时会影响细胞获得率。
分类表:血细胞寿命1、红细胞-携带氧的“运输兵”红细胞是血细胞中最多的细胞,内含血红蛋白,它能把人体从肺部吸入的氧气结合后,通过备注徨再释放给各组织,因此被称为携带氧气的“运输兵”。
红细胞的平均寿命为120天,每天均有细胞衰老、死亡、也就是说,每天约有20亿个红细胞死亡。
2、白细胞—人体健康的“卫士”白细胞能吞噬进入人体的细菌和病毒以及代谢产生的对人体有害的“异物”,白细胞还有免疫功能。
白细胞的平均寿命很短,约7-14天。
粒细胞在骨髓内经10天左右释放入血液,在血液不到1天然后溢出血管进入组织或体腔内。
在组织或体腔内可以行使防御功能2-3天。
素爱老的粒细胞被单核-巨噬细胞系统清除,也有一部分从口腔、气管、消化道和泌尿生殖道排出。
淋巴细胞:B淋巴细胞寿命较短,一般3-4天,景观抗原刺激后分化为浆细胞,产生特异性抗体,参与体液免疫。
T淋巴细胞寿命较长,可达数月,甚至数年,经抗原致敏后,可产生多种免疫活性物质,参与细胞免疫。

外周血单个核细胞分离实验报告一、实验目的本实验旨在通过外周血单个核细胞分离实验,掌握外周血单个核细胞的分离方法及相关技术。
二、实验原理外周血单个核细胞分离是利用密度梯度离心法,将外周血中的淋巴细胞、单核细胞和粒细胞分离出来。
具体步骤如下:1. 取外周血3ml,加入等体积的PBS缓冲液中,轻轻混合后放入无菌离心管中。
2. 将无菌离心管放入冰箱中静置30min。
3. 从冰箱取出后,将上清液吸取出来丢弃。
留下沉淀物。
4. 加入等体积的PBS缓冲液,轻轻混合后放入无菌离心管中。
5. 将无菌离心管放入密度梯度离心管中进行离心。
由于不同种类细胞密度不同,在经过密度梯度离心后会形成不同层次的沉淀物。
6. 取出沉淀物最上层液体,即为单个核细胞。
三、实验步骤1. 取外周血3ml,加入等体积的PBS缓冲液中,轻轻混合后放入无菌离心管中。
2. 将无菌离心管放入冰箱中静置30min。
3. 从冰箱取出后,将上清液吸取出来丢弃。
留下沉淀物。
4. 加入等体积的PBS缓冲液,轻轻混合后放入无菌离心管中。
5. 将无菌离心管放入密度梯度离心管中进行离心。
离心条件为2000rpm,20min。
6. 取出沉淀物最上层液体,即为单个核细胞。
四、实验结果经过实验操作后,得到了外周血单个核细胞。
观察镜下可见细胞形态完整、染色质均匀分布、核仁清晰。
五、实验注意事项1. 实验前应认真阅读操作步骤和注意事项,并做好充分准备工作。
2. 操作过程中应保持无菌操作环境,并使用消毒好的器材和试剂。
3. 离心时应注意转速和时间的控制,以避免对细胞造成不必要的损伤。
4. 实验结束后应及时清理实验台和器材,并妥善处理实验废弃物。
六、实验总结本实验通过密度梯度离心法,成功地将外周血中的淋巴细胞、单核细胞和粒细胞分离出来,得到了单个核细胞。
在操作过程中,需要注意无菌操作环境和离心条件的控制。
通过本次实验,我们掌握了外周血单个核细胞的分离方法及相关技术,为后续的研究提供了基础。

单细胞测序的细胞核分离和纯化方法单细胞测序是一种研究细胞生物学的重要技术,它能够揭示单个细胞在基因表达和功能方面的异质性。
在进行单细胞测序之前,对细胞核进行有效的分离和纯化是至关重要的。
本文将详细介绍单细胞测序中细胞核的分离和纯化方法。
一、细胞核分离方法1.酶解法:酶解法是利用特定的酶分解细胞膜和细胞器,从而释放细胞核。
常用的酶有胰蛋白酶、胶原酶和分散酶等。
这种方法适用于原代细胞和传代细胞的核分离。
2.离心法:离心法是通过高速离心将细胞核与其他细胞组分分离。
根据离心力的不同,可以将细胞核与其他细胞组分分开。
此方法操作简便,适用于各种类型的细胞。
3.过滤法:过滤法是将细胞悬液通过特定孔径的滤器,使细胞核被截留在滤器上,而其他细胞组分通过滤器。
这种方法适用于较大细胞的核分离。
二、细胞核纯化方法1.核酸染料染色法:利用核酸染料(如碘化丙啶)对细胞核进行染色,使细胞核显色,从而与其他细胞组分区分。
此方法操作简单,但纯度较低。
2.免疫磁珠法:利用特异性抗体与细胞核表面抗原结合,然后通过磁珠分离技术将细胞核与其他细胞组分分离。
此方法纯度较高,但操作复杂。
3.柱层析法:柱层析法是将细胞悬液通过特定柱子,利用柱子上吸附的分子与细胞核结合,从而将细胞核与其他细胞组分分离。
此方法纯度较高,操作相对简单。
综上所述,单细胞测序中的细胞核分离和纯化方法有多种,不同的方法适用于不同类型的细胞。
在实际应用中,需要根据实验目的和细胞特性选择合适的分离和纯化方法。
同时,为了获得高质量的单细胞测序结果,还需注意实验操作的严谨性和数据分析的准确性。

单核细胞是从血液中分离出来的,具体步骤如下:
1.采集5-7ml抗凝全血,注入无菌试管。
轻轻混匀后,以3000r/min离心
10分钟。
2.吸取约1.5ml红细胞层至另一无菌试管(避免含有血小板)。
3.将上一步所得的混合物再次以3000r/min离心10分钟。
4.弃去上清液,留下白色沉淀。
其中包含有白细胞、单核细胞和未成熟的多能干
细胞。
5.用无菌吸管或注射器将白色沉淀中的细胞分离出来。
6.将获得的单个核细胞计数并计算出每个样本中的细胞数量。
需要注意的是,单核细胞的提取需要严格遵守无菌操作规程,确保所有步骤都是在无菌环境下进行。
此外,由于单核细胞在体内的含量相对较少,因此需要使用高纯度的方法来获得足够数量的细胞用于实验和分析。

外周血单个核细胞分离方法外周血单个核细胞(Peripheral blood mononuclear cells,PBMCs)是一类重要的免疫细胞,包括淋巴细胞、单核细胞和自然杀伤细胞等。
它们在免疫反应、炎症、感染和肿瘤等过程中起着重要作用。
因此,从外周血中分离出单个核细胞对于许多研究项目非常重要。
本文将介绍几种常用的外周血PBMCs分离方法,并详细描述它们的步骤和应用。
方法一:梯度离心梯度离心是最常用的PBMCs分离方法之一、它利用了外周血中不同细胞的密度差异,通过离心使PBMCs在浓度梯度上进行分离。
以下是具体步骤:1.收集外周血样本,将其加入离心管中。
2. 向离心管中缓慢加入等体积的稀释液,常用的等体积稀释液有Ficoll-Paque、Lymphoprep等。
3. 将稀释液中的血液离心,离心速度和时间根据样品的要求而定。
一般来说,1200rpm离心10分钟即可。
4.离心过程中,PBMCs会沉积在离心管的界面上,分离出上清液。
5.使用移液器或玻璃毛细管,将上清液移至新的离心管中。
6.向新的离心管中加入如PBS等缓冲液,使细胞沉淀。
7.用离心将细胞沉淀下来,并去除上清液。
8.向细胞沉淀中加入培养基,使其重悬。
这种方法的优点是简单、快速,可以同时分离出不同类型的免疫细胞。
缺点是离心的条件需要根据具体实验要求进行调整,有些细胞如自然杀伤细胞可能会受到损伤。
方法二:抗凝血液管离心另一种常用的PBMCs分离方法是使用抗凝血液管。
以下是具体步骤:1.收集外周血样本,将其加入含有抗凝剂的抗凝血液管中,常用的抗凝剂有EDTA、肝素等。
2.轻轻颠倒血液管使血液与抗凝剂充分混合。
3.将血液离心,离心速度和时间根据样品的要求而定。
4.离心过程中,PBMCs会沉积在离心管的底部,分离出上清液。
5.使用移液器或玻璃毛细管,将上清液移至新的离心管中。
6.向新的离心管中加入如PBS等缓冲液,使细胞沉淀。
7.用离心将细胞沉淀下来,并去除上清液。

外周血单个核细胞的分离注意事项外周血单个核细胞(Peripheral Blood Mononuclear Cells, PBMCs)是常见的实验材料,在许多免疫学、细胞生物学等实验中扮演着重要的角色。
然而,PBMCs分离过程中存在许多注意事项。
本文将从实验前准备、样本处理及分离步骤中列举几点需要注意的事项。
1. 实验前准备安全标准PBMCs的分离涉及血液样本采集和处理,需要保证操作人员的安全,防止血液污染。
为此,实验前需要使用防护手套、口罩、护目镜等器材,并制定相关血液样本处理的实验室安全操作规范。
试剂采购PBMCs分离需要许多慢速离心管、离心机、PBS等试剂,需要提前预置备足够的试剂和设备。
2. 样本处理血液处理PBMCs分离需要血液样本。
在血样提取过程中需要注意消毒操作,以及遵循血样相关的法律法规,根据实验需要动物实验和人类样本需要进行严格的伦理、道德审查手续。
推迟凝固血液采样后需要将血液样本尽快抽入慢速离心管中,加入分离液等样品处理操作。
尽可能的避免血液凝固、变质,以保证分离的单核细胞数量和质量。
3. 分离步骤慢速离心PBMCs分离需要慢速离心。
慢速离心的转速和时间是影响分离效果的重要因素。
理论上,慢速离心时间越长,分离效果越好,但是过长的离心时间会影响细胞的活性。
合适的离心强度和离心时间是需要事先确定的。
分离液制备PBMCs分离的关键是分离液制备。
分离液的配方、pH值、浓度等是影响单核细胞分离效果的关键因素。
不同样本需要不同的分离液组合。
为了保证分离效果,同时避免细胞受损,可以在实验前进行样品处理的优化。
总结本文总结了外周血单个核细胞分离的注意事项,包括试剂的准备、血样的处理、慢速离心的参数控制、分离液的配方等。
在实验前,科研人员应制定严格的安全检查标准,并确保实验操作人员的安全、细胞处理质量与数量的稳定。

单核细胞分离方法将用等体积生理盐水稀释的抗凝血,加入塑料离心管中的Ficoll Hypaque分离液表面,以450 g离心25min收集单个核细胞,用10 小牛血清的RPMI一1640培养液悬浮细胞,置于6x 6 cm 玻璃培养皿中,在5 %CO2 、37℃下孵育2 h,收集贴壁的单核细胞。
用0.2乳白蛋白的RPMI-1 640培养液悬浮单核细胞,Wright 染色计数单核细胞>95%,调整细胞密度为4×10/ml。
将细胞悬液加入24孔培养板中,在5 %CO2,37℃下培养24 h,离心收集上清液,冻存于一70℃冰箱中备用。
细胞培养前后台盼蓝染色法测定细胞存活率。
细胞分离中需要注意的几个问题1.如果您要做细胞培养,记住实验中所用的试剂(分离液,洗涤液等)、器械等都要是无菌消毒的,并注意实验中的无菌操作。
2. 离心转速单位及时间:目前国外的文献报道基本上用g为单位,注意g和转速(r pm)的换算。
3.离心温度:有的要求室温,有的要求4摄氏度。
实验的操作要求尽可能熟练,连贯。
4.在用Ficoll分离单个核细胞(PBMC)时,通常含有少量的红细胞,对于一般的实验影响不大,如果实验要求较高,可采取裂解液(有的需要无菌),并注意裂解时间控制,以免影响单个核细胞的活性。
5. 在用Percoll配不连续梯度时(一般用高渗NaCl),注意各成份体积的准确性,否则密度与预期的不一样,影响分离效果。
6.用全血离心效果比全血稀释后再离心效果差,稀释一般等体积稀释一倍。
7.分离液与样本的体积比:一般应小于1:2(即一般为1体积分离液,2体积样本,不宜超过2体积,小于2体积均可)8.洗涤液的成分:不同文献报道不一,有的使用PBS,有的为Hank’s,KRP等,可自己选定。
主要是离子浓度及成份的不同,有的含有Mg2+,Ca2+。
9. 细胞活性:0.2%台盼蓝染色3-5分钟,镜下观察计数死亡细胞(蓝染)。
中性粒细胞分离的方法1、标准方法:Ficoll-泛影钠(Ficoll-Hypaque)密度梯度及红细胞裂解法1)取一50ml聚乙烯管,无菌采集人外周静脉血,加4.4ml3.8%或5%的柠檬酸盐液定容至40ml。

实验预备一.人外周血单核细胞分离1.抗凝血的预离心别离取正常人新鲜抗凝全血A: 20 mL于50 mL离心管中,以2 000 r /min离心20 min,吸弃上层血浆,取得基层沉淀细胞约10~mL。
2.沉淀细胞的稀释与离心分离在所获取沉淀A 中的细胞中加入Hank′s液( 不含Ca2+、Mg2+, pH ~体积比仍未1:1,混匀,制成细胞悬液。
B: 无菌抗凝血与Hank′s液或PBS以1:1体积在试管中混匀。
另取一离心管,加入LTS1077淋巴细胞分层液,然后用毛细吸管距分层液上1cm处将细胞悬液警惕而缓慢地加于其上面,使稀释血液重叠于分层液上。
现在稀释后的细胞悬液分离液淋巴细胞体积为:1:1。
与用水平离心机以2000 r /min 离心20min,离心终止后,掏出离心管,可见管中液体已经分层。
管内可见分为4层:最上层是血浆,含部份血小板:第二层为薄薄的白膜层,要紧台单个核细胞,还混杂有少量血小板;第三层为分离液层;第四层为粒细胞及红细胞,红细胞沉于管底,而粒细胞那么紧贴在压积红细胞上呈一层很薄的白膜(图21—3):3.单个核细胞的提取、洗涤与悬浮、贴壁吸去最上层的血浆,搜集血浆层和淋巴细胞分离液交壤面的单个核细胞,尽可能全数吸出PBMC。
加3~4倍以上体积Hanks或PBS液于所得的单个核细胞中,用毛细吸管轻轻吹判均匀,幸免产小气泡,液柱高度不超过离心管的2/3。
混匀后离心1500r/min离心10min,低速离心有利于去除细胞悬液中留存的血小板,去上清液。
注意:还能够先用吸管把雾状层上面的液体吸走,注意不要碰着雾状层,然后在把要的部份慢慢吸出来。
第二种方式,比较简单一些。
再用一样洗涤液洗涤细胞2次,1500r/min离心10min,洗去残留的淋巴细胞分离液。
再以RPMI-1640 培育基离心洗涤1次,吸尽上清,以充分去除血小板等杂质。
按每毫升血液标本加mL含20%小牛血清的Hank′s液( 或含10%胎牛血清及25 mmol /L hepas的RPMI-1640液3~4 mL) 从头混悬细胞37℃、5% CO2孵育箱中培育2 ~3 h后去除上清,取得贴壁的单核细胞。
单核细胞分离方法嘿,你知道吗?单核细胞那可是身体里的小卫士呢!那怎么把它们分离出来呢?这就好比在一堆宝藏里找出最闪亮的那颗宝石。
首先说说分离单核细胞的步骤吧。
第一步,采集血液样本,这就像是开启一场神秘的探险,从身体这个大宝库中取出关键的线索。
把血液收集到合适的容器中,一定要小心操作,可不能让这珍贵的样本受到污染哦!第二步,进行密度梯度离心。
这就如同在一个大旋转木马上,不同密度的东西会被分到不同的位置。
通过特定的离心力,让血液中的各种成分根据密度分层。
单核细胞就在其中一层等待着被发现呢。
第三步,收集含有单核细胞的那一层。
哇,这感觉就像在一堆沙子里找到了那颗闪闪发光的金子,超有成就感的!在这个过程中有啥注意事项呢?那可不少呢!采集血液的时候,一定要确保无菌操作,不然就像在干净的花园里突然闯进了一群捣乱的小怪兽,会把整个实验搞砸。
离心的时候,速度和时间都得把握好,稍有差错,就可能让单核细胞迷失方向。
还有,使用的试剂也得是高质量的,不然就像给战士配上了劣质的武器,怎么能打胜仗呢?那这个过程安全吗?稳定性咋样呢?放心吧!只要严格按照步骤操作,就像走在一条稳稳当当的大路上,安全得很呢。
而且这个方法经过了无数次的验证,就像一个久经沙场的老将,可靠性极高。
只要不出现意外情况,比如突然停电或者操作失误,分离过程是非常稳定的。
单核细胞分离出来有啥用呢?应用场景那可多了去了。
在医学研究中,研究人员可以通过分析单核细胞来了解疾病的发生机制,这就好比是侦探在寻找案件的线索,为攻克疾病提供重要的依据。
在临床治疗中,有时候需要提取患者的单核细胞进行特殊处理后再回输到体内,增强患者的免疫力,哇,这简直就是给身体派来了一支超级救援队。
它的优势也是杠杠的!分离出来的单核细胞纯度高,就像一颗纯净的钻石,没有杂质的干扰。
而且操作相对简单,不需要特别复杂的设备,就像用一把普通的钥匙就能打开一扇神秘的大门。
来个实际案例吧!有个研究团队在研究某种罕见病的时候,就通过分离单核细胞,发现了疾病的关键线索。
单核细胞的分离在外周血中,要分离到足够数量的单核细胞,通常不用比重为1.077的细胞分层液,因为单核细胞的比重与淋巴细胞近似,且含量仅为3%-8%,故很难将两者分开。
而如用黏附法,则黏附细胞的剥离较难控制,剥离过度易造成细胞损伤,剥离不全使细胞回收率下降。
以下介绍的两种方法可获得量多且纯度和活力都较好的单核细胞。
(一)Colotta方法【实验原理】见Percoll 非连续密度梯度分离法。
【主要试剂与器材】(1)人外周血分离的PBMC悬液。
(2) HBSS(无Ca2+ 、Mg2+),含10% FCS和 25mmol/L HEPES的RPMI-1640 (pH7.2)。
(3) 46%浓度的Percoll。
【操作步骤】(1)将分离获得的PBMC用HBSS洗涤2次(1000rpm,5min),加5ml完全培养液重悬。
(2)将细胞悬液缓慢叠加在5ml的46% Percoll上,室温离心(2200rpm,20min或400g,25min);得到3个带:第一带为富集的单核细胞(83%);第二带含少量的单核细胞;第三带则为淋巴细胞。
(3)收集第一、第二带的细胞,经洗涤后,重悬于培养液中。
【注意事项】将细胞悬液叠加在Percoll分离液上时,应缓缓加入,保证二者间的比重界间不被破坏,否则影响分离效果。
(二)密度梯度离心法【主要试剂与器材】(1)肝素抗凝血。
(2)不同比重的聚蔗糖-泛影葡胺细胞分层液:A液:90g/L聚蔗糖15ml,加500g/L泛影葡胺10ml (比重为1.14)。
B液:90g/L聚蔗糖17.5ml,加500g/L泛影葡胺10ml (比重为1.13)。
C液:90g/L聚蔗糖20ml,加500g/L泛影葡胺10ml (比重为1.12)。
D液:90g/L聚蔗糖24ml,加500g/L泛影葡胺10ml (比重为1.08)。
【操作步骤】(1)在15ml离心管内依次加入A液、B液、C液和D液各2ml,制成梯度。
实验二十四外周血单个核细胞的分离(Separation of mononuclear cell in peripheral blood)免疫细胞是一组不均一的细胞群体,它包括T、B淋巴细胞、NK细胞、单核细胞/巨噬细胞以及粒细胞等,这些细胞的生物学特性,如细胞的大小、密度、表面电荷、黏附能力以及细胞表面的分子标志等均存在差异,借助这些差异可区分不同的细胞类别。
外周血单个核细胞(PBMC)的分离主要有两种方法,即聚蔗糖-泛影葡胺(Ficoll-Hypaque)分离法和聚乙烯吡咯烷酮硅胶(Percoll)分离法。
此处只介绍聚蔗糖-泛影葡胺分离法。
【实验原理】血液中单个核细胞的分离常采用密度梯度离心法。
市售淋巴细胞分离液是由聚蔗糖(Ficoll)和泛影葡胺(Hypaque) 按一定比例混合制成,20℃密度为1.077±0.001,单个核细胞包括淋巴细胞和单核细胞,其密度为1.050~1.077,而粒细胞和红细胞的密度为1.080~1.110。
将待分离的细胞悬液小心铺于淋巴细胞分离液上,经离心后单个核细胞悬浮于分离液上层界面,而红细胞与粒细胞沉于管底。
【主要试剂和器材】1.聚蔗糖-泛影葡胺分层液密度为1.077±0.001。
2.5g/L台盼蓝。
3.250U/ml肝素溶液用Hank,s液配制。
4.Hank,s液。
5.注射器、刻度离心管、吸管、滴管、血细胞计数板、载玻片、盖玻片。
6.水平离心机、显微镜。
【操作方法】1.抽取静脉血2ml,注入含有0.2ml肝素溶液的无菌试管中摇匀,作白细胞计数和分类计数。
再加入等量Hank,s液混匀。
2.取2ml分层液置于离心管中,将稀释血液沿管壁缓缓叠加于分层液上,形成清晰界面。
稀释血液与分层液的容积比例以2∶1~3∶1为宜。
3.置水平离心机中,2000r/min离心20min。
4.离心后从离心管的底部到液面分为四层,依次为红细胞和粒细胞层、分层液层、单个核细胞层、血浆层(含血小板和破碎细胞)。
实验1 密度梯度离心法分离血液单个核细胞姓名:李思露学号:131140040一、实验原理外周血细胞由密度不同的红细胞、粒细胞、单核细胞、淋巴细胞、血小板等组成。
对人血液来讲,其中红细胞密度最大,为 1.09~1.11g/L;粒细胞密度次之,为1.080~1.092g/L;单核细胞、淋巴细胞及NK细胞密度相近,为1.050~1.077g/L;血小板密度最小,只有1.030~1.060g/L;将其中的单核细胞、淋巴细胞、NK细胞等统称为外周血单个核细胞(Peripheral blood mononuclear cell, PBMC)。
当将稀释的抗凝血叠加于适宜密度(与单个核细胞密度相近)的淋巴细胞分离液之上,经适当的离心力离心一段时间后,不同种类细胞因密度而分布于离心管的不同位置,红细胞和粒细胞密度大于分层液,沉积于管底;血小板则因密度小而悬浮在血浆中;其中与分层液密度相当的单个核细胞分布在血浆层和分层液之间的界面。
二、实验材料、试剂及器材1.材料肝素抗凝鸡血:先给注射器中吸入0.1mL 180IU/mL肝素钠溶液,鸡翅下静脉采血5mL。
肝素抗凝绵羊血。
2.试剂(1)肝素钠溶液:用生理盐水配成180IU/mL。
(2)D-Hanks液。
(3)人淋巴细胞分离液:市售。
20℃时密度应为(1.077±0.001)g/L。
3.仪器和用具10mL低速离心机、托盘天平、一次性塑料注射器、10mL离心管、胶头滴管、40mL 小烧杯等。
三、实验操作(1)稀释血液:用D-Hanks液按1:1稀释抗凝血。
(2)加样:先在10 mL离心管中加入2 mL鸡血淋巴细胞分离液,再沿管壁在距分层液界面上1 cm处缓慢加入2 mL稀释血。
应注意保持两者界面清晰,勿使血液混入分层液内。
(3)离心:2000 r/min离心20 min。
(4)肉眼观察分离效果。
(5)收集PBMC:用胶头吸管轻轻插入灰白色层,沿管壁轻轻吸出PBMC,转入另一离心管。
小鼠外周血单个核细胞分离、纯化①徐太哲1,李丽2,王长山2(1.佳木斯市红十字医院,黑龙江佳木斯154003;2.佳木斯大学,黑龙江佳木斯154007)摘要:目的:探讨小鼠外周血单个核细胞(PBMC)最佳分离条件,提高细胞获得率与纯度,以便后续分子生物学实验。
方法:小鼠摘除眼球取血,设置离心力、离心时间、实验环境温度等梯度优化,分别采用EDTA-K2、肝素、枸橼酸钠抗凝,Ficoll 密度梯度离心法分离单个核细胞,直接进行贴壁培养和分析获得率、纯度,计数存活率。
结果:Ficoll密度梯度离心法经条件优化后分离的PBMC纯度可达85%,细胞获得率最高可达80%以上,活细胞百分率在92%以上。
结论:Ficoll密度梯度离心法在优化条件下可有效地分离PBMC,对后续分子生物学实验无影响。
关键词:小鼠;Ficoll密度梯度离心;PBMC中图分类号:R446.11+3文献标识码:A文章编号:1008-0104(2016)04-0010-02外周血单个核细胞(Peripheral blood mononucle-ar cells,PBMCs)包括淋巴细胞和单核细胞。
是免疫系统的重要组成,是研究免疫老化和衰老的主要依据。
研究T、B淋巴细胞首要分离外周血单个核细胞,主要的分离方法是Ficoll-hypaque密度梯度离心法,因血液中各组成成分的沉降系数存在差异,而得以分离[1]。
离心后,单个核细胞因与分离液密度相当,集中在血浆层和分层液的界面上,呈白雾层,吸取该层细胞经洗涤离心即获得PBMC。
PBMC分离是分子生物学试验常用的技术,其效果直接影响PCR等后续试验结果。
实验对象小鼠因体重小,体内血液量少,Ficoll密度梯度离心法正适用这样少量血液的分离,本文探讨小鼠外周血单个核细胞的分离最佳条件。
1材料和方法1.1材料与分组BALB/c小鼠18只,5 6月龄,体重23 25g,雌雄不限;小鼠外周血单核细胞分离液试剂(天津市灏洋生物制品科技有限责任公司)。
单核细胞分选指标
单核细胞分选指标是指用于分离和纯化单核细胞的方法和技术。
常用的单核细胞分选指标包括外周血单核细胞分选系统(Peripheral Blood Mononuclear Cell Sorter,PBMC-Sort)、流式细胞术(Flow Cytometry)、磁珠分选法(Magnetic Beads)等。
外周血单核细胞分选系统是一种常用的单核细胞分选方法,其基本原理是利用单核细胞表面的CD16受体与外周血中的抗CD16单克隆抗体结合,使其与外周血中的单核细胞分离。
该方法具有操作简便、快速、灵敏度高等优点,适用于临床检测和科研研究。
流式细胞术是一种常用的单核细胞分选技术,其基本原理是利用流式细胞仪对单核细胞进行分选和检测。
该方法具有高度敏感性、特异性和准确性,适用于单核细胞的分选和检测。
磁珠分选法是一种利用磁性颗粒对单核细胞进行分选的方法。
该方法具有操作简便、快速、灵敏度高等优点,适用于单核细胞的分选和检测。
除了上述分选方法,还有其他一些单核细胞分选技术,如单细胞凝胶电泳(Single Cell Gel Electrophoresis,SCGE)、单细胞RNA测序(Single Cell RNA Sequencing,scRNA-seq)等。
这些技术各有优缺点,可根据实际需要选择使用。