药物中常见残留溶剂及限度
- 格式:pdf
- 大小:45.07 KB
- 文档页数:1

ICH常用有机溶剂分类及残留限度国际药品管理机构ICH(International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use)在药品的质量控制方面,制定了一系列规定。
其中,ICH Q3C Guideline for Residual Solvents是针对制药过程中可能存在的残留有机溶剂进行限制和规定的。
该指南中将有机溶剂分为三类:类1、类2和类3。
本文将详细介绍ICH常用的有机溶剂分类及其残留限度。
类1有机溶剂类1有机溶剂是指在制药工业中使用频率最高、风险最低的有机溶剂。
这类有机溶剂在制药过程中的使用应该越少越好,但即使在非常规制造情况下,其残留量也应该受到限制。
以下是ICH对类1有机溶剂的限制:有机溶剂残留限度(mg/每日剂量单位)苯 2甲苯50二氯甲烷601,2-二氯乙烷 41,1,1-三氯乙烷0.61,1-二氯乙烷 61,1,2-三氯乙烷 11,1,2,2-四氯乙烷0.62-氯乙酸乙酯2002-乙醇5000甲醇3000丙酮300乙酸丁酯300乙酸乙酯900甲醛30N,N-二甲基甲酰胺390乙酸乙酰胺600乙醇5000类2有机溶剂类2有机溶剂与类1有机溶剂相比,使用的风险略高一些。
类2有机溶剂的使用应该尽量避免,但如果使用,其残留也应该受到限制。
以下是ICH对类2有机溶剂的限制:有机溶剂残留限度(mg/每日剂量单位)丁酮0.81-丁醇802-丁醇50叔丁醇600溴丁烷 3正丁烷3000甲苯500乙苯420乙醇3000乙酸异丙酯500乙腈20二甲苯150二甲醚3000二氯乙烷 5甲酸甲酯 3甲酸乙酯300甘油正丁醚690甘油乙二醇正丁醚690甘油乙醚/环已醚840马来酸酐30甲酸300三氯乙烯 4类3有机溶剂类3有机溶剂的使用量和风险都比类1和类2更高。
这类有机溶剂在制药过程中必须严格控制,在常规制药过程中尽可能避免使用。
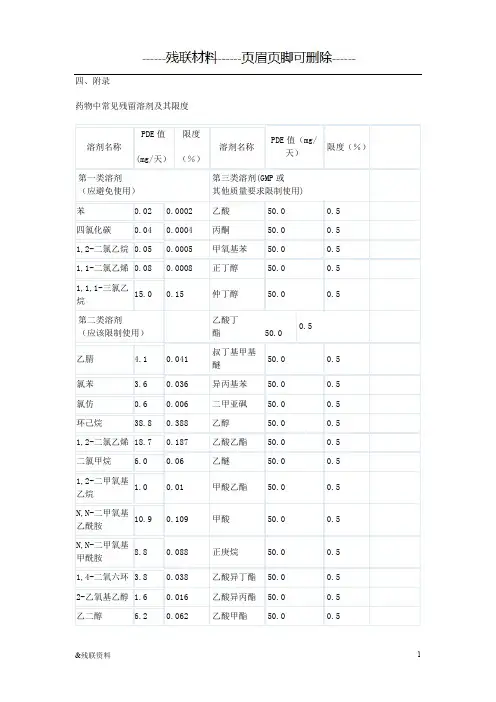
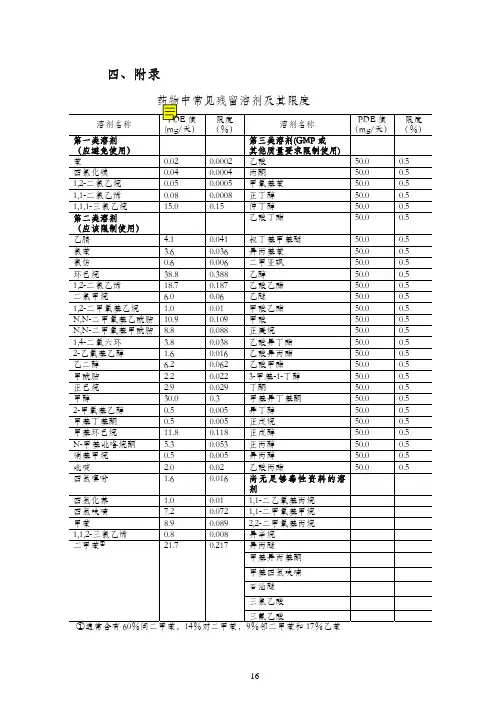
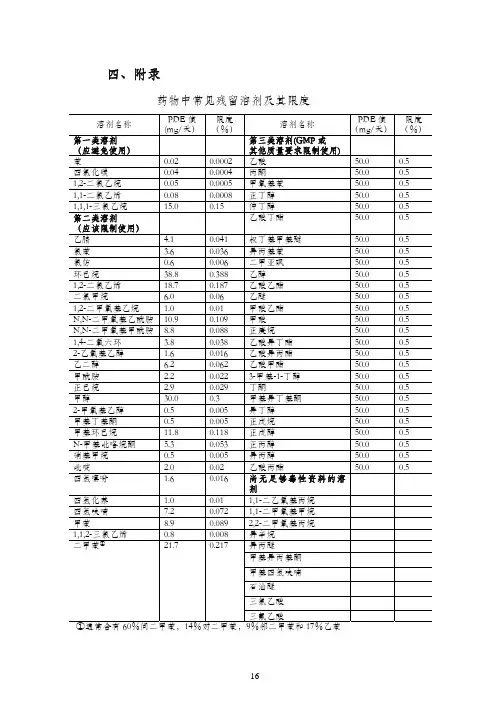
四、附录161、残留溶剂表示方法1.1允许日接触量允许日接触量(permitted daily exposure, PDE)是指某一有机溶剂被允许摄入而不产生毒性的日平均最大剂量,单位为mg/天。
某一具体有机溶剂的PDE值是由不产生反应量、体重调整系数、种属之间差异的系数、个体差异、短期接触急性毒性研究的可变系数等推算出的。
部分有机溶剂的PDE 值见附录。
由于国内目前尚未对此有系统的研究,附录中所列出的数据均是参考ICH残留溶剂研究指导原则中的数据。
1.2浓度限度在PDE 表示方法的基础上,为了更加便于计算,引入了浓度限度(%)表示方法,其计算公式为浓度限度(%)=PDE(mg/天)9 /(1000×剂量(g/天))×100%,其中剂量初步定为10g/天。
部分有机溶剂的浓度限度见附录。
1.3两种表示方法的比较以上两种表示方法在残留溶剂研究中均可行,但需要指出的是,PDE值是绝对值,也就是说无论原料药、辅料和制剂,只要能明确各成分的溶剂残留量,以PDE值来计算是很精确的;而对于某一具体制剂来说,由于很难确定处方中各活性成分和各辅料的残留溶剂水平,因此以浓度限度来计算更为简便,只要日摄入总量不超过10g,就无需进一步计算。
综合以上情况并考虑目前国内的实际情况,由于大多数药物的日摄入量不会超过10g(包括活性成分和辅料),浓度限度表示方式是目前更为简便可行的。
当然,在某些原料、辅料或制剂的残留溶剂不符合浓度限度时,可根据实际测定的各种残留溶剂量及用法用量计算实际日接触量,并与PDE值比较,如符合限量要求则也属可行。
此外,虽然本指导原则采用浓度限度的表示方式,但由于PDE 值的精确性,药物研发者可采用适当的PDE 值的方式进行残留溶剂研究。

医药中常用有机溶剂分类及残留限度医药中常用有机溶剂分类及残留限度药品的残留溶剂无治疗作用并可能对人体的健康和环境造成危害,本文对国际协调大会(ICH)制订的指导原则及各国执行情况作了较为详尽的介绍。
药品的残留溶剂,又称有机挥发性杂质,是指在活性药物成分、辅料和药品生产过程中使用和产生的有机挥发性化学物质。
药品还可被来自包装、运输、仓储中的有机溶剂污染。
药品生产商有责任确保终产品中的任何一种残留溶剂对人体无害。
各国药监部门曾使用不同的药品残留溶剂指导原则,为此国际组织展开了协调工作。
经相关程序讨论和审查后,国际协调大会的指导原则于1997年7月17日获得通过,被推荐至国际协调大会(ICH)的指导委员会采用。
该指导原则要求,如果某个药品的生产或纯化过程可导致溶剂残留,就应对这个药品进行检测,并且只检测生产过程或纯化中使用或产生的那种溶剂。
根据使用量的多少,可采用累加的方法计算药品中残留溶剂的量。
如果累加量低于或等于指导原则中的推荐量,则该药品无需进行残留溶剂检测;如果累加量高于推荐量,则必须对该药品进行残留溶剂检测。
该指导原则适用于颁布以后上市的所有剂型和给药途径,但不适用于在临床研究阶段使用的潜在新药和新辅料,也不适用于已上市的现有药物。
在某些情况如短期(小于30天)或局部应用下,视具体情况,溶剂的高残留量也可接受。
按照毒性大小和对环境的危害程度,该指导原则将溶剂分成三类(所列举的溶剂并不完全,应对合成和生产过程所有可能的残留溶剂进行评估):第一类溶剂是指已知可以致癌并被强烈怀疑对人和环境有害的溶剂。
在可能的情况下,应避免使用这类溶剂。
如果在生产治疗价值较大的药品时不可避免地使用了这类溶剂,除非能证明其合理性,残留量必须控制在规定的范围内,如:苯(2ppm)、四氯化碳(4ppm)、1,2-二氯乙烷(5ppm)、1,1-二氯乙烷(8ppm)、1,1,1-三氯乙烷(1500ppm)。
第二类溶剂是指无基因毒性但有动物致癌性的溶剂。
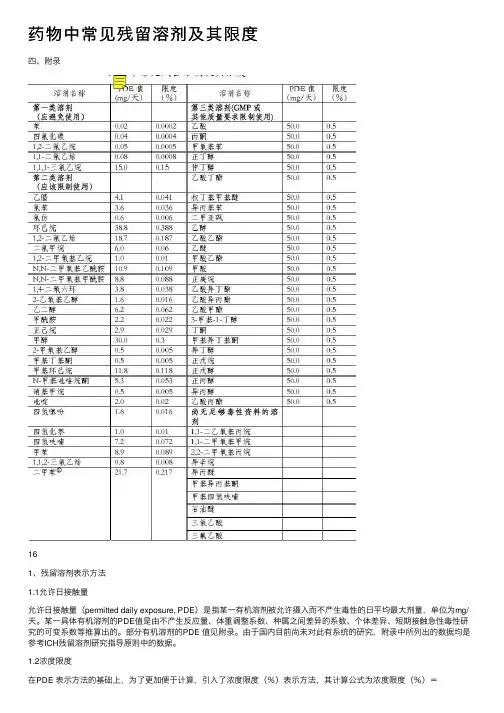
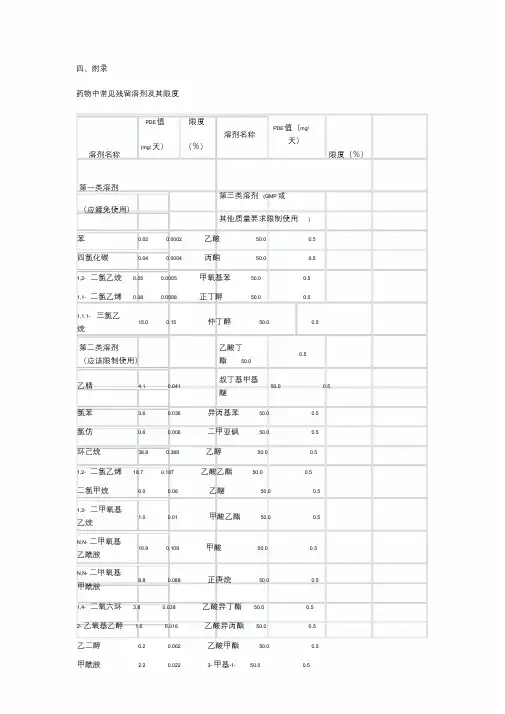
药物中常见残留溶剂及其限度四、附录161、残留溶剂表⽰⽅法1.1允许⽇接触量允许⽇接触量(permitted daily exposure, PDE)是指某⼀有机溶剂被允许摄⼊⽽不产⽣毒性的⽇平均最⼤剂量,单位为mg/天。
某⼀具体有机溶剂的PDE值是由不产⽣反应量、体重调整系数、种属之间差异的系数、个体差异、短期接触急性毒性研究的可变系数等推算出的。
部分有机溶剂的PDE 值见附录。
由于国内⽬前尚未对此有系统的研究,附录中所列出的数据均是参考ICH残留溶剂研究指导原则中的数据。
1.2浓度限度在PDE 表⽰⽅法的基础上,为了更加便于计算,引⼊了浓度限度(%)表⽰⽅法,其计算公式为浓度限度(%)=PDE(mg/天)9 /(1000×剂量(g/天))×100%,其中剂量初步定为10g/天。
部分有机溶剂的浓度限度见附录。
1.3两种表⽰⽅法的⽐较以上两种表⽰⽅法在残留溶剂研究中均可⾏,但需要指出的是,PDE值是绝对值,也就是说⽆论原料药、辅料和制剂,只要能明确各成分的溶剂残留量,以PDE值来计算是很精确的;⽽对于某⼀具体制剂来说,由于很难确定处⽅中各活性成分和各辅料的残留溶剂⽔平,因此以浓度限度来计算更为简便,只要⽇摄⼊总量不超过10g,就⽆需进⼀步计算。
综合以上情况并考虑⽬前国内的实际情况,由于⼤多数药物的⽇摄⼊量不会超过10g(包括活性成分和辅料),浓度限度表⽰⽅式是⽬前更为简便可⾏的。
当然,在某些原料、辅料或制剂的残留溶剂不符合浓度限度时,可根据实际测定的各种残留溶剂量及⽤法⽤量计算实际⽇接触量,并与PDE值⽐较,如符合限量要求则也属可⾏。
此外,虽然本指导原则采⽤浓度限度的表⽰⽅式,但由于PDE 值的精确性,药物研发者可采⽤适当的PDE 值的⽅式进⾏残留溶剂研究。

医药中常用有机溶剂分类及残留限度医药中常用有机溶剂分类及残留限度医药中常用有机溶剂分类及残留限度药品的残留溶剂无治疗作用并可能对人体的健康和环境造成危害,本文对国际协调大会(ICH)制订的指导原则及各国执行情况作了较为详尽的介绍。
药品的残留溶剂,又称有机挥发性杂质,是指在活性药物成分、辅料和药品生产过程中使用和产生的有机挥发性化学物质。
药品还可被来自包装、运输、仓储中的有机溶剂污染。
药品生产商有责任确保终产品中的任何一种残留溶剂对人体无害。
各国药监部门曾使用不同的药品残留溶剂指导原则,为此国际组织展开了协调工作。
经相关程序讨论和审查后,国际协调大会的指导原则于1997年7月17日获得通过,被推荐至国际协调大会(ICH)的指导委员会采用。
该指导原则要求,如果某个药品的生产或纯化过程可导致溶剂残留,就应对这个药品进行检测,并且只检测生产过程或纯化中使用或产生的那种溶剂。
根据使用量的多少,可采用累加的方法计算药品中残留溶剂的量。
如果累加量低于或等于指导原则中的推荐量,则该药品无需进行残留溶剂检测;如果累加量高于推荐量,则必须对该药品进行残留溶剂检测。
该指导原则适用于颁布以后上市的所有剂型和给药途径,但不适用于在临床研究阶段使用的潜在新药和新辅料,也不适用于已上市的现有药物。
在某些情况如短期(小于30天)或局部应用下,视具体情况,溶剂的高残留量也可接受。
按照毒性大小和对环境的危害程度,该指导原则将溶剂分成三类(所列举的溶剂并不完全,应对合成和生产过程所有可能的残留溶剂进行评估):第一类溶剂是指已知可以致癌并被强烈怀疑对人和环境有害的溶剂。
在可能的情况下,应避免使用这类溶剂。
如果在生产治疗价值较大的药品时不可避免地使用了这类溶剂,除非能证明其合理性,残留量必须控制在规定的范围内,如:苯(2ppm)、四氯化碳(4ppm)、1,2-二氯乙烷(5ppm)、1,1-二氯乙烷(8ppm)、1,1,1-三氯乙烷(1500ppm)。

医药中常用有机溶剂分类及残留限度医药中常用有机溶剂分类及残留限度药品的残留溶剂无治疗作用并可能对人体的健康和环境造成危害,本文对国际协调大会(ICH)制订的指导原则及各国执行情况作了较为详尽的介绍。
药品的残留溶剂,又称有机挥发性杂质,是指在活性药物成分、辅料和药品生产过程中使用和产生的有机挥发性化学物质。
药品还可被来自包装、运输、仓储中的有机溶剂污染。
药品生产商有责任确保终产品中的任何一种残留溶剂对人体无害。
各国药监部门曾使用不同的药品残留溶剂指导原则,为此国际组织展开了协调工作。
经相关程序讨论和审查后,国际协调大会的指导原则于1997年7月17日获得通过,被推荐至国际协调大会(ICH)的指导委员会采用。
该指导原则要求,如果某个药品的生产或纯化过程可导致溶剂残留,就应对这个药品进行检测,并且只检测生产过程或纯化中使用或产生的那种溶剂。
根据使用量的多少,可采用累加的方法计算药品中残留溶剂的量。
如果累加量低于或等于指导原则中的推荐量,则该药品无需进行残留溶剂检测;如果累加量高于推荐量,则必须对该药品进行残留溶剂检测。
该指导原则适用于颁布以后上市的所有剂型和给药途径,但不适用于在临床研究阶段使用的潜在新药和新辅料,也不适用于已上市的现有药物。
在某些情况如短期(小于30天)或局部应用下,视具体情况,溶剂的高残留量也可接受。
按照毒性大小和对环境的危害程度,该指导原则将溶剂分成三类(所列举的溶剂并不完全,应对合成和生产过程所有可能的残留溶剂进行评估):第一类溶剂是指已知可以致癌并被强烈怀疑对人和环境有害的溶剂。
在可能的情况下,应避免使用这类溶剂。
如果在生产治疗价值较大的药品时不可避免地使用了这类溶剂,除非能证明其合理性,残留量必须控制在规定的范围内,如:苯(2ppm)、四氯化碳(4ppm)、1,2-二氯乙烷(5ppm)、1,1-二氯乙烷(8ppm)、1,1,1-三氯乙烷(1500ppm)。
第二类溶剂是指无基因毒性但有动物致癌性的溶剂。
1。
目的:建立残留溶剂测定法(二部)检验标准操作规程,并按规程进行检验,保证检验操作规范化。
2. 依据:2。
1。
《中华人民共和国药典》2010年版二部。
3。
范围:适用于所有用残留溶剂测定法(二部)测定的供试品。
4。
责任:检验员、质量控制科主任、质量管理部经理对本规程负责.5.正文:5。
1. 药品中的残留溶剂系指在原料药或辅料的生产中,以及在制剂制备过程中使用的,但在工艺过程中未能完全去除的有机溶剂.药品中常见的残留溶剂及限度见附表1,除另有规定外,第一、第二、第三类溶剂的残留限度应符合表1中的规定;对其他溶剂,应根据生产工艺的特点,制定相应的限度,使其符合产品规范、药品生产质量管理规范(GMP)或其他基本的质量要求。
5。
2。
本法照气相色谱法(附录ⅤE)测定。
5。
3。
色谱柱5.3.1. 毛细管柱:除另有规定外,极性相近的同类色谱柱之间可以互换使用。
5.3。
1。
1。
非极性色谱柱:固定液为100%的二甲基聚硅氧烷的毛细管柱。
5.3。
1.2。
极性色谱柱:固定液为聚乙二醇(PEG-20M)的毛细管柱。
5。
3.1.3。
中性色谱柱:固定液为(35%)二苯基—( 65%)甲基聚硅氧烷、(50%)二苯基—(50%)二甲基聚硅氧烷、(35%)二苯基-( 65%)二甲基聚硅氧烷、(14%)氰丙基苯基—(86%)二甲基聚硅氧烷、(6%)氰丙基苯基—(94%)二甲基聚硅氧烷的毛细管柱等。
5.3。
1.4。
弱极性色谱:柱固定液为(5%)苯基-(95%)甲基聚硅氧烷、(5%)二苯基—(95%)二甲基硅氧烷的毛细管柱等.5.3.2. 填充柱:以直径为0。
18~0。
25mm 的二乙烯苯—乙基乙烯苯型高分子多孔小球或其他适宜的填料作为固定相.5.4. 系统适用性试验。
5.4。
1。
用待测物的色谱峰计算,毛细管色谱柱的理论板数一般不低于5000;填充柱的理论板数一般不低于1000。
5.4。
2. 色谱图中,待测物色谱峰与其相邻色谱峰的分离度应大于1。
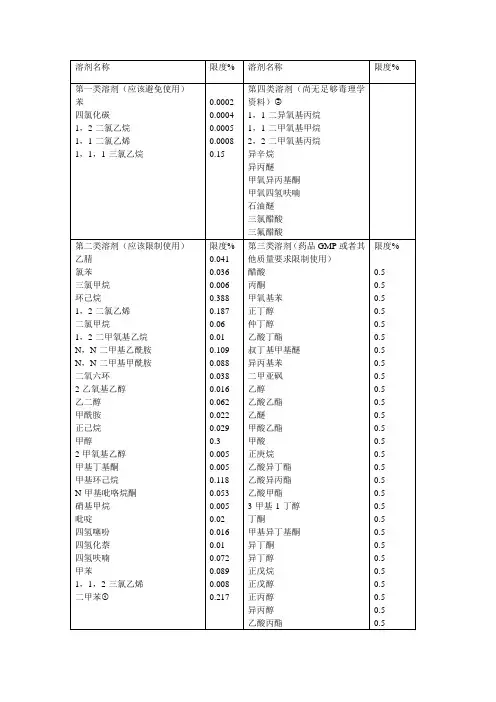
溶剂名称限度/%限度/ppm溶剂名称限度/%限度/ppm第一类溶剂(应该避免使用)第二类溶剂(应该限制使用)苯0.0002 2 二氧六环0.038 380 四氯化碳0.0004 4 2-乙氧基乙醇0.016 160 1,2-二氯乙烷0.0005 5 乙二醇0.062 620 1,1-二氯乙烷0.0008 8 甲酰胺0.022 220 1,1,1-三氯乙烷0.15 1500正己烷0.029 290甲醇0.3 3000 第二类溶剂(应该限制使用)2-甲氧基乙醇0.005 50 乙腈0.041 410甲基丁基酮0.005 50 氯苯0.036 360甲基环己烷0.118 1180 三氯甲烷0.006 60 N-甲基吡咯烷酮0.053 530 环己烷0.388 3880硝基甲烷0.005 50 1,2-二氯乙烯0.187 1870吡啶0.02 200 二氯甲烷0.06 600四氢噻吩0.016 160 1,2-而甲氧基乙烷0.01 100四氢化萘0.01 100 N,N-二甲基乙酰胺0.109 1090四氢呋喃0.072 720 N,N-二甲基甲酰胺0.088 880 甲苯0.089 890 1,1,2-三氯乙烯0.0008 8 二甲苯* 0.217 2170 * 通常含有60%间二甲苯、14%对二甲苯、9%邻二甲苯和17%乙苯溶剂名称 限度/%限度 /ppm溶剂名称 限度/%限度 /ppm第三类溶剂 (药品GMP 或其他质量要求限制使用)第三类溶剂(药品GMP 或其他质量要求限制使用)醋酸 0.5 5000 丁酮 0.5 5000 丙酮 0.5 5000 甲基异丁基酮 0.5 5000 甲氧基苯 0.5 5000 异丁醇 0.5 5000 正丁醇 0.5 5000 正戊醇 0.5 5000 仲丁醇 0.5 5000 正丙醇 0.5 5000 乙酸丁酯 0.5 5000 异丙醇 0.5 5000 叔丁基甲基醚 0.5 5000 乙酸丙酯0.5 5000 异丙基苯 0.5 5000 二甲基亚砜 0.5 5000第四类溶剂(尚无足够毒理学资料)# 乙醇 0.5 5000 1,1-二乙氧基丙烷 乙酸乙酯 0.5 5000 1,1-二甲氧基甲烷 乙醚 0.5 5000 2,2-二甲氧基丙烷 甲酸乙酯 0.5 5000 异辛烷 甲酸 0.5 5000 异丙醚 正庚烷 0.5 5000 甲基异丙基酮 乙酸异丁酯 0.5 5000 甲基四氢呋喃 乙酸异丙酯 0.5 5000 石油醚 乙酸甲酯 0.5 5000 三氯醋酸 3-甲基-1-丁醇0.5 5000 三氟醋酸#药品生产企业在使用时应提供该类溶剂在制剂中残留水平的合理性论证报告。
医药中常用有机溶剂分类及残留限度医药中常用有机溶剂分类及残留限度药品的残留溶剂无治疗作用并可能对人体的健康和环境造成危害,本文对国际协调大会(ICH)制订的指导原则及各国执行情况作了较为详尽的介绍。
药品的残留溶剂,又称有机挥发性杂质,是指在活性药物成分、辅料和药品生产过程中使用和产生的有机挥发性化学物质。
药品还可被来自包装、运输、仓储中的有机溶剂污染。
药品生产商有责任确保终产品中的任何一种残留溶剂对人体无害。
各国药监部门曾使用不同的药品残留溶剂指导原则,为此国际组织展开了协调工作。
经相关程序讨论和审查后,国际协调大会的指导原则于1997年7月17日获得通过,被推荐至国际协调大会(ICH)的指导委员会采用。
该指导原则要求,如果某个药品的生产或纯化过程可导致溶剂残留,就应对这个药品进行检测,并且只检测生产过程或纯化中使用或产生的那种溶剂。
根据使用量的多少,可采用累加的方法计算药品中残留溶剂的量。
如果累加量低于或等于指导原则中的推荐量,则该药品无需进行残留溶剂检测;如果累加量高于推荐量,则必须对该药品进行残留溶剂检测。
该指导原则适用于颁布以后上市的所有剂型和给药途径,但不适用于在临床研究阶段使用的潜在新药和新辅料,也不适用于已上市的现有药物。
在某些情况如短期(小于30天)或局部应用下,视具体情况,溶剂的高残留量也可接受。
按照毒性大小和对环境的危害程度,该指导原则将溶剂分成三类(所列举的溶剂并不完全,应对合成和生产过程所有可能的残留溶剂进行评估):第一类溶剂是指已知可以致癌并被强烈怀疑对人和环境有害的溶剂.在可能的情况下,应避免使用这类溶剂.如果在生产治疗价值较大的药品时不可避免地使用了这类溶剂,除非能证明其合理性,残留量必须控制在规定的范围内,如:苯(2ppm)、四氯化碳(4ppm)、1,2-二氯乙烷(5ppm)、1,1-二氯乙烷(8ppm)、1,1,1-三氯乙烷(1500ppm)。
第二类溶剂是指无基因毒性但有动物致癌性的溶剂。
医药中常用有机溶剂分类及残留限度医药中常用有机溶剂分类及残留限度医药中常用有机溶剂分类及残留限度药品的残留溶剂无治疗作用并可能对人体的健康和环境造成危害,本文对国际协调大会(ICH)制订的指导原则及各国执行情况作了较为详尽的介绍。
药品的残留溶剂,又称有机挥发性杂质,是指在活性药物成分、辅料和药品生产过程中使用和产生的有机挥发性化学物质。
药品还可被来自包装、运输、仓储中的有机溶剂污染。
药品生产商有责任确保终产品中的任何一种残留溶剂对人体无害。
各国药监部门曾使用不同的药品残留溶剂指导原则,为此国际组织展开了协调工作。
经相关程序讨论和审查后,国际协调大会的指导原则于1997年7月17日获得通过,被推荐至国际协调大会(ICH)的指导委员会采用。
该指导原则要求,如果某个药品的生产或纯化过程可导致溶剂残留,就应对这个药品进行检测,并且只检测生产过程或纯化中使用或产生的那种溶剂。
根据使用量的多少,可采用累加的方法计算药品中残留溶剂的量。
如果累加量低于或等于指导原则中的推荐量,则该药品无需进行残留溶剂检测;如果累加量高于推荐量,则必须对该药品进行残留溶剂检测。
该指导原则适用于颁布以后上市的所有剂型和给药途径,但不适用于在临床研究阶段使用的潜在新药和新辅料,也不适用于已上市的现有药物。
在某些情况如短期(小于30天)或局部应用下,视具体情况,溶剂的高残留量也可接受。
按照毒性大小和对环境的危害程度,该指导原则将溶剂分成三类(所列举的溶剂并不完全,应对合成和生产过程所有可能的残留溶剂进行评估):第一类溶剂是指已知可以致癌并被强烈怀疑对人和环境有害的溶剂。
在可能的情况下,应避免使用这类溶剂。
如果在生产治疗价值较大的药品时不可避免地使用了这类溶剂,除非能证明其合理性,残留量必须控制在规定的范围内,如:苯(2ppm)、四氯化碳(4ppm)、1,2-二氯乙烷(5ppm)、1,1-二氯乙烷(8ppm)、1,1,1-三氯乙烷(1500ppm)。