附录8 标准物质
- 格式:doc
- 大小:306.00 KB
- 文档页数:13

1.目的本规程适用于标准物质、标准溶液、滴定液在保存期间的核查。
2.人员及职责2.1 标准物质、标准溶液、滴定液使用及配置人员负责核查的实施。
2.2 部门负责人执行核查的监督管理。
3.引用标准3.1 中国药典2005版(二部)附录。
3.2 GBT601-2002 标准溶液配制和标定标准。
3.3 标准物质、标准溶液、滴定液配置管理规程。
4. 检查方法及技术要求4.1 形式检查4.1.1未开封的标准物质对照说明书检查储存条件是否一致并帐物相符。
保存温度检查:科室内的对照品应进行冷藏保存的,检查冰箱温度是否与规定的温度一致。
4.1.2 已开启使用的标准物质保存条件检查:科室内已开启使用的对照品均应在干燥器中保存,并按要求存放;均应有封签。
检查是否保存于干燥器中;检查是否都有封签;检查冰箱温度是否与规定的温度一致;检查温度记录。
4.1.3 标准物质记录检查:每次使用时,实验人员对前一人的使用记录进行检查,检查标准物质在使用中是否发现异常。
4.1.4 麻醉、精神药品对照品与剧毒对照品:应专柜存放,双人双锁管理,帐物相符。
检查是否专柜存放,是否双人双锁管理,是否帐物相符。
4.1.5 标准溶液、滴定液使用记录检查:每次使用时,实验人员对前一人的使用进行检查,检查标准溶液在使用中是否发现异常,如颜色变浅、颜色加深、发生沉淀等影响标准溶液的正常使用或检验结果出现明显偏离时,需对标准溶液进行考察或开启新的标准物质或基准物质对比核查。
核查方法可参照药典该品种项下方法进行。
5. 滴定液的期间核查:5.1由指定人员按药典规定方法作验证性滴定,一般做两份即可。
5.2当滴定液浓度在规定限度以内(相对偏差0.1%)继续使用原数据。
5.3当滴定液浓度超出规定限度,滴定液停止使用,重新标定。
5.4详细记录,以作滴定液稳定性考查分析资料。
6.对照品溶液的期间核查:6.1 按药典检验项目,取新处理的对照品制备对照品溶液一份。
6.2 取新、旧对照品溶液同时试验,比对试验数据。



一级标准物质技术规范(JJG 1006-94)本规范适用于化学成分、物理化学特性及工程技术特性一级标准物质的研制(二级标准物质的研制可参照本技术规范执行)。
一、标准物质的制备1 候选物1.1 候选物的选择应满足适用性、代表性,以及容易复制的原则。
1.2 候选物的基体应和使用的要求相一致或尽可能接近。
1.3 候选物的均匀性、稳定性以及特定特性量的量值范围应适合该标准物质的用途。
1.4 系列化标准物质特性量的量值分布梯度应能满足使用要求,以较少品种覆盖预期的范围。
1.5 候选物应有足够的数量,以满足在有效期间使用的需要。
2 制备2.1 根据候选物的性质,选择合理的制备程序、工艺,并防止污染及待定特性量的量值变化。
2.2 对待定特性量不易均匀的候选物,在制备过程中除采取必要的均匀措施外,还应进行均匀性初检。
2.3 候选物的待定特性量有不易稳定趋向时,在加工过程中应注意研究影响稳定性的因素,采取必要的措施改善其稳定性,如辐照灭菌、添加稳定剂等,选择合适的贮存环境。
2.4 当候选物制备量大,为便于保存可采取分级分装。
最小包装单元应以适当方式编号并注明制备日期。
2.5 最小包装单元中标准物质的实际质量或体积与标称的质量或体积应符合规定的要求。
二标准物质的均匀性检验3 不论制备过程中是否经过均匀性初检,凡成批制备并分装成最小包装单元的标准物质,必须进行均匀性检验。
对于分级分装的标准物质,凡由大包装分装成最小包装单元时,都需要进行均匀性检验4 抽取单元数抽取单元数目对样品总体要有足够的代表性。
抽取单元数取决于总体样品的单元数和对样品的均匀程度的了解。
当总体样品的单元数较多时,抽取单元数也应相应增多。
当已知总体样品均匀性良好时,抽取单元数可适当减少。
抽取单元数以及每个样品的重复测量次数还应适合所采用的统计检验要求。
4.1 当总体单元数少于500时,抽取单元数不少于15个,当总体单元数大于500时,抽取单元数不少于25个。

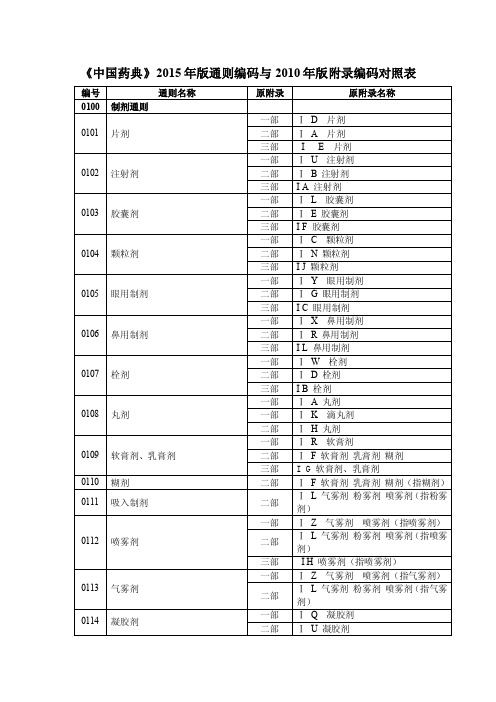
《中国药典》2015年版通则编码与2010年版附录编码对照表编号通则名称原附录原附录名称0100 制剂通则0101 片剂一部Ⅰ D 片剂二部Ⅰ A 片剂三部I E 片剂0102 注射剂一部ⅠU 注射剂二部Ⅰ B 注射剂三部I A 注射剂0103 胶囊剂一部ⅠL 胶囊剂二部Ⅰ E 胶囊剂三部I F 胶囊剂0104 颗粒剂一部Ⅰ C 颗粒剂二部ⅠN 颗粒剂三部I J 颗粒剂0105 眼用制剂一部ⅠY 眼用制剂二部ⅠG 眼用制剂三部I C 眼用制剂0106 鼻用制剂一部ⅠX 鼻用制剂二部ⅠR 鼻用制剂三部I L 鼻用制剂0107 栓剂一部ⅠW 栓剂二部Ⅰ D 栓剂三部I B 栓剂0108 丸剂一部Ⅰ A 丸剂一部ⅠK 滴丸剂二部ⅠH 丸剂0109 软膏剂、乳膏剂一部ⅠR 软膏剂二部Ⅰ F 软膏剂乳膏剂糊剂三部I G 软膏剂、乳膏剂0110 糊剂二部ⅠF 软膏剂乳膏剂糊剂(指糊剂)0111 吸入制剂二部ⅠL 气雾剂粉雾剂喷雾剂(指粉雾剂)0112 喷雾剂一部ⅠZ 气雾剂喷雾剂(指喷雾剂)二部ⅠL 气雾剂粉雾剂喷雾剂(指喷雾剂)三部I H 喷雾剂(指喷雾剂)0113 气雾剂一部ⅠZ 气雾剂喷雾剂(指气雾剂)二部ⅠL 气雾剂粉雾剂喷雾剂(指气雾剂)0114 凝胶剂一部ⅠQ 凝胶剂二部ⅠU 凝胶剂三部I M 凝胶剂0115 散剂一部Ⅰ B 散剂二部ⅠP 散剂三部I K 散剂0116 糖浆剂一部ⅠH 糖浆剂二部ⅠK 糖浆剂0117 搽剂一部ⅠV 搽剂洗剂涂膜剂(指搽剂)二部ⅠT 搽剂涂剂涂膜剂(指搽剂)0118 涂剂二部ⅠT 搽剂涂剂涂膜剂(指涂剂)三部I D 外用制剂0119 涂膜剂一部ⅠV 搽剂洗剂涂膜剂(指涂膜剂)二部ⅠT 搽剂涂剂涂膜剂(指涂膜剂0120 酊剂一部ⅠN 酊剂二部Ⅰ C 酊剂0121 贴剂一部Ⅰ I 贴膏剂 (指贴剂) 二部ⅠV 贴剂0122 贴膏剂一部ⅠI 贴膏剂0123 口服溶液剂口服混悬剂口服乳剂二部ⅠO 口服溶液剂口服混悬剂口服乳剂0124 植入剂二部ⅠJ 植入剂0125 膜剂二部ⅠM 膜剂0126 耳用制剂二部ⅠQ耳用制剂0127 洗剂一部ⅠV 搽剂洗剂涂膜剂(指洗剂)二部ⅠS洗剂冲洗剂灌肠剂(指洗剂)0128 冲洗剂一部ⅠV 搽剂洗剂涂膜剂(指洗剂)二部ⅠS洗剂冲洗剂灌肠剂(指冲洗剂)0129 灌肠剂二部ⅠS洗剂冲洗剂灌肠剂(指灌肠剂)0181 合剂一部ⅠJ 合剂0182 锭剂一部ⅠE 锭剂0183 煎膏剂(膏滋)一部ⅠF 煎膏剂(膏滋)0184 胶剂一部ⅠG 胶剂0185 酒剂一部ⅠM 酒剂0186 膏药一部ⅠP 膏药0187 露剂一部ⅠS 露剂0188 茶剂一部ⅠT 茶剂0189 流浸膏剂与浸膏剂一部ⅠO 流浸膏剂与浸膏剂0200 其他通则0211 药材和饮片取样法一部ⅡA 药材和饮片取样法0212 药材和饮片检定通则一部ⅡB 药材和饮片检定通则0213 炮制通则一部ⅡD 炮制通则0251 药用辅料二部附录Ⅱ药用辅料0261 制药用水一部附录ⅩⅣ制药用水二部附录ⅩⅥ制药用水0291 国家药品标准物质通则新增第二增补本03000301 一般鉴别试验一部附录Ⅳ一般鉴别试验二部附录Ⅲ一般鉴别试验0400光谱法一部附录Ⅴ分光光度法二部附录Ⅳ分光光度法三部附录Ⅱ分光光度法0401 紫外-可见分光光度法一部Ⅴ A 紫外-可见分光光度法二部Ⅳ A 紫外-可见分光光度法三部Ⅱ A 紫外-可见分光光度法0402 红外分光光度法一部Ⅴ C 红外分光光度法二部Ⅳ C 红外分光光度法0405 荧光分光光度法二部Ⅳ E 荧光分析法三部Ⅱ C 荧光分析法0406 原子吸收分光光度法一部Ⅴ D 原子吸收分光光度法二部Ⅳ D 原子吸收分光光度法三部Ⅱ B 原子吸收分光光度法0407 火焰光度法二部Ⅳ F 火焰光度法三部Ⅱ D 火焰光度法ⅦI 钾离子测定法ⅦJ 钠离子测定法0411 电感耦合等离子体原子发射光谱法一部Ⅺ E 电感耦合等离子体原子发射光谱法0412 电感耦合等离子体质谱法一部ⅪD 电感耦合等离子体质谱法0421 拉曼光谱法二部ⅩⅨL 拉曼光谱法指导原则0431 质谱法二部ⅨJ 质谱法0441 核磁共振波谱法二部ⅨK 核磁共振波谱法0451 X射线衍射法二部ⅨF X射线粉末衍射法0500色谱法0501 纸色谱法一部Ⅵ A 纸色谱法二部Ⅴ A 纸色谱法三部Ⅲ A 纸色谱法0502 薄层色谱法一部Ⅵ B 薄层色谱法二部Ⅴ B 薄层色谱法0511 柱色谱法一部Ⅵ C 柱色谱法二部Ⅴ C 柱色谱法0512 高效液相色谱法一部Ⅵ D 高效液相色谱法二部Ⅴ D 高效液相色谱法三部Ⅲ B 高效液相色谱法0513 离子色谱法一部ⅥG 离子色谱法二部ⅤJ 离子色谱法三部Ⅲ E 离子色谱法0514 分子排阻色谱法二部ⅤH 分子排阻色谱法三部Ⅲ D 分子排阻色谱法0521 气相色谱法一部Ⅵ E 气相色谱法二部Ⅴ E 气相色谱法三部Ⅲ C 气相色谱法0531 超临界流体色谱法新增0532 临界点色谱法新增0541 电泳法二部Ⅴ F 电泳法三部Ⅳ A 醋酸纤维素薄膜电泳法三部Ⅳ B 琼脂糖凝胶电泳法三部Ⅳ C SDS-聚丙烯酰胺凝胶电泳法三部Ⅳ D 等电聚焦电泳法0542 毛细管电泳法一部Ⅵ F 毛细管电泳法二部ⅤG 毛细管电泳法0600 物理常数测定法0601 相对密度测定法一部Ⅶ A 相对密度测定法二部Ⅵ A 相对密度测定法0611 馏程测定法一部Ⅶ B 馏程测定法二部Ⅵ B 馏程测定法0612 熔点测定法一部Ⅶ C 熔点测定法二部Ⅵ C 熔点测定法0613 凝点测定法一部Ⅶ D 凝点测定法二部Ⅵ D 凝点测定法0621 旋光度测定法一部Ⅶ E 旋光度测定法二部Ⅵ E 旋光度测定法0622 折光率测定法一部Ⅶ F 折光率测定法二部Ⅵ F 折光率测定法0631 pH值测定法一部ⅦG pH值测定法二部ⅥH pH值测定法三部Ⅴ A pH值测定法0632 渗透压摩尔浓度测定法一部Ⅺ F 渗透压摩尔浓度测定法二部ⅨG 渗透压摩尔浓度测定法三部ⅤH 渗透压摩尔浓度测定法0633 黏度测定法二部ⅥG 黏度测定法0661 热分析法二部ⅧQ 热分析法0681 制药用水电导率测定法二部ⅧS 制药用水电导率测定法0682 制药用水中总有机碳测定法二部ⅧR 制药用水中总有机碳测定法0700其他测定法Other Assays0701 电位滴定法与永停滴定法一部Ⅷ A 电位滴定法与永停滴定法二部Ⅶ A 电位滴定法与永停滴定法0702 非水溶液滴定法一部Ⅷ B 非水溶液滴定法二部Ⅶ B 非水溶液滴定法0703 氧瓶燃烧法二部ⅦC 氧瓶燃烧法0704 氮测定法一部ⅨL 氮测定法二部Ⅶ D 氮测定法三部Ⅵ A 氮测定法0711 乙醇量测定法一部ⅨM 乙醇量测定法二部Ⅶ E 乙醇量测定法0712 甲氧基、乙氧基与羟丙氧基测定法二部Ⅶ F 甲氧基、乙氧基与羟丙氧基测定法0713 脂肪与脂肪油测定法一部ⅨN 脂肪与脂肪油测定法二部ⅦH 脂肪与脂肪油测定法0721 维生素A测定法二部ⅦJ 维生素A测定法0722 维生素D测定法二部ⅦK 维生素D测定法0731 蛋白质含量测定法二部ⅦM 蛋白质含量测定法三部Ⅵ B 蛋白质测定法0800 限量检查法0801 氯化物检查法一部Ⅸ C 氯化物检查法二部Ⅷ A 氯化物检查法0802 硫酸盐检查法二部ⅧB 硫酸盐检查法0803 硫化物检查法二部ⅧC 硫化物检查法0804 硒检查法二部ⅧD 硒检查法0805 氟检查法二部ⅧE 氟检查法0806 氰化物检查法二部Ⅷ F 氰化物检查法三部ⅥX 氰化物残留量测定法0807 铁盐检查法一部Ⅸ D 铁盐检查法二部ⅧG 铁盐检查法0808 铵盐检查法二部ⅧK 铵盐检查法0821 重金属检查法一部Ⅸ E 重金属检查法二部ⅧH 重金属检查法0822 砷盐检查法一部Ⅸ F 砷盐检查法二部ⅧJ 砷盐检查法0831 干燥失重测定法一部ⅨG 干燥失重测定法二部ⅧL 干燥失重测定法三部ⅦL 干燥失重测定法0832 水分测定法一部ⅨH 水分测定法二部ⅧM 水分测定法三部Ⅶ D 水分测定法0841 炽灼残渣检查法一部ⅨJ 炽灼残渣检查法二部ⅧN 炽灼残渣检查法0842 易炭化物检查法二部ⅧO 易炭化物检查法0861 残留溶剂测定法二部ⅧP 残留溶剂测定法三部ⅥV 残留溶剂测定法0871 甲醇量检查法一部ⅨT 甲醇量检查法0872 合成多肽中的醋酸测定法二部ⅦN 合成多肽中的醋酸测定法0873 2-乙基己酸测定法二部ⅦL 2-乙基己酸测定法0900 物理特性检查法0901 溶液颜色检查法一部Ⅺ A 溶液颜色检查法二部Ⅸ A 溶液颜色检查法0902 澄清度检查法二部ⅨB 澄清度检查法0903 不溶性微粒检查法一部ⅨR 不溶性微粒检查法二部Ⅸ C 不溶性微粒检查法三部ⅤI 不溶性微粒检查法0904 可见异物检查法一部Ⅺ C 可见异物检查法二部ⅨH 可见异物检查法三部Ⅴ B 可见异物检查法0921 崩解时限检查法一部Ⅻ A 崩解时限检查法二部Ⅹ A 崩解时限检查法三部Ⅴ C 崩解时限检查法0922 融变时限检查法一部Ⅻ B 融变时限检查法二部Ⅹ B 融变时限检查法三部Ⅴ D 融变时限检查法0923 片剂脆碎度检查法二部ⅩG 片剂脆碎度检查法三部Ⅴ E 片剂脆碎度检查法0931 溶出度测定法(合并释放度测定法)二部Ⅹ C 溶出度测定法二部Ⅹ D 释放度测定法0941 含量均匀度检查法二部ⅩE 含量均匀度检查法0942 最低装量检查法一部Ⅻ C 最低装量检查法二部Ⅹ F 最低装量检查法三部Ⅴ F 最低装量检查法0951 吸入制剂微细粒子空气动力学特性测定法二部ⅩH 吸入气雾剂、吸入粉雾剂、吸入喷雾剂的雾滴(粒)分布测定法0952 粘附力测定法一部ⅫE 贴膏剂黏附力测定法二部ⅩJ 贴剂黏附力测定法0981 结晶性检查法二部ⅨD 结晶性检查法0982 粒度和粒度分布测定法一部Ⅺ B 粒度测定法二部Ⅸ E 粒度和粒度分布测定法三部ⅤG 粒度测定法0983 锥入度测定法二部ⅩK 锥入度测定法1000 分子生物学技术1100 生物检查法1101 无菌检查法一部ⅩⅢ B 无菌检查法二部ⅪH 无菌检查法三部Ⅻ A 无菌检查法1105 非无菌产品微生物限度检查:微生物计数法一部ⅩⅢ C 微生物限度检查法二部Ⅺ J 微生物限度检查法三部Ⅻ G 微生物限度检查法1106 非无菌产品微生物限度检查:控制菌检查法一部ⅩⅢ C 微生物限度检查法二部Ⅺ J 微生物限度检查法三部Ⅻ G 微生物限度检查法1107 非无菌药品微生物限度标准一部ⅩⅢ C 微生物限度检查法二部Ⅺ J 微生物限度检查法三部Ⅻ G 微生物限度检查法1121 抑菌效力检查法一部ⅩⅧ D 抑菌剂效力检查法指导原则二部ⅪⅩ N 抑菌剂效力检查法指导原则三部ⅩⅦ A 抑菌剂(防腐剂)效力检查法指导原则1141 异常毒性检查法一部ⅩⅢ E 异常毒性检查法二部Ⅺ C 异常毒性检查法三部Ⅻ F 异常毒性检查法1142 热原检查法一部ⅩⅢ A 热原检查法二部Ⅺ D 热原检查法三部Ⅻ D 热原检查法1143 细菌内毒素检查法一部ⅩⅢ D 细菌内毒素检查法二部Ⅺ E 细菌内毒素检查法三部Ⅻ E 细菌内毒素检查法1144 升压物质检查法二部ⅪF 升压物质检查法1145 降压物质检查法一部ⅩⅢ F 降压物质检查法二部ⅪG 降压物质检查法1146 组胺类物质检查法新增1147 过敏反应检查法一部ⅩⅢG 过敏反应检查法二部ⅪK 过敏反应检查法1148 溶血与凝聚检查法一部ⅩⅢH 溶血与凝聚检查法二部ⅪL 溶血与凝聚检查法1200 生物活性测定法1201 抗生素微生物检定法二部ⅪA 抗生素微生物检定法1202 青霉素酶及其活力测定法二部ⅪB 青霉素酶及其活力测定法1205 升压素生物测定法二部ⅫA 升压素生物测定法1206 细胞色素C活力测定法二部ⅫB 细胞色素C活力测定法1207 玻璃酸酶测定法二部ⅫC 玻璃酸酶测定法1208 肝素生物测定法二部ⅫD 肝素生物测定法1209 绒促性素生物测定法二部ⅫE 绒促性素生物测定法1210 缩宫素生物测定法二部ⅫF 缩宫素生物测定法1211 胰岛素生物测定法二部ⅫG 胰岛素生物测定法1212 精蛋白锌胰岛素注射液延缓作用检查法二部ⅫH 精蛋白锌胰岛素注射液延缓作用检查法1213 硫酸鱼精蛋白生物测定法二部ⅫJ 硫酸鱼精蛋白生物测定法1214 洋地黄生物测定法二部ⅫK 洋地黄生物测定法1215 葡萄糖酸锑钠毒力检查法二部ⅫL 葡萄糖酸锑钠毒力检查法1216 卵泡刺激素生物测定法二部ⅫM 卵泡刺激素生物测定法1217 黄体生成素生物测定法二部ⅫN 黄体生成素生物测定法1218 降钙素生物测定法二部ⅫO 降钙素生物测定法1219 生长激素生物测定法二部ⅫP 生长激素生物测定法1401 放射性药品检定法二部ⅩⅢ放射性药品检定法1421 灭菌法一部ⅩⅥ灭菌法二部ⅩⅦ灭菌法三部ⅩⅤ灭菌法1431 生物检定统计法二部ⅩⅣ生物检定统计法2000 中药相关检查方法2001 显微鉴别法一部ⅡC 显微鉴别法2101 膨胀度测定法一部ⅨO 膨胀度测定法2102 膏药软化点测定法一部ⅫD 膏药软化点测定法2201 浸出物测定法一部ⅩA 浸出物测定法2202 鞣质含量测定法一部ⅩB 鞣质含量测定法2203 桉油精含量测定法一部ⅩC 桉油精含量测定法2204 挥发油测定法一部ⅩD 挥发油测定法2301 药材和饮片杂质检查法一部ⅨA 杂质检查法2302 灰分测定法一部ⅨK 灰分测定法2303 酸败度测定法一部ⅨP 酸败度测定法2321 铅、镉、砷、汞、铜测定法一部ⅨB 铅、镉、砷、汞、铜测定法2322 汞和砷元素形态及其价态测定法新增2331 二氧化硫残留量测定法一部ⅨU 二氧化硫残留量测定法2341 农药残留量测定法一部ⅨQ 农药残留量测定法2351 黄曲霉毒素测定法一部ⅨV 黄曲霉毒素测定法2400 中药注射剂有关物质检查法一部ⅨS 注射剂有关物质检查法3000 生物制品相关检查方法(附后)待定3100 含量测定法3101 固体总量测定法三部ⅦM 固体总量测定法3102 唾液酸测定法三部ⅥC 唾液酸测定法3103 磷测定法三部ⅦA 磷测定法3104 硫酸铵测定法三部ⅦC 硫酸铵测定法3105 亚硫酸氢钠测定法三部ⅦE 亚硫酸氢钠测定法3106 氢氧化铝(或磷酸铝)测定法三部ⅦF 氢氧化铝(或磷酸铝)测定法3107 氯化钠测定法三部ⅦG 氯化钠测定法3108 枸橼酸离子测定法三部ⅦH 枸橼酸离子测定法3109 辛酸钠测定法三部ⅥK 辛酸钠测定法3110 乙酰色氨酸测定法三部ⅥW 乙酰色氨酸测定法3111 苯酚测定法三部ⅥM 苯酚测定法3112 间甲酚测定法三部ⅥN 间甲酚测定法3113 硫柳汞测定法三部ⅦB 硫柳汞测定法3114 对羟基苯甲酸甲酯、对羟基苯甲酸丙酯含量测定法三部ⅥT 对羟基苯甲酸甲酯、对羟基苯甲酸丙酯含量测定法3115 O-乙酰基测定法三部ⅥF O-乙酰基测定法3116 己二酰肼含量测定法三部ⅧK 己二酰肼含量测定法3117 高分子结合物含量测定法三部ⅧL 高分子结合物含量测定法3118 人血液制品中糖及糖醇测定法三部ⅥP 人血液制品中糖及糖醇测定法3119 人血白蛋白多聚体测定法三部ⅥQ 人血白蛋白多聚体测定法3120 人免疫球蛋白类制品IgG单体加二聚体测定法三部ⅥR 人免疫球蛋白类制品IgG单体加二聚体测定法3121 人免疫球蛋白类中甘氨酸含量测定法三部ⅥS 人免疫球蛋白中甘氨酸含量测定法3122 重组人粒细胞刺激因子蛋白质含量测定法三部ⅥU 重组人粒细胞刺激因子蛋白质含量测定法3123 组胺人免疫球蛋白中游离磷酸组胺测定法三部Ⅵ E 组胺人免疫球蛋白中游离磷酸组胺测定法3124 IgG含量测定法三部ⅪK IgG含量测定法3200 化学残留物测定法3201 乙醇残留量测定法三部ⅥD 乙醇残留量测定法3202 聚乙二醇残留量测定法三部ⅥG 聚乙二醇残留量测定法3203 聚山梨酯80残留量测定法三部ⅥH 聚山梨酯80残留量测定法3204 戊二醛残留量测定法三部ⅥI 戊二醛残留量测定法3205 磷酸三丁酯残留量测定法三部ⅥJ 磷酸三丁酯残留量测定法3206 碳二亚胺(EDAC)残留量测定法三部ⅥY 碳二亚胺(EDAC)残留量测定法3207 游离甲醛测定法三部ⅥL 游离甲醛测定法3208 人血白蛋白铝残留量测定法三部ⅦK 人血白蛋白铝残留量测定法3209 羟胺残留量测定法新增3300 微生物检查法3301 支原体检查法三部ⅫB 支原体检查法3302 病毒外源因子检查法三部ⅫC 病毒外源因子检查法3303 鼠源性病毒检查法三部ⅫH 鼠源性病毒检查法3400 生物测定法3401 免疫印迹法三部ⅧA 免疫印迹法3402 免疫斑点法三部ⅧB 免疫斑点法3403 免疫双扩散法三部ⅧC 免疫双扩散法3404 免疫电泳法三部ⅧD 免疫电泳法3405 肽图检查法三部ⅧE 肽图检查法3406 质粒丢失率检查法三部ⅨG 质粒丢失率检查法3407 SV40核酸序列检查法三部ⅨH SV40核酸序列检查法3408 外源性DNA残留量测定法三部ⅨB 外源性DNA残留量测定法3409 抗生素残留量检查法三部ⅨA 抗生素残留量检查法3410 激肽释放酶原激活剂测定法三部ⅨF 激肽释放酶原激活剂测定法3411 抗补体活性测定法三部ⅨK 抗补体活性测定法3412 牛血清白蛋白残留量测定法三部ⅧI 牛血清白蛋白残留量测定法3413 大肠杆菌菌体蛋白质残留量测定法三部Ⅸ C 大肠杆菌菌体蛋白质残留量测定法3414 假单胞菌菌体蛋白质残留量测定法三部Ⅸ D 假单胞菌菌体蛋白质残留量测定法3415 酵母工程菌菌体蛋白质残留量测定法三部Ⅸ E 酵母工程菌菌体蛋白质残留量测定法3416 类A血型物质测定法三部ⅨI 类A血型物质测定法3417 鼠IgG残留量测定法三部ⅨL 鼠IgG残留量测定法3418 无细胞百日咳疫苗鉴别试验三部ⅨS 无细胞百日咳疫苗鉴别试验3419 抗毒素、抗血清制品鉴别试验三部ⅨT 抗毒素、抗血清制品鉴别试验3420 A群脑膜炎球菌多糖分子大小测定法三部ⅧG A群脑膜炎球菌多糖分子大小测定法3421 伤寒Vi多糖分子大小测定法三部ⅧH 伤寒Vi多糖分子大小测定法3422 b型流感嗜血杆菌结合疫苗多糖含量测定法三部ⅧJ b型流感嗜血杆菌结合疫苗多糖含量测定法3423 人凝血酶活性检查法三部ⅨN 人凝血酶活性检查法3424 活化的凝血因子活性检查法三部ⅨO 活化的凝血因子活性检查法3425 肝素含量测定法三部ⅨP 肝素含量测定法3426 抗A、抗B血凝素测定法三部ⅨJ 抗A、抗B血凝素测定法3427 人红细胞抗体测定法三部ⅨQ 人红细胞抗体测定法3428 人血小板抗体测定法三部ⅨR 人血小板抗体测定法3429 猴体神经毒力试验三部ⅪL 猴体神经毒力试验3430 人血浆病毒核酸检测技术要求新增3431 单抗纯度茨顶方法-CE-SDS毛细管电泳(还原和非还原)新增3500 生物活性/效价测定法3501 重组乙型肝炎疫苗(酵母)体外相对效力检查法三部Ⅹ A 重组乙型肝炎疫苗(酵母)体外相对效力检查法3502 甲型肝炎灭活疫苗体外相对效力检查法三部ⅩS 甲型肝炎灭活疫苗体外相对效力检查法3503 人用狂犬病疫苗效价测定法三部ⅪA 人用狂犬病疫苗效价测定法3504 吸附破伤风疫苗效价测定法三部ⅪB 吸附破伤风疫苗效价测定法3505 吸附白喉疫苗效价测定法三部ⅪC 吸附白喉疫苗效价测定法3506 类毒素絮状单位测定法三部ⅪD 类毒素絮状单位测定法3507 白喉抗毒素效价测定法三部ⅪE 白喉抗毒素效价测定法3508 破伤风抗毒素效价测定法三部ⅪF 破伤风抗毒素效价测定法3509 气性坏疽抗毒素效价测定法三部ⅪG 气性坏疽抗毒素效价测定法3510 肉毒抗毒素效价测定法三部ⅪH 肉毒抗毒素效价测定法3511 抗蛇毒血清效价测定法三部ⅪI 抗蛇毒血清效价测定法3512 狂犬病免疫球蛋白效价测定法三部ⅪJ 狂犬病免疫球蛋白效价测定法3513 人免疫球蛋白中白喉抗体效价测定法三部ⅩO 人免疫球蛋白中白喉抗体效价测定法3514 人免疫球蛋白Fc段生物学活性测定法三部ⅩP 人免疫球蛋白Fc段生物学活性测定法3515 抗人T细胞免疫球蛋白效价测定法(E玫瑰花环形成抑制试验)三部ⅩQ 抗人T细胞免疫球蛋白效价测定法(E玫瑰花环形成抑制试验)3516 抗人T细胞免疫球蛋白效价测定法(淋巴细胞毒试验)三部ⅩR 抗人T细胞免疫球蛋白效价测定法(淋巴细胞毒试验)3517 人凝血因子Ⅱ效价测定法三部ⅩJ 人凝血因子Ⅱ效价测定法3518 人凝血因子Ⅶ效价测定法三部ⅩK 人凝血因子Ⅶ效价测定法3519 人凝血因子Ⅸ效价测定法三部ⅩL 人凝血因子Ⅸ效价测定法3520 人凝血因子Ⅹ效价测定法三部ⅩM 人凝血因子Ⅹ效价测定法3521 人凝血因子Ⅷ效价测定法三部ⅩN 人凝血因子Ⅷ效价测定法3522 重组人促红素体内生物学活性测定法三部Ⅹ B 重组人促红素体内生物学活性测定法3523 干扰素生物学活性测定法三部ⅩC 干扰素生物学活性测定法3524 重组人白介素-2生物学活性测定法三部Ⅹ D 重组人白介素-2生物学活性测定法3525 重组人粒细胞刺激因子生物学活性测定法三部Ⅹ E 重组人粒细胞刺激因子生物学活性测定法3526 重组人粒细胞巨噬细胞刺激因子生物学活性测定法三部Ⅹ F 重组人粒细胞巨噬细胞刺激因子生物学活性测定法3527 重组牛碱性成纤维细胞生长因子生物学活性测定法三部ⅩG 重组牛碱性成纤维细胞生长因子生物学活性测定法3528 重组人表皮生长因子生物学活性测定法三部ⅩH 重组人表皮生长因子生物学活性测定法3529 重组链激酶生物学活性测定法三部ⅩI 重组链激酶生物学活性测定法3530 鼠神经生长因子生物学活性测定新增法3531 尼妥珠单抗生物学活性测定法新增3532 白介素-11-生物活性测定方法新增3600 特定生物原材料/动物3601 无特定病原体鸡胚质量检测要求三部ⅩⅢ A 无特定病原体鸡胚质量检测要求3602 实验动物微生物学检测要求三部ⅩⅢB 实验动物微生物学检测要求3603 实验动物寄生虫学检测要求三部ⅩⅢC 实验动物寄生虫学检测要求3604 新生牛血清检测要求三部ⅩⅢD 新生牛血清检测要求3611 细菌生化反应培养基三部ⅩⅣ细菌生化反应培养基8000 试剂与标准物质8001 试药一部ⅩⅤ A 试药二部ⅩⅤ A 试药8002 试液一部ⅩⅤ B 试液二部ⅩⅤ B 试液8003 试纸一部ⅩⅤ C 试纸二部ⅩⅤ C 试纸8004 缓冲液一部ⅩⅤ D 缓冲液二部ⅩⅤ D 缓冲液8005 指示剂与指示液一部ⅩⅤ E 指示剂与指示液二部ⅩⅤ E 指示剂与指示液8006 滴定液一部ⅩⅤ F 滴定液二部ⅩⅤ F 滴定液8061 标准物质一部ⅩⅤG 对照品对照药材对照提取物二部ⅩⅤG 标准品与对照品9000 指导原则9001 原料药与药物制剂稳定性试验指导原则二部ⅩⅨ C 原料药与药物制剂稳定性试验指导原则9011 药物制剂人体生物利用度和生物等效性试验指导原则二部ⅩⅨ B 药物制剂人体生物利用度和生物等效性试验指导原则9012 生物样品定量分析方法验证指导原则新增9013 缓释、控释和迟释制剂指导原则二部ⅩⅨ D 缓释、控释和迟释制剂指导原则9014 微粒制剂指导原则二部ⅩⅨ E 微囊、微球与脂质体制剂指导原则9015 药品晶型研究及晶型质量控制指导原则新增9101 药品质量标准分析方法验证指导一部ⅩⅧ A 中药质量标准分析方法验证原则指导原则二部ⅩⅨ A 药品质量标准分析方法验证指导原则9102 药品杂质分析指导原则二部ⅩⅨ F 药品杂质分析指导原则9103 药物引湿性试验指导原则二部ⅩⅨ J 药物引湿性试验指导原则9104 近红外分光光度法指导原则二部ⅩⅨK 近红外分光光度法指导原则9105 中药生物活性测定指导原则一部ⅩⅧC 中药生物活性测定指导原则9106 基于基因芯片药物评价技术指导原则新增9107 中药材DNA条形码分子鉴定法指导原则新增9201 药品微生物检验替代方法验证指导原则一部ⅩⅧ E 药品微生物检验替代方法验证指导原则二部ⅩⅨO 药品微生物检验替代方法验证指导原则三部ⅩⅦ B 药品微生物检验替代方法验证指导原则9202 非无菌药品微生物限度检查指导原则一部ⅩⅧ F 微生物限度检查法应用指导原则二部ⅩⅨP 微生物限度检查法应用指导原则9203 药品微生物实验室质量管理指导原则一部ⅩⅧG 药品微生物实验室规范指导原则二部ⅩⅨQ 药品微生物实验室规范指导原则9204 微生物鉴定指导原则新增9205 药品洁净实验室微生物监测和控制指导原则新增9206 无菌检查用隔离系统验证指导原则新增9301 注射剂安全性检查法应用指导原则一部ⅩⅧ B 中药注射剂安全性检查法应用指导原则二部ⅩⅨ M 化学药品注射剂安全性检查法应用指导原则9302 中药有害残留物限量制定指导原则新增9303 色素检测指导原则新增9304 中药中铝、铬、铁、钡元素测定指导原则新增9305 中药中真菌毒素测定指导原则新增9401 生物制品定量分析方法指导原则新增生物制品类预留位置。

中国药典2015年版《中国药典》2015年版通则编码与2010年版附录编码对照表《中国药典》2015年版通则编码与2010年版附录编码对照表编号通则名称原附录原附录名称0100制剂通则一部工D片剂0101片剂二部I A片剂三部I E片剂一部I u注射剂0102注射剂二部I B注射剂三部I A注射剂一部I L胶囊剂0103胶囊剂二部I E胶囊剂三部I F胶囊剂一部I C颗粒剂0104颗粒剂二部I N颗粒剂三部I J颗粒剂一部I Y眼用制剂0105眼用制剂二部I G眼用制剂三部I c眼用制剂一部I X鼻用制剂0106鼻用制剂二部I R 鼻用制剂三部I L鼻用制剂一部I w栓剂0107栓剂二部I D栓剂三部I B栓剂一部I A丸剂0108丸剂一部I K滴丸剂二部I H丸剂一部I R 软音剂0109软裔剂乳裔剂二部I F软膏剂乳裔剂糊剂三部I G软裔剂、乳裔剂0110糊剂二部I F 软膏剂乳音剂糊剂(指糊剂)0111吸人制剂二部I L气雾剂粉雾剂喷雾剂(指粉雾剂)一部I Z气雾剂喷雾剂(指喷雾剂)0112喷雾剂二部I L气雾剂粉雾剂喷雾剂(指喷雾剂)三部I H喷雾剂一部I Z气雾剂喷雾剂(指气雾剂)0113气雾剂二部I L 气雾剂粉雾剂喷雾剂(指气雾剂)• 425《中国药典》2015年版通则编码与2010年版附录编码对照表中国药典2015年版续表编号通则名称原附录原附录名称一部I Q凝胶剂0114凝胶剂二部I U凝胶剂三部I M凝胶剂一部I B散剂0115散剂二部I P散剂三部I K散剂一部I H糖浆剂0116糖浆剂二部I K糖浆剂一部I V搽剂洗剂涂膜剂(指搽剂)0117搽剂二部I T搽剂涂剂涂膜剂(指搽剂)二部I T搽剂涂剂涂膜剂(指涂剂)0118涂剂三部I D外用制剂一部I V搽剂洗剂涂膜剂(指涂膜剂)0119涂膜剂二部I T搽剂涂剂涂膜剂(指涂膜剂)一部I N酊剂0120酊剂二部I C酊剂一部I I 贴音剂(指贴剂)0121贴剂二部I V贴剂0122贴裔剂一部I I贴音剂0123口服溶液剂口服混悬剂口服乳剂二部I o口服溶液剂口服混悬剂口服乳剂0124植人剂二部I J植人剂0125膜剂二部I M膜剂0126耳用制剂二部I Q耳用制剂-部I V搽剂洗剂涂膜剂(指洗剂)0127洗剂二部I s洗剂冲洗剂灌肠剂(指洗剂)一部I V搽剂洗剂涂膜剂(指洗剂)0128冲洗剂二部I S洗剂冲洗剂灌肠剂(指冲洗剂〉0129灌肠剂二部I S 洗剂冲洗剂灌肠剂(指灌肠剂)0181合剂一部I J 合剂0182锭剂一部I E锭剂0183煎膏剂(裔滋)一部I F煎裔剂(裔滋)0184胶剂一部I G胶剂0185酒剂—部I M酒剂0186裔药一部I P裔药0187露剂一部I S露剂0188茶剂一部I T茶剂0189流浸裔剂与浸資剂一部I o流浸裔剂与浸裔剂0200其他通则0211药材和饮片取样法一部n a药材和饮片取样法0212药材和饮片检定通则一部n b药材和饮片检定通则0213'炮制通则一部n d炮制通则0251药用辅料二部n药用辅料• 426 •中国药典2015年版《中国药典》2015年版通则编码与2010年版附录编码对照表续表.....编号通则名称原附录原附录名称0261制药用水-部m制药用水二部m制药用水0291国家药品标准物质通则新增第二增补本03000301一般鉴别试验一部w一般鉴别试验二部i n一般鉴别试验0400光谱法一部Y分光光度法二部W分光光度法三部n分光光度法0401紫外-可见分光光度法一部V A紫外-可见分光光度法二部IV A 紫外-可见分光光度法三部n a紫外-可见分光光度法0402红外分光光度法一部V c红外分光光度法二部i v c红外分光光度法0405荧光分光光度法二部N E荧光分析法三部n c荧光分析法0406原子吸收分光光度法一部V D原子吸收分光光度法二部IV D原子吸收分光光度法三部n b原子吸收分光光度法0407火焰光度法二部IV F火焰光度法三部n d火焰光度法0411电感耦合等离子体原子发射光谱法一部H E电感耦合等离子体原子发射光谱法0412电感耦合等离子体质谱法一部H D电感耦合等离子体质谱法0421拉曼光谱法二部XK L拉曼光谱法指导原则0431质谱法.二部IX J 质谱法0441核磁共振波谱法二部IX K 核磁共振波谱法0451X射线衍射法二部IX F X射线粉末衍射法0500色谱法0501纸色谱法一部YI A 纸色谱法二部V A纸色谱法三部m a纸色谱法0502薄层色谱法一部VI B 薄层色谱法二部V B薄层色谱法0511柱色谱法一部yi c柱色谱法二部v c柱色谱法0512髙效液相色谱法-部VI D髙效液相色谱法二部V D高效液相色谱法三部冚 B 髙效液相色谱法0513离子色谱法一部YI G离子色谱法二部V J 离子色谱法三部m e离子色谱法• 427《中国药典》2015年版通则编码与2010年版附录编码对照表中国药典2015年版续表编号通则名称原附录原附录名称0514分子排阻色谱法二部V H 分子排阻色谱法三部m d分子排阻色谱法一部V I E 气相色谱法0521气相色谱法二部V E 气相色谱法三部in c气相色谱法0531超临界流体色谱法新增0532临界点色谱法新增二部V F 电泳法三部W A 醋酸纤维素薄膜电泳法0541电泳法三部IV B 琼脂糖凝胶电泳法三部N C SD&聚丙烯酰胺凝胶电泳法三部IV D 等电聚焦电泳法0542毛细管电泳法一部二部V I F毛细管电泳法V G 毛细管电泳法0600物理常数测定法0601相对密度测定法一部1 A 相对密度测定法二部yi a相对密度测定法0611馏程测定法一部W B 馏程测定法二部V I B馏程测定法0612熔点测定法一部M C 熔点测定法二部*V I C 熔点测定法0613凝点测定法一部1D凝点测定法二部VI D凝点测定法0621旋光度测定法一部1E旋光度测定法二部E旋光度测定法0622折光率测定法一部m f折光率测定法二部V I F折光率测定法一部1G p H值测定法0631p H值测定法二部V I H p H值测定法三部V A p H值测定法一部X I F渗透压摩尔浓度测定法0632渗透压摩尔浓度测定法二部K G 渗透压摩尔浓度测定法三部V H渗透压摩尔浓度测定法0633黏度测定法二部V I G黏度测定法0661热分析法二部1Q 热分析法0681制药用水电导率测定法二部1S制药用水电导率测定法0682制药用水中总有机碳测定法二部1R 制药用水中总有机碳测定法0700其他测定法0701电位滴定法与永停滴定法一部1 A 电位滴定法与永停滴定法二部I A 电位滴定法与永停滴定法%0702非水溶液滴定法一部1B非水溶液滴定法二部M B 非水溶液滴定法• 428中国药典2015年版《中国药典》2015年版通则编码与2010年版附录编码对照表续表编号通则名称原附录原附录名称0703氧瓶燃烧法二部1 C 氧瓶燃烧法一部K L氮测定法0704氮测定法二部1D氮测定法三部M l A氮测定法一部K M乙醇量测定法0711乙醇量测定法二部\I E乙醇量测定法0712甲氧基、乙氧基与羟丙氧基测定法二部\l F甲氧基、乙氧基与羟丙氧基测定法一部IX N脂肪与脂肪油測定法0713脂肪与脂肪油测定法二部1H脂肪与脂肪油测定法0721维生素A测定法二部1J 维生素A测定法0722维生素D测定法二部1K维生素D测定法二部1M蛋白质含量测定法0731蛋白质含量测定法三部YI B蛋白质测定法0800限量检査法一部H C氯化物检査法0801氣化物检查法二部1A氯化物检查法0802硫酸盐检查法二部1B硫酸盐检查法0803硫化物检査法二部1 C 硫化物检查法0804硒检查法二部1D砸检查法0805氟检查法二部1E氟检查法二部1F氰化物检查法0806氰化物检查法三部YI X氮化物残留量测定法一部IX D铁盐检查法0807铁盐检查法二部1G铁盐检查法0808铵盐检查法二部1K铵盐检查法一部K E重金属检査法0821重金属检查法二部1H重金属检查法一部IX F砷盐检查法0822砷盐检査法二部1J 砷盐检查法一部K G干燥失重测定法0831干燥失重测定法二部1L干燥失重测定法三部W L干燥失重测定法一部K H水分测定法0832水分测定法二部坩M水分测定法三部\I D水分测定法一部K J 炽灼残渣检查法0841炽灼残渣检查法二部W N炽灼残渣检查法0842易炭化物检查法二部1C) 易炭化物检查法二部1P残留溶剂测定法0861残留溶剂测定法三部VI V残留溶剂测定法0871甲醇量检查法一部IX T甲醇量检查法0872合成多肽中的醋酸测定法二部1N合成多肽中的醋酸测定法429《中国药典》2015年版通则编码与2010年版附录编码对照表中国药典2015年版续表编号通则名称原附录原附录名称08732-乙基己酸测定法二部1L2-乙基己酸测定法0900特性检査法0901溶液颜色检查法一部H A溶液颜色检查法二部K A溶液颜色检查法0902澄清度检查法二部I X B澄清度检査法一部I X R不溶性微粒检查法0903不溶性微粒检查法二部I X c不溶性微粒检査法三部V I不溶性微粒检査法一部X I c可见异物检查法0904可见异物检査法二部I X H可见异物检查法三部V B 可见异物检査法一部M A崩解时限检查法0921崩解时限检查法二部\A崩解时限检查法三部V C崩解时限检查法一部1B融变时限检查法0922融变时限检査法二部I B融变时限检査法三部V D 融变时限检查法0923片剂脆碎度检查法二部X G片剂脆碎度检査法三部V E 片剂脆碎度检査法0931溶出度与释放度测定法二部X C溶出度测定法二部I D释放度测定法0941含量均匀度检查法二部X E 含量均匀度检查法—部a C最低装量检査法0942最低装量检查法二部\F最低装量检查法三部V F最低装量检查法0951吸人制剂微细粒子空气动力学特性测定法二部吸人气雾剂、吸人粉雾剂、吸入喷雾剂的雾滴(粒)X H分布测定法0952黏附力测定法一部1 E 贴膏剂黏附力测定法二部I J贴剂黏附力测定法0981结晶性检查法二部K D结晶性检查法一部X I B粒度测定法0982粒度和粒度分布测定法二部K E 粒度和粒度分布测定法三部V G粒度测定法0983锥入度测定法二部I K 锥入度测定法1100生物检査法一部I I B无菌检查法1101无菌检查法二部X I H 无菌检查法三部W A无菌检查法非无菌产品微生物限度检査:微生物计数法一部m c微生物限度检查法1105二部H J微生物限度检查法%三部I G微生物限度检査法• 430 •中国药典2015年版《中国药典》2015年版通则编码与2010年版附录编码对照表续表4编号通则名称原附录原附录名称非无菌产品微生物限度检查:控制菌检查法一部X I O c微生物限度检査法1106二部X I J微生物限度检査法三部M G微生物限度检查法一部X D I C微生物限度检查法1107非无菌药品微生物限度标准二部X I J微生物限度检査法三部M G微生物限度检査法一部X I D抑菌剂效力检查法指导原则1121抑菌效力检查法二部X I X N抑菌剂效力检査法指导原则三部X I A抑菌剂(防腐剂)效力检查法指导原则一部X f f l E异常毒性检查法1141异常毒性检查法二部X I c异常毒性检査法三部I F异常毒性检査法一部m a热原检査法1142热原检查法二部X I D热原检査法三部M D热原检查法一部X f f l D细菌内毒素检查法1143细菌内毒素检査法二部X I E细菌内毒素检査法三部1E细菌内毒素检查法1144升压物质检查法二部X I F升压物质检查法1145降压物质检查法一部m f降压物质检査法二部X I G降压物质检査法1146组胺类物质检查法新增1147过敏反应检查法一部X I I G过敏反应检査法二部X I K过敏反应检査法1148溶血与凝聚检查法—部X f f l H溶血与凝聚检査法二部X I L溶血与凝聚检查法1200生物活性测定法1201抗生素微生物检定法二部X I A抗生素微生物检定法1202青霉素酶及其活力测定法二部X I B青霉素酶及其活力测定法1205升压素生物测定法二部1A升压素生物测定法1206细胞色素C活力测定法二部I B细胞色素C活力測定法1207玻璃酸酶测定法二部m C玻璃酸酶测定法1208肝素生物测定法二部M D肝素生物测定法1209绒促性素生物测定法二部1E绒促性素生物测定法1210缩宫素生物测定法二部M F缩宫素生物测定法1211胰岛素生物测定法二部M G胰岛素生物测定法1212精蛋白锌胰岛素注射液延缓作用测定法二部I H精蛋白锌胰岛素注射液延缓作用测定法1213硫酸鱼精蛋白生物测定法二部1J硫酸鱼精蛋白生物测定法1214洋地黄生物测定法二部孤K洋地黄生物测定法1215葡萄糖酸锑钠毒力检查法二部I L葡萄糖酸锑钠毒力检查法1216卵泡刺激素生物测定法二部M M卵泡刺激素生物测定法1217黄体生成素生物测定法二部1N黄体生成素生物测定法431《中国药典》2015年版通则编码与2010年版附录编码对照表中国药典2015年版续表编号通则名称原附录原附录名称1218降钙素生物测定法二部1O降钙素生物测定法1219生长激素生物测定法二部1P 生长激素生物测定法1401放射性药品检定法二部X I放射性药品检定法一部n灭菌法1421灭菌法二部X I灭菌法三部XV 灭菌法1431生物检定统计法二部X W生物检定统计法2000中药其他方法2001显微鉴别法一部n c显微鉴别法2101膨胀度测定法一部IX () 膨胀度测定法2102裔药软化点测定法一部1D裔药软化点测定法2201浸出物测定法一部X A浸出物测定法2202鞣质含量测定法一部X B鞣质含量测定法2203桉油精含量测定法一部X c桉油精含量测定法2204挥发油测定法一部I D挥发油测定法2301杂质检査法一部IX A杂质检查法2302灰分测定法一部K K灰分测定法2303酸败度测定法一部IX P 酸败度测定法2321铅、镉、砷、汞、铜测定法一部IX B 铅、镉、砷、汞、铜测定法2322汞和砷元素形态及其价态测定法新增2331二氧化硫残留量测定法一部IX u二氧化硫残留量测定法2341农药残留量测定法一部IX Q农药残留量测定法2351黄曲霉毒素测定法一部IX V黄曲霉毒素测定法2400注射剂有关物质检查法一部K S 注射剂有关物质检查法3000生物制品相关检査方法3100含量测定法3101固体总量测定法三部1M固体总量测定法3102唾液酸测定法三部yi c唾液酸测定法3103磷测定法三部W A磷测定法3104硫酸铵测定法三部w c硫酸铵测定法3105亚硫酸氢钠测定法三部I E亚硫酸氢钠测定法3106氢氧化铝(或磷酸铝)测定法三部1F氢氧化铝(或磷酸铝)测定法3107氣化钠测定法三部I G氯化钠测定法3108枸橼酸离子测定法三部I H枸橼酸离子测定法3109钾离子测定法三部1I钾离子测定法3110钠离子测定法三部I J 钠离子测定法3111辛酸钠测定法三部V I K辛酸钠测定法3112乙酰色氨酸测定法三部VI W乙酰色氨酸测定法3113苯酚测定法三部V I M苯酚测定法3114间甲酚测定法三部VI N间甲酚测定法3115'硫柳汞测定法三部1B硫柳汞测定法432中国药典2015年版《中国药典》2015年版通则编码与2010年版附录编码对照表续表编号通则名称原附录原附录名称对羟基苯甲酸甲酯、对羟基苯甲酸丙酯含三部M l T对羟基苯甲酸甲酯、对羟基苯甲酸丙酯含量测定法3116量测定法3117O-乙酰基测定法三部M l F O乙酰基测定法3118己二酰肼含量测定法三部1K己二酰肼含量测定法3119高分子结合物含量测定法三部L高分子结合物含量测定法3120人血液制品中糖及糖醇测定法三部VI P人血液制品中糖及糖酵测定法3121人血白蛋白多聚体测定法三部yi Q人血白蛋白多聚体测定法人免疫球蛋白类制品Ig G单体加二聚体测三部yi r人免疫球蛋白类制品i g G单体加二聚体测定法3122定法3123人免疫球蛋白中甘氨酸含量测定法三部S 人免疫球蛋白中甘氨酸含量测定法3124重组人粒细胞刺激因子蛋白质含量测定法三部yi u重组人粒细胞刺激因子蛋白质含量测定法3125组胺人免疫球蛋白中游离磷酸组胺测定法三部V I E组胺人免疫球蛋白中游离磷酸组胺测定法3126I g G含量测定法三部H K I g G含量测定法3127单抗分子大小变异体测定法新增3200化学残留物测定法3201乙醇残留量测定法三部Y I D乙醇残留量测定法3202聚乙二醇残留量测定法三部V I G聚乙二醇残留量测定法3203聚山梨酯80残留量测定法三部Y I H聚山梨酯80残留量测定法3204戊二醛残留量测定法三部V I I戊二醛残留量测定法3205磷酸三丁酯残留量测定法三部V I J磷酸三丁酯残留量测定法3206碳二亚胺残留量测定法三部V I Y碳二亚胺残留量测定法3207游离甲醛测定法三部Y I L游离甲醛测定法3208人血白蛋白铝残留量测定法三部1K人血白蛋白铝残留量测定法3209羟胺残留童测定法新增3300微生物检査法3301支原体检査法三部M B支原体检查法3302外源病毒因子检査法三部1C病毒外源因子检査法3303鼠源性病毒检査法三部I H 鼠源性病毒检查法3304S V40核酸序列检査法三部I X H S V40核酸序列检査法3305猴体神经毒力试验三部X I L猴体神经毒力试验血液制品生产用人血浆病毒核酸检测技术新增3306要求3400生物澜定法3401免疫印迹法三部V I A 免疫印迹法3402免疫斑点法三部11 B 免疫斑点法3403免疫双扩散法1三部11 C免疫双扩散法3404免疫电泳法三部1 D 免疫电泳法3405肽图检查法三部1E肽图检查法3406质粒丢失率检査法三部I X G质粒丢失率检査法3407外源性D N A残留量测定法三部K B外源性D N A残留量测定法3408抗生素残留量检查法三部I X A抗生素残留量检查法3409激肽释放酶原激活剂测定法三部I X F激肽释放酶原激活剂测定法433《中国药典》2015年版通则编码与2010年版附录编码对照表中国药典2015年版续表编号通则名称原附录原附录名称3410抗补体活性测定法三部I X K抗补体活性测定法3411牛血清白蛋白残留量测定法三部1I牛血清白蛋白残留量测定法3412大肠杆菌菌体蛋白质残留量测定法三部I X C大肠杆菌菌体蛋白质残留量测定法3413假单胞菌菌体蛋白质残留量测定法三部I X D假单胞菌菌体蛋白质残留量测定法3414酵母工程菌菌体蛋白质残留量测定法三部K E酵母工程菌菌体蛋白质残留量测定法3415类A血型物质测定法三部K I类A血型物质测定法3416鼠I g G残留量测定法三部I X L鼠I g G残留量测定法3417无细胞百日咳疫苗鉴别试验三部I X s无细胞百日咳疫苗鉴别试验3418抗毒素、抗血清制品鉴别试验三部K T 抗毒素、抗血清制品鉴别试验3419A群脑膜炎球菌多糖分子大小测定法三部1G A群脑膜炎球菌多糖分子大小测定法3420伤寒V i多糖分子大小测定法三部I H 伤寒V i多糖分子大小测定法3421b型流感嗜血杆菌结合疫苗多糖含量测定法三部m J b型流感嗜血杆菌结合疫苗多糖含量测定法3422人凝血酶活性检查法三部I X N人凝血酶活性检查法3423活化的凝血因子活性检查法三部I X0活化的凝血因子活性检查法3424肝素含量测定法三部I X P 肝素含量测定法3425抗A、抗B血凝素测定法三部K J抗A、抗B血凝素测定法3426人红细胞抗体测定法三部I X Q人红细胞抗体测定法3427人血小板抗体测定法三部I X R人血小板抗体测定法3500生物活性/效价测定法3501重组乙型肝炎疫苗(酵母)体外相对效力检査法三部\A重组乙型肝炎疫苗(酵母)体外相对效力检查法3502甲型肝炎灭活疫苗体外相对效力检查法三部I S 甲型肝炎灭活疫苗体外相对效力检査法3503人用狂犬病疫苗效价测定法三部X I A人用狂犬病疫苗效价测定法3504吸附破伤风疫苗效价测定法三部XI B 吸附破伤风疫苗效价测定法3505吸附白喉疫苗效价测定法三部X I C吸附白喉疫苗效价测定法3506类毒素絮状单位测定法三部X I D 类毒素絮状单位测定法3507白喉抗毒素效价测定法三部XI E 白喉抗毒素效价测定法3508破伤风抗毒素效价测定法三部X I F破伤风抗毒素效价测定法3509气性坏疽抗毒素效价测定法三部X I G气性坏疽抗毒素效价测定法3510肉毒抗毒素效价测定法三部X I H 肉毒抗毒素效价测定法3511抗蛇毒血清效价测定法三部X I I抗蛇毒血清效价测定法3512狂大病免疫球蛋白效价测定法三部X I J 狂犬病免疫球蛋白效价测定法3513人免疫球蛋白中白喉抗体效价测定法三部I0人免疫球蛋白中白喉抗体效价测定法3514人免疫球蛋白F c段生物学活性测定法三部I P 人免疫球蛋白F c段生物学活性测定法3515抗人T细胞免疫球蛋白效价测定法(E玫瑰花环形成抑制试验)三部抗人T细胞免疫球蛋白效价测定法(E玫瑰花环形成X Q抑制试验)3516抗人T细胞免疫球蛋白效价测定法(淋巴细胞毒试验)三部抗人T细胞免疫球蛋白效价测定法(淋巴细胞X R毒试验)3517人凝血因子n效价测定法三部x j人凝血因子n效价测定法3518人凝血因子V I[效价测定法三部X K人凝血因子V I I效价测定法3519^人凝血因子I X效价测定法三部X L 人凝血因子K效价测定法3520人凝血因子X效价测定法三部X M人凝血因子X效价测定法• 434 •中国药典2015年版《中国药典》2015年版通则编码与2010年版附录编码对照表续表«编号通则名称原附录原附录名称3521人凝血因子V I E效价测定法三部X N人凝血因子1效价测定法3522重组人促红素体内生物学活性测定法三部I B重组人促红素体内生物学活性测定法3523干扰素生物学活性测定法三部I C 干扰素生物学活性测定法3524重组人白介素-2生物学活性测定法三部I D重组人白介素-2生物学活性测定法3525重组人粒细胞剌激因子生物学活性测定法三部X E重组人粒细胞刺激因子生物学活性测定法重组人粒细胞巨噬细胞剌激因子生物学活三部\F重组人粒细胞巨噬细胞剌激因子生物学活性测定法3526性测定法重组牛碱性成纤维细胞生长因子生物学活三部X G重组牛碱性成纤维细胞生长因子生物学活性测定法3527性测定法3528重组人表皮生长因子生物学活性测定法三部I H重组人表皮生长因子生物学活性测定法3529重组链激酶生物学活性测定法三部I I 重组链激酶生物学活性测定法3530鼠神经生长因子生物学活性测定法新增3531尼妥珠单抗生物学活性测定法新增3532重组人白介素-11生物学活性测定法新增3533A型肉毒毒素效价测定法新增3600特定生物原材料/动物3601无特定病原体鸡胚质量检测要求三部XII A无特定病原体鸡胚质量检测要求m b实验动物微生物学检测要求3602实验动物微生物学检测要求三部m c实验动物寄生虫学检测要求3603实验动物寄生虫学检测要求三部3604新生牛血淸检测要求三部XI D新生牛血清检测要求3605细菌生化反应培养基三部X I V细菌生化反应培养基37003701生物制品国家标准物质目录新增试剂与标准物质8000一部XV A试药8001试药二部XV A试药一部XV B试液8002试液二部I V B试液一部I V c试纸8003试纸二部I V C 试纸一部I V D缓冲液8004缓冲液二部X V D缓冲液一部XV E指示剂与指示液8005指示剂与指示液二部X V E指示剂与指示液一部XV F滴定液8006滴定液二部XV F滴定液8061对照品对照药材对照提取物—部X V G对照品对照药材对照提取物8062标准品与对照品二部I V G 标准品与对照品9000指导原则9001原料药物与制剂稳定性试验指导原则二部XIX c原料药与药物制剂稳定性试验指导原则• 435 •《中国药典》2015年版通则编码与2010年版附录编码对照表中国药典2015年版续表编号通则名称原附录原附录名称9011药物制剂人体生物利用度和生物等效性试验指导原则二部药物制剂人体生物利用度和生物等效性试验指导XIX B原则9012生物样品定量分析方法验证指导原则新增9013缓释、控释和迟释制剂指导原则二部XIX D 缓释、控释和迟释制剂指导原则9014微粒制剂指导原则二部XIX E 微襄、微球与脂质体制剂指导原则9015药品晶型研究及晶型质量控制指导原则新增9101药品质量标准分析方法验证指导原则一部二部X I A 中药质量标准分析方法验证指导原则m A 药品质量标准分析方法验证指导原则9102药品杂质分析指导原则二部XIX F 药品杂质分析指导原则9103药物引湿性试验指导原则二部X K J 药物引湿性试验指导原则9104近红外分光光度法指导原则二部XIX K 近红外分光光度法指导原则9105中药生物活性测定指导原则一部X I C 中药生物活性测定指导原则9106基于基因芯片的药物评价技术与方法指导原则新增9107中药材D N A条形码分子鉴定法指导原则新增一部X I E 药品微生物检验替代方法验证指导原则9201药品微生物检验替代方法验证指导原则二部XIX 0药品微生物检验替代方法验证指导原则三部X I B 药品微生物检验替代方法验证指导原则9202非无菌产品微生物限度检查指导原则一部二部11 F 微生物限度检查法应用指导原则XIX P 微生物限度检查法应用指导原则9203药品微生物实验室质量管理指导原则一部二部11G 药品微生物实验室规范指导原则XIX Q 药品微生物实验室规范指导原则9204微生物鉴定指导原则新增9205药品洁净实验室微生物监测和控制指导原则新增9206无菌检査用隔离系统验证指导原则新增9301注射剂安全性检査法应用指导原则—部二部I I B 中药注射剂安全性检查法应用指导原则XIX M 化学药品注射剂安全性检査法应用指导原则9302中药有害残留物限量制定指导原则新增9303色素测定法指导原则新增9304中药中铝、铬、铁、钡元素测定指导原则新增9305中药中真菌毒素测定指导原则新增9501正电子类放射性药品质量控制指导原则二部M G 正电子类放射性药品质量控制指导原则9502锝[99m T c]放射性药品质量控制指导原则二部XIX H 得[99™Tc]放射性药品质量控制指导原则9601药用辅料功能性指标研究指导原则新增9621药包材通用要求指导原则新增9622药用玻璃材料和容器指导原则新增9901国家药品标准物质制备指导原则新增第二增补本• 436。

中国药典标准品《中华人民共和国药典》(简称《中国药典》)2015年版,药典包括凡例、正文及附录,是药品研制、生产、经营、使用和监督管理等均应遵循的法定依据。
所有国家药品标准应当符合中国药典凡例及附录的相关要求。
新版药典进一步扩大药品品种的收载和修订,共收载品种5608种。
一部收载品种2598种,其中新增品种440种。
二部收载品种2603种,其中新增品种492种。
三部收载品种137种,其中新增品种13种、修订品种105种。
首次将上版药典附录整合为通则,并与药用辅料单独成卷作为新版药典四部。
四部收载通则总数317个,其中制剂通则38个、检测方法240个、指导原则30个、标准物质和对照品相关通则9个;药用辅料收载270种,其中新增137种、修订97种。
标准品,即标准物品,是中药标准对照品研究中心代理的作为一种衡量标准;用做药物方面,则为含量测定中的标准含量。
标准品包括化学计量标准品、冶金标准品和药检标准品。
对照品和标准品一样是指国家药品标准中用于鉴别、检查、含量测定、杂质和有关物质检查等标准物质,它是国家药品标准不可分割的组成部分。
国家药品标准物质是国家药品标准的物质基础,它是用来检查药品质量的一种特殊的专用量具;是测量药品质量的基准;也是作为校正测试仪器与方法的物质标准。
在药品检验中,它是确定药品真伪优劣的对照,是控制药品质量必不可少的工具。
对照品:是指用于鉴别、检查、含量测定的标准物质,由国务院药品监督管理部门指定的单位制备、标定和供应。
标准品系是用于生物测定、抗生素或生化药品中含量或效价测定的标准物质,以国际标准品进行标定;对照品除另有规定外,按干燥进行计算后使用。
药智数据国内顶级医药健康产业数据服务平台,拥有100余个专业数据库,提供研发、生产、销售、使用、监管等医药全产业链数据查询与定制服务,里面有中国药典,标准品详细查询。


2016年《检验检测机构资质认定评审准则》质量管理体系文件换版实施方案
国家认监委新近颁布的《检验检测机构资质认定评审准则》于2016年1月1日起正式实施,省质监局要求“已获证检验检测机构应于2016年6月30日前按照‘新准则’要求补充完善质量管理体系,完成换版。
”为了做好中心资质认定有关工作,保证新准则的顺利实施、平稳过渡,特制定中心体系文件修改办法如下:
一、依据
《检验检测机构资质认定评审准则》、检验检测机构资质认定管理办法》(总局令第163号)
二、领导小组
组长:XXX
成员:XXX XXX XXX XXX
三、时间安排
1、3月7日-3月11日管理体系框架
2、3月14日-3月25日质量手册全面修改
3、3月28日-4月8日程序文件修订
4、4月11日-4月15日体系文件审核
5、4月18日-4月22日体系文件批准
6、4月29日体系文件宣贯
7、5月-7月新体系文件试运行并征求意见
8、8月初修改、定稿、印刷
9、8月中旬 2016年附加内审
10、9月中旬 2016年附加管理评审
四、工作流程
五、工作要求
管理体系的建立是为实现质量方针、目标的一组相互联系、相互作用的要素的集合。
应具有系统、全面、有效、适用的特征,各要素相互依赖、配合、促进、制约,形成具有一定活动规律的有机整体,对各项活动覆盖、有效控制,具备预防措施和纠正措施功能,可不断改进。
5.1质量手册的修改
质量手册是按照质量方针、目标和适用的质量体系标准描述管理体系的要求。
应能反映质量管理体系总貌,内容清楚、准确、全面、适用、易懂。
表1新版质量手册框架及修改分工表。



1.药物标准:根据药物自身的理化与生物学特性,按照批准的来源、处方、生产、工艺、贮藏运输条件等所制定的,用以检验药品质量是否达到用药要求并衡量其质量是否稳定均一的技术规定。
2.性状:是对药物的外观、嗅味、溶解度以及物理常数等的规定,反映了药物特有的物理性质。
3.熔点:一种物质按规定方法测定,由固体熔化成液体的温度熔融同时分解的温度或在熔化时自初熔到全熔的一段温度。
4.比旋度:在一定波长和温度下,偏振光透过长1dm且每1ml中含有旋光性物质1g的溶液时测得的旋光度。
5.吸收系数:在给定的波长、溶剂和温度等条件下,吸光物质在单位浓度、单位液层厚度时的吸收度称为吸收系数。
6.一般鉴别试验:依据某一类药物的化学结构或者理化性质的特性,通过化学反应来鉴别药物的真伪。
7.专属鉴别试验:根据每一种药物化学结构的差异及其所引起的理化性质的不同,选用某些特有的、灵敏的定性反应来判断药物的真伪。
8.比移值:薄层色谱法中原点到斑点中心的距离与原点到溶剂前沿的距离的比值。
(百度)9.色谱鉴别法:利用不同物质在不同色谱条件下,产生各自的特征色谱行为(比移值或保留时间)进行的鉴别试验。
标准物质:系指供试品中物理和化学测试及生物方法试验用,具有确定特性量值,用于校准设备、评价测量方法或者给供试药品赋值的物质,包括标准品、对照品、对照药材、参考品。
10.标准品:用于生物鉴定、抗生素或生化药品中含量或效价测定的标准物质。
按效价单位(或μg)计,以国际标准品标定。
11.对照品,:用于结构确切物质(如化学药)分析。
按干燥品(或无水物)进行计算后使用。
12.鉴别:根据药物的某些物理、化学或生物学等特性所进行的试验,以判定药物的真伪。
13.检查:是对药物的安全性、有效性、均一性和纯度四个方面的状态所进行的试验分析。
14.制剂的规格:制剂的规格,系指每一支、片或其他每一个单位制剂中含有主药的重量(或效价)或含量(%)或装量,即制剂的标示量。

附件:《中国药典》2010年版二部附录修订内容附录Ⅲ一般鉴别试验书页号:《中国药典》2010年版一部附录20水杨酸盐(1)■取供试品的中性或弱酸性稀溶液■【修订】,加三氯化铁试液1滴,即显紫色。
芳香第一胺类■取供试品50mg,加稀盐酸1ml,必要时缓缓煮沸使溶解,加0.1mol/L亚硝酸钠溶液数滴,加与0.1mol/L亚硝酸钠溶液等体积的1mol/L脲溶液,振摇1分钟,滴加碱性β-萘酚试液数滴,视供试品不同,生成由粉红到猩红色沉淀。
■【修订】附录ⅧK铵盐检查法书页号:《中国药典》2010年版一部附录59标准氯化铵溶液的制备■称取氯化铵29.7mg■【订正】,臵1000ml 量瓶中,加水适量使溶解并稀释至刻度,摇匀,即得(每1ml相当于10μg的NH4)。
附录ⅧQ热分析法■热分析法是利用温度和(或)时间关系来准确测量物质理化性质变化的关系,研究物质受热过程所发生的晶型转变、熔融、蒸发、脱水等物理变化或热分解、氧化等化学变化以及伴随发生的温度、能量或重量改变的方法。
物质在加热或冷却过程中,当发生相变或化学反应时,必然伴随着热量的吸收或释放。
同时根据相律,物相转化时的温度(如熔点、沸点等)保持不变。
纯物质具有特定的物相转换温度和相应的热焓变化值(△H)。
这些常数可用于物质的定性分析,而供试品的实际测定值与这些常数的偏离及其偏离程度又可用于定量检查样品的纯度。
热分析法可广泛应用于物质的多晶型、物相转化、结晶水、结晶溶剂、热分解以及药物的纯度、相容性与稳定性等研究中。
一、热重分析热重分析是在程序控制温度下,测量物质的质量与温度关系的一种技术。
记录的重量变化与温度或时间的关系曲线即热重曲线(TG 曲线)。
由于物相变化(如失去结晶水、结晶溶剂,或热分解等)时的温度保持不变,所以热重曲线通常呈台阶状,重量基本不变的区段称平台。
利用这种特性,可以方便地区分样品中所含水分是吸附水(或吸附溶剂)还是结晶水(或结晶溶剂),并根据平台之间的失重率可以计算出所含结晶水(或结晶溶剂)的分子比。

F了萨中华人民共和国国家计量技术规范JJF 1 186——2007标准物质认定证书和标签内容编写规则The R ul es for D r a ft i n g of Co n t e n t s for C e rt i fi c a te s an dLabels of Ce rt if ie d R c!fe re nc e Materials2007—12—10发布2008—03—10实施国家质量监督检验检疫总局发布标准物质认定证书和标签内容£、编写规则{JJF1186~2007 l T h e Rul髑f栅Dmfti鸭。
f C。
nt蛐ts for Certifi∞t豁{h㈣wm~}一~pa n d I盘beis of Cer tine d Refe ren ce Materials本规范经国家质量监督检验检疫总局于2007年12月10日批准,并自2008年3月10日起施行。
归口单位i全国标准物质管理委员会起草单位:中国计量科学研究院本规范由全国标准物质管理委员会负责解释本规范主要起草人:于亚东(中国计量科学研究院) 倪晓丽(中国计量科学研究院)参加起草人:邵明武(中国计量科学研究院) 赵敏(中国计量科学研究院) 吴方迪(中国计量科学研究院) 卢晓华(中国计量科学研究院) 修宏宇(中国计量科学研究院)目录1范围12引用文献 1 3术语和定义 l4总则14.1证书编写的一般要求 1 4.2标签编写的一般要求 2 4.3证书和标签的表述要求 26证书内容 ;l /25证书的结构 26.1封面 · ..26.2证书正文 3 7证书附件 5 8标签 5 附录A 国家一级标准物质认定证书封面格式 6 附录B 国家二级标准物质认定证书封面格式 7 附录c 标准物质认定证书正文目次 8 附录E 参考文献v V ;9“^、i附录D 标准物质标签格式标准物质认定证书和标签内容编写规则本规则等效采用ISO Guide 31:2000 Reference materials--Contents of certificates and labels的内容,同时为适合我国国情,保留了JJG 1006--1994《一级标准物质技术规范》中行之有效的内容。

XXXX版中国药典知识1.2010年版中国药典概况凡例、正文、附录、标准物质(对比品、对比药材、对比提取物、标准品)组成完整的药品标准。
了解《凡例》十分重要。
其包含:总则;正文;附录;名称与编排;项目与要求;检验方法和限度;对比品;对比药材、对比品提取物、标准品;计量;周密度;试药、试剂、指示剂;动物实验;讲明书、包装、标签等。
一、二、三部内容略有不同。
2010年版《中国药典》是新中国成立以来第9版药典,于2010年7月1日起正式执行.本版药典收载品种总计4567个,其中新增品种1386个;药典一部收载药材及饮片、植物油脂和提取物、成方和单味制剂共2165个,其中新增1 019个,修订634个;药典二部收载化学药品、抗生素、生化药品、放射性药品及药用辅料共2271个,其中新增330个,修订1500个;药典三部收载生物制品131个品种,其中新增37个,修订94个;药典附录新增47个,修订154个。
正文系按照药物自身的理化与生物特性,按照批准的处方来源、生产工艺、贮藏条件等所制定的、用以检测药品质量是否能达到用药要求并衡量其质量是否稳固均一的技术规定。
附录要紧收载制剂通则、通用检测方法和指导原则。
制剂通则系按照药物剂型分类,针对剂型特点所规定的差不多技术要求;通用检测方法系各正文品种进行相同检查项目的检测时采纳的统一的设备、程序、方法及限度;指导原则系为执行药典、考察药品质量、起草与复核药品标准等所制定的指导性规定。
凡例的增修订情形新版药典凡例进行了重大修订:1)、首次在凡例中设置总则一节。
增加了“总则”一节,将中国药典中最重要、最原则、最通用、最基础的内容集中阐明,同时做到一、二、三部之凡例的体例、结构的一致性。
内容在保留特点的基础上也差不多一致。
2)、首次明确药典制定颁布依据。
新版药典凡例总则之一明确“《中华人民共和国药典》简称《中国药典》。
《中国药典》依据《中国人民共和国药品治理法》组织制定和颁布实施”。


附录8 主要标准物质一览表
标准物质名称:标准溶液第1页,共13页
主要标准物质一览表
标准物质名称:标准溶液第2页,共13页
主要标准物质一览表
标准物质名称:标准样品第3页,共13页
主要标准物质一览表
标准物质名称:标准样品第4页,共13页
主要标准物质一览表
标准物质名称:标准样品第5页,共13页
主要标准物质一览表
标准物质名称:标准样品第6页,共13页
主要标准物质一览表
标准物质名称:标准样品第7页,共13页
主要标准物质一览表
标准物质名称:标准样品第8页,共13页
主要标准物质一览表
标准物质名称:标准样品第9页,共13页
主要标准物质一览表
标准物质名称:标准样品第10页,共13页
主要标准物质一览表
标准物质名称:标准样品第11页,共13页
主要标准物质一览表
标准物质名称:标准样品第12页,共13页
主要标准物质一览表
标准物质名称:标准样品第13页,共13页。