2019-2020年九年级化学下册 第十单元 课题1《生活中的酸和碱(第1课时)》导学案 (新版)新
- 格式:doc
- 大小:24.00 KB
- 文档页数:2


第十单元酸和碱课题1 常见的酸和碱课时1 酸、碱与指示剂作用【教材分析】本课是九年级化学第十单元课题1《常见的酸和碱》第1课时。
本节内容是下册课程的学习中有着十分重要的地位,是在学习了氧气、碳及其化合物、金属等简单物质的性质和用途的基础上,更高层次的学习。
本节课的内容与日常生活、生产有着密切的联系,体现了新教材的特点,通过实验探究的方法获得感性认识,代替了枯燥的概念性文字,同时培养了学生的实验技能和创新能力,对学生今后参加社会实践具有非常重要的作用。
【教学理念】1.理论联系实际,梳理知识要点的同时,重点突出生活应用。
化学从生活中来,又走向生活中去,学会用化学知识分析和解决与生活有关的一些常见的实际问题2.教师主导,学生主体,为学生创造问题情境,启发学生思考,激活学生思维,培养学生能力【教学目标】1、知识与技能(1)初步了解生活中常见酸和碱(2)通过实验了解酸碱指示剂及其变色规律(3)了解酸碱指示剂发现过程,学会自制指示剂。
(4)用指示剂判断溶液的酸碱性,并会其原理解释生活中的现象。
2、过程与方法(1)培养学生对实验现象的观察分析能力。
(2)学会运用指示剂的知识解决实际问题(真假的鉴别紫米、变绿的鸡蛋、不同水中黑枸杞等)3、情感态度价值观(1)激发学生的好奇心和学习的兴趣,培养学生勤于思考的科学精神。
(2)注重培养学生关注和热爱生活的情感。
【教学重点】(1)掌握酸碱指示剂及其变色规律。
(2)能够利用酸碱指示剂来检验常见物质酸碱性。
【教学难点】(1)利用酸碱指示剂的变色原理解释生活中的一些现象。
【课前准备】将学生分成九组,组内进行明确的分工合作。
实验仪器:试管8支、试管架、胶头滴管8支、六孔井穴板4个实验药品:石蕊溶液、酚酞溶液、醋酸溶液、石灰水溶液、氢氧化钠溶液、盐酸溶液、自来水学生课前准备:1、查阅资料自制指示剂方法,每小组至少自制两种指示剂2、从家里带来肥皂水、洗洁精、洁厕灵、橘子水、洗发水等各种液体。

第十单元课题1 常见的酸和碱第1课时酸碱指示剂一、教材分析1、教材的地位和作用本节课内容选自人教版九年级化学下册第十单元课题一常见的酸和碱。
酸和碱是我们比较熟悉的两种物质,酸和碱的生产和使用对我国的现代化建设具有重大的作用。
本课的主要目的是认识酸和碱,并学会用酸碱指示剂鉴别酸和碱,扩大学生视野,并巩固前面所学的知识,提高学生的观察、分析能力,培养学生学习化学的兴趣。
用酸碱指示剂识别酸、碱的方法是本节课的重难点。
本课从酸碱指示剂的实验,简单地反映酸和碱能与指示剂反应并显示不同的颜色,从而说明酸和碱作为不同类物质具有不同的性质,使学生对酸和碱有一些初步的认识,会用酸碱指示剂区分酸和碱。
然后通过探究活动,学生用自带的花瓣、果实自制酸碱指示剂,并试验它们在酸溶液和碱溶液中的颜色变化,是学生感到化学知识和生活实际是紧密相连的。
2、教学目标分析知识与技能:知道酸和碱溶液能和酸碱指示剂反应;能自制酸碱指示剂,并设计完成与之有关的实验;过程与方法:通过探究活动,进一步认识与体验科学探究的过程;学会运用酸碱指示剂检验酸溶液和碱溶液。
情感态度与价值观:进一步增强探究物质的好奇心和求知欲。
3、教学重难点学会运用酸碱指示剂检验酸溶液和碱溶液。
二、学情分析对于酸碱指示剂这一内容,学生比较陌生,正因为如此,本课采用设疑的方法,激发学生的探究欲望。
进行演示实验,学生能够通过观察、透过表象看到事物的本质,探索出变色规律,形成深刻印象。
对于自制酸碱指示剂这一内容,学生比较感兴趣,所以,在教学时把课堂交给学生,自主进行探究和总结,分享探究结果,体会化学学习乐趣。
三、教法分析作为一名化学教师,不仅要传授给学生化学知识,更重要的是传授给学生化学思想和探究问题的能力。
在教学中,教师要善于引导和调动学生的学习积极性,充分激发学生的求知欲,通过设疑的方法来引导学生思考问题,在思考探究中体会学习化学的乐趣。
同时,采用实验教学的方法,更加直观具体,提高课堂效率。

《课题1 常见的酸和碱》教学目标:1、知识与技能(1)知道几种常见酸和碱的主要性质和用途。
(2)会用酸碱指示剂检验溶液的酸碱性。
(3)认识酸和碱的腐蚀性及使用时的安全注意事项。
(4)能完成简单的探究实验。
2、过程与方法(1)进一步认识和体验科学探究的过程。
(2)运用实验的方法获取信息,运用比较概括等方法对获取的信息进行加工。
(3)增强对化学现象的探究欲,发展善于合作、勤于思考的科学精神。
3、情感态度与价值观进一步增强探究物质的好奇心和求知欲。
教学重点:1、运用酸碱指示剂检验溶液的酸碱性。
2、酸碱各自相似的化学性质。
教学难点:酸和碱各自具有相似化学性质的原因。
教学过程:过渡:酸和碱对于大家来说并不陌生。
其实酸和碱不仅是生活中常见的物质,也是化学中常见的两类重要物质。
在生活中可以通过品尝辩别一些物质,而化学试剂是不允许品尝的。
我们怎么确定物质是酸还是碱?提出问题:试管中的紫色石蕊溶液,在不借助实验室中任何化学药品的情况下,能否使之变成红色?学生演示:向试管中吹气。
紫色石蕊溶液变成红色创设情境,回顾已学的知识,引入课题问题研究:是什么物质使石蕊试液变红?设问:除了碳酸,我们熟悉的食醋、盐酸、石灰水等物质能使紫色石蕊试液发生什么样的变化呢?学生回答:二氧化碳与水反应生成碳酸。
培养学生分析问题的能力演示实验:在试管内分别滴入食醋、盐酸、石灰水、氢氧化钠溶液,向其中滴加2-3滴紫色石蕊试液,观察颜色的变化。
学生观察实验,记录实验现象,培养学生观察能力资料:石蕊溶液遇酸溶液变成红色,遇碱溶液变成蓝色讨论:1、根据上述实验现象和信息,试分析这4种物质中,哪些可能是酸溶液,哪些可能是碱溶液?2、你认为紫色石蕊有什么作用?学生思考后回答:1、醋和盐酸是酸溶液,石灰水和氢氧化钠溶液是碱溶液2、紫色石蕊可用于检验酸或碱的溶液培养学生分析问题,解决问题的能力讲述:像石蕊溶液这样能跟酸或碱溶液起作用而显示不同颜色的试剂,称作酸碱指示剂。


课题1 常见的酸和碱(第一课时)【教学目标】知识与技能了解常见酸碱指示剂及其变色情况;了解几种常见的酸;认识浓硫酸的腐蚀性。
过程和方法通过自主探究实验和拟人化的活动展示,培养实验技能、分析能力及与他人交流合作能力。
情感态度和价值观使学生辩证地看待物质的利弊,掌握其性质,合理地利用它们。
【重点和难点】指示剂、浓硫酸的腐蚀性。
【实验准备】教师:锥形瓶、双孔塞、分液漏斗、玻璃导管、烧杯、玻璃棒【教学过程】【引言】在我们学习过程中,对酸并不陌生,大家回忆一下我们以前学习了那些酸的化学式:盐酸HCl 硫酸H2SO4碳酸 H2CO3在我们生活中又有哪些酸呢,请同学们说一说。
醋酸 CH3COOH 柠檬酸硝酸 HNO3我们一起来观察一下,这些酸的化学式有什么共同点 H+酸根大家一起来写一下:高锰酸锰酸氯酸的化学式【过渡】刚刚我们大概的了解的酸,我们来看一下碱,碱在我们已前的学习中好像没有什么看过,实际上我们常常遇到过,只不过老师并没有点明这种物质是碱例如:氢氧化钙 Ca(OH)2在我们生活中也有很多是碱:澄清石灰水炉具清洁剂里有 NaOH大家看一下,碱的化学式有什么共同点:金属阳离子+OH老师:酸是显酸性,碱是显性水是显中性哪么我怎么去判断溶液它是酸还是碱呢?我们通过下面的实验大家一起来学习一下二、酸碱指示剂1、定义:能跟酸或碱的溶液起作用而显示不同色的物质。
2、常见的有:石蕊溶液酚酞溶液讨论:酸碱指示剂可不可检验溶液的酸碱性的强弱呢?不能,酸碱指示剂只能判断一种溶液是酸性还是碱性,但不能判断这种酸有多强。
【过渡】为什么各种各样的酸和碱都有一样的性质呢?我们通过下面的实验给大家一样来分析一下我们知道金属能导电,我们也知道一些溶液也能导电,例如前面我们学习了水的电解知道水是几乎不导电的,但是生活中常常听过在水里被电的事情,原来在水里有些其它的物质使水能够导电了【实验】这里我们准备了盐酸、硫酸、醋酸、澄清石灰水、氢氧化钠、氯化钠固体和溶液、酒精我们现在来看看它们通不能导电?。
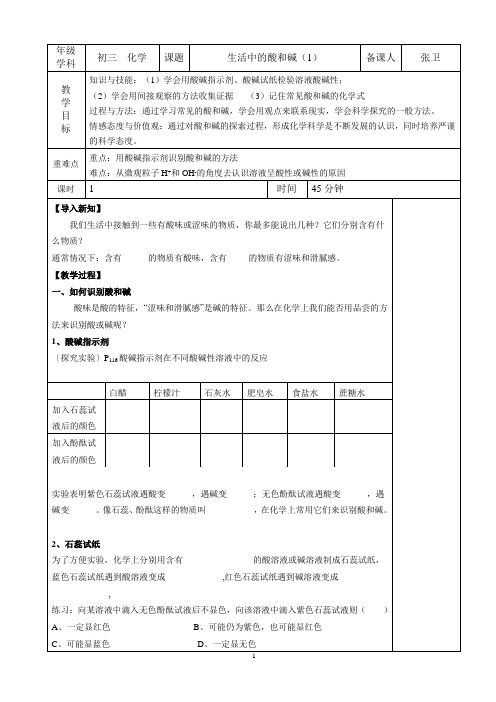
年级学科 初三 化学 课题 生活中的酸和碱(1) 备课人 张卫教 学 目 标知识与技能:(1)学会用酸碱指示剂、酸碱试纸检验溶液酸碱性; (2)学会用间接观察的方法收集证据 (3)记住常见酸和碱的化学式过程与方法:通过学习常见的酸和碱,学会用观点来联系现实,学会科学探究的一般方法。
情感态度与价值观:通过对酸和碱的探索过程,形成化学科学是不断发展的认识,同时培养严谨的科学态度。
重难点 重点:用酸碱指示剂识别酸和碱的方法难点:从微观粒子H +和OH -的角度去认识溶液呈酸性或碱性的原因课时1 时间 45分钟【导入新知】我们生活中接触到一些有酸味或涩味的物质,你最多能说出几种?它们分别含有什么物质?通常情况下:含有______的物质有酸味,含有_____的物质有涩味和滑腻感。
【教学过程】 一、如何识别酸和碱酸味是酸的特征,“涩味和滑腻感”是碱的特征。
那么在化学上我们能否用品尝的方法来识别酸或碱呢? 1、酸碱指示剂〔探究实验〕P 116酸碱指示剂在不同酸碱性溶液中的反应实验表明紫色石蕊试液遇酸变______,遇碱变______;无色酚酞试液遇酸变______,遇碱变______。
像石蕊、酚酞这样的物质叫___________,在化学上常用它们来识别酸和碱。
2、石蕊试纸为了方便实验,化学上分别用含有________________的酸溶液或碱溶液制成石蕊试纸,蓝色石蕊试纸遇到酸溶液变成_____________,红色石蕊试纸遇到碱溶液变成_____________,练习:向某溶液中滴入无色酚酞试液后不显色,向该溶液中滴入紫色石蕊试液则( ) A 、一定显红色 B 、可能仍为紫色,也可能显红色 C 、可能显蓝色 D 、一定显无色白醋 柠檬汁 石灰水 肥皂水 食盐水 蔗糖水 加入石蕊试液后的颜色加入酚酞试液后的颜色(1)指示剂与酸或碱反应,变色的是指示剂,而不是酸碱溶液。
(2)酸或碱能使指示剂变色,但能使指示剂变色的溶液不一定是酸或碱,也可能是显酸性或碱性的溶液。



【同步教育信息】一. 本周教学内容:第十单元 酸和碱课题1 常见的酸和碱二. 重点、难点:1. 知道几种常见酸和碱的主要性质和用途。
2. 会用酸碱指示剂检验溶液的酸碱性。
3. 认识酸和碱的腐蚀性及使用时的安全注意事项。
三. 教学过程:(一)常见的酸在日常生活中,我们食用过食醋,食醋有酸味,这是因为食醋中含有醋酸;一些水果有酸味,因为水果中含有各种果酸。
“酸”一词从有酸味的酒而来。
最早,在制酒的时候,有时把比较珍贵的酒放在窖中保存,在微生物的作用下,产生了酸。
在学习二氧化碳的性质时,我们学习过将二氧化碳通入水中能够生成碳酸。
除了我们熟悉的醋酸、果酸、碳酸外,在实验室中我们还知道有盐酸、硫酸等,下面,我们来学习盐酸和硫酸。
1. 盐酸:盐酸是氯化氢的水溶液。
化学名称为氢氯酸,俗称盐酸。
化学式:HCl(1)物理性质纯净的盐酸是无色液体,打开浓盐酸的瓶盖,瓶口有白雾,小心扇闻有刺激性气味,有酸味。
说明:浓盐酸具有挥发性,挥发出的氯化氢气体遇到空气中的水蒸气形成白雾。
浓盐酸具有腐蚀性。
(2)化学性质①能使紫色石蕊溶液变成红色,不能使无色酚酞溶液变色。
石蕊溶液和酚酞溶液叫做酸碱指示剂。
②能和活泼金属反应:在学习金属的化学性质中学过稀盐酸能和镁、铝、锌、铁等活泼金属反应。
Mg HCl MgCl H Al HCl AlCl H Zn HCl ZnCl H Fe HCl FeCl H +=+↑+=+↑+=+↑+=+↑226232222322222③盐酸和金属氧化物反应:将一根生锈的铁钉放在盐酸中,过一会儿,铁锈溶解在酸中,溶液呈黄色。
Fe O HCl FeCl H O 2332623+=+一些金属制品在焊接前,先用盐酸清洗表面,目的是除去金属表面的氧化层,使焊接牢(3)盐酸的用途:重要化工产品。
用于金属表面除锈、制造药物(如盐酸麻黄素、氯化锌)等;人体胃液中含有盐酸,可帮助消化。
2. 硫酸:化学式:H SO 24(1)浓硫酸的物理性质:浓硫酸是无色、粘稠的液体,难挥发,无酸味。

人教版九年级化学下册第10单元课题1 常见的酸和碱第1课时教案一、教学目标1.了解酸和碱的基本概念和特征;2.掌握酸和碱的常见性质;3.能够根据指示物的变化判断溶液的酸碱性;4.能够根据实验现象判断物质的酸碱性。
二、教学内容1.酸和碱的基本概念;2.酸和碱的常见性质;3.通过实验观察酸碱性变化。
三、教学重点1.酸和碱的基本概念;2.酸和碱的常见性质。
四、教学方法1.教师讲解;2.实验演示;3.学生实验操作;4.学生讨论。
五、教学准备1.实验器材:酸、碱和中性溶液各一份,酸碱指示剂;2.教学投影仪。
六、教学过程1. 导入新课(5分钟)教师通过展示酸和碱的一些图片、实验现象等,引起学生的兴趣和思考,带入新课内容。
2. 学习酸和碱的基本概念(10分钟)教师通过PPT讲解酸和碱的基本概念:酸是指能够溶于水形成氢离子(H+离子)的物质,呈酸性;碱是指能够溶于水形成氢氧根离子(OH-离子)的物质,呈碱性。
3. 学习酸和碱的常见性质(15分钟)教师通过PPT展示酸和碱的常见性质,并与学生进行互动讨论。
3.1 酸的常见性质•酸有酸味,酸味酸臭;•酸可以腐蚀金属;•酸可以变色指示剂;•酸溶液的pH值小于7。
3.2 碱的常见性质•碱有碱味,苦涩;•碱可以腐蚀皮肤;•碱可以变色指示剂;•碱溶液的pH值大于7。
4. 实验观察酸碱性变化(20分钟)教师将酸、碱和中性溶液放在不同的试管中,加入酸碱指示剂,演示实验过程,引导学生观察实验现象,判断溶液的酸碱性。
5. 实验报告和讨论(15分钟)学生根据实验结果和观察现象,记录实验报告,并与同伴进行讨论,互相比较实验结果,分享观察感受。
6. 总结归纳(5分钟)教师与学生一起总结酸和碱的基本概念和常见性质,并回答学生提出的问题。
七、作业完成课后习题,巩固对酸和碱的理解。
八、课堂小结本节课主要学习了酸和碱的基本概念和常见性质,并通过实验观察酸碱性变化。
通过实验和讨论,学生掌握了判断溶液酸碱性的方法,并对酸和碱有了更深入的认识。

2019-2020年九年级化学下册第十单元课题1《生活中的酸和碱(第1课时)》导学案(新
版)新人教版
学习目标:
1.学会用酸碱指示剂和酸碱试纸识别酸和碱;
2.知道酸和碱的定义,能判断所给物质的分类
3.记住常见的原子团
学习重点:酸和碱的鉴别
学习难点:从电离的角度了解酸和碱两类化合物溶于水时发生变化的特征
理解酸和碱的定义
导学过程:
一、课前预习:(10分钟)
1.把二氧化碳气体通入紫色水蕊试液中,观察到的现象是___________________________,原因是______________(用化学方程式表示),由此我们知道,二氧化碳的水溶液中含有________________它能使紫色试蕊石液变红色。
2.石蕊是()色的固体,溶于水便得到石蕊的溶液,通常叫做石蕊试液。
酚酞是一种固体能溶于酒精,通常叫酚酞试液。
它们遇到酸碱性的溶液会反应生成不同颜色的物质,人们利用这一性质来识别酸碱性,是酸碱指示剂。
(1)、上述溶液分为()()类,(2)、能否用紫色石蕊试液和无色的酚酞试液识别含有酸和碱
的溶液?()。
()(能或不能)利用无色的酚酞
试液区分碱性和中性的溶液?()
(3)酸、碱变色还是指示剂变色?如:碳酸使紫色的石蕊试
液变为红色(),石蕊试液使紫色的碳酸变为红色
()。
通常的描述有两种:紫色的石蕊试液遇酸性溶液
变红色;酸性溶液使紫色石蕊试液变红色。
(4)酸碱性溶液使指示剂变色是物理变化还是化学变化?
(),酚酞试液遇酸性溶液不变色,是物理变化还
是化学变化?()。
(5)酸溶液()是酸性的,但是酸性的溶液()
是酸溶液。
如硫酸铵、氯化铵是盐,但他们的水溶液显酸性。
碱溶液()是碱性的,但是碱性的溶液()
是碱溶液。
如碳酸钠、碳酸钾是盐,但他们的水溶液显碱性。
3.为了方便实验,化学上分别用含有石蕊的碱溶液制成()
色的石蕊试纸,用含有石蕊的酸溶液制成()色的石蕊试
纸。
一般用红色的石蕊试纸来检验溶液是不是()性,
一般用蓝色的石蕊试纸来检验溶液是不是()性。
3.划出下列物质中的原子团并指出其名称
NaOH HNO3 H2SO4 Na2 CO3 NH4Cl
4.酸:电离时生成的阳离子全部是H+的化合物叫做酸。
如:
___________、___________、___________。
5.碱:电离时生成的阴离子全部是OH-的化合物叫做碱。
如:
___________、___________、___________。
二、展示预习结果:
三、自我小结:(2分钟)
四、达标测试:(10分钟)
1、下列物质都是日常生活中常遇到的物质,其中能使紫色的
石蕊试液变红色的是()
A、食盐水
B、白醋
C、肥皂水
D、石灰水
2、下列物质的水溶液中,既能使紫色石蕊试液变蓝,又能使
无色的酚酞试液变红的是()
A、肥皂水
B、蔗糖水
C、番茄汁
D、水
3.含有下列各组离子的溶液,其中的溶质属于酸的是()
A. Na+ H+ SO42-
B. Ca2+ OH- NO3-
C. H+ Cl- SO42-
D. K+ CO32- NO3-
4、用下列方法能把食醋、食盐水、石灰水一次区别开的是
()
A、品尝一下
B、分别滴加石蕊试液
C、分别滴加酚酞试液
D、
闻一闻气味
5.下列物质中,不能够直接证明稀硫酸是酸性溶液的是()
A.PH试纸 B.无色酚酞试液 C.紫色石蕊试液 D.蓝色石
蕊试纸
6.用H、S、O、Na四种元素符号组成化学式,完成填空:
金属氧化物;非金属氧化物;酸;
碱;相对分子质量最小的氧化物________________;有
刺激性气味的大气污染物_________________ 。
五、评价反思
教学手记
时间: No
一、导学策略
二、板书设计
三、导学反思
四、备注(错题记录)
参考答案:
一、1、紫色石蕊试液变红色 CO2+H2O=H2CO3 H2CO3 2、紫能能指示剂变色指示剂变色化学变化化学变色一定不一定一定不一定
3、蓝色红色碱酸氢氧根硝酸根硫酸根碳酸根铵根
4、HCl H2SO4 HNO3 Ba(OH)2 Ca(OH)2 NaOH
四、1、B 2、A 3、C 4、B 5、B 6、Na2O SO2 H2SO4 NaOH
H2O SO2
-----如有帮助请下载使用,万分感谢。