第三章吸收
- 格式:ppt
- 大小:874.00 KB
- 文档页数:31

第3章人体的物质和能量来源于食物第4节人体对食物的消化吸收教学目标:知识目标1.描述人体消化系统的组成2.说出小肠的结构特点能力目标1.培养学生实验的观察、操作能力。
2.以学生自主学习、合作学习为主要方式,培养自主学习、合作学习的能力。
情感目标1.通过小肠结构的观察活动,理解小肠是消化和吸收的主要场所,认同结构与功能相统一的观点。
2.培养学生关爱牙齿,养成良好的习惯,为今后工作和学习拥有良好的身体打下基础。
3.培养学生学习生物学的兴趣,体会在活动中与他人合作的重要性。
教学重点:1.描述人体消化系统的组成。
2.说出小肠的结构特点教学难点:说出小肠的结构特点课时安排:2课时教学过程:导入CAI:有关食物的录像片提问:他们在干什么?为什么要吃?食物进入人体后将发生怎样的变化呢?导入新课——人体对食物的消化吸收一、人体消化系统的组成[小故事]:姗姗小朋友吃苹果时不小心将种子咽下去了。
这粒种子在姗姗的消化道内经历了一天的历险。
他先遇到了像轧钢似的上下坚硬的怪物,差点被压得粉身碎骨;然后咯噔一下掉进了万丈深渊;刚躲过一劫又遇到酸雨;后来又钻进了一条又长又窄的迷宫;走出迷宫又钻进死胡同,幸亏及时改变方向;后来又与很臭的东西混在一起;最后在姗姗上厕所时离开了姗姗。
[出示]:消化系统模式图,请同学们描述消化系统的器官组成。
[讲述]:刚才同学们按照食物的经过路线描述的消化系统的组成,我们把食物经过的通道称之为消化道。
但大分子的营养物质要在消化道内被分解成简单的溶于水的物质才能被人体细胞吸收,而起关键作用的则是消化腺。
[提问]:你知道消化道周围有哪些消化腺吗?它们分泌什么消化液?你能在自己身体上指出它们的部位吗?[小结]:消化系统组成:消化道——口腔、咽、食道、胃、小肠、大肠、肛门唾液腺——分泌唾液肝脏——分泌胆汁消化腺胰腺——分泌胰液胃腺——分泌胃液肠腺——分泌肠液教师活动[讲述]:口腔是消化道的起始端。
口腔中有哪些器官呢?它们对食物的消化起什么作用?[出示]:牙齿的模型。


第三章药动学药动学:机体对药物的作用。
药物自进入机体到离开机体历经吸收、分布、代谢及排泄过程,这是机体对药物的处置,这些处置可以概括为药物的转运(吸收、分布、排泄)和药物的转化(代谢)1、吸收(absorption ):是指药物自体外或给药部位经过细胞组成的屏障进入血液循环的过程.1.2、药物的转运方式:被动转运和主动转运被动转运:单纯扩散:(脂溶性物质直接溶于膜的类脂相而通过)、易化扩散:*需特异性载体*顺浓度梯度,不耗能、滤过扩散主动转运特点:耗能,逆浓度差,需载体参与影响药物吸收的因素:(1)、给药途径静脉>吸入>肌肉(im)>皮下(ih)>舌下>直肠>口服>经皮。
(2)口服给药对药物吸收的影响首关消除(第一关卡效应或首过消除):有些口服药物首次通过肝脏就发生转化,减少进入体循环量,(3)血液循环的状态也影响药物的吸收(4)生物利用度也影响药物的吸收2、分布:指吸入血液的药物被转运至组织器官的过程。
药物在体内的分布速率主要取决于药物的理化性质,各器官组织的血流量与对药物的通透性,以及药物在组织与血浆的分配比。
影响因素:(1)与血浆蛋白的结合率(2)体内屏障(3)与组织的亲和力(4)组织器官的血流量3、生物转化(代谢):指药物在体内发生的化学过程,这种变化主要是结构的变化,由于结构变化引起性质变化,以至作用强度的变化。
注意:有少数药不发生化学变化,原型作用,原型排泄,如色甘酸、链霉素等。
1、转化的场所:肝脏微粒体2、生物转化的类型第一步:为氧化、还原、水解。
这步反应多数药物灭活,但也有例外(可待因)。
第二步:为结合。
总使药物活性降低或灭活并使极性增加。
影响药物转化的因素肝脏的功能:肝脏的功能是药物代谢的主要器官,肝脏功能不全时可影响代谢。
药酶诱导剂:某些药物能使肝脏药酶的活性增加或加速其合成。
如:苯巴比妥、水合氯醛、保泰松等可加速其代谢,使药物作用减弱。
药酶抑制剂:凡能抑制药酶活性或减少药酶合成的药物。




第三章紫外可见吸收光谱法1.定义2.紫外吸收光谱的产生3.物质对光的选择性吸收4.电子跃迁与分子吸收光谱第一节概述11. 定义根据溶液中物质的分子或离子对紫外、可见光谱区辐射能的吸收来研究物质的组成和结构的方法,包括比色分析法与分光光度法。
◆比色分析法:比较有色溶液颜色深浅来确定物质含量的方法。
◆分光光度法:使用分光光度计进行吸收光谱分析测量的方法。
2/紫外-可见波长范围:(真空紫外区)◆远紫外光区:10-200 nm;◆近紫外光区:200-400 nm;◆可见光区:400-780 nm。
◆O2、N2、CO2、H2O等可吸收远紫外区(60-200 nm)电磁辐射。
◆测定远紫外区光谱时,须将光学系统抽真空,并充入惰性气体。
◆准确:近紫外-可见分光光度法(200-780 nm)。
3/方法特点:◆仪器较简单,价格较便宜;◆分析操作简单;◆分析速度较快。
4/紫外可见吸收光谱:分子中价电子能级跃迁(伴随着振动能级和转动能级跃迁)。
2. 紫外可见吸收光谱的产生价电子的定义?AB 电磁辐射5/◆分子内部三种运动形式:电子相对于原子核的运动;原子核在其平衡位置附近的相对振动;分子本身绕其重心的转动。
◆分子具有三种不同能级:电子能级、振动能级和转动能级(量子化,具有确定能量值)。
◆分子内能:包括电子能量E e、振动能量E v、转动能量Er 。
2.1 电子跃迁与分子吸收光谱6/分子的各能级:◆转动能级能量差:0.005~0.05 eV,跃迁产生吸收光谱位于远红外区(远红外光谱或分子转动光谱)。
◆振动能级能量差:0.05~1 eV,跃迁产生吸收光谱位于红外区(红外光谱或分子振动光谱)。
◆电子能级能量差:1~20 eV。
电子跃迁产生的吸收光谱在紫外-可见光区(紫外-可见光谱或分子的电子光谱)。
7/8/◆电子能级间跃迁的同时,总伴随有振动和转动能级间的跃迁。
◆电子光谱中总包含有振动/转动能级间跃迁产生的若干谱线而呈现宽谱带(带状光谱)。


第三章原子吸收分光光度法§3-1概述原子吸收分光光度法又称原子吸收光谱分析,是二十世纪五十年代提出,但在六十年代有较大发展的一种光学分析方法。
该方法是基于测量气态原子对电磁辐射吸收而进行测定的分析方法。
原子吸收光谱的研究起源于对太阳光的观测。
1802年渥拉斯通发现太阳光谱中存在许多黑线,以后弗兰霍夫详细研究了这些现象,但未阐明原因。
因此,这些黑线也称弗兰霍夫线。
1860年柯尔希霍夫对碱金属和碱土金属元素的发射光谱自吸现象的研究证实了基态的原子蒸气对于同种原子发射的电磁波的具有吸收作用,联系到弗兰霍夫线的位置恰好相当于某些化学元素发射的特征谱线的位置,从而说明这些黑线是由于大气层中的蒸气组分吸收了太阳辐射的某些波长的电磁波所造成的。
1955年瓦尔西(Wals)正式提出原吸理论,1959年沃夫(Wolf)发明非火焰法(石墨炉),1965年威尔茨提出N2O-C2H4焰,70年代出现背景扣除技术。
原子吸收分光光度法:利用物质所产生的原子蒸气对特征谱线的吸收作用来进行定量分析的一种方法。
原子吸收分光光度法优点:①灵敏度高10-10g(火焰)10-10(非)②准确性高,重现性好,<0.5%③用途广④样品量少(石墨炉5-10ul 0.05~30mg)⑤选择性好§3-2原子吸收分光光度法分析基础一、共振吸收线原子受外界能量激发时,外层电子可跃迁到不同能级上,我们把电子从基态跃迁到第一激发态所产生的吸收谱线称做共振吸收线。
对不同元素,其原子结构和外层电子排布不同,因此,其共振吸收线的频率也不相同。
即:共振吸收线是与元素的原子结构相关的特征谱线,共振吸收能量最低,最容易发生,一般原子吸收分光光度分析就是利用元素的共振吸收来进行分析的。
二、原子吸收基本定律(以火焰法为例)原吸示意图光源显示原子化器单色器检测器放大器锐线光源发射的共振线被基态原子吸收的程度与火焰宽度及原子蒸气浓度的关系符合朗伯-比尔定律。

第三章红外吸收光谱(Infrared Absorption Spectroscopy)3.1 概述红外光谱又称为分子振动光谱或分子振转光谱1、特点:特征性强,适应范围广。
有机、无机、高分子化合物;固态、液态、气态样品都可以进行测定红外分为三个区域,近红外区(0.76μm~2.5μm,12820~4000cm-1)、中红外区(2.5μm~25μm, 4000~400cm-1)和远红外区(25μm~1000μm, 400~33cm-1)。
绝大多数有机化合物的基团震动频率处于中红外区。
2、表示方法:红外光谱多用透光率T%为纵坐标,表示吸收强度,以波数ζ(cm-1)为横坐标,表示吸收峰的位置。
也有用吸光度A为纵坐标,出反峰。
波数是频率的一种表示方法(每厘米长的光波中的波的数目)ζ(cm-1)=波数(cm-1)=1/波长(λcm)=104/波长(μm)=1/λ(cm);ζ·λ=1cm 3、红外光谱产生的基本条件1)E红外光=△E分子振动或υ红外光=υ分子振动2)分子振动时其偶极矩(μ)必须发生变化,即△μ≠0,μ=δr3.2 红外光谱与分子结构的关系3.2.1分子的振动形式*基频:分为两大类:伸缩振动和弯曲(变型)振动。
用υs表示对称伸缩,用υas 表示不对称伸缩,δ表示面内弯曲振动,γ表示面外弯曲振动。
以亚甲基为例:此外,还有一些其它的振动吸收峰存在:*倍频:由振动能级基态跃迁到第二,第三激发态时所产生的,不是整数倍。
*组合频:一种频率红外光,同时被两个振动所吸收。
倍频和组合频统称为泛频,在谱图中均显示为弱峰。
*振动偶合:当相同的两个基团相邻,且振动频率相近时,会发生振动偶合裂分,成为两个峰。
*费米共振:基频与泛频之间发生的振动偶合。
当泛频峰与某基峰相近时,发生相互作用,使原来很弱的泛频吸收峰增强。
图3-12费米共振和倍频。
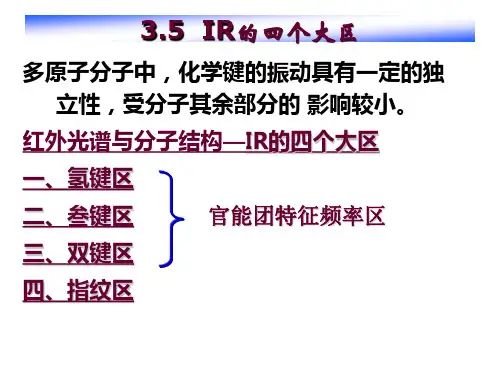
3.2.2 红外光谱的分区(1)基团结构与振动频率的关系表3-1 基团振动频率与化学键力常数的关系(化学键种类)基团化学键力常数(K/N·cm-1) 键长(Â)振动频率(cm-1)C—C(三键)12~18 1.27 2262~2100C—C(双键)8~12 1.40 1600~1800C—C(单键)4~6 1.54 1000~1300(弱)表3—2基团振动频率与原子折合质量的关系(原子种类)基团折合质量键长(Â)振动频率cm-1C—H 0.9 1.12 2800~3100C—C 6 1.54 约1000C—Cl 7.3 1.77 约625C—I 8.9 2.31 约5000—H N—H 0.971.0336003300-3500(2)基团频率区的划分(表3-3)前三个区域(氢键区、叁键及累积双键区、双键区,即4000——1500 cm-1)称为特征频率区,小于1500 cm-1的区域称为指纹区(单键区,有些文献中以1350 cm-1作为二者的界限)。