物理化学考试重点
- 格式:doc
- 大小:136.87 KB
- 文档页数:3

第一章【理想气体的能与焓只是温度的函数,与体积或压力的变化无关,所以对理想气体定温过程:dU=O, dH=O,A U=O,A H=0 变温过程:△ U=nC,m△H=nC,m△ T节流膨胀:(特点)绝热、定焓,••• Q=Q △ H=0,无论是理想气体还是实际气体均成立】1. 理想气体的状态方程可表示为:pV=nRT2. 能量守恒定律:自然界的一切物质都具有能量,能量有各种不同形式,能够从一种形式转化为另一种形式,但在转化过程中,能量的总值不变。
3. 第一定律的数学表达式:△ U=Q+;对微小变化:dU=8 Q+8 W(因为热力学能是状态函数,数学上具有全微分性质,微小变化可用dU表示;Q和W 不是状态函数,微小变化用3表示,以示区别。
)4. 膨胀作功:①自由膨胀:W=0②等外压膨胀:W=-P外(V2-V i)=P2 (V1-V2);③可逆膨胀:W=i RT In也=nRT In旦;④多次等外压膨胀,做V2 P的功越多。
5. ①功与变化的途径有关。
不是状态函数。
②可逆膨胀,体系对环境作最大功;可逆压缩,环境对体系作最小功。
6. 恒温恒压的可逆相变W= :P e dV :(R dP)dV P i△V nRT(恒温恒压的可逆相变,气体符合理想气体方程)7. 焓的定义式:H=U+PV等压效应Q p =△ H,焓是容量性质。
8. 理想气体的热力学能和焓仅是温度的函数:在恒温时,改变体积或压力,理想气体的热力学能和焓保持不变。
还可以推广为理想气体的Cv,Cp也仅为温度的函数。
9. ①等压热容Cp:C p仝(-)p , △ H Q p C p dTdT T②等容热容Cv:C v-Q v(—)V ,△u Q v C v dT ;③ Q p Q v△nRTdT T p10. 理想气体的Cp与Cv之差:C p C V nR或C p,m C v,m R;单原子分子系统:C v,m 2R ,双原子分子系统:C v,m 2 R△H n C p,m △T , n C v,m △T11. 绝热过程的特点:绝热压缩,使体系温度升高,而绝热膨胀,可获得低温。
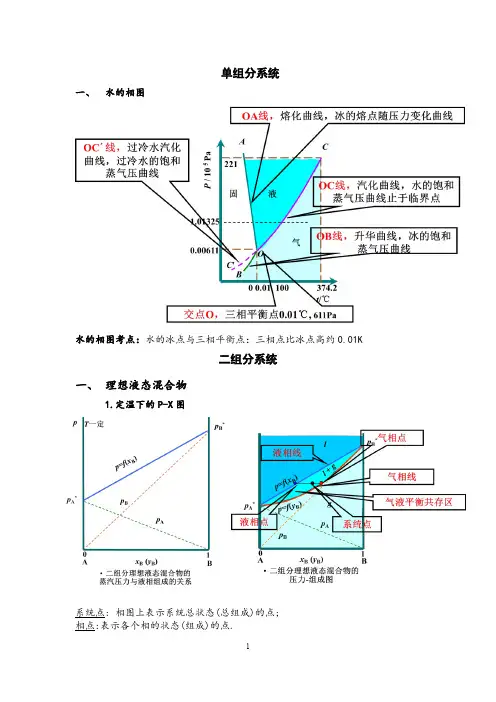
单组分系统一、水的相图水的相图考点:水的冰点与三相平衡点:三相点比冰点高约0.01K二组分系统一、理想液态混合物1.定温下的P-X图系统点: 相图上表示系统总状态(总组成)的点;相点:表示各个相的状态(组成)的点.结线:两个平衡相点的连结线.系统点总是在结线上2.定压下的T-X图泡点: 液相升温至开始起泡沸腾的温度;露点: 气相降温至开始凝结的温度.两点之间为相变温度区间, 与系统总组成有关.精馏原理:将液态混合物同时经多次部分气化和部分冷凝而使之分离的操作称为精馏。
同一层隔板上, 自下而上的有较高温度的气相与反方向的较低温度的液相相遇. 通过热交换,气相部分冷凝, 液相则部分气化.二、非理想液态混合物1.二组分真实液态混合物的4种类型的P-X图关于正偏差:若两组分分子间的吸引力小于各纯组分分子间吸引力,形成混合物后,分子就容易逸出液面而产生正偏差.若纯组分有缔合作用,在形成混合物后发生离解,因分子数增多而产生正偏差.混合时常有吸热及体积增大现象.关于负偏差:若两组分分子间的吸引力大于各纯组分分子间吸引力,形成混合物后,分子就较难逸出液面而产生负偏差.若形成混合物后分子发生缔合,因分子数减少而产生负偏差.混合时常有放热及体积缩小现象.2. 二组分真实液态混合物的4种类型的T-X图恒沸点处气相组成和液相组成相同。
此点对应的自由度数为0.一般正偏差和一般负偏差系统的温度-组成相图与理想系统的类似.3.部分互溶系统部分互溶的情况:系统会以两个饱和溶液平衡共存,这两个液层称为共轭溶液. 当混合物组成未达到两组分的相互溶解度时, 系统都以均相存在。
将具有两个液层的系统升高或降低至某个温度,两个液层的界面消失而成为一个液相,这个温度叫做最高或最低会溶温度。
4. 二组分液态完全互溶向部分互溶过渡5. 二组分液态部分互溶向完全不互溶过渡6. 完全不互溶三、二组分固-液平衡体系1.固态完全不互溶系统2.热分析法冷却曲线出现平台的原因:释放的凝固热抵消了因冷却而散失的热量出现最低点:因最初非常微细的晶体难以析出,过冷现象导致斜率变小的原因:固态Bi析出所释放的凝固热部分抵消了降温过程散失的热量低共熔温度、低共熔混合物3.溶解度法4.固态部分互熔系统5.固态完全互熔系统晶内偏析:退火:淬火:6.生成稳定化合物的系统注:若化合物数目有N种,则其相图就被看作是由(N+1)个简单低共熔点的固态不互溶系统的相图组合而成。


物化地报考的学科要求与学习重点物理化学和地球化学是两个与地球科学相关的重要学科,它们在地质学、环境科学、能源科学等领域中扮演着重要角色。
学习这两门学科需要具备一定的学科要求和学习重点。
本文将介绍物化地报考的学科要求与学习重点,帮助读者了解学习这两门学科的基本知识和技能。
一、学科要求1. 物理化学要求物理化学是研究物质的结构、性质和变化规律的学科。
学习物理化学需要具备以下要求:(1)具备坚实的物理学和化学基础知识,包括力学、电磁学、热学、量子力学、化学反应动力学等内容;(2)具备较强的数学能力,能够运用数学方法解决物理化学问题;(3)具备实验设计和实验操作能力,能够进行物理化学实验并分析实验数据。
2. 地球化学要求地球化学是研究地球物质的组成、结构和演化的学科。
学习地球化学需要具备以下要求:(1)具备地质学和化学基础知识,包括岩石学、矿物学、地球化学元素周期表等内容;(2)了解地球系统的基本概念,包括大气圈、水圈、岩石圈等;(3)具备实验设计和实验操作能力,能够进行地球化学实验并分析实验数据。
二、学习重点1. 物理化学的学习重点(1)理解物质的结构与性质:学习物质的原子结构、分子结构和晶体结构,以及不同结构对物质性质的影响。
(2)学习化学反应动力学:了解化学反应的速率、反应机理和影响因素,掌握反应速率方程的推导和应用。
(3)掌握量子力学的基本原理:学习分子能级和电子结构,了解量子力学对物理化学的重要性。
2. 地球化学的学习重点(1)学习地球物质的组成和分布:了解地球不同部分的物质组成,包括地壳、大气、水体等,以及它们之间的相互作用。
(2)了解地球化学元素的地球循环:学习元素在地球系统中的循环过程,包括生物地球化学循环、岩石圈循环等。
(3)研究地球化学指示物:了解地球化学指示物在地球科学研究中的应用,如稳定同位素、元素分馏等。
三、实践应用物化地的知识在地球科学的研究和应用中具有重要价值。
通过对地质样品、环境样品的物理化学分析,可以推断地球的演化过程和资源分布情况,为地质勘探、环境保护和资源开发提供科学依据。

第一章【理想气体的内能与焓只是温度的函数,与体积或压力的变化无关,所以对理想气体定温过程:dU=0,dH=0,△U=0,△H=0变温过程:△U=nC v,m △T ;△H=nC p,m △T节流膨胀:(特点)绝热、定焓,∴Q=0,△H=0,无论是理想气体还是实际气体均成立】1.理想气体的状态方程可表示为: pV=nRT2.能量守恒定律:自然界的一切物质都具有能量,能量有各种不同形式,能够从一种形式转化为另一种形式,但在转化过程中,能量的总值不变。
3.第一定律的数学表达式:△U=Q+W ;对微小变化:dU=δQ +δW (因为热力学能是状态函数,数学上具有全微分性质,微小变化可用dU 表示;Q 和W 不是状态函数,微小变化用δ表示,以示区别。
)4.膨胀作功:①自由膨胀:W=0;②等外压膨胀:W=-P 外(V 2-V 1)=P 2(V 1-V 2); ③可逆膨胀:W=nRT ln 21V V =nRT ln 12P P ;④多次等外压膨胀,做的功越多。
5.①功与变化的途径有关。
不是状态函数。
②可逆膨胀,体系对环境作最大功;可逆压缩,环境对体系作最小功。
6.恒温恒压的可逆相变 W=RT V P dV dP P dV P i V V i V Ve n )(2121-=-=--=-⎰⎰△(恒温恒压的可逆相变,气体符合理想气体方程)7.焓的定义式:H=U+PV ,等压效应H =Q p △,焓是容量性质。
8.理想气体的热力学能和焓仅是温度的函数:在恒温时,改变体积或压力,理想气体的热力学能和焓保持不变。
还可以推广为理想气体的Cv,Cp 也仅为温度的函数。
9.①等压热容Cp :p pp THdTQ C )(∂∂==δ,T C Q H p d p ⎰==△②等容热容Cv :T C Q U TUdTQ C V vvd )(v v ⎰==∂∂==,△δ; ③RTQ Q vn p △=-10.理想气体的Cp 与Cv 之差:nR C C VP =- 或 R C C m v m p =-,,;单原子分子系统:R C m v 23,=,双原子分子系统:R C m v 25,=T nC H m p △△,= , T nC U m v △△,=11.绝热过程的特点:绝热压缩,使体系温度升高,而绝热膨胀,可获得低温。

傅献彩物理化学考研考点精讲【原创版】目录1.傅献彩《物理化学》考研考点精讲概述2.考点详解:气体、热力学第一定律、热力学第二定律、多组分系统热力学及其在溶液中的应用、相平衡、化学平衡、统计热力学基础、电解质溶液、可逆电池的电动势及其应用、电解与极化作用、化学动力学基础、表面物理化学、胶体分散系统和大分子溶液3.考研题库及视频网课复习资料正文一、傅献彩《物理化学》考研考点精讲概述傅献彩《物理化学》是一本广受好评的物理化学教材,被众多高校作为本科生和研究生教材。
为了让考生更好地掌握这本书的内容,我们特推出傅献彩《物理化学》考研考点精讲,旨在帮助考生梳理重点知识点,攻克考试难点。
二、考点详解1.气体本章主要讲述理想气体、实际气体和混合气体的性质及其状态方程。
重点掌握理想气体状态方程、摩尔体积、摩尔质量等概念。
2.热力学第一定律热力学第一定律是热力学的基本原理之一,主要涉及能量守恒、热量和功的计算等问题。
重点掌握热力学第一定律的表达式和应用。
3.热力学第二定律热力学第二定律主要涉及热力学过程的方向性和熵的概念。
重点掌握熵增加原理和熵的计算方法。
4.多组分系统热力学及其在溶液中的应用本章主要讨论多组分系统的热力学性质及其在溶液中的应用。
重点掌握拉乌尔定律、亨利定律和吉布斯 - 亨德森方程等。
5.相平衡相平衡是物理化学中的重要概念,涉及相平衡条件、相图和相平衡常数等。
重点掌握克拉珀龙方程和相平衡常数的计算方法。
6.化学平衡化学平衡主要涉及化学反应的平衡条件和平衡常数。
重点掌握化学平衡的三段式和计算方法。
7.统计热力学基础统计热力学主要涉及微观态、宏观态和统计分布等概念。
重点掌握麦克斯韦 - 玻尔兹曼分布和费米 - 狄拉克分布等。
8.电解质溶液本章主要讨论电解质溶液的性质及其相关现象。
重点掌握电解质溶液的电导率、电离度和酸碱度等概念。
9.可逆电池的电动势及其应用可逆电池是物理化学中的重要概念,涉及电动势、电极电势和电池效率等。

《无机材料物理化学》课程考试大纲适用专业:无机材料专业及电子信息课程性质/学时:专业基础课、学位课/ 64材料方向一、考试的目和性质无机材料物理化学课程是无机材料专业及电子信息材料方向的重耍专业课。
学习基础是:己经学习了“大学物理”、''无机化学”、“物理化学”。
设置本课程的目的是让学生熟悉和掌握无机材料物理化学的基本概念和基本理论,为无机材料及电子信息材料的研究和生产奠定良好的基础。
二、考试的内容和范围考试内容:硅酸盐晶体结构,同质多晶原理。
硅酸盐材料与缺陷的关系。
固溶体、熔体的基本概念, 内部结构的规律性,及影响其性质的因素。
硅酸盐材料的农面和界面行为。
相图的基本规则和原理,会应用分析,计算相图。
扩散的基本概念、影响扩散的因素。
相变实质、机理。
固柑反应的基本知识、基本理论,影响固相反应的因素。
烧结的基本知识、基本理论,影响烧结的因素。
考试范围:第一章第一章晶体结构缺陷考核知识点:缺陷的形成,类型,缺陷反应式,缺陷反应式的写法、分析,硅酸盐材料与缺陷的关系。
考核要求:••准确掌握缺陷的基本理论和基本概念。
••准确地掌握缺陷反应式,缺陷反应式的写法。
理解硅酸盐材料与缺陷的关系。
第二章第二章固溶体考核知识点:固溶体的分类,形成固溶体的物理化学规律,影响固溶体性质的因素。
固溶体的结构与性质,特别是性质部分。
考核要求:••准确掌握固溶体的基本概念°掌握形成固溶体的物理化学规律,影响固溶体性质的因素。
• •掌握固溶体的结构与性质,特别是性质部分。
第三章第三章熔体和非晶态固体考核知识点:熔体和玻璃的概念,熔休的性质。
重点为玻璃结构,特别是玻璃结构学说,玻璃通性及晶体性质的区别。
玻璃性质与玻璃结构内在规律性。
考核要求:• •准确掌握熔体和玻璃的概念,玻璃结构学说,玻璃通性及品体性质的区别。
••掌握玻璃性质与玻璃结构内在规律性。
第二章第四章固体表面与界面行为考核知识点:硅酸盐材料的表而和界而行为。

一、内容提要:热力学第二定律是在研究热功转化的效率的过程中发展和建立起来的。
热力学第二定律的主要任务,是解决过程的方向和限度问题,为了解决这个问题,本章首先从常见的自发过程入手,发现自发变化过程都有一定的方向和限度,而自发过程能否成为可逆过程的问题又可归结到热是否能够全部转换为功而不引起其他变化(结论是不能)的问题,从而得出自发过程的共同特征—不可逆性,根据自发变化的这一规律性引出了热力学第二定律的经验叙述。
然后通过研究热功转化的理想循环—卡诺循环、归纳出卡诺定理,解决了热功转换的最大效率问题;得出卡诺循环的热温商之和为零,然后将卡诺循环的这个特点推广到任意的可逆循环从而得到了热力学第二定律的基本状态函数—熵,再通过可逆循环和不可逆循环过程的热温商的推导,得出熵变的计算方法以及熵变与过程的热温商之和之间的关系,从而得出了热力学第二定律的数学表达式—克劳修斯不等式和熵增原理,将熵增原理应用于孤立系统因而得出了熵判据,根据熵判据,我们可以判断所有过程的方向和限度(或者平衡条件)。
(一) 自发过程的共同特征——不可逆性,且都可以归结到热功交换的不可逆性。
(二) 热力学第二定律表述:1、Clausius 说法:不可能把热从低温物体传到高温物体而不引起其他变化。
这一说法揭示了热量传递的不可逆性2、Kelvin 说法:不可能从单一热源取热,使之完全转变为功而不发生其它变化,这一说法揭示了热功交换的不可逆性。
Kelvin 的另一说法:第二类永动机是不可能制成的。
人们在研究热功转化规律的基础上,抓住了事物的共性,提出了具有普遍意义的熵函数,根据熵函数和由此导出的另两个状态函数—亥姆霍兹自由能和吉布斯自由能,可以较简便的解决化学反应的方向和限度问题。
这就是热力学第二定律的重要作用和目的。
(三)卡诺循环结论:h l h l 0Q Q T T += (由此结论得出了得到了热力学第二定律的基本状态函数-熵)(四)卡诺定律:IR R ηη<,热力学第二定律证明,工作于同温热源与同温冷源之间的所有热机,可逆热机的效率最大。

热力学第一定律功:δW =δW e +δW f(1) 膨胀功 δW e =p 外dV 膨胀功为正,压缩功为负。
(2) 非膨胀功δW f =xdy非膨胀功为广义力乘以广义位移。
如δW (机械功)=fdL ,δW (电功)=EdQ ,δW (表面功)=rdA 。
热 Q :体系吸热为正,放热为负。
热力学第一定律: △U =Q —W 焓 H =U +pV 理想气体的内能和焓只是温度的单值函数。
热容 C =δQ/dT(1)等压热容:C p =δQ p /dT = (∂H/∂T )p (2)等容热容:C v =δQ v /dT = (∂U/∂T )v 常温下单原子分子:C v ,m =C v ,m t =3R/2常温下双原子分子:C v ,m =C v ,m t +C v ,m r =5R/2 等压热容与等容热容之差:(1)任意体系 C p —C v =[p +(∂U/∂V )T ](∂V/∂T )p (2)理想气体 C p —C v =nR 理想气体绝热可逆过程方程:pV γ=常数 TV γ-1=常数 p 1-γT γ=常数 γ=C p / C v 理想气体绝热功:W =C v (T 1—T 2)=11-γ(p 1V 1—p 2V 2) 理想气体多方可逆过程:W =1nR-δ(T 1—T 2) 热机效率:η=212T T T - 冷冻系数:β=-Q 1/W 可逆制冷机冷冻系数:β=121T T T -焦汤系数: μJ -T =H p T ⎪⎪⎭⎫⎝⎛∂∂=-()pT C p H ∂∂ 实际气体的ΔH 和ΔU :ΔU =dT T U V ⎪⎭⎫ ⎝⎛∂∂+dV V U T⎪⎭⎫ ⎝⎛∂∂ΔH =dT T H P ⎪⎭⎫⎝⎛∂∂+dp p H T⎪⎪⎭⎫ ⎝⎛∂∂ 化学反应的等压热效应与等容热效应的关系:Q p =Q V +ΔnRT当反应进度 ξ=1mol 时, Δr H m =Δr U m +∑BB γRT化学反应热效应与温度的关系:()()()dT B C T H T H 21T T m p B1m r 2m r ⎰∑∆∆,+=γ热力学第二定律Clausius 不等式:0TQS BA B A ≥∆∑→δ—熵函数的定义:dS =δQ R /T Boltzman 熵定理:S =klnΩ Helmbolz 自由能定义:F =U —TS Gibbs 自由能定义:G =H -TS 热力学基本公式: (1) 组成恒定、不作非膨胀功的封闭体系的热力学基本方程:dU =TdS -pdV dH =TdS +Vdp dF =-SdT -pdV dG =-SdT +Vdp (2) M axwell 关系:T V S ⎪⎭⎫ ⎝⎛∂∂=VT p ⎪⎭⎫ ⎝⎛∂∂Tp S ⎪⎪⎭⎫ ⎝⎛∂∂=-p T V ⎪⎭⎫ ⎝⎛∂∂ (3) 热容与T 、S 、p 、V 的关系:C V =T V T S ⎪⎭⎫ ⎝⎛∂∂ C p =T pT S ⎪⎭⎫⎝⎛∂∂Gibbs 自由能与温度的关系:Gibbs -Helmholtz 公式 ()pT /G ⎥⎦⎤⎢⎣⎡∂∆∂T =-2T H ∆ 单组分体系的两相平衡: (1)Clapeyron 方程式:dT dp=mX m X V T H ∆∆ 式中x 代表vap ,fus ,sub 。

826物化考试大纲826物化考试大纲是指物理化学考试的大纲,它是为了帮助学生更好地准备考试而制定的一份指导性文件。
下面我们就来详细了解一下826物化考试大纲。
首先,826物化考试大纲包括了物理和化学两个科目的内容。
在物理方面,主要包括力学、热学、光学、电磁学等内容。
在化学方面,主要包括无机化学、有机化学、分析化学等内容。
这些内容涵盖了物理和化学的基本知识和原理。
其次,826物化考试大纲明确了每个科目的重点和难点。
对于物理方面来说,力学是一个重点,其中包括运动规律、牛顿定律等内容;热学也是一个重点,其中包括热力学定律、热传导等内容;光学和电磁学也是重点,其中包括光的反射折射、电磁波等内容。
对于化学方面来说,无机化学是一个重点,其中包括元素周期表、离子反应等内容;有机化学也是一个重点,其中包括有机反应、有机合成等内容;分析化学也是一个重点,其中包括化学分析方法、质谱分析等内容。
再次,826物化考试大纲还明确了考试的形式和要求。
考试形式一般为选择题和解答题相结合,选择题主要考察对知识点的掌握程度,解答题主要考察对问题的分析和解决能力。
考试要求学生能够熟练掌握基本概念和原理,并能够运用所学知识解决实际问题。
最后,826物化考试大纲还提供了一些备考建议。
建议学生在备考过程中注重理论与实践相结合,通过做题、实验等方式加深对知识的理解;建议学生多做模拟试题,熟悉考试形式和要求;建议学生合理安排时间,制定备考计划,并且要有坚持不懈的学习态度。
总之,826物化考试大纲是一份重要的指导性文件,它为学生提供了明确的学习目标和备考建议。
只有在充分理解大纲内容的基础上,才能更好地准备物理化学考试,并取得好成绩。
希望同学们能够认真遵循大纲要求,在备考过程中不断提高自己的学习能力和解决问题的能力。

地生会考重点复习资料地生会考是高中生必须经历的一项考试,随着高考分数线的逐年提高,地生会考越来越重要。
对于地生会考的复习,很多同学容易被繁杂的知识点所迷惑,往往不知道从何入手。
在这篇文章中,我们将介绍一些地生会考的重点复习资料,希望能够对大家有所帮助。
一、物理学地生会考的物理学部分主要围绕着基本物理原理、运动学、力学、电学、光学等方面。
在复习时,同学们可以先从理论知识开始,例如形式化的公式、基本定理等等。
然后再把理论运用到实际生活中去,例如力的作用力、生活中的电器和电线排列等,加强实践操作。
另外,同学们还可以通过试题和模拟考试,强化练习,提高应对考试的能力。
二、地球科学地球科学的内容包括地理、地质学、气象学、海洋学等方面,也是地生会考的重点。
在复习这一部分内容时,同学们需要注意理论和实践的结合。
例如,地球内部的火山构造和地壳的变化,需要理论的知识支撑,同时也要学会分析地形和探测技术的实际应用。
在复习的过程中,同学们可以先把理论部分过一遍,然后通过实地考查和实践操作,加深对知识点的理解。
三、生命科学生命科学的内容包含生物、生态、遗传学、微生物学等方面,也是地生会考的重点。
复习这一部分内容时,同学们应该注重基本的原理和概念,例如生命的基本特征、细胞结构等。
此外,同学们还需要了解生态平衡、生态环境等实际应用。
在复习的过程中,可以通过观察自然生态、慢慢分析和研究,逐渐提升应用能力。
四、化学学化学学是地生会考的重点科目之一,主要包括基本物理化学(物质的组成和性质、化学反应)、有机化学、无机化学和生物化学等方面。
在复习时,同学们需要注意化学实验中不同化学物质对生物体及环境的影响。
此外,还需要学习有机化学、无机化学的实际应用,例如化肥、农药等。
同学们可以在复习的过程中,进行小实验和模拟考试。
五、数学数学作为地生会考的核心科目之一,是各大高校对考生重点关注的对象。
复习数学考试,同学们需要把重点放在解题能力的提升上。
高中物理化学实验知识点汇总,高频考点,必背现象当我第一遍读一本好书的时候,我仿佛觉得找到了一个朋友;当我再一次读这本书的时候,仿佛又和老朋友重逢。
我们要把读书当作一种乐趣,并自觉把读书和学习结合起来,做到博览、精思、熟读,更好地指导自己的学习,让自己不断成长。
让我们一起到店铺一起学习吧!物理实验复习要点整验证性实验一、验证力的平等四边形定则1.目的:验证平行四边形法则。
2.器材:方木板一个、白纸一张、弹簧秤两个、橡皮条一根、细绳套两个、三角板、刻度尺,图钉几个。
3.主要测量:a.用两个测力计拉细绳套使橡皮条伸长,绳的结点到达某点O。
结点O的位置。
记录两测力计的示数F1、F2。
两测力计所示拉力的方向。
b.用一个测力计重新将结点拉到O点。
记录弹簧秤的拉力大小F及方向。
4.作图:刻度尺、三角板5.减小误差的方法:a.测力计使用前要校准零点。
b.方木板应水平放置。
c.弹簧伸长方向和所测拉力方向应一致,并与木板平行.d.两个分力和合力都应尽可能大些.e.拉橡皮条的细线要长些,标记两条细线方向的两点要尽可能远些.f.两个分力间的夹角不宜过大或过小,一般取600---1200为宜二、验证动量守恒定律原理:两小球在水平方向发生正碰,水平方向合外力为零,动量守恒。
m1v1=m1v1/+m2v2/本实验在误差允许的范围内验证上式成立。
两小球碰撞后均作平抛运动,用水平射程间接表示小球平抛的初速度:OP-----m1以v1平抛时的水平射程OM----m1以v1’平抛时的水平射程O‘N-----m2以V2’ 平抛时的水平射程验证的表达式:m1OP=m1OM+m2O/N1.实验仪器:斜槽、重锤、白纸、复写纸、米尺、入射小球、被碰小球、游标卡尺、刻度尺、圆规、天平。
2.实验条件:a.入射小球的质量m1大于被碰小球的质量m2(m1 >m2)b.入射球半径等于被碰球半径c.入射小球每次必须从斜槽上同一高度处由静止滑下。
d.斜槽未端的切线方向水平e.两球碰撞时,球心等高或在同一水平线上3.主要测量量:a.用天平测两球质量m1、m2b.用游标卡尺测两球的直径,并计算半径。
初中物理公式概念汇总 一.概念 声学 1、声音是由物体振动产生的。 2、正在发声的物体叫声源。 3、声音以声波的形式传播。 4、声音的传播需要介质。 5、声音的特性有:音调、响度和音色。 6、音调是指声音的高低,由频率决定,频率越高音调越高。人耳听觉范围20~20000Hz。20Hz以下称为次声波,20000Hz以上称为超声波。 7、响度是指人主观上感觉声音的大小(强弱)(俗称音量),由振幅和人离声源的距离决定,振幅越大响度越大,人和声源的距离越小,响度越大。 8、音色是一种声音的特性,由发声物体本身材料、结构决定,不同的物体音色不同。音色又称音品。 9、乐音是指有规则的让人愉悦的声音。 10、噪音从物理学的角度看,由发声体作无规则振动时发出的声音;从环境保护角度看,凡是干扰人们正常工作、学习和休息的声音,以及对人们要听的声音起干扰作用的声音。 11、声音能传递信息和能量。 光学 12、能发光的物体是光源。 13、光在同种均匀介质中沿直线传播。 14、光的传播不需要介质,但不能有阻挡物。 15、光的反射是指光在传播到不同物质时,在分界面上改变传播方向又返回原来物质中的现象。 16、光的反射定律 a、反射光线,入射光线和法线都在同一个平面内; b、反射光线,入射光线分居法线两侧; c、反射角等于入射角。 17、光路是可逆的。 18、平行光线射到光滑表面上时反射光线也是平行的,这种反射叫做镜面反射。 19、平行光线射到凹凸不平的表面上,反射光线射向各个方向,这种反射叫做漫反射。 20、平面镜成像的实质是光的反射,是人眼接收到的光线的反向延长线会聚在一起而形成的。 21、光的折射是指光由一种介质斜射入另一种介质或在同一种不均匀介质中传播时,方向发生偏折的现象。 22、光的折射定律 a、折射光线、入射光线、法线在同一平面内。(三线在同一平面内); b、折射光线和入射光线分居法线两侧(法线居中); c、当光线从空气斜射入其它介质时,折射角小于入射角; d、当光线从其他介质斜射入空气时,折射角大于入射角; e、光线垂直入射时,光的传播方向不变,但光的传播的速度改变。 23、光的色散是指复色光分解为单色光而形成光谱的现象。 24、由单色光混合而成的光叫做复色光;不能再分解的色光叫做单色光。 25、白光是由红、橙、黄、绿、蓝、靛、紫等各种色光组成的。 26、自然界红绿蓝三种颜色无法用其它颜色混合而成,而其他颜色可以通过红、绿、蓝光的适当混合而得到的,因此红、绿、蓝三种颜色被称为光的“三原色”。 27、可见光中红光的波长最长,频率最低;紫光的波长最短,频率最高。 28、光谱中红光以外的光叫做红外线,紫光以外的光叫做紫外线,红外线和紫外线都不能由人眼直接看到。 29、透镜是常见的光的折射的利用。 30、透镜是折射镜,其折射面是两个球面(球面一部分),或一个球面(球面一部分)一个平面的透明体。它所成的像有实像也有虚像。 31、透镜一般可以分为两大类:凸透镜和凹透镜。 中央部分比边缘部分厚的叫凸透镜,有双凸、平凸、凹凸三种; 中央部分比边缘部分薄的叫凹透镜,有双凹、平凹、凸凹三种。 32、当一束平行于主光轴的光线通过凸透镜后相交于一点,这个点称“焦点”。 33、凸透镜成像规律 物距(u) 像距(v) 正倒 大小 虚实 应用 u>2f fu=2f v=2f 倒立 等大 实像 特点:大小分界点 f2f 倒立 放大 实像 投影仪;幻灯机 u=f v=∞ 不成像 / / 特点:虚实分界点 uv 正立 放大 虚像 放大镜
高二物化政报考的学科知识体系与重点领域在高二学习期间,物理、化学和政治是高中学生必修的三门学科。
这三门学科涵盖了不同的知识体系和重点领域,对学生的综合素质和学业发展都有着重要的影响。
一、物理学科知识体系与重点领域物理学是一门研究物质运动、能量变化以及它们之间相互关系的学科。
在高二物理学科中,学生会学习到力学、热学、光学、电磁学和原子物理等内容。
1. 力学力学是物理学的基础,研究的是物体在力的作用下的运动规律。
高二物理中的力学内容主要包括牛顿运动定律、牛顿万有引力定律以及动量和能量守恒等。
2. 热学热学是研究物体热现象和能量传递的学科。
在高二物理学科中,学生会学习热力学的基本概念和热传导、热对流以及热辐射等内容。
3. 光学光学研究光的传播、反射、折射和干涉等现象。
在高二物理学科中,学生会学习光学的基本原理,包括光的波粒二象性、光的传播和成像等内容。
4. 电磁学电磁学研究电荷和电磁场之间的相互作用。
在高二物理学科中,学生会学习电荷、电场、电流以及电磁感应等内容。
5. 原子物理原子物理是研究原子和原子核结构、性质和相互作用规律的学科。
在高二物理学科中,学生会学习到原子的组成、原子核的结构以及放射性等内容。
二、化学学科知识体系与重点领域化学是一门研究物质组成、性质、结构、变化规律以及物质之间的相互作用的学科。
在高二化学学科中,学生会学习到无机化学、有机化学和物理化学等内容。
1. 无机化学无机化学研究无机物质的性质、合成方法和与其他物质之间的反应。
在高二化学学科中,学生会学习到无机物质的组成、离子方程式、酸碱中和反应等内容。
2. 有机化学有机化学研究有机物质的性质、结构和合成方法。
在高二化学学科中,学生会学习到有机物质的功能团、官能团以及有机化合物的命名和合成等内容。
3. 物理化学物理化学研究物质的物理性质和化学性质之间的关系。
在高二化学学科中,学生会学习到化学反应热力学、化学平衡以及电化学等内容。
三、政治学科知识体系与重点领域政治学是一门研究国家、政府和政治行为的学科。
现代远程教育《物理化学》课程学习指导书作者:***2006年 9月第一章热力学第一定律一.学习目标了解热力学的一些基本概念,明确状态函数与可逆过程的概念和特点明确热力学第一定律的数学表达式;热与功只在体系与环境有能量交换时才有意义掌握两个热力学状态函数即内能和焓的概念较熟练应用热力学第一定律计算各种过程的ΔU,ΔH,Q和W。
明确热效应的含义和盖斯定律的内容能熟练应用生成热,燃烧热计算反应热;会应用盖斯定律了解基尔霍夫定律二.重点和难点重点:1.热力学第一定律及其应用2.盖斯定律及其应用三.练习题及答案(一).填空题1.应用热力学第一定律来计算化学变化中的,应用热力学第二定律来解决化学变化的。
2.一切自发过程都是过程。
其本质是转换的不可逆性。
3.物理化学是从研究物理变化和化学变化的入手以探求的基本规律的一门科学。
4.能量交换和传递的方式有和。
5.已知298.15K时,下列反应的热效应:(1)CO(g)+ (1/2)O2 (g)=CO2 (g) ∆rH= –283KJ(2) H2 (g) + (1/2)O2 (g)= H2O (l) ∆rH= –285.8KJ则反应CO(g)+ H2O (l) = CO2 (g) + H2 (g)∆rH(298.15K)= 。
6.各种不同状态物质的化学势可统一表示为。
(二).单项选择题1.已知:Zn(s)+(1/2)O2(g)= ZnO(s) Δr H mΘ=351.5kJ/molHg(s)+(1/2)O2(g)= HgO(s) Δr H mΘ=90.8kJ/mol因此Zn(s)+ HgO(s) = ZnO(s)+ Hg(s)的Δr H mΘ是:( )A. 442.2 kJ/molB. 260.7kJ/molC. -62.3kJ/molD. -442.2kJ/mol2.1mol单原子理想气体,从273K,202.65kPa,PT=常数的可逆途径压缩到405.3kPa的终态,该过程的ΔU是:()A. 1702JB. -406.8JC. 406.8JD. -1702J3.恒压下,无相变的单组分封闭体系的焓值随温度的升高而()A. 增加B. 减少C. 不变D. 不一定4.ΔH=Qp适用于下列哪个过程?()A. 理想气体从1×107Pa反抗恒定的1×105Pa膨胀到1×105PaB. 0o C,101325Pa下冰融化成水C.101325Pa下电解CuSO4水溶液D. 气体从298K,101325Pa可逆变化到373K,10132.5Pa5.苯在一个刚性的绝热容器中燃烧,C6H6(l)+(15/2) O2(g)=6CO2(g)+3H2O(g)下列关系式正确的是:()A.ΔU=0,Q=0B. ΔU<0,Q=0C. ΔU=0,Q>0D. ΔU=0,Q<=06.反应热效应是在()条件下定义的。
物理化学基础知识点总结
嘿呀!咱们今天来好好唠唠《物理化学基础知识点总结》!
首先呢,咱们得说一说物理化学中的热力学部分。
哇!这可是相当重要的一块呀!热力学第一定律,你晓得不?能量守恒定律呀!哎呀呀,这就意味着能量不会凭空产生,也不会凭空消失呢!比如说,一个热机在工作的时候,输入的能量和输出的能量加上损失的能量,它们之间的关系那是绝对不变的呀!这是不是很神奇?
然后呢,热力学第二定律也不能忽略呀!它告诉我们热量不能自发地从低温物体传到高温物体。
嘿,你想想,要是没有这个定律,那世界不就乱套啦?!
再来讲讲化学热力学部分。
标准摩尔生成焓、标准摩尔燃烧焓,这些概念可得搞清楚哟!知道它们,就能计算化学反应的热效应啦。
哎呀呀,这在实际应用中可太有用啦,比如设计化学反应的条件,提高反应的效率啥的。
还有化学平衡这一块儿呢!平衡常数你得懂吧?通过平衡常数,就能知道反应进行的程度啦。
哇哦!要是平衡常数很大,那就说明反应进行得很彻底;要是很小,那反应就不太容易进行下去咯。
接着说说电化学!原电池和电解池,这俩可是重点中的重点呀!原电池能把化学能转化为电能,电解池则反过来。
哎呀呀,想想那些电池,不都是基于这个原理嘛!
然后是动力学部分。
反应速率的概念要清楚,反应级数也不能迷糊。
知道了这些,就能预测反应的快慢,还能想办法去控制反应的进
程呢!
最后,再提一提表面化学和胶体化学。
表面张力、吸附作用,这些在生活中也有不少应用哟!比如说洗涤剂能去污,就和表面化学有关系呢!
哎呀呀,物理化学的基础知识点可真是不少呀!但只要咱们认真学,就一定能掌握好!哇,是不是觉得很有收获呀?。
物化重点(药2)
题型:填空题10',选择题20',判断题10',简答题40',计算题20'
(注:这些题型是我们期末考可能考的的题型,仅供参考)
Eg :
计算题 P71 第5题
P72 第10,11题
P262 第12,13,14题
还有:
第一章:考第八、九节不考
第二章:第七节、第二小节熵与概率不考,第十二节不考
第三章:重点看偏摩尔量,化学势以及拉乌尔定律,其余的大家选择性的看
第四章:不一定考,但课本第一百页的两个方程式4—16和4—17重点复习
第五章:第六节不考,重点考相图题如第136页的相图以及第四节
第六章:没大题,但重点第二节中电导
第七章:第四节、第七节、第八节以及第五节的第三小节不考
第八章:第五节不考,重点考第三节和第六节,其余的过一遍
第九章:主要看胶环结构以及聚沉
相关计算题:
P71 第5题
1mol 水在373K 和100kPa 向真空蒸发,变成373K 和100kPa 的水蒸气,试计算此过程的ΔS 、ΔS 环境 和 ΔS 孤立,并判断过程是否自发。
水的蒸发热40.64kJ/mol 。
解:ΔS=T
H ∆=(40.64 x 103)/373=109 J/K ΔS 环境 =环T Q - = 环T U -∆ = 环
)(T H -pV ∆∆ = —100.97 J/K ΔS 孤立 = ΔS +ΔS 环境 = 8.3 J/K 〉0
该反应自发进行。
P72 第10题
1mol 甲苯在其沸点383.2K 时蒸发为气态,求该过程的Q 、W 、ΔU 、ΔH 、ΔS 、ΔG 和ΔF ,已知该温度下甲苯的汽化热362kJ/Kg 。
解:Q= ΔH =(92/1000)x 362 = 33.3kJ
ΔU= ΔH - p ΔV = ΔH - nRT = 33.3-1x8.314x382.2x10-3 = 30.1kJ
W = ΔU - Q = -3.2kJ
ΔS = T
H ∆ = (33.3 x 103)/383.2 = 87.9J/K ΔG = 0
ΔF = W R = -3.2kJ
P72 第11题
1mol O 2 在298.2K 时:(1)由101.3kPa 等温可逆压缩至608.0kPa ,求Q 、W 、ΔU 、ΔH 、ΔF 、ΔG 、ΔS 和ΔS 孤立 ;(2)若自始自终用608.0kPa 的外压等温压缩到终态,求上述各热力学量的变化。
解:(1) W = -nRTln P2
P1 = -1x8.314x298.2x ln
608.0101.3 = 4443J
ΔU = ΔH = 0
Q = -W = -4443J
ΔS = T
Q = -14.9J/(K·mol) ΔG = ΔF = -T ΔS = -Q = 4443J
ΔS 孤立 = ΔS + ΔS 环境
= ΔS - T
Q = 0
(2) W = -p e ΔV
= -608x103×(3608.2x10298.28.3141⨯⨯ - 3
103.101298.28.3141⨯⨯⨯) = 12396J
Q = -W =-12396J
ΔU 、ΔH 、ΔS 、ΔF 、ΔG 与(1)相同
ΔS 孤立 = ΔS + ΔS 环境
= ΔS - T
Q = -14.9+41.6
= 26.7J/(K·mol )
P262 第12题
阿司匹林的水解为一级反应。
373.15K 下速率常数为7.92d -1 ,活化能为56.484kJ/mol 。
求290.15K 下水解30%所需的时间。
解:ln 12k k = - R E a (2
T 1 - 1T 1) 290.15K 的速率常数
令m = -8.314
1056.4843
⨯(290.151 - 373.151) k=7.92 × e m = 4.33×10-2 d -1
290.15K 时水解30%所需时间
t = k 1ln c c 0=2-104.331⨯ln 0.7
1=8.24d
P262 第13题
二级反应A+D →G 的活化能为92.05kJ/mol 。
A 和D 的初始溶度均为1mol/L ,在293.15K 30分钟后,两者各消耗一半。
求:
(1)在293.15K1小时后两者各剩多少;
(2)313.15K 温度下的速率常数。
解:(1)因为t 1/2 = 0A c k 1=0.5 → k A = 1/20t c 1=0
c 2= 2 L/(mol ·h ) 故0
A c 1-c 1=k A t = 0c 2×1 = 2 c A = c D =
3c 0=0.33mol/L (2)由m=ln 12k k = -R E a (2T 1-1
T 1)得到313.15的速率常数 K 313.15 =k 293 · e m = 22.32 L/(mol ·h )
P262 第14题
溴乙烷的分解是一级反应,活化能为230.12kJ/mol ,指前因子为3.802×1033 s -1。
求:
(1)反应以每分钟1/1000的速率进行时的温度;
(2)以每小时分解95%的速率进行时的温度。
解:(1)k =
c c ln t 10=1/1000
-11ln 601=1.668×10-5 s -1
由lnk = lnA - RT
E a ,得T = 313.4K (2)k = 95%-11ln 60601c c ln t 10⨯==8.321×10-4 s -1
同理T=327.9K
老师在黑板上讲的例题
将等体积的 0.1mol/dm 3 AgNO 3 和0.08mol/dm 3 KI 溶液制成AgI 溶胶,试解下列问题:
(1)写出胶团结构式;
(2)指出电泳方向;
(3)将下列电解质对此溶胶的聚沉能力从大到小排序:CaCl 2 、 Na 2SO 4 、MgSO 4 、 K 2[Fe (CN)6] ,并说明原因。
解:Ag +过量,吸附Ag +,溶胶带正电。
(1)胶团结构式:[(AgI )m ·nAg +·(n-x )NO 3-]·xNO 3-
(2)胶粒带正电,电泳方向为负极。
(3)K 2[Fe (CN)6] 〉Na 2SO 4 〉MgSO 4 〉CaCl 2
因为反离子价数[Fe (CN)6]4-〉SO 42-〉Cl -,且聚沉能力Na +〉Mg 2-。