丙酸氯倍他索检验标准
- 格式:doc
- 大小:21.50 KB
- 文档页数:2

一、 单选题(共10题,每题1分,共10分,在正确答案上打“√”或在括号内填上正确的答案编号)1. 药品质量标准的主要内容( E )A.名称、性状、正文、规格与用途B.结构、正文、贮藏、制剂与用量C.鉴别、检查、含量测定、记录与报告D.鉴别、检查、含量测定、稳定性试验E.性状、鉴别、检查、含量测定2. 下列哪个数据可认为是4位有效数字( C )A. 5.20B. 0.0520C. 9.60D. 5.2×103E. 0.0963. 红外光谱图中,1650~1900 cm -1处具有强吸收峰的基团是( A )A.羰基B.共轭双键C.酚羟基D.氨基E.烃基4. 用溴酸钾法测定异烟肼含量时,1摩尔溴酸钾与几摩尔异烟肼相当( D )A. 1/3B. 1/6C. 1/2D. 3/2E. 2/35. 糖类附加剂对哪种定量方法有干扰( C )A.酸碱滴定法B.非水溶液滴定法C.氧化还原滴定法D.配位滴定法E.沉淀滴定法6. 《中国药典》规定紫外测定中,溶液的吸光度应控制在( D )A. 0.2~0.8B. 0.3~1.0C. 0.00~2.00D. 0.3~0.7E. 0.1~1.07. 一般ODS 柱适用的流动相pH 范围为( C )A. 1~7B. 3~9C. 2~8D. 2~9E. 1~148. 色谱法适合于多组分的分离分析,中药鉴别中最常用的方法是( B )A.高效液相法B.薄层色谱法C.肽图法D.指纹图谱法E. DNA 指纹图谱法9. 在用古蔡法检查砷盐时,导气管中塞入醋酸铅棉花的目的是( C )A.除去I 2B.除去AsH 3C.除去H 2SD.除去HBrE.除去SbH 310. 药品的法定名称是指( B )A.商品名B. 通用名C.学名D.专利名E.化学名二、配伍选择题(共10题,每题1.5,共15分,在括号内填上正确的答案编号)(1~3题共用备选答案)A.氯贝丁酯B.磺胺嘧啶C.硫喷妥钠D.异戊巴比妥E.阿司匹林1. 能与铜盐-吡啶试剂生成绿色配合物( C )2. 具有芳香第一胺反应( B )3. 用两步滴定法测定含量( A )(4~5题共用备选答案)A.相对误差B.绝对误差C.相对标准偏差D.系统误差E.偶然误差4. 不可定误差( E )5. 分析试剂不纯等原因造成的误差( D )(6~8题共用备选答案) A. h 0.05W T = B. XX A f C = C. t t R R R )(212-=D. 22/)(54.5hR W t n ⨯= E. R X R X A A C C = 6. 分离度计算式( C ) 7. 拖尾因子计算式( A )8. 理论板数计算式( D )(9~10题共用备选答案)A.凝胶电泳法B.鲎试剂法C.家兔法D.肽图法E.酶法9. 细菌内毒素检查( B )10. 热原检查( C )三、多选题(共5题,每题2分,共10分,在正确的答案上打“√”或在括号内填上正确答案编号)1. 制定药品标准的基本原则是( ACDE )A.安全有效B.方法准确C.针对性D.规范性E.技术先进2. 中国药典收载的HPLC 法检查药物中杂质的方法有 ( BCDE )A .标准加入法B .加校正因子的主成分自身对照法C .内标法D .外标法E. 不加校正因子的主成分自身对照法3. 药物制剂的检查内容包括( ACE )A.制剂生产过程中引入或产生的杂质B.辅料的检查项目C.制剂贮存过程中产生的杂质D.原料药的检查项目E.药典制剂通则中规定的常规检查项目4. 中国药典(2010年版)一部收载的水分测定方法有( ABCE )A.甲苯法B.减压干燥法C.气相色谱法D.热重法E.烘干法5. 紫外-可见分光光度法测定药物含量的方法有( AE )A.吸收系数法B.内标法C.外标法D.标准加入法E.对照品比较法四、名词解释(共5题,每题3分,共15分)6. 恒重——系指供试品连续两次干燥或炽灼后的重量差异在0.3mg 以下的重量。

·1356·Hemld of Medicine V01.31No.100ctober2012分平均总含量的80%~200%为限度范围,即每克含总转移率不是很高,这可能是制备过程中,麻黄采用水药膏体中含盐酸麻黄碱和盐酸伪麻黄碱两种成分的总煎煮工艺,而麻黄碱和伪麻黄碱均有一定的挥发性,在量应为0.090~0.230 mg。
约100℃因挥发损失而导致转移率偏低。
2010年版《中华人民共和国药典》一部麻黄项下参考文献规定,麻黄含水量不得过9.O%;按干燥品计算,含盐[1] 肖崇厚,杨松松,洪筱坤,等.中药化学[M].上海:上海科学技术出版社,1997.酸麻黄碱(C。
H。
,N0·HCl)和盐酸伪麻黄碱(C,。
H。
,[2] 陈德昌.中药化学对照品工作手册[M].北京:中国医药N0·HCl)的总量不得少于0.80%。
上述测定结果表科技出版社,2000.明,用于中试投料的麻黄饮片符合2010年版《中华人[3] 国家药典委员会.中华人民共和国药典(一部)[M].北民共和国药典》要求。
根据以上测定结果,可以计算3京:中国医药科技出版社,2010:1.批中试样品中盐酸麻黄碱和盐酸伪麻黄碱的平均总转[4] 梁生旺.中药制剂分析[M].北京:中国中医药出版社,移率约46.81%。
2007.3讨论DO I lO.3870/vvdb.2012.10.034 3批中试样品盐酸麻黄碱和盐酸伪麻黄碱的平均《中华人民共和国药典》利福平及制剂标准中有关物质测定方法的修改建议余忠1,朱江2,徐婷婷1(1.湖北省随州市中心医院药剂科,441300;2.湖北省随州市食品药品监督检验所,441300) 摘要目的对2叭0年版《中华人民共和国药典》中利福平及其制剂质量标准中有关物质测定方法存在的问题进行探讨。
方法采用反相高效液相色谱法,Si ncom C。
色谱柱(含碳量为11%)(150m m×4.6mm,5斗m),甲醇一乙腈一0.075mol·L“磷酸二氢钾溶液一1.O mo l·L“枸橼酸溶液(10:50:36:4)为流动相,检测波长为254nm。


丙酸氯倍他索溶液稳定性研究陈良梅;王柏;周云飞;吴满红【期刊名称】《中国药科大学学报》【年(卷),期】2006(37)3【摘要】目的:考察不同pH条件下丙酸氯倍他索(clobetasol propionate,CBT)的稳定性,并利用人工神经网络对氯倍他索在设定条件下的(伪)一级降解速率常数进行预测。
方法:根据化学动力学原理,采用经典恒温法进行试验,并通过高效液相色谱法测定氯倍他索的浓度;建立3层BP人工神经网络,并通过此经过训练的网络进行(伪)一级降解速率常数的预测。
结果:丙酸氯倍他索溶液的降解反应属(伪)一级反应,绘制的pH-速度图是典型的V型,在pH为3.23条件下丙酸氯倍他索溶液最稳定,其预测的室温贮存有效期为761 d,pH条件明显影响丙酸氯倍他索溶液稳定性;根据本研究建立的3层BP人工神经网络(即2-15-1网络结构)所得到的一级降解速度常数预测值与常规方法得到的一级降解速度常数估算值之间具有良好的线性相关性。
结论:本研究首次通过所建立和训练的人工神经网络,能够对丙酸氯倍他索的一级降解速率常数进行预测,预测结果和实际计算结果基本一致,故说明人工神经网络可以用于药物理化性质(如化学稳定性)的预测。
【总页数】4页(P226-229)【关键词】丙酸氯倍他索;稳定性;pH;经典恒温法;人工神经网络【作者】陈良梅;王柏;周云飞;吴满红【作者单位】中国药科大学药剂学教研室【正文语种】中文【中图分类】R944【相关文献】1.注射用头孢唑林钠溶液稳定性及配伍稳定性研究 [J], 赖可;陶静;邓盛齐;张彧2.稳定性亚氯酸钠溶液的制备及稳定性研究 [J], 蔡秀萍;张世其;苏庆珍3.稳定性二氧化氯溶液与亚氯酸钠溶液的评估指标研究 [J], 贺启环;郭登元4.溶液中锌(Ⅱ)与维生素D_3和一些小分子配体形成三元混合配体配合物的稳定性研究——关于三元混合配体配合物相对稳定性定量表征的讨论 [J], 张锋;刘祁涛5.溶液中某些镉(Ⅱ)的混合配体配合物的稳定性研究——关于混合配体配合物相对稳定性定量表征的讨论 [J], 张锋;刘祁涛因版权原因,仅展示原文概要,查看原文内容请购买。

丙酸氯倍他索乳膏【用法用量】外用:薄薄一层均匀涂于患处,一日2次。
【注意事项】1.本品不宜长期大面积应用,亦不宜采用封包治疗,大面积使用不能超过2周。
2.治疗顽固、斑块状银屑病。
若用药面积仅占体表面积的5%~10%可连续应>4周,每周用量均不能超过50g。
3.伴有皮肤感染时,必须同时使用抗感染药物。
4.用药一周后症状未缓解,应向医师咨询。
药品性状发生改变时,禁止使用。
【不良反应】1.易引起红斑、灼热、丘疹、痂皮等。
2.长期用药可出现皮肤萎缩、毛细血管扩张、多毛、毛囊炎等。
【禁忌】1.对细菌、真菌、病毒感染症可使感染恶化。
2.对本品和其他皮质激素有过敏史患者禁用。
3.鼓膜穿孔的湿疹性外耳道炎患者,会延迟治疗。
4.对溃疡、二度以上烫伤、冻伤有抑制皮肤再生的作用。
5.不可用于眼部。
【适应症】本品适用于慢性湿疹,银屑病,扁平苔藓,盘状红斑狼疮,神经性皮炎,掌跖脓疱病等皮质类固醇外用治疗有效的皮肤病。
【药物相互作用】如与其他药物同时使用可能会发生,详情请咨询医师或药师。
【药理毒理】本品为强效外用肾上腺皮质激素类药。
本品外用具有:1.抗炎、抗过敏、止痒和减少渗出作用。
2.可以减轻和防止组织对炎症的反应,能消除局部非感染性炎症引起的发热、发红及肿胀,从而减轻炎症的表现。
3.免疫抑制作用:防止或抑制中介的免疫反应,延迟性的过敏反应,并减轻原发免疫反应的扩展。
【儿童用药】婴儿应慎用,避免长期大量密封给药【老人用药】避免长期大量密封给药。
【包装】20g【药物过量】未进行相关实验且无可供参考数据。
【类型】处方药【医保】乙类【国家/地区】国产【剂型】乳膏剂【药代动力学】本品可经毛囊腺、皮肤吸收,尤其在皮肤破损处吸收更快,大面积使用于皮肤破损或长期用封闭性敷料可因吸收引起全身反应。
本品亲脂性强,易渗透,涂于患处30分钟后即生效,软膏剂的T1/2约为3小时。
钠潴留及糖原沉着作用很弱,也无雄性、雌性及蛋白同化激素样的作用,对体温和尿也无明显影响。

丙酸氯倍他索检验标准拼音名:Bingsuan Lubeitasuo英文名:Clobetasol Propionate书页号:2000年版二部-103C25H32ClFO5 466.99本品为16β-甲基11β-羟基-17-(1-氧代丙基)-9-氟-21-氯-孕甾-1,4-二烯-320-二酮。
按干燥品计算,含C25H32ClFO5应为97.0%~103.0%。
【性状】本品为类白色或微黄色结晶性粉末。
本品在氯仿中易溶,在醋酸乙酯中溶解,在甲醇和乙醇中略溶,在水中不溶。
熔点本品的熔点(附录Ⅵ C)应为194~198,熔融时同时分解。
比旋度取本品,精密称定,加二氧六环溶解并定量稀释制成每1ml 中含10mg 的溶液,依法测定(附录Ⅵ E),比旋度应为+99°至+105°。
【鉴别】 (1) 取本品少许,加乙醇1ml ,混合,置水浴上加热2 分钟,加硝酸(1→2)2ml ,摇匀,加硝酸银试液数滴,即显白色沉淀。
(2) 本品显有机氟化合物的鉴别反应(附录Ⅲ)。
(3) 本品的红外光吸收图谱应与对照的图谱(光谱集 592图)一致。
【检查】其他甾体取本品,加氯仿-甲醇(8.5:1.5) 制成1ml 中含10mg的溶液作为供试品溶液;精密量取适量,加氯仿-甲醇(8.5:1.5) 稀释制成每1ml 中含 0.1mg的溶液,作为对照溶液。
照薄层色谱法(附录Ⅴ B)试验,取上述两种溶液各5μl,分别点于同一硅胶G薄层板上,以苯-丙酮(9:1) 为展开剂,展开后,晾干,喷20%硫酸显色,在105 ℃加热10分钟,供试品溶液如显杂质斑点,其颜色与对照溶液的主斑点比较,不得更深。
干燥失重取本品,在105 ℃干燥至恒重,减失重量不得过0.5 %(附录Ⅷ L)。
【含量测定】照高效液相色谱法(附录Ⅴ D)测定。
色谱条件与系统适用性试验用十八烷基硅键合硅胶为填充剂;以0.05mol/L磷酸氢钠溶液(用85%磷酸溶液调节PH值至2.5)-乙腈-甲醇(425:475:100)为流动相;检测波长为240nm。

丙酸倍氯米松吸入粉雾剂中国药典2015年版氯米松200M g (5)每瓶200揿,每揿含丙酸倍氯米松250M g (6)每瓶80揿,每揿含丙酸倍氯米松250fxg【贮藏】密闭*在凉暗处保存。
丙酸倍氯米松吸入粉雾剂Bingsuan Beilumisong Xiru FenwujiBeclometasone DipropionatePowder for Inhalation本品为微粉化丙酸倍氯米松(0.5〜lOpm)和适宜的辅料装入胶囊制成的吸入用粉雾剂,置于专用装置中使用。
含丙酸倍氯米松(C28 H37C107)应为标示量的90.0%〜115. 0%。
【性状】本品为供吸人用的硬胶囊,内含白色粉末。
【鉴别】(1)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2)取含量均匀度项下的续滤液,照紫外-可见分光光度法(通则0401)测定,在238nm的波长处有最大吸收。
【检査】含量均匀度取本品1粒,将内容物倾人10ml 量瓶中,用无水乙醇洗涤胶囊内壁,洗液并入量瓶中,用无水乙醇稀释至刻度,摇匀,用滤膜(0.45pm)滤过,取续滤液,照紫外-可见分光光度法(通则0401),在238nm的波长处测定吸光度•,另取丙酸倍氯米松对照品,精密称定,加无水乙醇溶解并定量稀释制成每l m l中约含10pg的溶液,同法测定吸光度,计算含量。
除限度为士20%外,应符合规定(通则0941)。
微细粒子剂量取本品10粒,照吸人制剂微细粒子空气动力学特性测定法(通则0951第一法)测定,在第二级分布瓶H中精密加人内标溶液(取丙酸睾丸素适量,加甲醇溶解并稀释制成每lm l中约含40M g的溶液,摇匀)5ml与甲醇25ml,作为接受液。
清洗规定部件,合并洗液与第二级分布瓶H中的接受液,置50ml 量瓶中,用甲醇稀释至刻度,摇勻,照含量测定项下的色谱条件,取2(^1注人液相色谱仪,记录色谱图。
另取丙酸倍氯米松对照品,精密称定,加甲醇溶解并定量稀释制成每lm l中约含40#的溶液,精密量取该溶液5ml与内标溶液5ml,置同一 50ml量瓶中,用甲醇稀释至刻度,摇匀,同法测定。

卫生部办公厅关于印发《消毒产品中丙酸氯倍他索和盐酸左氧氟沙星测定——液相色谱―串联质谱法》的通知文章属性•【制定机关】卫生部(已撤销)•【公布日期】2010.03.30•【文号】卫办监督发[2010]54号•【施行日期】2010.03.30•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】免疫规划正文卫生部办公厅关于印发《消毒产品中丙酸氯倍他索和盐酸左氧氟沙星测定--液相色谱-串联质谱法》的通知(卫办监督发〔2010〕54号)各省、自治区、直辖市卫生厅局,新疆生产建设兵团卫生局,中国疾病预防控制中心、卫生部卫生监督中心,有关单位:为加强消毒产品监督管理,我部组织制定了《消毒产品中丙酸氯倍他索和盐酸左氧氟沙星测定--液相色谱-串联质谱法》,现印发给你们,推荐用于相关消毒产品的检测。
附件:《消毒产品中丙酸氯倍他索和盐酸左氧氟沙星测定--液相色谱-串联质谱法》二○一○年三月三十日消毒产品中丙酸氯倍他索和盐酸左氧氟沙星测定¾液相色谱-串联质谱法Determination of clobetasol propionate and levofloxacinhydrochloride in disinfection product - LC-MS-MS method 1范围本方法规定了膏霜类消毒产品中丙酸氯倍他索和盐酸左氧氟沙星残留量液相色谱-串联质谱测定方法。
本方法适用于膏霜类消毒产品中丙酸氯倍他索和盐酸左氧氟沙星残留量的测定。
取样量为0.1g时,本方法对丙酸氯倍他索和盐酸左氧氟沙星的检出限见表1。
2规范性引用文件3原理试样中丙酸氯倍他索和盐酸左氧氟沙星用甲醇提取,提取液经0.45μm滤膜过滤,用C18柱分离后,用液相色谱-串联质谱仪测定,正离子扫描,离子对定性,峰面积定量。
4试剂和材料除另有说明外,所用试剂均为分析纯,水为不含有机物的纯水,纯水中干扰物的浓度需低于方法中待测物的检出限。

丙酸氯倍他索原料安全操作及保养规程丙酸氯倍他索作为一种抗生素,用于治疗各种感染症状,是医疗机构不可或缺的药品之一。
但是,在使用丙酸氯倍他索时,需要注意一些安全操作和保养规程,以确保人员、设备和环境的安全。
安全操作规程1.在使用丙酸氯倍他索一系列药品时,需要先了解使用方法和剂量,以避免病人的过量或不足药量。
2.操作前必须佩戴个人防护装备,包括口罩、手套和护目镜,以避免接触药品对人体造成伤害。
3.操作中需要注意药品的可燃性和易挥发性,以及药品的冷却性。
4.在操作过程中需要密切观察药品的状况,如药品颜色、气味、黏度等,避免出现异常情况。
5.使用时,需要将药品直接注射到肌肉或血管中,避免滴注。
6.在操作完毕后,需要彻底清洗手套和器具,避免药品残留。
7.操作过程中,丙酸氯倍他索需要存储在干燥、阴凉、避光的环境中,避免储存过程中潮湿和光照。
原料保养规程1.丙酸氯倍他索储存期限一般为2年,在存储过程中要注意避免超过保质期,超过保质期后药品效果会降低。
2.在使用过程中,要注意药品的色泽和气味,如出现变质现象,需立即停止使用。
3.丙酸氯倍他索在使用后需要存储在合适的温度、湿度和避光的环境下,以避免药品受潮、氧化或光照。
4.运输过程中要避免撞击和震荡,以避免药品结构损坏或破裂。
5.在储存和使用药品时,需要先阅读产品说明书并按照其规定进行操作,避免药品使用不当或过量。
6.丙酸氯倍他索不能与其他药品混用,以免发生化学反应或药品效果失效。
7.在处理废弃物时,需要按照药物管理规定进行处理,以避免对环境和人体造成伤害。
总结使用丙酸氯倍他索需要高度重视安全操作和保养规程,以确保人员、设备和环境的安全。
在储存和使用中,需要遵守相应的规定,避免出现药品过期、变质,以及无法使用等问题。
为了有效地保护病人和人员的健康安全,医疗机构需要高度重视使用药品的相关规定,制定相应的操作和停药规程,并加强对工作人员的安全培训和管理。

HPLC法测定丙酸氯倍他索尿素乳膏中丙酸氯倍他索的含量目的:建立丙酸氯倍他索尿素乳膏中丙酸氯倍他索含量的HPLC测定方法。
方法:色谱柱为SHIMADZU VP-ODS C18柱(4.6 mm×150 mm,5 μm),流动相为0.05 mol/L磷酸氢二钠溶液(用85%磷酸溶液调节pH值至2.5)-乙腈-甲醇(42.5∶47.5∶10),流速为1.0 ml/min,检测波长为254 nm。
结果:丙酸氯倍他索的线性范围为5~40 μg/ml,r=0.999 9,平均回收率为98.05%,RSD为0.72%。
结论:本方法准确可靠、简单可行,可用于丙酸氯倍他索尿素乳膏中丙酸氯倍他索的含量测定。
[Abstract] Objective: To establish a HPLC method for the content determination of clobetasol propionate in Clobetasol Propionate Urea Cream. Methods: The analytical column was SHIMADZU VP-ODS C18 column(4.6 mm×150 mm, 5 μm) with a mobile phase consisted of 0.05 mol/L disodium hydrogen phosphate solution(85% phosphoric acid solution with pH adjustment to 2.5)-acetonitrile-methanol(42.5∶47.5∶10) at the flow rate of 1.0 ml/min, the detection wavelength was set at 254 nm. Results: The linear range of clobetasol propionate was 5-40 μg/ml, r=0.999 9, the average recovery was 98.05% with a RSD of 0.72%. Conclusion: The method is accurate, reliable, simple and feasible, and can be used in the content determination of clobetasol propionate in Clobetasol Propionate Urea Cream.[Key words] Clobetasol Propionate Urea Cream; Clobetasol propionate; High performance liquid chromatography; Content determination丙酸氯倍他索尿素乳膏是信阳职业技术学院附属医院的医院制剂,由丙酸氯倍他索和尿素加适量基质制成,主要用于治疗慢性湿疹、扁平苔藓、神经性皮炎、瘙痒症、银屑病等皮质类固醇外用治疗有效的皮肤病。
丙酸氯倍他索乳膏说明书请仔细阅读说明书并按说明使用或在药师指导下购买和使用【药品名称】通用名称:丙酸氯倍他索乳膏英文名称:Clobetasol Propionate Cream汉语拼音:Bingsuanlübeitasuo Rugao【成份】本品主要成份为:丙酸氯倍他索。
其化学名称为:16β-甲基-11β-羟基-17-(1-氧代丙基)-9-氟-21-氯-孕甾-1,4-二烯-3,20-二酮。
化学结构式:分子式:C25H32ClFO5分子量:466.99【性状】本品为白色乳膏。
【适应症】适用于慢性湿疹、银屑病、扁平苔藓、盘状红斑狼疮、神经性皮炎、掌跖脓疱病等皮质类固醇外用治疗有效的皮肤病的短期治疗。
【规格】10g:5mg【用法用量】外用:薄薄一层均匀涂于患处,一日2次。
疗程不得超过2周,由于该药可能抑制下丘脑-垂体-肾上腺轴,每周总剂量不得超过20g(相当于丙酸氯倍他索10mg)。
【不良反应】本品用药2周以内的耐受性一般较好,最常见的不良反应为局部烧灼感、刺激和瘙痒,发生率约0.5%。
其他较少见的不良反应为刺痛、皲裂、红斑、毛囊炎、手指麻木、皮肤萎缩及毛细血管扩张,其发生率约为0.3%。
局部应用皮质类固醇尚可引起下述少见的局部不良反应:烧灼感、痒感、刺激、皮肤干燥、多毛症、痤疮样疹、色素减退、口周皮炎、过敏性接触性皮炎、皮肤软化、继发感染、皮肤萎缩、出现皮纹、痱子。
在极少数情况病例,用皮质类固醇治疗银屑病(或停药)可使病情加重或诱发脓疱型银屑病,故需注意监测。
【禁忌】对本药及基质成分过敏者、对其他皮质类固醇过敏者禁用。
【注意事项】(1)本品属于强效皮质类固醇外用制剂,在低至每日0.8g(相当于丙酸氯倍他索0.4mg)的剂量时即可抑制下丘脑-垂体-肾上腺(PHA)轴,由于全身性吸收作用,可造成可逆性下丘脑-垂体-肾上腺(PHA)轴的抑制,部分患者可出现库欣综合征、高血糖及尿糖等表现。
(2)应用强效皮质类固醇,大面积用药、较长时间用药并采用封包方法均可增加系统吸收,所以,大面积皮肤应用大剂量强效皮质类固醇的患者,应定期进行尿游离可的松测定和ACTH刺激试验,评价下丘脑-垂体-肾上腺(PHA)轴的抑制情况。
HPLC法测定复方咪康唑软膏中硝酸咪康唑和丙酸氯倍他索的
含量
谢子立;武谷
【期刊名称】《安徽医药》
【年(卷),期】2001(005)001
【摘要】目的用HPLC法测定复方咪康唑复方软膏中硝酸咪康唑和丙酸氯倍他索的含量.方法以ODS为固定相,0.35%磷酸溶液(用三乙胺调节pH→3.2±0.1)-甲醇(20:80)为流动相,检测波长为240 nm,流速为1.0 ml·min-1;黄体酮为内标.结果硝酸咪康唑、丙酸氯倍他索的浓度线性范围分别为0.16~1.6 g·L-1和0.004~0.04 g·L-1,回收率分别为99.1%和100.0%.结论本法操作简便,结果准确,可以有效地控制质量.
【总页数】2页(P69-70)
【作者】谢子立;武谷
【作者单位】安徽省药品检验所,合肥,230061;安徽省药品检验所,合肥,230061【正文语种】中文
【中图分类】R9
【相关文献】
1.HPLC法测定复方硝酸咪康唑软膏中硝酸咪康唑和丙酸倍氯米松的含量 [J], 林聪明
2.HPLC法测定复方硝酸咪康唑软膏中硝酸咪康唑的含量 [J], 庄江兴;陈育琳;林恬
聪
3.高效液相色谱法测定复方硝酸咪康唑软膏中硝酸咪康唑和丙酸倍氯米松含量 [J], 罗荣;陈标
4.HPLC法测定复方硝酸咪康唑搽剂中醋酸氟轻松和硝酸咪康唑的含量 [J], 肖音;陈晓亮;汪旭
5.HPLC法测定复方珊瑚姜溶液尿素咪康唑软膏复合制剂中硝酸咪康唑含量 [J], 黄春青; 曹桂红; 祝晶; 杨婷; 许波; 罗曼
因版权原因,仅展示原文概要,查看原文内容请购买。
液相色谱法测定复方酮康唑乳膏中丙酸氯倍他索和酮康唑的含量方法对比摘要:目的:应用反相高效液相色谱法分离和测定复方酮康唑乳膏中丙酸氯倍他索和酮康唑的含量。
方法:该供试品经80℃水浴锅传热溶解,放冷至室温以无水乙醇定容至50mL量瓶,超声30min,滤纸过滤。
再经0.45μm滤过后采用Diamosilc18(2)为色谱柱,甲醇-0.01mol/L磷酸二氢钾【用40%氢氧化钠调PH 值为7.2】(70:30)为流动相,流速为1.0ml/min,检测波长239nm。
结果:丙酸氯倍他索和酮康唑的线性范围分别为0.01236~0.02884mg/mL和0.4799981~1.119995mg/mL,并与相应的峰面积呈线性关系,相关系数分别为r1=0.9999611和r2=0.99999583;测得丙酸氯倍他索和酮康唑的平均回收率分别为和%。
结论:该法可快速、灵敏、准确测定丙酸氯倍他索和酮康唑含量,并应用于日常样品复方酮康唑乳膏的分析检测。
关键词:反相高效液相法;丙酸氯被他索;酮康唑引言:复方酮康唑乳膏属于外用制剂,主要用于皮肤浅表真菌感染。
反相高效液相检测的主要成分分别为丙酸氯倍他索和酮康唑。
丙酸氯倍他索属外用强效皮质激素,作用迅速,具有较强的毛细管收缩作用及抗炎作用。
酮康唑属吡格类抗真菌药,对皮真菌、酵母菌、双相真菌和真菌纲有抑菌和杀菌作用。
目前,液相色谱仪法对乳膏制剂的测定已被广泛的应用。
但在实验中发现其丙酸氯倍他索和酮康总测定的方法过于繁琐、时间长和效率较慢。
因此,为了能快速、准确地测定复方酮康唑乳膏中的丙酸氯倍他索和酮康唑含量,本文建立其分析方法,并应用于日常样品复方酮康唑乳膏的液相分析。
1 仪器与试剂高效液相色谱仪(岛津企业管理(中国)有限公司,配备LC-16型二元溶剂输送泵、SPD-16型紫外-可见检测器、CTO-16型柱温箱、SIL-16自动进样器和labsolution5.83)、电子恒温水浴锅(型号HHS21-8)、十万分之一电子天平(岛津AUW220D)、PH计(雷磁PHS-3C)和超声仪(洁康PS-60A)丙酸氯倍他索对照品(系中国食品药品检定研究院公司提供,批号100302-201804),标准贮备液(8mg/ml)的制备:精密称取酮康唑标准品800mg,加无水乙醇溶解并定容至100ml量瓶,摇匀,备用。
消毒产品中丙酸氯倍他索和盐酸左氧氟沙星测定−液相色谱-串联质谱法Determination of clobetasol propionate and levofloxacin hydrochloride indisinfection product - LC-MS-MS method1 范围本方法规定了膏霜类消毒产品中丙酸氯倍他索和盐酸左氧氟沙星残留量液相色谱-串联质谱测定方法。
本方法适用于膏霜类消毒产品中丙酸氯倍他索和盐酸左氧氟沙星残留量的测定。
取样量为0.1g时,本方法对丙酸氯倍他索和盐酸左氧氟沙星的检出限见表1。
表1 丙酸氯倍他索和盐酸左氧氟沙星的检出限、保留时间和特征离子中文名称英文名称检出限(µg/g)保留时间(min)特征离子(m/z)丙酸氯倍他索Clobetasol propionate 0.009 7.83 467.0/355.2/373.4盐酸左氧氟沙星Levofloxacinhydrochloride0.06 1.11 362.0/260.9/318.22 规范性引用文件3 原理试样中丙酸氯倍他索和盐酸左氧氟沙星用甲醇提取,提取液经0.45μm滤膜过滤,用C18柱分离后,用液相色谱-串联质谱仪测定,正离子扫描,离子对定性,峰面积定量。
4 试剂和材料除另有说明外,所用试剂均为分析纯,水为不含有机物的纯水,纯水中干扰物的浓度需低于方法中待测物的检出限。
4.1甲醇:农药残留级。
4.2乙腈:农药残留级。
4.3甲酸:分析纯。
4.4标准品:丙酸氯倍他索和盐酸左氧氟沙星均购自中国药品生物制品检定所,纯度≥99.8%。
4.5标准溶液:准确称取丙酸氯倍他索适量,用乙腈-水(1:1)配制成100µg/mL 的标准贮备液。
准确称取盐酸左氧氟沙星适量,用纯水配制成100µg/mL的标准贮备液。
准确量取上述标准贮备溶液适量,用乙腈稀释配制成浓度为10.0µg/mL的混合标准中间溶液,将标准中间溶液转移到安瓿瓶中于4︒C保存。
高效液相色谱-串联质谱法测定膏霜类消毒产品中丙酸氯倍他索和盐酸左氧氟沙星李志斌;吕东晋;张辉【期刊名称】《理化检验-化学分册》【年(卷),期】2016(052)006【摘要】采用高效液相色谱-串联质谱法测定膏霜类消毒产品中丙酸氯倍他索和盐酸左氧氟沙星的含量。
样品用乙腈提取20 min,所得萃取液以Thermo Hypersil Gold色谱柱为分离柱,以不同体积比的0.1%(ψ)甲酸溶液和乙腈混合液为流动相进行梯度洗脱,采用电喷雾正离子源多反应监测模式检测。
2种化合物的质量浓度均在0.50~100μg·L-1范围内与其峰面积呈线性关系,方法的检出限(3S /N)在0.06~0.009μg·kg-1之间。
在0.50,5.0,50.0μg·L-1等3个浓度水平进行加标回收试验,回收率在90.0%~95.6%之间,测定值的相对标准偏差(n=5)在1.9%~4.0%之间。
【总页数】4页(P695-698)【作者】李志斌;吕东晋;张辉【作者单位】青海省产品质量监督检验所,西宁810000;青海省疾病预防控制中心,西宁810000;青海省疾病预防控制中心,西宁810000【正文语种】中文【中图分类】O657.63【相关文献】1.高效液相色谱法测定复氯培霜中丙酸氯倍他索的含量 [J], 张波;刘玉波;聂渝琼;魏萍2.高效液相色谱法测定氯洁霜中丙酸氯倍他索的含量 [J], 刘源;张林松3.高效液相色谱-原子荧光光谱法测定护肤膏霜中砷形态 [J], 施煜;郑增尧;黄文水;郑曼冰4.高效液相色谱-串联质谱法测定黄瓜与土壤中烯酰吗啉和氰霜唑及其代谢物的残留量 [J], 赵民娟;郭虹娜;邵华;金芬;金茂俊;佘永新;王珊珊;郑鹭飞;王静5.超高效液相色谱-串联质谱法测定马铃薯中ue15e唑菌酮、氰霜唑及其代谢物CCIM的残留量 [J], 周悦;孙慧;李欣;王远;王洪庆;龙惊惊;丁琦;张璋因版权原因,仅展示原文概要,查看原文内容请购买。
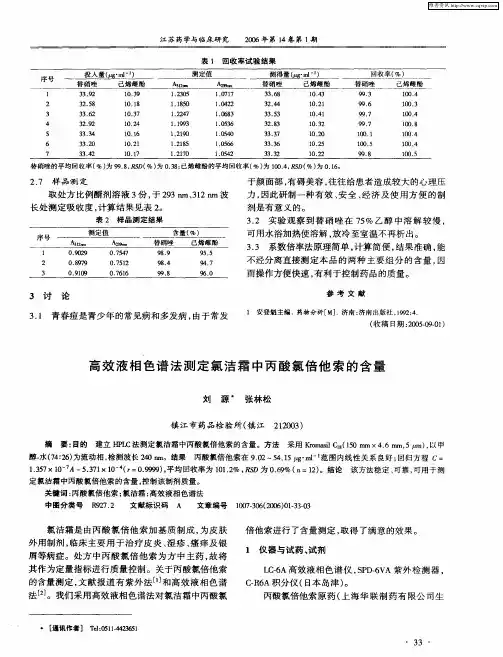
丙酸氯倍他索检验标准
拼音名:Bingsuan Lubeitasuo
英文名:Clobetasol Propionate
书页号:2000年版二部-103
C25H32ClFO5 466.99
本品为16β-甲基11β-羟基-17-(1-氧代丙基)-9-氟-21-氯-孕甾-1,4-二烯-3
20-二酮。
按干燥品计算,含C25H32ClFO5应为97.0%~103.0%。
【性状】本品为类白色或微黄色结晶性粉末。
本品在氯仿中易溶,在醋酸乙酯中溶解,在甲醇和乙醇中略溶,在水中不溶。
熔点本品的熔点(附录Ⅵ C)应为194~198,熔融时同时分解。
比旋度取本品,精密称定,加二氧六环溶解并定量稀释制成每1ml 中含10mg 的溶
液,依法测定(附录Ⅵ E),比旋度应为+99°至+105°。
【鉴别】 (1) 取本品少许,加乙醇1ml ,混合,置水浴上加热2 分钟,加硝酸(1
→2)2ml ,摇匀,加硝酸银试液数滴,即显白色沉淀。
(2) 本品显有机氟化合物的鉴别反应(附录Ⅲ)。
(3) 本品的红外光吸收图谱应与对照的图谱(光谱集 592图)一致。
【检查】其他甾体取本品,加氯仿-甲醇(8.5:1.5) 制成1ml 中含10mg的溶液
作为供试品溶液;精密量取适量,加氯仿-甲醇(8.5:1.5) 稀释制成每1ml 中含 0.1mg
的溶液,作为对照溶液。
照薄层色谱法(附录Ⅴ B)试验,取上述两种溶液各5μl,分
别点于同一硅胶G薄层板上,以苯-丙酮(9:1) 为展开剂,展开后,晾干,喷20%硫酸
显色,在105 ℃加热10分钟,供试品溶液如显杂质斑点,其颜色与对照溶液的主斑点比
较,不得更深。
干燥失重取本品,在105 ℃干燥至恒重,减失重量不得过0.5 %(附录Ⅷ L)。
【含量测定】照高效液相色谱法(附录Ⅴ D)测定。
色谱条件与系统适用性试验用十八烷基硅键合硅胶为填充剂;以0.05mol/L
磷酸氢钠溶液(用85%磷酸溶液调节PH值至2.5)-乙腈-甲醇(425:475:100)为流动相;
检测波长为240nm。
理论板数按丙酸氯倍他索峰计算应不低于5000,丙酸氯倍他索峰与内标物质峰的分离度应符合要求。
内标溶液的制备取丙酸倍氯米松,加甲醇制成每1ml中含0.40mg的溶液,即得。
测定法取本品适量,精密称定,加甲醇溶解并定量稀释制成每1ml中约含40μg的溶液,精密量取10μl注入液相色谱仪,记录色谱图;另取丙酸氯倍他索对照品适量,同法测定。
按外标法以峰面积计算,即得【类别】肾上腺皮质激素类药。
【检查】重金属取本品1.0g,依法测定(附录ⅧH 第二法),含重金属不得过百万分之二十。
【贮藏】遮光,密封保存。