乙酰乙酸乙酯的合成
- 格式:ppt
- 大小:1.66 MB
- 文档页数:33

乙酰乙酸乙酯的正确构造式乙酰乙酸乙酯是一种有机化合物,化学式为CH3COOCH2CH3。
它是一种无色、具有特殊气味的液体,在常温下易挥发。
乙酰乙酸乙酯是一个重要的有机溶剂,广泛应用于化学、药学、涂料、油漆、香料等行业。
乙酰乙酸乙酯的制备方法有多种,其中常用的是将乙酸和乙醇在硫酸的催化作用下缩合,生成乙酰乙酸乙酯。
此外,还有醋酸和乙醇直接酯化的方法。
乙酰乙酸乙酯具有高溶解度、较低的芳香度和较低的毒性,因此在制备无水氨基甲酸和其他有机合成中广泛应用。
同时,在食品、香料和饮料工业中,它也被用作溶剂和调味剂。
此外,乙酰乙酸乙酯还具有较长的保存期限,可以有效地保留香料、调味品和食品的味道和香气。
然而,乙酰乙酸乙酯也存在一定的危险性。
在高温、高压、火源或摩擦力的作用下,容易发生爆炸。
因此,在使用乙酰乙酸乙酯的过程中需要严格遵守安全操作规程。
总之,乙酰乙酸乙酯作为一种重要的有机化合物,具有广泛的应用要求。
在科学研究和生产中,需要认真掌握其制备方法、应用范围和安全操作规程。


乙酰乙酸乙酯的合成方程式乙酰乙酸乙酯是一种常见的有机溶剂,也是一种重要的合成原料,它的合成方程式如下:CH3COOCH2CH3 + HCl → CH3COOH + CH3CH2ClCH3COOH + CH3CH2OH → CH3COOCH2CH3 + H2O上述合成方程式是乙酰乙酸乙酯的两步反应过程。
一、原料准备1. 乙酸乙酯(CH3COOCH2CH3)是由乙酸和乙醇经过酯化反应得到的化合物。
它是一种透明无色液体,带有类似于甜酸味的气味。
乙酸和乙醇的化学式分别为CH3COOH和CH3CH2OH。
2. 氯化乙烷(CH3CH2Cl)氯化乙烷是一种有机化合物,分子式为CH3CH2Cl。
它是一种无色气体,在常温常压下常温沸热。
氯化乙烷是制备乙酰乙酸乙酯的重要原料之一。
二、反应步骤制备乙酰乙酸乙酯需要两步反应,第一步是氯化乙烷与乙酸乙酯发生酯化反应,生成乙酸和氯化乙基。
CH3COOCH2CH3 + HCl → CH3COOH + CH3CH2Cl第二步是乙酸和乙醇发生酯化反应,生成乙酰乙酸乙酯和水。
CH3COOH + CH3CH2OH → CH3COOCH2CH3 + H2O三、反应条件该反应需要在适宜的反应条件下进行,具体条件如下:1. 酯化反应条件:反应时间:2-4小时反应温度:60-80℃反应物比例:1:1.2(乙酸乙酯:氯化乙烷)酯化反应催化剂:HCl2. 酯交换反应条件:反应时间:3-4小时反应温度:70-80℃反应物比例:1:1(乙酸:乙醇)酯交换反应催化剂:硫酸、盐酸等四、反应机理1. 酯化反应机理酯化反应是一种酸催化反应,HCl催化剂可以将氯离子引入乙酸乙酯中,使其易于与氯化乙烷进行反应,产生水和氯化乙基。
同时,水也可以与氯化乙基反应,生成HCl和乙醇。
这个平衡反应可以通过蒸馏来实现。
2. 酯交换反应机理酯交换反应也是一种酸催化反应,硫酸或盐酸可以抑制乙酸与水的反应,从而使乙酸和乙醇之间发生酯化反应,生成乙酰乙酸乙酯和水。

乙酰乙酸乙酯的制备前言:乙酰乙酸乙酯,无色至淡黄色的澄清液体。
微溶于水,易溶于乙醚,乙醇。
有刺激性和麻醉性。
可燃,遇明火、高热或接触氧化剂有发生燃烧的危险。
有醚样和苹果似的香气。
广泛应用于食用香精中,主要用以调配苹果、杏、桃等食用香精。
制药工业用于制造氨基比林、维生素B等。
染料工用作合成染料的原料和用于电影基片染色。
涂料工业用于制造清。
有机工业用作溶剂和合成有机化合物的原料。
减压蒸馏基本原理:某些沸点较高的有机化合物在未达到沸点时往往发生分解或氧化的现象,所以,不能用常压蒸馏。
在较低压力下进行蒸馏的操作称为减压蒸馏。
当蒸馏系统内的压力降低后,其沸点便降低,当压力降低到1.3~2.0 kPa (10~15 mmHg)时,许多有机化合物的沸点可以比其常压下的沸点降低80~100℃。
因此,减压蒸馏对于分离提纯沸点较高或高温时不稳定的液态有机化合物具有特别重要的意义。
反应方程式:CH3COOC2H5乙醇钠CH3COCH2COOC2H5+C2H5OH1、实验部分1.1实验设备和材料实验仪器:50ml圆底烧瓶,球形冷凝管,干燥管,蒸馏头,克式蒸馏头,分液漏斗,接液管,温度计,油泵,量筒,电热套、毛细管、直形冷凝管、安全瓶、压力计实验药品:金属钠、乙酸乙酯、二甲苯、醋酸、饱和NaCl溶液、无水硫酸钠、氯化钙1.2实验装置回流装置减压蒸馏装置1.3实验过程(1)制钠珠:将0.9g 金属钠和5mL 干燥二甲苯放入装有回流冷凝管的50ml原定烧瓶中。
加热使钠熔融。
拆去冷凝管,用磨口玻塞塞紧圆底烧瓶,趁热用力振摇(两下)得细粒状钠珠。
(2回流、酸化:稍经放置钠珠沉于瓶底,将二甲苯倒入指定回收瓶中。
迅速向瓶中加入10mL 乙酸乙酯,装上冷凝管,并在其顶端装一氯化钙干燥管。
反应开始有氢气泡逸出。
如反应很慢时,可稍加温热。
待激烈的反应过后,则小火加热,保持微沸状态,直至所有金属钠全部作用完为止。
此时生成的乙酰乙酸乙酯钠盐为桔红色透明溶液。



最全面乙酰乙酸乙酯的制备实验报告一、实验目的1.掌握乙酰乙酸乙酯的制备方法与过程;2.了解配合物在有机合成中的应用;3.学习利用减压蒸馏进行分离纯化的方法。
二、实验原理乙酰乙酸乙酯又称乙酰三乙基酯,是一种无色、易挥发液体,常用于溶剂和香料等方面。
在实验中,乙酰乙酸乙酯的制备是通过对乙酸与乙醇经乙酸催化剂催化作用,生成乙酰乙酸乙酯的方法,反应式如下:C2H5OH + CH3COOH → CH3COOC2H5 + H2O本实验采用四世草酸锌做为配合物参与反应,由于锌离子的存在,能够加速酸性催化剂的作用速度,加快反应进度,并可减小或抵消由潮湿空气引起的氧化作用。
当反应结束后,利用减压蒸馏的方式进行分离提纯出乙酰乙酸乙酯。
三、实验步骤1.实验前准备。
称取30g四世草酸锌加入500mL三角瓶中,用5mL无水乙醇溶解。
2.反应操作。
将混合液倒入圆底瓶中,加入100mL乙酸,搅拌至均匀。
再加入70mL 无水乙醇,搅拌30min到反应减慢或停止反应。
得到的产物为混合溶液。
3.蒸馏提纯。
将混合溶液倒入蒸馏瓶中,开始蒸馏。
收集第一滴油滴下时起计时,收集沸点在138℃-144℃之间的馏分。
得到纯净的乙酰乙酸乙酯。
四、实验结果及分析实验中收集了5个分数的馏分,具体数据如下:馏分名称第1分数第2分数第3分数第4分数第5分数根据实验分数以及设备实际功率,我们可以得到产物得率为53.33%。
五、实验结论本实验通过乙酸与乙醇反应得到了乙酰乙酸乙酯(即乙酰三乙基酯)。
在反应中,四世草酸锌做为配合物起到催化加速反应及保护反应中间体防止氧化的作用。
减压蒸馏的方式对混合液进行分离提纯,得到纯净的乙酰乙酸乙酯。
实验结果表明,产物得率为53.33%,符合预期。
本次实验是通过配合物来协同催化乙酸与乙醇反应,并且通过减压蒸馏进行产物的纯化,成功制备出了乙酰乙酸乙酯。
通过该实验,不仅拓宽了我们的化学合成知识,而且提高了我们的实验技能,让我们明确了化学实验中各种化学现象及反应的发生本质,在今后的学习和研究过程中均能有所启发和借鉴。

乙酰乙酸乙酯的合成及其波谱分析一、乙酰乙酸乙酯的合成㈠ 实验目的1.了解酯缩合反应制备β-酮酸酯的原理及方法。
2.掌握无水反应的操作要点。
3.掌握蒸馏、减压蒸馏等基本操作。
㈡ 实验原理(半微量实验)含有α-氢的酯在碱性催化剂存在下,能与另一分子的酯发生克莱森酯缩合反应,生成β-酮酸酯,乙酰乙酸乙酯就是通过这个反应来制备的。
本实验是用无水乙酸乙酯和金属钠为原料,以过量的乙酸乙酯为溶剂,通过酯缩合反应制得乙酰乙酸乙酯。
反应机理为,利用乙酸乙酯中含有的少量乙醇与钠作用生成乙醇钠。
↑+→+25252222H ON H C N OH H C a a随着反应的进行不断地生成乙醇,反应就不断地进行,直至钠消耗完。
在乙醇钠作用下,具有α-氢原子的乙酸乙酯自身缩合,生成烯醇型钠盐,再经醋酸酸化即得乙酰乙酸乙酯。
金属钠极易与水反应,并放出氢气和大量热,易导致燃烧和爆炸,故反应所用仪器必须是干燥的,试剂必须是无水的。
㈢ 实验装置乙酰乙酸乙酯合成的实验装置包括反应装置和减压蒸馏装置。
反应装置如图3-1所示,其回流冷凝管上须加干燥管。
减压蒸馏装置图3-2所示。
包括蒸馏、抽气、测压和保护四部分。
蒸馏部分由圆底烧瓶、克氏蒸馏头、冷凝管、接引管和接受器组成。
在克氏蒸馏头带有支管一侧的上口插温度计,另一口则插一根末端拉成毛细管的厚壁玻璃管。
毛细管下端离瓶底约1~2mm ,在减压蒸馏中,毛细管主要起到沸腾中心和搅动作用,防止爆沸,保持沸腾平稳。
在减压蒸馏装置中,接引管一定要带有支管。
该支管与抽气系统连接。
在蒸馏过程中若要收集不同馏分,则可用带支管的多头接引管。
根据馏程范围可转动多头接引管集取不同馏分。
接受器可用圆底烧瓶。
吸滤瓶等耐压容器,但不可用锥形瓶。
实验室里常用的抽气减压设备是水泵或油泵。
水泵常因其结构、水压和水温等因素,不易得到较高的真空度。
油泵可获得较高的真空度,好的油泵可达到13.3Pa 的真空度。
油泵的结构较为精密,如果有挥发性有机溶剂。
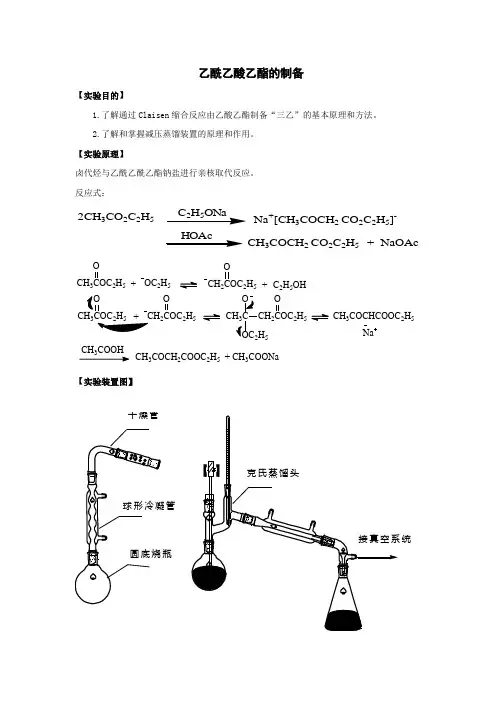
乙酰乙酸乙酯的制备【实验目的】1.了解通过Claisen 缩合反应由乙酸乙酯制备“三乙”的基本原理和方法。
2.了解和掌握减压蒸馏装置的原理和作用。
【实验原理】卤代烃与乙酰乙酰乙酯钠盐进行亲核取代反应。
反应式:2CH 3CO 2C 2H 5 Na +[CH 3COCH 2 CO 2C 2H 5]-CH 3COCH 2 CO 2C 2H 5 + NaOAcCH 3COC 2H 5O+OC 2H 5CH 2COC 2H 5O +C 2H 5OH32COC 2H 5O CH 3C OC 2H 5CH 2COC 2H 5O CH 3COCHCOOC 2H 5 Na 3CH 3COCH 2COOC 2H 5 + CH 3COONa【实验装置图】球形冷凝管圆底烧瓶干燥管统【实验的准备】仪器:圆底烧瓶(50 ml、100 ml各1个);球形冷凝器(1支);分液漏斗;直型冷凝管;磨口锥形瓶;减压蒸馏装置(1套)药品:无水乙酸乙酯22.5g(25ml,0.26mol) ,金属钠2.5g(0.11mol),乙酸溶液(50%),饱和氯化钠水溶液,碳酸钠溶液(5%),无水硫酸镁。
【操作步骤】1.安装回流反应装置2.制钠珠:将金属Na迅速切成薄片,放入100ml的圆底烧瓶中,并加入12.5ml二甲苯,小火加热回流使熔融,拆去冷凝管,用橡皮塞塞住瓶口,用力振摇即得细粒状钠珠。
稍冷后将二甲苯滗入回收瓶。
3.加酯回流:迅速放入27.5ml乙酸乙酯,反应开始。
若慢可温热。
回流1.5h至钠基本消失,得橘红色溶液,有时析出黄白色沉淀(均为烯醇盐)。
4.酸化:加50%醋酸(约15ml),至反应液呈弱酸性(固体溶完)。
5.分液:反应液转入分液漏斗,加等体积饱和氯化钠溶液,振摇,静置。
6.安装减压蒸馏装置(如84页图3.10)7.蒸馏:水浴蒸去乙酸乙酯,剩余物移至 50ml蒸馏瓶中进行减压蒸馏,收集馏分。
【检验与测试】乙酰乙酸乙酯的互变异构现象可通过以下试验来验证。

乙酰乙酸乙酯合成及后处理方法的筛选
乙酰乙酸乙酯是一种常见的有机化合物,具有广泛的应用领域。
本文旨在探讨乙酰乙酸乙酯的合成及后处理方法的筛选。
乙酰乙酸乙酯的合成方法有许多种,常见的包括酸催化法、碱催化法、酶催化法等。
在这些方法中,酸催化法是最常用的方法之一。
该方法通常使用硫酸或磷酸等强酸作为催化剂,将乙醇和乙酸酐反应,生成乙酰乙酸乙酯。
但是,酸催化法存在酸侵蚀、产物纯度低等问题,因此需要寻找更为优化的方法。
一种可能的优化方法是使用离子液体作为催化剂。
离子液体具有高催化活性、低毒性、易回收等优点,可用于代替传统的有机溶剂催化剂。
此外,离子液体还可通过改变其结构和配位离子等方式来调控反应的速率和选择性。
在乙酰乙酸乙酯的后处理过程中,通常需要进行蒸馏、结晶、过滤等步骤,以提高产物的纯度和收率。
其中,蒸馏是最常用的方法之一。
该方法通过调节温度和压力,将乙酰乙酸乙酯从反应混合物中分离出来。
但是,蒸馏过程中容易出现分解和副反应,影响产物的纯度和收率。
因此,需要进行适当的调节和优化。
另一种可能的优化方法是采用超声波辅助分离技术。
该技术利用超声波的物理效应,促进反应混合物的分离和提纯。
与传统的分离方法相比,超声波辅助分离技术具有反应速率快、产物纯度高等优点。
因此,针对乙酰乙酸乙酯的合成及后处理方法,可以通过筛选不同的催化剂和分离技术,以优化反应条件,提高产物的纯度和收率。
![[乙酰乙酸乙酯的合成]工业上合成乙酸乙酯的4种方法比较](https://uimg.taocdn.com/9a7b8d31a4e9856a561252d380eb6294dd88220a.webp)
[乙酰乙酸乙酯的合成]工业上合成乙酸乙酯的4种方法比较篇一: 工业上合成乙酸乙酯的4种方法比较酯化法。
醋酸酯化法生产醋酸乙酯的常见方法。
酯化法是在催化剂存在的条件下,由醋酸和乙醇发生酯化反应而得醋酸乙酯,然后再经过精制得到最终产品醋酸乙酯。
近年来开发出了1种酯化法工艺方法称之为”切换法”,即在同一套装置内通过切换生产原料,可以根据市场需要生产醋酸乙酯或醋酸丁酯。
这种对常规酯化技术的改革具有降低生产成本的潜力。
通过消除产品间的切换时间而增加多用途酯化设备的运转时间,从而降低投资成本和操作成本。
以前建设的酯化法醋酸乙酯装置或醋酸丁酯装置都可以投入少量资金改造为切换法。
此工艺目前国内比较成熟。
研究人员在现有醋酸酯化法基础上开发了1种醋酸乙酯绿色节能新工艺-非高分子固体酸催化酶化-加盐萃取精馏联合技术,简称”盐析法”。
据报道,与传统酯化法相比可减少20%-25%的能耗,能有效降低乙醇用量,此技术已经在部分企业实现改造。
酯化法工艺优点是技术成熟、投资少。
缺点是成本高、设备腐蚀严重、废酸不易处理、排放时环境污染大、副反应多及副产物处理困难等。
酯化法适用于拥有大量低成本乙醇的地区。
乙醛缩合法。
乙醛缩合法是在催化剂乙醇铝的存在下,2个分子的乙醛自动氧化和缩合,重排形成一分子的醋酸乙酯。
采用该工艺时,如果反应过程中有2种醛存在,则可以生产出混合酯类,例如Eastman 公司在生产中采用大量乙醛和适量丁醛,可同时生产醋酸乙酯和醋酸丁酯。
该工艺在常压低温下进行,反应条件温和,但是铝基催化剂目前尚无法回收,乙醇铝水解后产生的残渣如果直接排放,将会污染环境。
随着环保要求的提高,必须寻求适宜的处理方法。
该法不足之处是只有在乙醛价格处于低位时才具有竞争力。
乙醛缩合法在国外已经比较成熟。
该法的优点是化学反应中没有废物产生。
乙醛缩合法工艺受原料乙醛的限制,一般应建在乙烯-乙醛联合装置内。
乙醇脱氢法。
乙醇脱氢法是近年来开发的1种新的工艺方法。
乙酰乙酸乙酯的合成及其波谱分析一、乙酰乙酸乙酯的合成㈠ 实验目的1.了解酯缩合反应制备β-酮酸酯的原理及方法。
2.掌握无水反应的操作要点。
3.掌握蒸馏、减压蒸馏等基本操作。
㈡ 实验原理(半微量实验)含有α-氢的酯在碱性催化剂存在下,能与另一分子的酯发生克莱森酯缩合反应,生成β-酮酸酯,乙酰乙酸乙酯就是通过这个反应来制备的。
本实验是用无水乙酸乙酯和金属钠为原料,以过量的乙酸乙酯为溶剂,通过酯缩合反应制得乙酰乙酸乙酯。
反应机理为,利用乙酸乙酯中含有的少量乙醇与钠作用生成乙醇钠。
↑+→+25252222H ON H C N OH H C a a随着反应的进行不断地生成乙醇,反应就不断地进行,直至钠消耗完。
在乙醇钠作用下,具有α-氢原子的乙酸乙酯自身缩合,生成烯醇型钠盐,再经醋酸酸化即得乙酰乙酸乙酯。
金属钠极易与水反应,并放出氢气和大量热,易导致燃烧和爆炸,故反应所用仪器必须是干燥的,试剂必须是无水的。
㈢ 实验装置乙酰乙酸乙酯合成的实验装置包括反应装置和减压蒸馏装置。
反应装置如图3-1所示,其回流冷凝管上须加干燥管。
减压蒸馏装置图3-2所示。
包括蒸馏、抽气、测压和保护四部分。
蒸馏部分由圆底烧瓶、克氏蒸馏头、冷凝管、接引管和接受器组成。
在克氏蒸馏头带有支管一侧的上口插温度计,另一口则插一根末端拉成毛细管的厚壁玻璃管。
毛细管下端离瓶底约1~2mm ,在减压蒸馏中,毛细管主要起到沸腾中心和搅动作用,防止爆沸,保持沸腾平稳。
在减压蒸馏装置中,接引管一定要带有支管。
该支管与抽气系统连接。
在蒸馏过程中若要收集不同馏分,则可用带支管的多头接引管。
根据馏程范围可转动多头接引管集取不同馏分。
接受器可用圆底烧瓶。
吸滤瓶等耐压容器,但不可用锥形瓶。
实验室里常用的抽气减压设备是水泵或油泵。
水泵常因其结构、水压和水温等因素,不易得到较高的真空度。
油泵可获得较高的真空度,好的油泵可达到13.3Pa 的真空度。
油泵的结构较为精密,如果有挥发性有机溶剂。
有机化学实验报告学院化学化工学院班级12化师姓名学号成绩实验日期指导老师实验题目乙酰乙酸乙酯的制备一实验目的1、学习乙酰乙酸乙酯的制备原理和方法;2、掌握无水操作及减压蒸馏等操作。
二实验原理利用Claisen缩合反应,将两分子具有α-氢的酯在醇钠的催化作用下可以制得β-酮酸酯,其反应如下:1、通常以酯和金属钠为原料,且酯过量(同时作为溶剂),钠为计量依据物。
2、利用酯中含有的微量醇与钠反应来生成醇钠,随着反应的进行,醇不断生成,钠不断溶解,醇钠不断产生,反应能不断进行,直至钠消耗完毕。
作为原料的酯中含醇量过高又会影响产率的得率,一般要求酯中的含醇量在3%以下。
3、反应体系中如有水存在,对反应不利。
钠的损失降低了产率,也抑制了反应的进行,故要求反应体系无水。
4、反应中使用钠珠或钠丝可使其与酯的接触面增大,故先用二甲苯作溶剂制成细小的钠珠,以利于反应的进行。
乙酰乙酸乙酯在常压蒸馏下很易分解,产生“去水乙酸”,故应采用减压蒸馏法。
三、主要试剂及产物的物理常数试剂名称性状分子量M密度熔点(mp/℃)沸点(bp/℃)折射率(n D20)溶解度乙酰乙酸乙酯有果子香味无色或微黄色透明液体130.14 1.025 -45~-43180.4分解1.4194溶于水,能与一般有机溶剂混溶乙酸乙酯有果子香气无色可燃性液体88.12 0.9005 -83.6 77.1 1.3723微溶于水,溶于乙醇、乙醚、氯仿和苯等甲苯无色易挥发液体有芳香气味92.14 0.866 -95 110.8 1.4967不溶于水,溶于乙醇、乙醚和丙酮主要试剂及用量名称规格用量备注g mL mol金属钠去掉表面氧化膜0.9 0.04二甲苯干燥 5乙酸乙酯精制10 0.1醋酸50% 调pH5~6食盐水饱和等体积醋酸用量苯8 萃取用四实验装置图图2:减压蒸馏装置图五、实验步骤及现象记录步骤现象备注钠珠的制备:干燥的圆底烧瓶中放入0.9g去掉表面氧化膜的金属钠、5ml干燥的二甲苯,冷凝回流加热至Na熔融塞紧塞子,趁热振荡,得细粒状钠珠,冷却至室温,倾去二甲苯由于二甲苯温度逐渐下降,蒸气压随之下降,因此,要不时开启瓶盖或在瓶口夹一纸条,否则塞子难以打开。
乙炔合成乙酰乙酸乙酯合成路线乙炔是一种重要的化学原料,在化工领域有着广泛的应用。
而乙酰乙酸乙酯是一种常见的有机溶剂和合成材料,其合成路线多种多样。
本文将介绍一种常用的乙炔合成乙酰乙酸乙酯的合成路线。
乙炔是一种无色、有毒、易燃的气体,它是由乙烯经过裂解反应得到的。
乙炔的制备过程基本可以分为两步,即乙烯的制备和乙烯的裂解。
首先,乙烯的制备是乙炔合成乙酰乙酸乙酯的第一步。
乙烯是一种常见的有机物,可以通过石油、天然气等化石燃料的加热裂解得到。
在工业上,常用的方法是通过催化剂的作用,将乙烷转化为乙烯。
乙烯是一种无色、有毒、易燃的气体,可以作为化工原料用于合成其他有机物。
第二步是乙烯的裂解。
乙烯在高温下经过裂解反应可以得到乙炔。
乙烯裂解的条件包括温度、压力、催化剂等。
一般来说,乙烯裂解的温度要高于600摄氏度,压力一般在1-2兆帕左右。
在催化剂的选择上,常用的是氧化锌、氧化镁等金属氧化物。
乙炔合成乙酰乙酸乙酯的第三步是通过化学反应将乙炔转化为乙酰乙酸乙酯。
乙酰乙酸乙酯是一种无色液体,具有香气,可溶于水和多种有机溶剂。
乙酰乙酸乙酯的合成方法有多种,其中一种常用的方法是通过乙炔和乙醇的酯化反应得到。
在酯化反应中,乙炔和乙醇在催化剂的作用下发生酯化反应,生成乙酰乙酸乙酯。
常用的催化剂包括硫酸、磷酸等。
乙酰乙酸乙酯是一种重要的有机溶剂和合成材料,在化工、制药、食品等行业有着广泛的应用。
它具有挥发性小、溶解力强、熔点低等特点,适用于溶解和提取多种有机物。
乙炔合成乙酰乙酸乙酯的路线是通过乙烯的制备、乙烯的裂解以及乙炔的酯化反应三个步骤来完成的。
这种合成路线简单、成本低、操作方便,因此被广泛应用于工业生产中。
乙酰乙酸乙酯的应用领域广泛,对于提高化工生产效率和产品质量有着重要意义。
乙酰乙酸乙酯的合成
乙酰乙酸乙酯(ethyl acetate)是一种重要的工业原料,它广泛用于日用化工、精细化工等领域。
合成乙酰乙酸乙酯的原料主要有一氧化氮、乙醇、氢氧化钠和硫酸等。
首先,将一氧化氮进行酸化反应,将其转化为硝酸,再将硝酸放入乙醇中,加入少量的硫酸,并搅拌使各组分均匀反应起来,再加入氢氧化钠及少量硫酸,反应温度维持在20~30℃,反应时间为2小时左右,在此期间,乙醇和乙酸会化裂,产生乙酰乙酸乙酯。
接着,将反应后的混合液在高温的环境下反应,将水以长效的方式提取,保证不产生大量的水汽,来调节温度。
最后,混合液会在有碱反应的条件下凝固。
再将凝固的乙酰乙酸乙酯放入水中,表面会出现大量的胶膜,就证明乙酰乙酸乒酯已经合成完成。
本文介绍了乙酰乙酸乙酯的合成过程,它具有广泛的用途,在日用化工、精细化工等领域均有广阔的应用前景。
以上就是乙酰乙酸乙酯的合成过程,希望对大家有所帮助,也希望大家能够更好地利用乙酰乙酸乙酯的工业原料,给我们的生活中增添更多的乐趣。