医疗器械不良事件报告表
- 格式:docx
- 大小:14.16 KB
- 文档页数:3



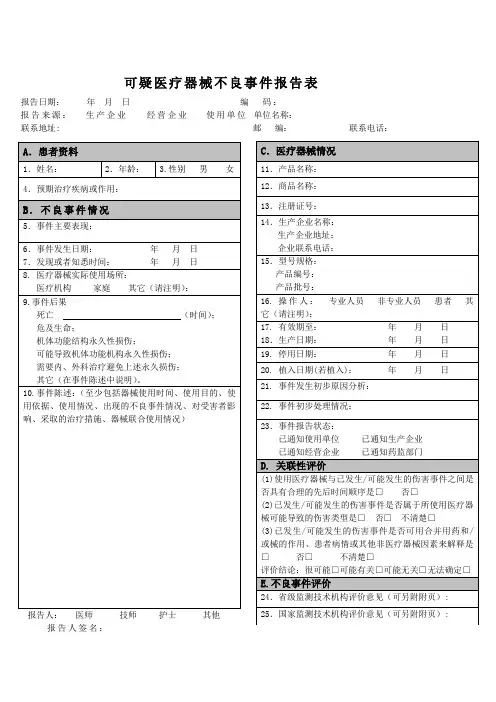
附件1:国家食品药品监督管理局制可疑医疗器械不良事件报告表报告日期:年月日编码:报告来源:生产企业经营企业使用单位单位名称:联系地址: 邮编:联系电话:A.患者资料1.姓名:2.年龄: 3.性别男女4.预期治疗疾病或作用:B .不良事件情况5.事件主要表现:6.事件发生日期:年月日7.发现或者知悉时间:年月日8. 医疗器械实际使用场所:医疗机构家庭其它(请注明):9.事件后果死亡(时间);危及生命;机体功能结构永久性损伤;可能导致机体功能机构永久性损伤;需要内、外科治疗避免上述永久损伤;其它(在事件陈述中说明)。
10.事件陈述:(至少包括器械使用时间、使用目的、使用依据、使用情况、出现的不良事件情况、对受害者影响、采取的治疗措施、器械联合使用情况)报告人:医师技师护士其他报告人签名:C.医疗器械情况11.产品名称:12.商品名称:13.注册证号:14.生产企业名称:生产企业地址:企业联系电话:15.型号规格:产品编号:产品批号:16. 操作人:专业人员非专业人员患者其它(请注明):17. 有效期至:年月日18.生产日期:年月日19. 停用日期:年月日20. 植入日期(若植入):年月日21. 事件发生初步原因分析:22. 事件初步处理情况:23.事件报告状态:已通知使用单位已通知生产企业已通知经营企业已通知药监部门D. 不良事件评价24.省级监测技术机构评价意见(可另附附页): 25.国家监测技术机构评价意见(可另附附页):例子:附件1: 国家食品药品监督管理局制可疑医疗器械不良事件报告表报告日期:2010年10月25日 编 码: 报告来源: 生产企业 经营企业 √使用单位 单位名称:按实际填写 联系地址: 按实际填写 邮 编: 联系电话:C .医疗器械情况11.产品名称:一次性使用静脉留置针 12.商品名称:13.注册证号:国食药监械(准)字2007第3150968号 14.生产企业名称:江西洪达医疗器械集团有限公司生产企业地址:南昌市进贤县城胜利南路39号 企业联系电话: 15.型号规格:24GA产品编号:3601 产品批号:100502 16. 操作人:√专业人员 非专业人员患者其它(请注明):17. 有效期至: 2013 年 04 月 30 日 18.生产日期: 2010年 05月 02 日 19. 停用日期: 2010年 10月 22 日 20. 植入日期(若植入): 2010 年 10 月20日 21. 事件发生初步原因分析:部分患者对一次性使用静脉留置针发生排斥反应而致穿刺部位组织红肿。
可疑医疗器械不良事件报告表报告日期: 年 月 日 编 码: 报告来源: 生产企业 经营企业 使用单位 单位名称:联系地址: 邮 编: 联系电话:报告人签名:A .患者资料 1.姓名:2.年龄:3.性别 男 女4.预期治疗疾病或作用:B .不良事件情况5.事件主要表现:6.事件发生日期: 年 月 日7.发现或者知悉时间: 年 月 日 8. 医疗器械实际使用场所:医疗机构 家庭 其它(请注明): 9.事件后果死亡 (时间); 危及生命;机体功能结构永久性损伤;可能导致机体功能机构永久性损伤; 需要内、外科治疗避免上述永久损伤; 其它(在事件陈述中说明)。
10.事件陈述:(至少包括器械使用时间、使用目的、使用依据、使用情况、出现的不良事件情况、对受害者影响、采取的治疗措施、器械联合使用情况)报告人: 医师 技师 护士 其他 C .医疗器械情况11.产品名称: 12.商品名称: 13.注册证号: 14.生产企业名称:生产企业地址: 企业联系电话: 15.型号规格:产品编号: 产品批号:16. 操作人:专业人员 非专业人员 患者 其它(请注明):17. 有效期至: 年 月 日 18.生产日期: 年 月 日 19. 停用日期: 年 月 日 20. 植入日期(若植入): 年 月 日 21. 事件发生初步原因分析: 22. 事件初步处理情况: 23.事件报告状态: 已通知使用单位 已通知生产企业 已通知经营企业已通知药监部门D. 关联性评价(1)使用医疗器械与已发生/可能发生的伤害事件之间是否具有合理的先后时间顺序是□ 否□(2)已发生/可能发生的伤害事件是否属于所使用医疗器械可能导致的伤害类型是□ 否□ 不清楚□(3)已发生/可能发生的伤害事件是否可用合并用药和/或械的作用、患者病情或其他非医疗器械因素来解释是□ 否□ 不清楚□评价结论:很可能□可能有关□可能无关□无法确定□E.不良事件评价24.省级监测技术机构评价意见(可另附附页):25.国家监测技术机构评价意见(可另附附页):填写要求:《可疑医疗器械不良事件报告表》由题眉、患者资料、不良事件情况、医疗器械情况、关联性评价、不良事件评价及题末7部分组成。

国家食品药品监督管理局制可疑医疗器械不良事件报告表报告日期:报告来源: 联系地址:A. 患者资料1.姓名:2 .年龄: 3•性别 男 女4 .预期治疗疾病或作用:B. 不良事件情况5. 事件主要表现: 6 .事件发生日期: 年 月曰 7 •发现或者知悉时间: 年 月曰8. 医疗器械实际使用场所:医疗机构 家庭 其它(请注明):9. 事件后果死亡 _________________________________ (时间); 危及生命;机体功能结构永久性损伤; 可能导致机体功能机构永久性损伤; 需要内、外科治疗避免上述永久损伤; 其它(在事件陈述中说明)。
10. 事件陈述:(至少包括器械使用时间、使用目的、使 用依据、使用情况、出现的不良事件情况、对受害者影 响、采取的治疗措施、器械联合使用情况)报告人: 医师 技师 护士 其他邮 编:联系电话:报告人签名:附件1:年 月曰生产企业经营企业例子:附件1:可疑医疗器械不良事件报告表报告日期:2010年10月25日 编 码:邮 编:联系电话:A. 患者资料1.姓名:2 .年龄:3•性别男女"4 •预期治疗疾病或作用:输液B. 不良事件情况5•事件主要表现:穿刺部位红肿 6.事件发生日期: 2010年10 月22日7 .发现或者知悉时间: 2010年10月22日8. 医疗器械实际使用场所:V 医疗机构 家庭 其它(请注明):9. 事件后果死亡 _________________________________ (时间); 危及生命;机体功能结构永久性损伤; 可能导致机体功能机构永久性损伤; 需要内、外科治疗避免上述永久损伤;V 其它(在事件陈述中说明)。
国家食品药品监督管理局制报告来源: 生产企业 经营企业 "使用单位 单位名称:按实际填写联系地址:按实际填写10. 事件陈述:(至少包括器械使用时间、使用目的、使用依据、使用情况、出现的不良事件情况、对受害者影响、采取的治疗措施、器械联合使用情况)患者于2010年10月20日在我院留医治疗使用一次性使用静脉留置针,穿刺部位于穿刺输液后2天出现皮肤红肿,无发热等现象,拔除一次性使用静脉留置针1天后症状消失。

可疑医疗器械不良反应报告表范文英文回答:Adverse Event Reporting Form for Suspected Medical Device Adverse Reactions.Name: [Your Name]Date: [Date]Patient Information:Name: [Patient's Name]Age: [Patient's Age]Sex: [Patient's Gender]Medical History: [Brief summary of patient's medical history]Device Information:Device Name: [Name of the medical device]Manufacturer: [Name of the manufacturer]Model/Serial Number: [Model/Serial Number of the device]Date of Implantation/Use: [Date of deviceimplantation/use]Description of the Adverse Event:Please provide a detailed description of the adverse event experienced by the patient, including any signs or symptoms observed.Example: I recently used a blood pressure monitoring device on a patient. The patient experienced severe painand discomfort during the procedure. The device seemed tobe malfunctioning as it was displaying inconsistentreadings. The patient's blood pressure was also abnormally high, which was concerning.Actions Taken:Please describe any actions taken in response to the adverse event, such as discontinuation of device use, medical intervention, or device replacement.Example: As soon as I noticed the patient's discomfort and the device malfunction, I immediately stopped using the device. I informed the patient about the situation and provided them with alternative methods for monitoring their blood pressure. I also reported the incident to thehospital's medical device department for further investigation.Outcome:Please describe the outcome of the adverse event, including any medical interventions or treatments provided to the patient.Example: After discontinuing the use of the blood pressure monitoring device, the patient's pain and discomfort subsided. The patient was closely monitored for any further complications and was eventually switched to a different device for blood pressure monitoring. No further adverse events were reported.Preventive Measures:Please suggest any preventive measures that can be taken to avoid similar adverse events in the future.Example: To prevent similar adverse events in the future, it is important to conduct regular maintenance and calibration checks on medical devices. Additionally, healthcare professionals should receive proper training on device usage and troubleshooting. It is also crucial to establish a robust reporting system for adverse events to ensure prompt investigation and appropriate action.中文回答:可疑医疗器械不良反应报告表。

可疑医疗器械不良事件报告表可疑医疗器械不良事件报告表 A(患者资料 1(姓名: 2(年龄: 3.性别, 男 ,女 4(预期治疗疾病或作用:B(不良事件情况 5(事件主要表现:(患者的表现和器械的表现)6(事件发生日期(患者或其他人首次返现异常的日期): 年月日7(发现或者知悉时间(我们获知的时间): 年月日 8. 医疗器械实际使用场所: , ?医疗机构 , 家庭 , 其它(请注明):9.事件后果, 死亡 (时间);, 危及生命;, 机体功能结构永久性损伤;, 可能导致机体功能机构永久性损伤(指治疗可能无效或效果较差); , 需要内、外科治疗避免上述永久损伤(指治疗可使功能恢复); , 其它(在事件陈述中说明)。
10.事件陈述:使用时间:使用目的:使用依据:使用情况(使用过程是否正常按说明书操作,说明书是否清楚明白详细,产品有无异常):出现的不良事件情况(尽量详细描述产品使用过程中发生的变化和对患者的损害或对诊断治疗的影响):对受害者影响(对治疗、生理身体功能、生活等有无影响):采取的治疗措施:器械联合使用情况C(医疗器械情况11(产品名称:12(商品名称:13(注册证号:14(生产企业名称:生产企业地址:企业联系电话:15 型号规格:产品编号:产品批号:16. 操作人:,?专业人员 ,非专业人员 ,患者 ,其它(请注明): 17. 有效期至: 年月日18(生产日期: 年月日19. 停用日期(若停用): 年月日 20. 植入日期(若植入): 年月日21. 事件发生初步原因分析(简单判断):22. 事件初步处理情况(任何措施,如更换产品、对患者损害处理、安抚、报告、留样封存):23(事件报告状态:, 已通知使用单位 , 已通知生产企业, 已通知经营企业 , 已通知药监部门D. 不良事件评价24(省级监测技术机构评价意见(可另附附页): 25(国家监测技术机构评价意见(可另附附页): 报告人: 医师, 技师, 护士, 其他,国家食品药品监督管理局制。

医疗器械不良事件报告表
一、报告单位信息。
1. 报告单位名称:
2. 单位地址:
3. 联系人:
4. 联系电话:
5. 邮政编码:
二、器械基本信息。
1. 器械名称:
2. 型号:
3. 规格:
4. 生产厂家:
5. 出厂日期:
6. 有效期至:
三、不良事件描述。
1. 事件发生时间:
2. 事件发现时间:
3. 不良事件描述:
4. 不良事件对患者造成的影响:
5. 不良事件对医疗过程的影响:
6. 不良事件对医疗器械的影响:
四、不良事件原因分析。
1. 不良事件的直接原因:
2. 不良事件的间接原因:
3. 不良事件的根本原因:
4. 防范措施及改进建议:
五、处理结果。
1. 患者处理情况:
2. 医疗器械处理情况:
3. 相关人员处理情况:
4. 预防措施及改进措施:
六、报告人信息。
1. 姓名:
2. 职务:
3. 联系电话:
4. 电子邮箱:
5. 签名:
七、报告时间。
1. 年月日。
以上是医疗器械不良事件报告表的内容,医疗器械不良事件的及时报告对于医疗安全至关重要,希望各报告单位能够认真填写以上信息,确保医疗器械使用过程中的安全和有效性。
同时,对于不良事件的原因分析和处理结果也需要进行深入的思考和总结,以期减少类似事件的再次发生,保障患者和医护人员的安全。

医疗器械不良事件报告表疗人员的死亡或严重伤害,应该按可疑医疗器械不良事件报告。
3、主动报告原则:医疗器械生产企业、经营企业、使用单位应该在发现可疑医疗器械不良事件后,主动向药监部门报告。
四、报告流程:1、发现可疑医疗器械不良事件后,立即停止使用该器械,采取必要的救治措施,并将事件报告给医疗器械生产企业、经营企业、使用单位的负责人。
2、医疗器械生产企业、经营企业、使用单位应该及时向药监部门报告可疑医疗器械不良事件,提供详细的事件陈述和医疗器械情况。
3、药监部门收到报告后,将对事件进行调查和分析,评估事件的严重程度,并根据评估结果采取相应的措施,包括通知医疗器械生产企业、经营企业和使用单位,要求其采取必要的措施,防止类似事件再次发生。
五、报告表填写说明:医疗器械不良事件报告表应该详细记录患者资料、医疗器械情况、不良事件情况、事件处理情况等信息,并在事件陈述中尽可能详细地描述事件的经过和影响。
填写报告表时应该注意格式的正确性,删除明显有问题的段落,并尽可能用简明的语言表达。
1、格式错误已经被修正;2、删除明显有问题的段落;3、改写每段话如下:一、报告原则:医疗器械不良事件报告是指在医疗器械使用过程中,发生了与医疗器械有关的意外、事故、质量问题、疾病传播等不良事件,需要向相关部门进行报告。
报告原则包括:必报原则、可疑即报原则和免除报告原则。
二、必报原则:根据《医疗器械不良事件报告管理办法》,以下情况必须报告:1.引起或造成死亡或严重伤害的事件;2.对医疗器械性能的影响性质严重,很可能引起或造成死亡或严重伤害的事件;3.使器械不能发挥其必要的正常作用,并且影响医疗器械的治疗、检查或诊断作用,可能引起或造成死亡或严重伤害的事件;4.医疗器械属于长期植入物或生命支持器械,因此对维持人类生命十分必要的事件;5.医疗器械生产企业需要采取或被要求采取行动来减少产品对公众健康造成损害的风险的事件;6.类似事件在过去实际已经引起或造成死亡或严重伤害的事件。

附件1:《可疑医疗器械不良事件报告表》及填写要求可疑医疗器械不良事件报告表报告日期: 年 月 日 编 码: 报告来源: 生产企业 经营企业 使用单位 单位名称:联系地址: 邮 编: 联系电话:报告人签名:国家食品药品监督管理局制填写要求《可疑医疗器械不良事件报告表》由题眉、患者资料、不良事件情况、医疗器械情况、关联性评价、不良事件评价及题末7部分组成。
1.题眉A.报告日期:是指填报人填报该次不良事件时的确切时间。
B.编码:由省(区、市)医疗器械不良事件监测技术机构填写,按以下排列方式:省(区、市)年份流水号□□□□□□□□□□□注:省(区、市)编码按中华人民共和国行政区划代码填写。
在医疗器械不良事件监测系统中,编码由系统自动生成。
C.报告来源:是指填报可疑医疗器械不良事件单位的类别,填写时请选择相应的选项,并在“□”中划“√”。
D.单位名称:是指填报可疑医疗器械不良事件单位的全称,不可用简称。
E.联系地址、电话及邮编:是指填报可疑医疗器械不良事件单位的联系地址、电话及邮编。
2.患者资料A.患者姓名:是指患者真实全名。
若患者姓名无法获知,应填写未知;新生儿无姓名,应填写××子或××女.B.年龄:是指患者发生可疑医疗器械不良事件时的实际年龄,字体为阿拉伯数字.若患者年龄小于1岁,应填写具体的月份或天数,如6个月.C.性别:是指患者的性别,填写时请选择相应的选项,并在“□”中划“√”。
D.预期治疗疾病或作用:是指涉及不良事件的医疗器械用于治疗的疾病或者预计使用该医疗器械所发挥的作用,例如血管内支架用于治疗急性心肌梗死。
3。
不良事件情况A.事件主要表现:是指使用医疗器械后引发的、可能与该医疗器械使用有关的有害事件(且与质量、医疗事故无关)。
填写不良事件主要表现要明确、具体,如放置节育器后,出现意外脱落者,可填写“节育器脱落".B.事件发生日期:是指不良事件发生的确切时间,如:×年×月×日,字体为阿拉伯数字。

可疑医疗器械不良事件报告表
可疑医疗器械不良事件报告表
报告来源生产企业经营企业使用单位个人报告日期
单位名称编码
联系地址联系电话邮编A.患者资料 C.医疗器械情况
患者姓名医疗器械分类名称
年龄产品名称
性别男女商品名称
联系电话注册证号
预期治疗疾病生产企业名称
预期作用生产企业地址
B.不良事件情况企业联系电话
事件主要表现型号规格
事件发生日期产品编号
发现患者知悉时间产品批号
操作人
专业人员非专业人员
患者其它
医疗器械实际使用场所医院诊所家庭其它
有效期至
事件后果(如选择其它,请在事件陈述中说明)死亡
威胁生命
机体功能结构永久损伤
需要内、外科治疗避免上述永久损伤
其它(在事件陈述中说明)
生产日期
停用日期
植入日期(若植入)
事件发生初步
原因分析
事件陈述事件初步处理情况
事件报告状态
已通知使用单位已通知企业
已通知药监部门
D.不良事件评价
评价结论
评价时间
监测机构意见陈述
评价人
评价单位
报告人类别医师技师
护士患者其他
报告人签名。
医疗器械不良反应报告表(可以直接使用,可编辑实用优秀文档,欢迎下载)附件1:《可疑医疗器械不良事件报告表》及填写要求可疑医疗器械不良事件报告表报告日期: 年 月 日 编 码: 报告来源: 生产企业 经营企业 使用单位 单位名称: : 邮 编: 联系 :报告人签名: 国家食品药品监督管理局制填写要求《可疑医疗器械不良事件报告表》由题眉、患者资料、不良事件情况、医疗器械情况、关联性评价、不良事件评价及题末7部分组成。
1.题眉A.报告日期:是指填报人填报该次不良事件时的确切时间。
B.编码:由省(区、市)医疗器械不良事件监测技术机构填写,按以下排列方式:省(区、市)年份流水号□□□□□□□□□□□注:省(区、市)编码按中华人民共和国行政区划代码填写。
在医疗器械不良事件监测系统中,编码由系统自动生成。
C.报告来源:是指填报可疑医疗器械不良事件单位的类别,填写时请选择相应的选项,并在“□”中划“√”。
D.单位名称:是指填报可疑医疗器械不良事件单位的全称,不可用简称。
E.、及:是指填报可疑医疗器械不良事件单位的、及。
2.患者资料A.患者姓名:是指患者真实全名。
若患者姓名无法获知,应填写未知;新生儿无姓名,应填写××子或××女。
B.年龄:是指患者发生可疑医疗器械不良事件时的实际年龄,字体为阿拉伯数字。
若患者年龄小于1岁,应填写具体的月份或天数,如6个月。
C.性别:是指患者的性别,填写时请选择相应的选项,并在“□”中划“√”。
D.预期治疗疾病或作用:是指涉及不良事件的医疗器械用于治疗的疾病或者预计使用该医疗器械所发挥的作用,例如血管内支架用于治疗急性心肌梗死。
3.不良事件情况A.事件主要表现:是指使用医疗器械后引发的、可能与该医疗器械使用有关的有害事件(且与质量、医疗事故无关)。
填写不良事件主要表现要明确、具体,如放置节育器后,出现意外脱落者,可填写“节育器脱落”。
报告人: 医师 技师 护士 其他
报告人签名:
附件4:
医疗器械不良事件报告表
报告日期:
年 月曰 报告来源: 生产企业
经营企业 使用单位
单位名称(单位盖早):
联系地址:
邮编:
联系电话:
编码
20.事件处理情况:
21 •事件报告状态:
已通知医院
已通知企业
已通知药监分局
D.不良事件评价
省级监测机构意见陈述:
国家监测机构意见陈述:
可疑医疗器械不良事件报告表填写说明
国家药品不良反应监测中心
A.患者资料
1患者姓名:
2 •年龄:
3.性别 男 女
4 •预期治疗疾病或作用:
B .不良事件情况
5.事件主要表现:
6•事件发生日期: 年 月曰 7. 医疗器械实际使用场所:
医院 诊所
家庭
其它(在陈述中说明)
8. 事件后果
死亡 (时间);
威胁生命;
机体功能结构永久损伤;
需要内、外科治疗避免上述永久损伤; 其它(在事件陈述中说明)。
9. 事件陈述:(至少包括器械使用时间、使用目的、使用依据、
使用情况、出现的不良事件情况、对受害者影响、采取的治疗 措
施、器械联合使用情况)
一、医疗器械不良事件定义:获准上市的、合格的医疗器械在正常使用情况下,发生的或可能发生的任何与医疗器械预期使用效果无
关的有害事件。
二、报告范围:需要医疗器械生产企业、经营企业、使用单位提供的可疑医疗器械不良事件报告是死亡和严重伤害报告。
其中,严重
伤害指①危及生命;②导致机体功能的永久性伤害或者机体结构的永久性损伤;③必须采取医疗措施才能避免上述永久性伤害或损伤。
“永久性”是对身体结构或功能的不可逆的伤害,不包括小的伤害或损害。
三、报告原则:
1、基本原则:造成患者、使用者或其他人员死亡、严重伤害的事件已经发生,并且可能与所使用医疗器械有关,需要按可疑医疗器械不良事
件报告。
2、濒临事件原则:有些事件当时并未造成人员伤害,但临床医务人员根据自己的临床经验认为再次发生同类事件时会造成患者或医
务人员死亡或严重伤害,则也需要报告。
3、可疑即报原则:在不清楚是否属于医疗器械不良事件时,按可疑医疗器械不良事件报告。
这些事件可以是与使用医疗器械有关的,也可
以是不能除外与医疗器械有关的事件。
注意事项:1、请务必填写清楚您的联系方式、产品名称和生产企业名称;
2 、若有内容填写不下,可加附表说明;
3 、进口产品在生产企业联系方式一栏请填写境内代理企业联系方式;
相关事件在以下情况必须报告:
⑴引起或造成死亡或严重伤害的几率较大;
⑵对医疗器械性能的影响性质严重,很可能引起或造成死亡或严重伤害;
⑶使器械不能发挥其必要的正常作用,并且影响医疗器械的治疗、检查或诊断作用,可能引起或造成死亡或严重伤害;
⑷医疗器械属于长期植入物或生命支持器械,因此对维持人类生命十分必要;
⑸医疗器械生产企业需要采取或被要求采取行动来减少产品对公众健康造成损害的风险;
⑹类似事件在过去实际已经引起或造成死亡或严重伤害。
三、免除报告原则:
1、使用者在应用前发现医疗器械有缺陷
2、完全是患者因素导致了不良事件
3、事件发生仅仅是因为器械超过有效期
4、事件发生时,医疗器械安全保护措施正常工作,并不会对患者造成伤害五、《可疑医疗器械不良事件报告表》填写说明
《可疑医疗器械不良事件报告表》由患者资料、不良事件情况、医疗器械情况、不良事件评价四部分21 条及报告来源信息组成:
1.患者资料
第1 条至第4 条为患者一般情况,包括:患者姓名、性别、年龄、预期治疗疾病或作用,资料请填写清楚,有利于资料的分析处理,其中:第4条预期治疗疾病或作用: 是指涉及不良事件的医疗器械用于治疗的疾病,例如: 心瓣膜用于治疗二尖瓣狭窄; 血管内支架用于治疗急性
心肌梗死;角膜塑形镜用于矫正屈光不正。
有关患者隐私的资料,如患者姓名在数据处理、反馈中将得到保密,不予公开。
2.不良事件情况
第5 条至第9 条为医疗器械不良事件情况,说明事件的性质和发生状况,其中死亡事件应注明死亡时间;
第7条医疗器械实际使用场所: 指医疗器械是在医院使用、诊所使用、患者个人使用,也可以在事件陈述中具体说明。
第9条事件陈述: 至少应包括使用医疗器械的目的、依据; 医疗器械使用情况; 预期效果应该怎样;出现了什么样的非预期结果;对患者造成什么影响;采取了哪些相应治疗措施;结果如何;同类事件再次发生能够出现的最大危害是什么;同类事件再次发生最可能出现的危害是什么。
可另附A4纸报告。
3.医疗器械情况
第10条至第21条为可疑医疗器械不良事件涉及医疗器械情况. 其中: 第10条,医疗器械分类名称按产品注册时医疗器械分类名称填写,使用单位如不明确可不填,由企业和省级AD隘测中心收到报告后按医疗器械分类名称填写;第12条,注册证号是产品上市的准入证明,也是产品识别依据,需仔细填写;第13条,生产企业联系方式中如果是进口产品,请填写国外生产企业在境内代表处或境内代理企业的联系方式;第14条,有关产品跟踪的信息对于企业识别、跟踪问题产品非常重要,使用单位如有填写困难,应联系生产企业协助填写;第15条操作者中的专业人员:是指获得资格证书和执业证书的医生、护士、技士。
第19条事件发生原因分析:可从医疗器械设计、使用、性能、其他干扰因素角度初步分析事件发生的可能原因;第20条事件处理情况: 生产企业根据事件的性质、程度主动采取的警示、修正、召回、停用、改进等措施及相应方案和时间表,可以包括对单个器械的修理。
第21 条事件报告状态:应说明使用单位在向省级监测中心报告后,是否已通知企业或药监分局;企业在报告医疗器械不良事件后,对其中需要采取措施的问题产品是否通知了使用单位或药监分局。
报告来源信息:包括选择报告主体、填写单位名称、联系方式、报告人身份及报告编码。
其中:代码填写:编号一栏,由省级医疗器械不良事件监测机构和国家药品不良反应监测中心填写,按以下排列方式:
省(自治区、直辖市)年代流水号
□□ □□□□ □□□□□ 注:省(自治区、直辖市)编码按中华人民共和国行政区划代码填写,如:北京11 上海31 广东44 。