物理化学天津大学第四版答案
- 格式:docx
- 大小:15.70 KB
- 文档页数:15


第一章气体的pVT性质1.1物质的体膨胀系数与等温压缩率的定义如下试推出理想气体的,与压力、温度的关系。
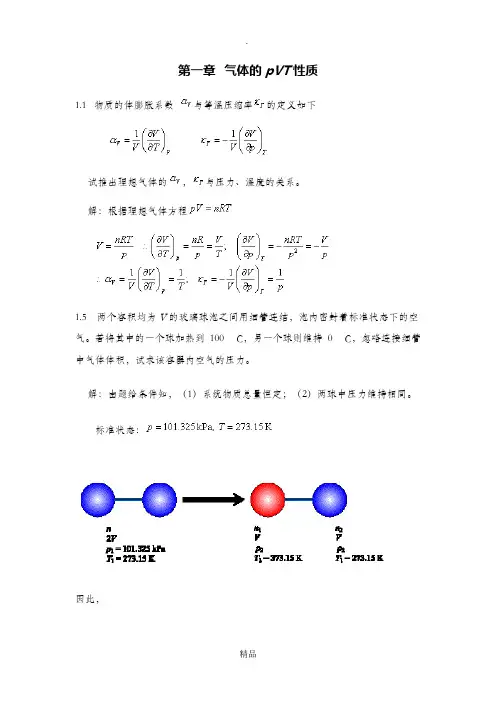
解:根据理想气体方程1.5两个容积均为V的玻璃球泡之间用细管连结,泡内密封着标准状态下的空气。
若将其中的一个球加热到100 C,另一个球则维持0 C,忽略连接细管中气体体积,试求该容器内空气的压力。
解:由题给条件知,(1)系统物质总量恒定;(2)两球中压力维持相同。
标准状态:因此,1.9 如图所示,一带隔板的容器内,两侧分别有同温同压的氢气与氮气,二者均可视为理想气体。
(1)保持容器内温度恒定时抽去隔板,且隔板本身的体积可忽略不计,试求两种气体混合后的压力。
(2)隔板抽取前后,H2及N2的摩尔体积是否相同?(3)隔板抽取后,混合气体中H2及N2的分压立之比以及它们的分体积各为若干?解:(1)等温混合后即在上述条件下混合,系统的压力认为。
(2)混合气体中某组分的摩尔体积怎样定义?(3)根据分体积的定义对于分压1.11 室温下一高压釜内有常压的空气,为进行实验时确保安全,采用同样温度的纯氮进行置换,步骤如下:向釜内通氮气直到4倍于空气的压力,尔后将釜内混合气体排出直至恢复常压。
重复三次。
求釜内最后排气至恢复常压时其中气体含氧的摩尔分数。
解:分析:每次通氮气后至排气恢复至常压p,混合气体的摩尔分数不变。
设第一次充氮气前,系统中氧的摩尔分数为,充氮气后,系统中氧的摩尔分数为,则,。
重复上面的过程,第n次充氮气后,系统的摩尔分数为,因此。
1.13 今有0 C,40.530 kPa的N2气体,分别用理想气体状态方程及van der Waals 方程计算其摩尔体积。
实验值为。
解:用理想气体状态方程计算用van der Waals计算,查表得知,对于N2气(附录七),用MatLab fzero函数求得该方程的解为也可以用直接迭代法,,取初值,迭代十次结果1.16 25 C时饱和了水蒸气的湿乙炔气体(即该混合气体中水蒸气分压力为同温度下水的饱和蒸气压)总压力为138.7 kPa,于恒定总压下冷却到10 C,使部分水蒸气凝结为水。

第九章统计热力学初步
1.按照能量均分定律,每摩尔气体分子在各平动自由度上的平均动能为。
现有1 mol CO气体于0 ºC、101.325 kPa条件下置于立方容器中,试求:
(1)每个CO分子的平动能;
(2)能量与此相当的CO分子的平动量子数平方和
解:(1)CO分子有三个自由度,因此,
(2)由三维势箱中粒子的能级公式
2.某平动能级的,使球该能级的统计权重。
解:根据计算可知,、和只有分别取2,4,5时上式成立。
因此,该能级的统计权重为g = 3! = 6,对应于状态。
3.气体CO分子的转动惯量,试求转动量子数J为4与3两能级
的能量差,并求时的。
解:假设该分子可用刚性转子描述,其能级公式为
4.三维谐振子的能级公式为,式中s为量子数,即。
试证明能级的统计权重为
解:方法1,该问题相当于将s个无区别的球放在x,y,z三个不同盒子中,每个盒子容纳的球数不受限制的放置方式数。
x盒中放置球数0,y, z中的放置数s + 1
x盒中放置球数1,y, z中的放置数s
……………………………………….
x盒中放置球数s,y, z中的放置数1
方法二,用构成一三维空间,为该空间的一个平面,其与三个轴均相交于s。
该平面上为整数的点的总数即为所求问题的解。
这些点为平
面在平面上的交点:
由图可知,
5.某系统由3个一维谐振子组成,分别围绕着
A, B, C三个定点做振动,总能量为。
试
列出该系统各种可能的能级分布方式。
解:由题意可知方程组
的解即为系统可能的分布方式。
方程组化简为,其解为。

第一章气体的pVT性质1.1物质的体膨胀系数与等温压缩率的定义如下试推出理想气体的,与压力、温度的关系。
解:根据理想气体方程1.5两个容积均为V的玻璃球泡之间用细管连结,泡内密封着标准状态下的空气。
若将其中的一个球加热到100 C,另一个球则维持0 C,忽略连接细管中气体体积,试求该容器内空气的压力。
解:由题给条件知,(1)系统物质总量恒定;(2)两球中压力维持相同。
标准状态:因此,1.9 如图所示,一带隔板的容器内,两侧分别有同温同压的氢气与氮气,二者均可视为理想气体。
(1)保持容器内温度恒定时抽去隔板,且隔板本身的体积可忽略不计,试求两种气体混合后的压力。
(2)隔板抽取前后,H2及N2的摩尔体积是否相同?(3)隔板抽取后,混合气体中H2及N2的分压立之比以及它们的分体积各为若干?解:(1)等温混合后即在上述条件下混合,系统的压力认为。
(2)混合气体中某组分的摩尔体积怎样定义?(3)根据分体积的定义对于分压1.11 室温下一高压釜内有常压的空气,为进行实验时确保安全,采用同样温度的纯氮进行置换,步骤如下:向釜内通氮气直到4倍于空气的压力,尔后将釜内混合气体排出直至恢复常压。
重复三次。
求釜内最后排气至恢复常压时其中气体含氧的摩尔分数。
解:分析:每次通氮气后至排气恢复至常压p,混合气体的摩尔分数不变。
设第一次充氮气前,系统中氧的摩尔分数为,充氮气后,系统中氧的摩尔分数为,则,。
重复上面的过程,第n次充氮气后,系统的摩尔分数为,因此。
1.13 今有0 C,40.530 kPa的N2气体,分别用理想气体状态方程及van der Waals 方程计算其摩尔体积。
实验值为。
解:用理想气体状态方程计算用van der Waals计算,查表得知,对于N2气(附录七),用MatLab fzero函数求得该方程的解为也可以用直接迭代法,,取初值,迭代十次结果1.16 25 C时饱和了水蒸气的湿乙炔气体(即该混合气体中水蒸气分压力为同温度下水的饱和蒸气压)总压力为138.7 kPa,于恒定总压下冷却到10 C,使部分水蒸气凝结为水。

第一章气体的pVT性质1.1物质的体膨胀系数与等温压缩率的定义如下试推出理想气体的,与压力、温度的关系。
解:根据理想气体方程1.5两个容积均为V的玻璃球泡之间用细管连结,泡内密封着标准状态下的空气。
若将其中的一个球加热到100 C,另一个球则维持0 C,忽略连接细管中气体体积,试求该容器内空气的压力。
解:由题给条件知,(1)系统物质总量恒定;(2)两球中压力维持相同。
标准状态:因此,1.9 如图所示,一带隔板的容器内,两侧分别有同温同压的氢气与氮气,二者均可视为理想气体。
(1)保持容器内温度恒定时抽去隔板,且隔板本身的体积可忽略不计,试求两种气体混合后的压力。
(2)隔板抽取前后,H2及N2的摩尔体积是否相同?(3)隔板抽取后,混合气体中H2及N2的分压立之比以及它们的分体积各为若干?解:(1)等温混合后即在上述条件下混合,系统的压力认为。
(2)混合气体中某组分的摩尔体积怎样定义?(3)根据分体积的定义对于分压1.11 室温下一高压釜内有常压的空气,为进行实验时确保安全,采用同样温度的纯氮进行置换,步骤如下:向釜内通氮气直到4倍于空气的压力,尔后将釜内混合气体排出直至恢复常压。
重复三次。
求釜内最后排气至恢复常压时其中气体含氧的摩尔分数。
解:分析:每次通氮气后至排气恢复至常压p,混合气体的摩尔分数不变。
设第一次充氮气前,系统中氧的摩尔分数为,充氮气后,系统中氧的摩尔分数为,则,。
重复上面的过程,第n次充氮气后,系统的摩尔分数为,因此。
1.13 今有0 C,40.530 kPa的N2气体,分别用理想气体状态方程及van der Waals 方程计算其摩尔体积。
实验值为。
解:用理想气体状态方程计算用van der Waals计算,查表得知,对于N2气(附录七),用MatLab fzero函数求得该方程的解为也可以用直接迭代法,,取初值,迭代十次结果1.16 25 C时饱和了水蒸气的湿乙炔气体(即该混合气体中水蒸气分压力为同温度下水的饱和蒸气压)总压力为138.7 kPa,于恒定总压下冷却到10 C,使部分水蒸气凝结为水。

第一章气体的pVT性质1.1物质的体膨胀系数与等温压缩率的定义如下试推出理想气体的,与压力、温度的关系。
解:根据理想气体方程1.5两个容积均为V的玻璃球泡之间用细管连结,泡内密封着标准状态下的空气。
若将其中的一个球加热到100 ︒C,另一个球则维持0 ︒C,忽略连接细管中气体体积,试求该容器内空气的压力。
解:由题给条件知,(1)系统物质总量恒定;(2)两球中压力维持相同。
标准状态:因此,1.9 如图所示,一带隔板的容器内,两侧分别有同温同压的氢气与氮气,二者均可视为理想气体。
(1)保持容器内温度恒定时抽去隔板,且隔板本身的体积可忽略不计,试求两种气体混合后的压力。
(2)隔板抽取前后,H2及N2的摩尔体积是否相同?(3)隔板抽取后,混合气体中H2及N2的分压立之比以及它们的分体积各为若干?解:(1)等温混合后即在上述条件下混合,系统的压力认为。
(2)混合气体中某组分的摩尔体积怎样定义?(3)根据分体积的定义对于分压1.11 室温下一高压釜内有常压的空气,为进行实验时确保安全,采用同样温度的纯氮进行置换,步骤如下:向釜内通氮气直到4倍于空气的压力,尔后将釜内混合气体排出直至恢复常压。
重复三次。
求釜内最后排气至恢复常压时其中气体含氧的摩尔分数。
解:分析:每次通氮气后至排气恢复至常压p,混合气体的摩尔分数不变。
设第一次充氮气前,系统中氧的摩尔分数为,充氮气后,系统中氧的摩尔分数为,则,。
重复上面的过程,第n次充氮气后,系统的摩尔分数为,因此。
1.13 今有0 ︒C,40.530 kPa的N2气体,分别用理想气体状态方程及van der Waals 方程计算其摩尔体积。
实验值为。
解:用理想气体状态方程计算气(附录七)用van der Waals计算,查表得知,对于N2,用MatLab fzero函数求得该方程的解为也可以用直接迭代法,,取初值,迭代十次结果1.16 25 ︒C时饱和了水蒸气的湿乙炔气体(即该混合气体中水蒸气分压力为同温度下水的饱和蒸气压)总压力为138.7 kPa,于恒定总压下冷却到10 ︒C,使部分水蒸气凝结为水。

物理化学第四版课后习题答案【篇一:物理化学第四版上册课后答案天津大学第三章】>3.1卡诺热机在(1)热机效率;的高温热源和的低温热源间工作。
求(2)当向环境作功源放出的热。
时,系统从高温热源吸收的热及向低温热解:卡诺热机的效率为根据定义3.5高温热源温度,低温热源。
今有120 kj的热直接从高温热源传给低温热源,龟此过程的解:将热源看作无限大,因此,传热过程对热源来说是可逆过程3.6 不同的热机中作于的高温热源及的低温热源之时,两热源的总熵变间。
求下列三种情况下,当热机从高温热源吸热。
(1)可逆热机效率(2)不可逆热机效率(3)不可逆热机效率。
解:设热机向低温热源放热,根据热机效率的定义因此,上面三种过程的总熵变分别为。
3.7 已知水的比定压热容下列三种不同过程加热成100 ?c的水,求过程的(1)系统与100 ?c的热源接触。
今有1 kg,10 ?c的水经。
(2)系统先与55 ?c的热源接触至热平衡,再与100 ?c的热源接触。
(3)系统先与40 ?c,70 ?c的热源接触至热平衡,再与100 ?c的热源接触。
解:熵为状态函数,在三种情况下系统的熵变相同在过程中系统所得到的热为热源所放出的热,因此3.8 已知氮(n2, g)的摩尔定压热容与温度的函数关系为将始态为300 k,100 kpa下1 mol的n2(g)置于1000 k的热源中,求下列过程(1)经恒压过程;(2)经恒容过程达到平衡态时的解:在恒压的情况下。
在恒容情况下,将氮(n2, g)看作理想气体将代替上面各式中的,即可求得所需各量3.9始态为同途径变化到,,的某双原子理想气体1 mol,经下列不的末态。
求各步骤及途径的。
(1)恒温可逆膨胀;(2)先恒容冷却至使压力降至100 kpa,再恒压加热至;(3)先绝热可逆膨胀到使压力降至100 kpa,再恒压加热至。
解:(1)对理想气体恒温可逆膨胀,?u = 0,因此(2)先计算恒容冷却至使压力降至100 kpa,系统的温度t:(3)同理,先绝热可逆膨胀到使压力降至100 kpa时系统的温度t:根据理想气体绝热过程状态方程,各热力学量计算如下【篇二:物理化学第四章课后答案傅献彩第五版】lass=txt>第七章电化学7.1 用铂电极电解能析出多少质量的解:电极反应为溶液。

第四章多组分系统热力学4.1有溶剂A 与溶质B 形成一定组成的溶液。
此溶液中B 的浓度为cB ,质量摩尔浓度为bB ,此溶液的密度为。
以MA ,MB 分别代表溶剂和溶质的摩尔质量,若溶液的组成用B 的摩尔分数xB 表示时,试导出xB 与cB ,xB 与bB 之间的关系。
解:根据各组成表示的定义4.2D-果糖溶于水(A )中形成的某溶液,质量分数,此溶液在20°C 时的密度。
求:此溶液中D-果糖的(1)摩尔分数;(2)浓度;(3)质量摩尔浓度。
解:质量分数的定义为4.3在25°C ,1kg 水(A )中溶有醋酸(B ),当醋酸的质量摩w ww .k h d a w .c o m 课后答案网尔浓度bB 介于和之间时,溶液的总体积。
求:(1)把水(A )和醋酸(B )的偏摩尔体积分别表示成bB 的函数关系。
(2)时水和醋酸的偏摩尔体积。
解:根据定义当时4.460°C 时甲醇的饱和蒸气压是84.4kPa ,乙醇的饱和蒸气压是47.0kPa 。
二者可形成理想液态混合物。
若混合物的组成为二者的质量分数各50%,求60°C 时此混合物的平衡蒸气组成,以摩尔分数表示。
解:质量分数与摩尔分数的关系为w w w .k h d a w .c o m 课后答案网求得甲醇的摩尔分数为根据Raoult 定律4.580°C 是纯苯的蒸气压为100kPa ,纯甲苯的蒸气压为38.7kPa 。
两液体可形成理想液态混合物。
若有苯-甲苯的气-液平衡混合物,80°C 时气相中苯的摩尔分数,求液相的组成。
解:根据Raoult 定律4.6在18°C ,气体压力101.352kPa 下,1dm3的水中能溶解O20.045g ,能溶解N20.02g 。
现将1dm3被202.65kPa 空气所饱和了的水溶液加热至沸腾,赶出所溶解的O2和N2,并干燥之,求此干燥气体在101.325kPa ,18°C 下的体积及其组成。

第三章热力学第二定律3.1卡诺热机在的高温热源和的低温热源间工作。
求(1)热机效率;(2)当向环境作功时,系统从高温热源吸收的热及向低温热源放出的热。
解:卡诺热机的效率为根据定义3.5高温热源温度,低温热源。
今有120kJ 的热直接从高温热源传给低温热源,龟此过程的。
解:将热源看作无限大,因此,传热过程对热源来说是可逆过程3.6不同的热机中作于的高温热源及的低温热源之间。
求下列三种情况下,当热机从高温热源吸热时,两热源的总熵变。
(1)可逆热机效率。
w w w .k h d a w .c o m 课后答案网(2)不可逆热机效率。
(3)不可逆热机效率。
解:设热机向低温热源放热,根据热机效率的定义因此,上面三种过程的总熵变分别为。
3.7已知水的比定压热容。
今有1kg ,10°C 的水经下列三种不同过程加热成100°C 的水,求过程的。
(1)系统与100°C 的热源接触。
(2)系统先与55°C 的热源接触至热平衡,再与100°C 的热源接触。
(3)系统先与40°C ,70°C 的热源接触至热平衡,再与100°C 的热源接触。
解:熵为状态函数,在三种情况下系统的熵变相同在过程中系统所得到的热为热源所放出的热,因此w w w .k h d a w .c o m 课后答案网3.8已知氮(N 2,g )的摩尔定压热容与温度的函数关系为将始态为300K ,100kPa 下1mol 的N 2(g)置于1000K 的热源中,求下列过程(1)经恒压过程;(2)经恒容过程达到平衡态时的。
解:在恒压的情况下w w w .k h d a w .c o m 课后答案网在恒容情况下,将氮(N 2,g )看作理想气体将代替上面各式中的,即可求得所需各量3.9始态为,的某双原子理想气体1mol ,经下列不同途径变化到,的末态。
求各步骤及途径的。
(1)恒温可逆膨胀;(2)先恒容冷却至使压力降至100kPa ,再恒压加热至;(3)先绝热可逆膨胀到使压力降至100kPa ,再恒压加热至。

物理化学第四版课后习题答案物理化学第四版课后习题答案物理化学是一门综合性的学科,涵盖了物理学和化学的知识。
学习物理化学需要理解和掌握一定的理论知识,并通过解决问题来加深对这些知识的理解。
课后习题是一个很好的学习工具,通过解答习题可以巩固和应用所学的知识。
本文将为大家提供物理化学第四版课后习题的答案。
第一章:量子力学基础1. 量子力学是描述微观世界的物理理论,它通过波函数描述微观粒子的运动状态。
波函数的平方表示了找到粒子在某个位置的概率。
2. 波函数的归一化条件是∫|Ψ(x)|^2dx = 1,其中Ψ(x)是波函数。
3. 薛定谔方程描述了波函数的演化,它是一个时间无关的定态方程,形式为HΨ = EΨ,其中H是哈密顿算符,Ψ是波函数,E是能量。
4. 电子在原子中的运动状态由量子数来描述。
主量子数n描述了电子的能级大小,角量子数l描述了电子的轨道形状,磁量子数ml描述了电子在轨道上的方向。
5. 电子自旋是电子的一个内禀属性,它有两个可能的取值:向上自旋和向下自旋。
第二章:分子结构与光谱学1. 分子的几何构型对其性质有重要影响。
分子的几何构型可以通过VSEPR理论来确定,根据原子间的排斥力确定分子的空间结构。
2. 共振现象是指分子中电子的位置可以在不同原子间跳跃,从而使分子的结构发生变化。
3. 光谱学是研究物质与光的相互作用的学科。
分子的光谱可以提供关于分子结构和化学键的信息。
4. 红外光谱可以用来确定分子中的化学键类型和它们的存在形式。
5. 核磁共振光谱可以提供关于分子中原子核的信息,包括原子核的类型、数量和化学环境。
第三章:热力学1. 热力学是研究能量转化和能量传递的学科。
它描述了物质和能量之间的关系。
2. 热力学第一定律是能量守恒定律,它表明能量可以从一种形式转化为另一种形式,但总能量保持不变。
3. 热力学第二定律描述了能量转化的方向性,它表明自然界中能量转化总是朝着熵增的方向进行。
4. 熵是描述系统无序程度的物理量,它可以用来判断一个过程的可逆性。
《物理化学》(天津大学第四版)作业问题----d05567ac-6ea5-11ec-88a2-7cb59b590d7d《物理化学》(天津大学第四版)作业问题华南理工大学应用化学系葛华才编写第102030405060709101112章第一章气体的性质作业问题1.5状态变化瓶1(n,p,v,t)+瓶2(n,p,v,t)→瓶1(n1,p’,v,t)+瓶2(n2,p’,v,t’)这个问题的关键是找到变化前后的守恒量:物质的量,并建立2n=N1+N2的关系再利用理想气体状态方程n=pv/rt即可求解。
1.6省略坐标轴名称和图纸名称。
使用非国家标准单位:ATM。
未给出计算值。
h23dm3n21dm3ptpt恒t混合h2,n24dm3p't1.9.两种气体的恒温混合过程如下:(1)混合后的总压力p'=NRT/v=[n(N2)+n(H2)]RT/4dm3=[(p×1dm3/RT)+(p×3DM3/RT)]RT/4dm3=p等于混合前的压力。
(2)摩尔体积vm=v/n=rt/p,仅与温度和(系统)压力有关。
混合前后温度和压力均摩尔体积是一样的。
注:当不应使用总压力时,不应使用总压力。
(3)该过程为恒温恒压混合,是理想气体,因此混合前纯组分的体积为组分的体积:v(h2)=3dm3,v(n2)=1dm3;[亦可按v(h2)=y(h2)v(总)计算]分压比p(H2):p(N2)=y(H2):y(N2)=n(H2)/n(N2)=(p×3dm3/rt)/(p×1dm3/rt)=3:1对于理想气体:分压是指占据所有可用空间的组件的压力;部件体积是指当压力为总压力时部件的体积。
1.17系统状态变化如下:T1=300kp1=101.325kpa,vt2=300kp2对于容器中的水和气体,这是一个具有复杂关系的非恒定质量过程;空气的变化是一个恒定质量和恒定体积的过程,因此可以根据理想气体状态方程建立空气状态变化关系:n air=p air V/RT,即(p1-3.567kpa)v/rt1=(p2-101.325kpa)v/rt2所以p2=101.325kpa+(p1-3.567kpa)t2/t1=101.325kpa+(101.325kpa-3.567kpa)×373.15k/300k=222.920kpa本题的关键是:空气的量和体积不变建立方程求压力。
物理化学天津大学第四版答案【篇一:5.天津大学《物理化学》第四版_习题及解答】ass=txt>目录第一章气体的pvt性质 ....................................................................................................... (2)第二章热力学第一定律 ....................................................................................................... . (6)第三章热力学第二定律 ....................................................................................................... .. (24)第四章多组分系统热力学 ....................................................................................................... . (51)第五章化学平衡 ....................................................................................................... .. (66)第六章相平衡 ....................................................................................................... (76)第七章电化学 ....................................................................................................... (85)第八章量子力学基础 ....................................................................................................... . (107)第九章统计热力学初步 ....................................................................................................... ...... 111 第十一章化学动力学 ....................................................................................................... . (117)第一章气体的pvt性质1.1 物质的体膨胀系数与等温压缩率的定义如下试推出理想气体的,与压力、温度的关系。
解:根据理想气体方程解:由题给条件知,(1)系统物质总量恒定;(2)两球中压力维持相同。
标准状态:因此,1.9 如图所示,一带隔板的容器内,两侧分别有同温同压的氢气与氮气,二者均可视为理想气体。
(1)保持容器内温度恒定时抽去隔板,且隔板本身的体积可忽略不计,试求两种气体混合后的压力。
(2)隔板抽取前后,h2及n2的摩尔体积是否相同?(3)隔板抽取后,混合气体中h2及n2的分压立之比以及它们的分体积各为若干?解:(1)等温混合后即在上述条件下混合,系统的压力认为。
(2)混合气体中某组分的摩尔体积怎样定义?(3)根据分体积的定义对于分压1.11 室温下一高压釜内有常压的空气,为进行实验时确保安全,采用同样温度的纯氮进行置换,步骤如下:向釜内通氮气直到4倍于空气的压力,尔后将釜内混合气体排出直至恢复常压。
重复三次。
求釜内最后排气至恢复常压时其中气体含氧的摩尔分数。
解:分析:每次通氮气后至排气恢复至常压p,混合气体的摩尔分数不变。
设第一次充氮气前,系统中氧的摩尔分数为为,则,,充氮气后,系统中氧的摩尔分数。
重复上面的过程,第n次充氮气后,系统的摩尔分数为因此。
,解:用理想气体状态方程计算用van der waals计算,查表得知,对于n2气(附录七),用matlab fzero函数求得该方程的解为也可以用直接迭代法,,迭代十次结果,取初值解:该过程图示如下设系统为理想气体混合物,则1.17 一密闭刚性容器中充满了空气,并有少量的水。
但容器于300k条件下大平衡时,容器内压力为101.325 kpa。
若把该容器移至373.15 k的沸水中,试求容器中到达新的平衡时应有的压力。
设容器中始终有水存在,且可忽略水的任何体积变化。
300 k时水的饱和蒸气压为3.567 kpa。
解:将气相看作理想气体,在300 k时空气的分压为由于体积不变(忽略水的任何体积变化),373.15 k时空气的分压为由于容器中始终有水存在,在373.15 k时,水的饱和蒸气压为101.325 kpa,系统中水蒸气的分压为101.325 kpa,所以系统的总压【篇二:物理化学课后答案】的体膨胀系数?v与等温压缩系数?t的定义如下:气体的pvt关系?v?1v1??v??v??t?????v???t?p??p? ???t试导出理想气体的?v、?t与压力、温度的关系?解:对于理想气体,pv=nrt?v?1??v?1??(nrt/p)?1nr1v???t?1 ? ??????v??t?pv??t?pvpvt1??v?v???p?1??(nrt/p)?1nrt1v????? ??2???p?1 ???v??pvp?t?tvp3?t??1-2 气柜内有121.6kpa、27℃的氯乙烯(c2h3cl)气体300m,若以每小时90kg的流量输往使用车间,试问贮存的气体能用多少小时?解:设氯乙烯为理想气体,气柜内氯乙烯的物质的量为pv121.6?103?300n???14618.623molrt8.314?300.1590?10390?103每小时90kg的流量折合p摩尔数为 v???1441.153mol?h?1mc2h3cl62.451-3 0℃、101.325kpa的条件常称为气体的标准状况。
试求甲烷在标准状况下的密度。
解:?ch4pn101325?16?10?3??mch4??mch4??0.714kg?m?3 vrt8.314?273.151-4 一抽成真空的球形容器,质量为25.0000g。
充以4℃水之后,总质量为125.0000g。
若改用充以25℃、13.33kpa的某碳氢化合物气体,则总质量为25.0163g。
试估算该气体的摩尔质量。
解:先求容器的容积v?125.0000?25.000100.00003?cm?100.0000cm3?h2o(l)1n=m/m=pv/rtm?)rtm8.314?298.15?(25.0163?25.0000??30.31g?mol ?4pv13330?101-5 两个体积均为v的玻璃球泡之间用细管连接,泡内密封着标准状况条件下的空气。
若将其中一个球加热到100℃,另一个球则维持0℃,忽略连接管中气体体积,试求该容器内空气的压力。
解:方法一:在题目所给出的条件下,气体的量不变。
并且设玻璃泡的体积不随温度而变化,则始态为n?n1,i?n2,i?2piv/(rti)终态(f)时 n?n1,f?n2,fpf?vv???r??t1,ft2,f?pfv???r??t2,f?t1,f??tt?1,f2,f?? ???2pi?t1,ft2,f??????t?t?t?i?1,f2,f??2?101.325?373.15?273.15??117.00kpa273.15(373.15?273.15)解:将数据处理如下:p/kpa-3t1,ft2,fn??pf?vr??t1,f?t2,f101.325 0.0227767.550 0.0226050.663 0.0225033.775 0.0224225.331 0.02237m???/p?p?0rt?0.02225?8.314?273.15?50.529g?mol?131-7 今有20℃的乙烷-丁烷混合气体,充入一抽真空的200 cm容器中,直至压力达101.325kpa,测得容器中混合气体的质量为0.3879g。
试求该混合气体中两种组分的摩尔分数及分压力。
解:设a为乙烷,b为丁烷。
n?pv101325?200?10?6??0.008315mol rt8.314?293.15m0.3897?yama?ybmb??46.867g?mol?1(1)n0.008315 ?30.0694ya?58.123ybm?ya?yb?1(2)联立方程(1)与(2)求解得yb?0.599,yb?0.401pa?yap?0.401?101.325?40.63kpapb?ybp?0.599?101.325?60.69 kpa1-8 如图所示一带隔板的容器中,两侧分别有同温同压的氢气与氮气,二者均克视为理想气体。
(1)保持容器内温度恒定时抽去隔板,且隔板本身的体积可忽略不计,试求两种气体混合后的压力。
(2)隔板抽去前后,h2及n2的摩尔体积是否相同?(3)隔板抽去后,混合气体中h2及n2的分压力之比以及它们的分体积各为若干?解:(1)抽隔板前两侧压力均为p,温度均为t。
ph2?nh2rt3dm3?pn2?nn2rt1dm3?p (1)得:nh?3nn22而抽去隔板后,体积为4dm,温度为,所以压力为34nn2rtnn2rtnrtrt(2) p??(nn2?3nn2)??333v4dm4dm1dm比较式(1)、(2),可见抽去隔板后两种气体混合后的压力仍为p。
(2)抽隔板前,h2的摩尔体积为vm,h?rt/p,n2的摩尔体积vm,n?rt/p22抽去隔板后v总?nh2vm,h2?nn2vm,n2?nrt/p?(3nn2?nn2)rt/p?? nh23nn2rtp?3nn2?nn2rtp所以有vm,h?rt/p,vm,n?rt/p22可见,隔板抽去前后,h2及n2的摩尔体积相同。
(3)yh2?3nn2nn2?3nn231?, yn2? 44ph2?yh2p?31p;pn2?yn2p?p 44所以有ph:pn?2231p:p?3:1 44vh2?yh2v? vn23?4?3dm3 4 1?yn2v??4?1dm34解:洗涤后的总压为101.325kpa,所以有pc2h3cl?pc2h4?101.325?2.670?98.655kpa(1)pc2h3cl/pc2h4?yc2h3cl/yc2h4?nc2h3cl/nc2h4?0.89/0.02(2)联立式(1)与式(2)求解得pc2h3cl?96.49kpa;pc2h4?2.168kpa1-10 室温下一高压釜内有常压的空气。