黄嘌呤氧化酶法优化大鼠血清SOD测定条件的探讨
- 格式:pdf
- 大小:238.60 KB
- 文档页数:3

第5卷 第10期 食品安全质量检测学报 Vol. 5 No. 102014年10月Journal of Food Safety and Quality Oct. , 2014基金项目: 黑龙江省自然科学基金项目(C2011-24)、黑龙江省教育厅科学技术研究项目(12511128)及黑龙江省博士后科研启动基金项目(LBH-Q13098)Fund: Supported by Natural Science Foundation of Heilongjiang Province of China (C2011-24), Science and Technology Research Project of Heilongjiang Province Department of Education (12511128) and Postdoctoral Scientific Research Start-up Fund Project of Heilongjiang Province (LBH-Q13098)*通讯作者: 曲敏, 教授, 主要研究方向为新型植物蛋白及食品添加剂。
E-mail: qumin777@*Corresponding author: QU Min, Professor, Harbin University of Commerce, Tongda Street 138, Daoli District, Harbin 150076, China. E-mail: qumin777@两种检测SOD 酶活性方法的比较曲 敏*, 秦丽楠, 刘羽佳, 范宏臣, 朱 姝, 王金凤(哈尔滨商业大学食品科学与工程省级重点实验室, 哈尔滨 150076)摘 要: 目的 比较邻苯三酚自氧化法和氮蓝四唑(NBT)光还原法分别测定超氧化物歧化酶(SOD)酶活力的差异。
方法 采用两种方法分别测定SOD 标准品、苜蓿和番茄两种植物提取物的不同来源SOD 酶活性, 比较其精确性和灵敏度。

妊娠期高脂血症患者SOD活性及MDA、NO含量的变化作者:李洁黄春林陈秀燕乔新惠来源:《中外医学研究》2014年第34期【摘要】目的:检测妊娠期高脂血症患者血浆超氧化物歧化酶(SOD)、丙二醛(MDA)和一氧化氮(NO)含量,寻找监测妊娠高脂血症的临床指标。
方法:采集45例妊娠期高脂血症患者血浆和50例正常孕妇血浆,以硫代巴比妥酸(TBA)比色法、黄嘌呤氧化酶法、硝酸还原酶法分别测定SOD、MDA、NO的含量。
结果:妊娠期高脂血症组血浆SOD 活性、NO的含量明显低于对照组,MDA含量明显高于对照组,两组比较差异均有统计学意义(P【关键词】妊娠期高脂血症;超氧化物歧化酶;丙二醛;一氧化氮中图分类号 R714 文献标识码 B 文章编号 1674-6805(2014)34-0067-03妊娠期高脂血症是妇产科常见的病理妊娠之一,而且还存在着许多代谢紊乱,高甘油三酯,高胆固醇,低密度脂蛋白升高,高密度脂蛋白下降和糖代谢异常[1]。
本文通过对妊娠期高脂血症患者与正常孕妇血浆SOD、MDA、NO的检测研究,探索这些指标与妊娠期高脂血症病理过程的关系。
现报告如下。
1 资料与方法1.1 一般资料选择2012年5月-2014年5月在笔者所在医院妇产科门诊进行检查的妊娠期高脂血症产妇45例为妊娠期高脂血症组,正常妊娠妇女50例为对照组,两组孕妇的年龄、孕周、孕次、产次等一般资料比较差异均无统计学意义(P>0.05),具有可比性。
详见表1。
1.2 妊娠期高脂血症诊断标准及标本收集对28~34周孕妇清晨空腹抽取静脉血,离心分离血浆,经生化分析仪测定:总胆固醇(TC),甘油三酯(TG),高密度脂蛋白(HDL),低密度脂蛋白(LDL),按世界卫生组织诊断标准空腹甘油三酯超过2.26 mmol/L,胆固醇超过6.21 mmol/L,诊断为妊娠期高脂血症(gestational hyperlipidemia)。
1.3 SOD、MDA和NO测定以黄嘌呤氧化酶法测定SOD浓度(NU/ml),以硫代巴比妥酸(TBA)比色法测定MDA 浓度(nmol/L),以硝酸还原酶法测定NO的浓度(μmol/L),所用测定试剂均购自南京建成生物工程研究所,仪器为722型分光光度计。

黄嘌呤氧化酶法测定抗氧化能力集团文件版本号:(M928-T898-M248-WU2669-I2896-DQ586-M1988)发酵过程产物形成的测定(SOD活性的测定)一、实验目的1、了解SOD活性测定的原理2、学习黄嘌呤氧化酶法测定SOD活性二、实验原理原理:黄嘌呤氧化酶催化黄嘌呤产生超氧阴离子自由基,后者氧化羟胺成亚硝酸盐,亚硝酸盐在对氨基苯磺酸与甲萘胺作用下呈现紫红色,用可见光分光光度计测其吸光度。
当被测样品中含SOD时,则对超氧阴离子自由基有专一性抑止作用,使可形成的亚硝酸盐减少,比色时测定管的吸光度值低于空白管的吸光度值,通过公式计算可求出被测样品中SOD 的活力。
操作步骤:如表2-1。
三、实验试剂硫酸盐缓冲液,盐酸羟胺,黄嘌呤,黄嘌呤氧化酶,醋酸等。
四、实验步骤试剂测定管对照管0.550.5575mmol/L 磷酸盐缓冲液(pH7.8)待测样品(ml)A(取样量)00.1mol/L 盐酸羟胺溶液0.050.0575mmol/L 黄嘌呤溶液0.050.050.037U/L 黄嘌呤氧化酶0.050.05双蒸水0.2-A0.2用漩涡振荡器充分混匀,置37℃恒温水浴30min。
显色剂(ml)11总体积1.9ml ,混匀,室温放置10min ,蒸馏水调零,测A530五、计算方法计算公式:每毫升反应液中SOD 抑止率达50%时对应的SOD 量为一个SOD 活力单位(U ),待测样品中的SOD 活力由下式计算:SOD 抑制率(%)=(A2-A1)/A2×100%SOD 活力(U/ml )=(A2-A1)/A2×100%÷50%×反应体系的稀释倍数×样本测试前的稀释倍数 式中:A1:测定管的吸光值;A2:空白管的吸光值 六、注意事项:1.试管要洗干净,在测定微量样品时尤为重要。
2.要做空白管,并且放在所有测试管的中间做,取平均值。
常用试剂(1)诱导剂:分别配制 IPTG 100μmol/mL ; CuSO 4·5H 2O 250μm/mL ; ZnSO 4 100μm/mL 。

实验三猪血中超氧化物歧化酶(SOD)的分离纯化及活力测定生物化学与分子生物学刘志坚S2*******一、超氧化物歧化酶(SOD)概述SOD是一种酸性蛋白,是唯一以自由基为底物的酶,具有清除自由基的功能酶,在酶分子上共价连接金属辅基,因此它对热、PH以及某些理化性质表现出异常的稳定性。
SOD根据所含金属辅基不同可分为三种:第一种是铜(Cu)锌(Zn)金属辅基称(Cu/Zn-SOD)最为常见的一种酶,呈绿色,主要存在于肌体细胞浆中。
它为同源二聚体酶,其中一个亚基结合一个Cu原子,另一个亚基结合一个Zn原子,两个亚基间的相互作用提高了酶的催化活性和稳定性,金属原子的氧化还原完成了酶的催化功能。
第二种是含锰(Mn)金属辅基的称(Mn—SOD),呈紫色,存在于真核细胞的线粒体和原核细胞内。
Mn—SOD是由203个氨基酸残基构成的四聚体,Mn3+处于三角双锥配位环境中,其中一轴向配位为水分子,另一轴向被蛋白质辅基的配位His-28占据,另3个配位His-83、His-170和Asp-166位于赤道平面。
第三种是含铁(Fe)金属辅基的称(Fe—SOD),呈黄褐色,存在于原核细胞中。
其活性中心是3个His,1个Asp和1个H2O扭曲四面体配位而成。
其中,Mn—SOD 、Fe—SOD的结构特征是不含半胱氨酸,含有较多的色氨酸和酪氨酸,因此紫外吸收光谱类似一般蛋白质,在280nm附近有最大吸收峰,Mn—SOD的可见光谱在475nm处附近有最大吸收,Fe—SOD在350nm处有最大吸收,这都反映了所含金属离子的光学性质。
SOD为自由基清除剂,它广泛存在于生物体的各种组织中,能清除O2-(超氧阴离子)自由基,而超氧阴离子自由基具有细胞毒性,可使脂质过氧化,损伤细胞膜,引起炎症,肿瘤和自身免疫性疾病,并可能促使机体衰老。
它的功能为:(1)抑制心脑血管疾病:机体的衰老与体内氧自由基的产生与积累密切相关,SOD课清除人体内过多的有害的氧自由基,是对健康的有益的功效成分。





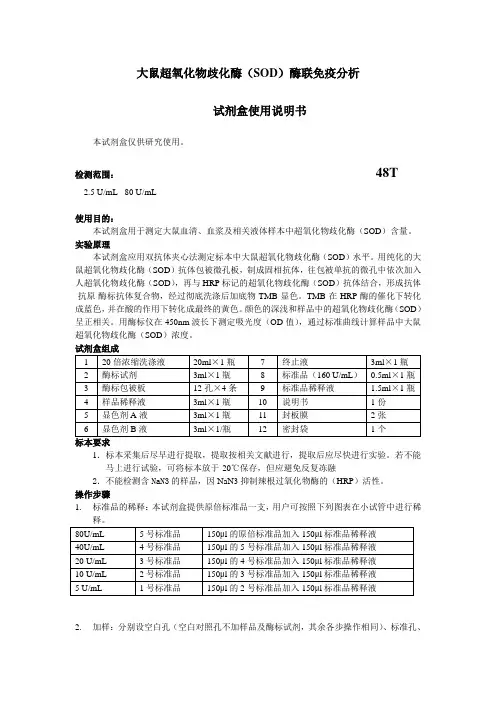
大鼠超氧化物歧化酶(SOD)酶联免疫分析试剂盒使用说明书本试剂盒仅供研究使用。
检测范围:48T2.5 U/mL - 80 U/mL使用目的:本试剂盒用于测定大鼠血清、血浆及相关液体样本中超氧化物歧化酶(SOD)含量。
实验原理本试剂盒应用双抗体夹心法测定标本中大鼠超氧化物歧化酶(SOD)水平。
用纯化的大鼠超氧化物歧化酶(SOD)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入人超氧化物歧化酶(SOD),再与HRP标记的超氧化物歧化酶(SOD)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的超氧化物歧化酶(SOD)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中大鼠超氧化物歧化酶(SOD)浓度。
1.标本采集后尽早进行提取,提取按相关文献进行,提取后应尽快进行实验。
若不能马上进行试验,可将标本放于-20℃保存,但应避免反复冻融2.不能检测含NaN3的样品,因NaN3抑制辣根过氧化物酶的(HRP)活性。
操作步骤1.标准品的稀释:本试剂盒提供原倍标准品一支,用户可按照下列图表在小试管中进行稀释。
2.加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、待测样品孔。
在酶标包被板上标准品准确加样50μl,待测样品孔中先加样品稀释液40μl,然后再加待测样品10μl(样品最终稀释度为5倍)。
加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。
3.温育:用封板膜封板后置37℃温育30分钟。
4.配液:将20倍浓缩洗涤液用蒸馏水20倍稀释后备用5.洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30秒后弃去,如此重复5次,拍干。
6.加酶:每孔加入酶标试剂50μl,空白孔除外。
7.温育:操作同3。
8.洗涤:操作同5。
9.显色:每孔先加入显色剂A50μl,再加入显色剂B50μl,轻轻震荡混匀,37℃避光显色15分钟.10.终止:每孔加终止液50μl,终止反应(此时蓝色立转黄色)。

皮肤组织中SOD活性测定的样品制备方法目的:确定应用黄嘌呤氧化酶法测定皮肤组织中SOD活性的生物样品处理方法。
方法:用不同的条件制备生物样品后进行皮肤组织中SOD活性的测定。
结果:皮肤组织中SOD活性测定的最佳生物样品处理条件是将皮肤组织的匀浆液以0℃,3 000 r/min离心10 min制备得到粗酶液。
结论:本研究建立测定皮肤中SOD活性的方法,为评价药品和化妆品对皮肤组织抗氧化、延缓皮肤衰老的功能奠定了基础。
[Abstract] Objective: To study the optimal situation of the xanthine oxidase method to determine the SOD activity in the skin tissure. Methods: Compared the different situation of the determination of the SOD in the rat′s skin. Results: The optimal situation was centrifuged at 0℃,3 000 r/minfor 10 minutes. Conclusion: The determination of SOD activity is available with the method. The study finds the basis to evaluate the function of the drug or the cosmetics to anti-oxdization and anti-senility in the skin tissure.[Key words] Rat; Skin tissure; Xanthine oxidase method; SOD avtivity; Chinese medicine超氧化物歧化酶(SOD)是生物机体内重要的自由基清除酶,其活性的高低表征着机体的抗氧化能力和衰老程度。
专利名称:一种临床检测用黄嘌呤氧化酶的制备方法专利类型:发明专利
发明人:尹春丽,杜国荣,张九东
申请号:CN201811036760.2
申请日:20180906
公开号:CN109735511A
公开日:
20190510
专利内容由知识产权出版社提供
摘要:本发明公开了提供一种临床检测用黄嘌呤氧化酶的制备方法,该方法包括如下步骤:步骤一、将xdhA、xdhB和xdhC三个基因导入大肠杆菌中,三个基因在大肠杆菌中共表达,得到黄嘌呤脱氢酶;步骤二、将所述黄嘌呤脱氢酶使用巯基特异性修饰剂处理,得到临床检测用黄嘌呤氧化酶。
该方法通过重组大肠杆菌发酵制备黄嘌呤氧化酶。
具有表达量高、纯化工艺简单、纯化得率高以及生产成本低的优势。
申请人:西安文理学院
地址:710065 陕西省西安市太白南路168号
国籍:CN
代理机构:陕西增瑞律师事务所
代理人:张瑞琪
更多信息请下载全文后查看。
影响超氧化物歧化酶活性测定的因素赵建;李想;鲁政;文镜【期刊名称】《食品科学》【年(卷),期】2010(031)009【摘要】目的:证实在黄嘌呤氧化酶法中影响超氧化物歧化酶(SOD)活性测定的干扰因素及其对保健食品抗氧化功能评价造成误差.方法:用黄嘌呤氧化酶法测定加入白蛋白、总蛋白、甘油三酯、葡萄糖、VC、还原型谷胱甘肽6种物质对SOD检测体系的影响以及小鼠灌胃VC后的SOD比活力值.结果:在黄嘌呤氧化酶法反应体系中,SOD灭活后依然能够检测到SOD比活力值.白蛋白、总蛋白、甘油三酯、葡萄糖、VC、还原型谷胱甘肤6种物质都对该体系造成干扰.透析能够消除小鼠血清中小分子物质的干扰.结论:由于黄嘌呤氧化酶法检测SOD为非特异性反应,血清中的蛋白质、脂肪、VC、还原型谷胱甘肽等物质都对SOD活性测定产生干扰而造成正误差.可采用透析的方法去除血清中含有对SOD检测体系构成干扰的小分子物质.【总页数】3页(P216-218)【作者】赵建;李想;鲁政;文镜【作者单位】北京联合大学,生物活性物质与功能食品北京市重点实验室,北京,100191;北京市药品检验所,北京,100035;北京联合大学,生物活性物质与功能食品北京市重点实验室,北京,100191;北京联合大学,生物活性物质与功能食品北京市重点实验室,北京,100191【正文语种】中文【中图分类】TS207.3【相关文献】1.凝胶注模成型固化过程及其影响因素--陶瓷浆料凝胶点测定及其影响因素的研究[J], 马利国;黄勇;杨金龙;苏亮;赵雷2.超氧化物歧化酶活性测定的影响因素研究 [J], 严万里;陈晓明;郭丽燕;柳芳3.国产3D面积测定仪表面积测定影响因素研究 [J], 邱烨; 孔维恒; 李祖敏; 郝欣; 郭文萍; 刘萤; 云环; 高欣; 刘鑫4.高频红外碳含量测定仪测定结果的影响因素探讨 [J], 刘淑梅5.哪些因素对血脂检查有影响?进行血脂检查时为什么要空腹12h?怎样减少血脂测定前的干扰因素对测定的影响? [J], 鄢盛恺因版权原因,仅展示原文概要,查看原文内容请购买。
改良的黄嘌呤氧化酶-羟胺法检测血清SOD活性
王珉;李洪;朱红枫
【期刊名称】《川北医学院学报》
【年(卷),期】2003(018)002
【摘要】@@ 超氧化物歧化酶(SOD)是体内清除超氧离子(O-2)的重要酶类,其在血清或组织细胞中的含量改变与炎症、肿瘤、损伤、糖尿病等疾病[1][2][3][4]的发生发展以及衰老过程有关.因此,检测患者体内的SOD活性,有助于相关疾病的诊断和治疗.
【总页数】2页(P92-93)
【作者】王珉;李洪;朱红枫
【作者单位】泸州医学院附属医院儿科,四川,泸州,646000;泸州医院生物化学教研室,四川,泸州,646000;泸州医学院附属医院儿科,四川,泸州,646000
【正文语种】中文
【中图分类】R446.11+2
【相关文献】
1.盐酸羟胺自氧化法测定SOD活性的电化学方法研究 [J], 张淑媛;卢青;邹洪
2.改良的紫外荧光光度计法检测小鼠血清中多巴胺β羟化酶活性的方法 [J], 刘林林;孙宝胜;杨巍;刘晓岚
3.黄嘌呤氧化酶法优化大鼠血清SOD 测定条件的探讨 [J], 翁闪凡;张晓林
4.保健食品中SOD活性测定改良Marklund法及检测条件的研究 [J], 罗速;杨春
玫
5.盐酸羟胺自氧化法测定SOD活性的电化学方法研究 [J], 张淑媛; 卢青; 邹洪因版权原因,仅展示原文概要,查看原文内容请购买。
发酵过程产物形成的测定(SOD活性的测定)一、实验目的1、了解SOD活性测定的原理2、学习黄嘌呤氧化酶法测定SOD活性二、实验原理原理:黄嘌呤氧化酶催化黄嘌呤产生超氧阴离子自由基,后者氧化羟胺成亚硝酸盐,亚硝酸盐在对氨基苯磺酸与甲萘胺作用下呈现紫红色,用可见光分光光度计测其吸光度。
当被测样品中含SOD时,则对超氧阴离子自由基有专一性抑止作用,使可形成的亚硝酸盐减少,比色时测定管的吸光度值低于空白管的吸光度值,通过公式计算可求出被测样品中SOD 的活力。
操作步骤:如表2-1。
三、实验试剂硫酸盐缓冲液,盐酸羟胺,黄嘌呤,黄嘌呤氧化酶,醋酸等。
四、实验步骤试剂测定管对照管75mmol/L 磷酸盐缓冲液(pH7.8)0.55 0.55待测样品(ml)A(取样量) 00.1mol/L 盐酸羟胺溶液0.05 0.0575mmol/L 黄嘌呤溶液0.05 0.050.037U/L 黄嘌呤氧化酶0.05 0.05双蒸水0.2-A 0.2用漩涡振荡器充分混匀,置37℃恒温水浴30min。
显色剂(ml) 1 1总体积1.9ml,混匀,室温放置10min,蒸馏水调零,测A530五、计算方法计算公式:每毫升反应液中SOD 抑止率达50%时对应的SOD 量为一个SOD 活力单位(U),待测样品中的SOD 活力由下式计算:SOD抑制率(%)=(A2-A1)/A2×100%SOD 活力(U/ml)=(A2-A1)/A2×100%÷50%×反应体系的稀释倍数×样本测试前的稀释倍数式中:A1:测定管的吸光值;A2:空白管的吸光值六、注意事项:1.试管要洗干净,在测定微量样品时尤为重要。
2.要做空白管,并且放在所有测试管的中间做,取平均值。
常用试剂(1)诱导剂:分别配制IPTG 100μmol/mL; CuSO4·5H2O 250μm/mL; ZnSO4 100μm/mL。
第29卷第3期佛山科学技术学院学报(自然科学版)V o l.29N o.3 2011年5月 Jou rnal of Fo shan U n iversity(N atu ral Science Editi on)M ay2011文章编号:100820171(2011)0320065203黄嘌呤氧化酶法优化大鼠血清SOD测定条件的探讨翁闪凡,张晓林(佛山科学技术学院检药系,广东佛山528000)摘要:目的 优化黄嘌呤氧化酶法测定大鼠血清SOD实验条件。
方法 采用黄嘌呤氧化酶法,探讨其加样量、方法重复性、显色稳定性、试剂稳定性及样品稳定性等最佳因素。
结果 黄嘌呤氧化酶法测定大鼠血清SOD最佳加样量为5Λl,其测定变异系数CV<1%,显色前后20m in吸光度比较(P>0.05);新配试剂与配制3个月试剂做测定,吸光度比较(P<0.01);新鲜标本和4°C放置48h标本进行测定,吸光度比较(P<0.01)。
结论 黄嘌呤氧化酶法测定大鼠血清SOD最佳加样量为5Λl,该法重复性好,显色稳定,测定试剂必须新鲜配制,标本必须新鲜制备。
关键词:黄嘌呤氧化酶法;SOD;测定中图分类号:R446.112 文献标志码:A自由基作为引起机体组织细胞损伤的重要因素,引起多种疾病发生、发展,日趋受到国内外医学界的认可及重视。
超氧化物阴离子是人类机体内重要的自由基,对机体有很大的损伤作用,超氧化物歧化酶(Sup erox ide dis m u tase,SOD)是广泛存在于各类生物体内的酸性金属酶,催化生物体内超氧自由基(O-2)发生歧化反应,是机体内O-2的天然消除剂,对机体细胞起保护作用。
近年来对抗氧化的动物实验研究越来越多,因此建立SOD活性的测定方法,并对其进行方法学探讨显得尤为重要。
目前,SOD活性测定主要有黄嘌呤氧化酶法、邻苯三酚自氧化法、羟胺发色法、四氮唑蓝(NB T)显色法、化学发光法[1],笔者主要对黄嘌呤氧化酶法测定大鼠血清SOD进行方法学探讨。
SOD测定试剂盒(南京建成生物工程研究所提供,批号:20100107);722分光光度计;微量加样器;吸嘴;试管。
1 实验原理通过黄嘌呤及黄嘌呤氧化酶反应系统产生的超氧阴离子自由基(O-2),后者氧化羟胺形成亚硝酸盐,在显色剂的作用下呈现紫红色,用可见分光光度计检测其吸光度。
当被测样品中含SOD时,则对超氧阴离子自由基(O-2)有专一性抑制作用,使形成的亚硝酸盐减少,比色时测定管的吸光度值低于对照管的吸光度值,通过公式计算可求出被测样品中的SOD活力。
2 实验方法及结果2.1 加样量2.1.1 方法 取大鼠新鲜血清20例,将加样量分为3Λl、4Λl、5Λl、6Λl4组,根据说明书中提供的抑制率参考范围收稿日期:2011203229基金项目:广东省自然科学基金资助项目(7010421)作者简介:翁闪凡(19752),女,广东佛山人,佛山科学技术学院讲师。
为48%~55%,确定最佳加样量。
抑制率=(对照管吸光度-测定管吸光度) 对照管吸光度。
2.1.2 结果结果见表1。
表1 大鼠血清SOD活力测定加样量组别3Λl4Λl5Λl6Λl 抑制率 %(x±s)18.35±0.9125.51±1.4351.40±1.9660.12±3.45 结果表明,最佳加样量为5Λl。
2.2 重复性取20例大鼠血清3平行测定,结果吸光度(A)为0.475±0.001,变异系数(CV,%)为0.077±0.087,由此可见,其变异系数(CV)<1%,该法重复性很好,精密度高。
2.3 显色稳定性2.3.1 方法取新鲜样本20例,分显色组与显色20m in组来测定其吸光度,做t检验。
2.3.2 结果结果见表2。
结果表明:显色组与显色20m in组其吸光度(A)比较P>0.05,两组无显著性差别,该法显色稳定性较好。
2.4 试剂稳定性2.4.1 方法将新鲜试剂和存放3个月的试剂(旧试剂)分成两组,大鼠新鲜血清测定其吸光度(A),做t检验,得出P值。
2.4.2 结果结果见表3。
结果表明:新鲜试剂组与旧试剂组吸光度(A)比较P<0.01,两组有显著性差别,表明该法测定试剂必须新鲜配置。
表2 大鼠血清SOD活力测定显色稳定性组别吸光度显色组0.470±0.112显色20m in组0.484±0.107 P值0.889表3 大鼠血清SOD活力测定试剂稳定性组别吸光度新鲜试剂组0.53±0.06旧试剂组0.61±0.01P值0.0082.5 样本稳定性2.5.1 方法取大鼠新鲜血清20例,分新鲜血清组和4°C放置48h血清组(大鼠陈旧血清组)两组,测定其吸光度值(A),做t检验,得出P值。
2.5.2 结果结果见表4。
结果表明:大鼠新鲜血清组和大鼠陈旧血清组吸光度(A)比较P<0.01,两组有显著性差别,表明测定标本必须新鲜,否则对测定影响很大。
表4 大鼠血清SOD活力测定样本稳定性组别吸光度大鼠新鲜血清组0.50±0.11大鼠陈旧血清组0.30±0.06P值0.003 讨论SOD有胞浆的铜锌SOD(Cu,Zn2SOD),线粒体内的锰SOD(M n2SOD),胞外的SOD(EC2SOD)3种[2],作为生物机体抗氧化酶系统中重要的抗氧化酶之一,SOD是生物体内重要的超氧阴离子自由基清除剂,其主要作用是能专一地清除生物氧化中产生的超氧阴离子自由基,有助于减少和阻止脂质的过氧化反应,延缓机体衰老及防止生物大分子损伤。
目前研究发现,SOD与呼吸系统、循环系统、消化系66佛山科学技术学院学报(自然科学版) 第29卷统、精神系统疾病及肿瘤有很大关系,其含量随病情变化而变化,动态监测SOD 含量对了解疾病的发病机制、病情、转归、预后以及临床治疗有重要的意义[3]。
目前,许多药物临床前研究、疾病发病机制等动物实验研究都需要测定SOD 活性,通过其活性来反映药物的抗氧化作用和阐明疾病的发病机制等相关信息。
由于大鼠的生理及遗传特性,大多数研究使用的实验动物为大鼠,因此有必要对大鼠血清SOD 测定的方法学进行探讨。
笔者经过一系列实验,结果表明,黄嘌呤氧化酶法可以很好地测定大鼠血清SOD 活性,其最佳加样量为5Λl ,其抑制率随着加样量的增加而相应升高,而加样量5Λl 抑制率全部落在反应曲线平坦部分;黄嘌呤氧化酶法由于其方法学为稳定的化学显色反应,其吸光度稳定性好,在保证操作者操作及实验环境的稳定性前提下,其平行操作的吸光度稳定,重复性好,显色稳定,结果精密度高。
该方法在标本处理问题上,血清标本贮存的条件对测定结果影响很大,建议标本存放在-20°C 最佳[4]。
标本随贮存期的延长其SOD 活力呈下降趋势[5],所以标本必须新鲜制备及检测更好。
该方法测定的试剂必须新鲜配制,尤其是显色剂更容易变红,最好是临用前配制。
参考文献:[1] 黎瑞珍,杨庆建,陈贻锐.超氧化物歧化酶(SOD )活性的测定及其应用研究[J ].琼州大学学报,2004,11(5):34236.[2] 谢继青,李玉华,杨春梅,等.超氧化物歧化酶的药理作用[J ].中国生化药物杂志,2009,30(1):72275.[3] 李长荣,姜军作,衣运玲.超氧化物歧化酶与疾病关系的探讨[J ].医学与哲学:临床决策论坛版,2007,10(28):43244.[4] 张娟,曾志将.不同贮存温度和时间对蜂王浆中SOD 活性的影响[J ].蜜蜂杂志,2008(7):627.[5] 蒋皎亮.105例血浆SOD 活力观察[J ].包头医学院学报,2003,19(3):178.【责任编辑:邓军文 dengjunw en 69@ 】The m ea surem en t ofseru m S OD xan th i ne ox ida se cond ition sW EN G Shan 2fan ,ZHAN G X iao 2lin(Schoo l of M edicine ,Fo shan U niversity ,Fo shan 528000,Ch ina )Abstract :Objective To op ti m ize the m easu rem en t of the serum SOD under the xan th ine ox idase exp eri m en tal conditi on s .M ethod to u se xan th ine ox idase to exp lo re the op ti m al facto rs such as the am oun t of the added sam p le ,m ethod rep roducib ility ,co lo r stab ility ,reagen t stab ility and sam p le stab ility fo r the m easu rem en t .Result T he op ti m al vo lum e of SOD w as 5Λl ,the coefficien t ofvariati on w as CV <1%and the co lo r ab so rbance w as P <0.05%20m inu tes befo re and after the test .Com pared w ith 32m on th reagen ts ,the new one w as found to have a co lo r ab so rbance of P <0.01and the co lo r ab so rbance w as P <0.01%w hen the new reagen t w as sto red at 4°C fo r 48h .Conclusion T he op ti m al sam p le vo lum e w as 5Λl w hen xan th ine ox idase w as u sed to m easu re serum SOD ,w h ich is of good rep roducib ility w ith a co lo r stab ility .T he reagen t and the speci m en s are bo th suggested to be fresh ly p repared .Key words :xan th ine ox idase ;SOD ;deter m inati on76第3期 翁闪凡等:黄嘌呤氧化酶法优化大鼠血清SOD 测定条件的探讨。