原料药检验报告模板
- 格式:doc
- 大小:36.50 KB
- 文档页数:1

药品质检报告模板电子版篇一:药品检验报告书摩达公司药品检验报告书检验项目 [性状] 比旋度 [鉴别] HPLC [检查] 吸光度有关物质干燥失重炽灼残渣重金属 [含量测定] 标准规定应为白色或微黄色结晶性粉末;无臭、味苦应-1°~+1°应与对照品保留时间一致A450nm应≤应≤% 应≤% 应≤% 应≤10ppm以干燥品计,含C18H20FN3O4 不得少于 %检验结果为微黄色结晶性粉末;无臭、味苦+°红外光谱鉴别应与对照品红外图谱一致溶液的澄清度应符合规定与对照品保留时间一致与对照品红外图谱一致符合规定 % % % <10ppm %结论:本品按内控质量标准检验,结果不符合规定。
质保部部长:xxx QC主任:xxx 检验员:xxx篇二:药品检验报告模板_胶囊剂水分检验日期:年月日仪器:电子天平编号:干燥条件:温度℃干燥时间计算公式:水分%=/W2*100%标准规定:结论:□符合规定□不符合规定检验日期:年月日温度: ℃湿度: %仪器:电子天平编号:取供试品10粒,结果:标示装量:平均装量:限度:标示装量(或平均装量)的±10%上限: ×=下限:×=10粒的情况:标准规定:每粒装量与平均装量相比较,超出装量差异限度的不得多于2粒,并不得有1粒超出装量差异限度1倍。
结论:□符合规定□不符合规定崩解时限检验日期:年月日温度: ℃湿度: %仪器:ZBS-6E崩解时限仪编号:YWH-003溶剂:溶剂温度: ℃是否加挡板□是□否崩解时间:分钟崩解情况:片均在分钟内全部崩解标准规定:□硬胶囊应在30分钟内全部崩解□软胶囊应在1小时内全部崩解□肠溶胶囊先不加挡板在盐酸溶液(9→1000)中检查2小时,每粒的囊壳均不得有裂缝或崩解现象,继加入挡板在人工肠液中检查,1小时内应全部崩解结论:□符合规定□不符合规定微生物限度见微生物限度检查表。
篇三:食品药检所检验报告书模板XXXXXXXXXXX食品药品检验所检验报告书报告书编号: 20XXA 二维码第3页共3页检验项目【检查】【含量测定】(以下空白)【性状】性状【鉴别】标准规定检验结果结论:本品按,结果符合规定。

附件2化学仿制原料药CTD格式申报资料撰写要求一、目录3。
2。
S 原料药3。
2。
S.1 基本信息3.2.S.1.1 药品名称3。
2。
S。
1。
2 结构3.2。
S。
1.3 理化性质3.2.S.2 生产信息3.2.S。
2。
1生产商3。
2.S。
2.2生产工艺和过程控制3。
2.S.2.3物料控制3.2。
S。
2.4关键步骤和中间体的控制3。
2.S。
2.5工艺验证和评价3.2。
S.2.6生产工艺的开发3.2.S.3 特性鉴定3。
2.S.3。
1结构和理化性质3.2。
S。
3.2杂质3.2.S。
4 原料药的质量控制3。
2。
S.4.1质量标准3.2。
S.4.2分析方法3.2.S。
4。
3分析方法的验证3。
2。
S。
4.4批检验报告3.2.S.4。
5质量标准制定依据3。
2。
S.5对照品3。
2.S.6包装材料和容器3。
2。
S。
7稳定性3。
2.S。
7.1稳定性总结3.2.S.7。
2上市后稳定性承诺和稳定性方案3.2.S.7.3稳定性数据二、申报资料正文及撰写要求—1 —3.2。
S.1 基本信息3.2.S。
1。
1药品名称提供原料药的中英文通用名、化学名,化学文摘(CAS)号以及其他名称(包括国外药典收载的名称),应与中国药典或上市产品收载一致.3。
2.S。
1.2 结构提供原料药的结构式、分子式、分子量,如有立体结构和多晶型现象应特别说明,应与中国药典或上市产品收载一致。
3。
2。
S。
1.3 理化性质提供文献(一般来源于药典和默克索引等)收载的原料药的物理和化学性质,具体包括如下信息:性状(如外观、颜色、物理状态);熔点或沸点;比旋度,溶解性,溶液pH, 分配系数,解离常数,将用于制剂生产的物理形态(如多晶型、溶剂化物、或水合物),粒度等。
列表提供与已上市产品或药典收载标准进行理化性质比较研究的资料。
3。
2。
S.2 生产信息3.2.S。
2。
1生产商生产商的名称(一定要写全称)、地址、电话、传真以及生产场所的地址、电话、传真等。
3.2。

第1篇一、前言1. 报告目的:简要说明本次调研的目的,例如为优化原料药采购策略、降低采购成本、提高供应链稳定性等。
2. 报告范围:明确本次调研所涉及的原材料范围,如抗生素、心血管药物、抗肿瘤药物等。
3. 报告时间:说明调研的时间范围,如2023年第一季度。
二、市场调研1. 市场规模:- 全球市场规模:概述全球原料药市场规模,包括销售额、产量等关键数据。
- 国内市场规模:分析国内原料药市场规模,与全球市场进行比较。
2. 市场趋势:- 行业发展趋势:分析行业整体发展趋势,如技术进步、市场需求变化等。
- 产品趋势:分析主要原料药产品的市场趋势,如新产品研发、产品生命周期等。
3. 竞争格局:- 主要供应商:列举主要原料药供应商,分析其市场份额、产品质量、价格竞争力等。
- 竞争态势:分析国内外原料药市场的竞争态势,包括价格竞争、技术竞争等。
三、供应商调研1. 供应商选择标准:- 质量标准:明确原料药质量要求,如纯度、杂质含量、微生物限度等。
- 价格标准:设定合理的价格区间,确保采购成本在可控范围内。
- 供应能力:评估供应商的产能、交货周期等。
2. 供应商调研内容:- 供应商资质:了解供应商的注册证书、生产许可证等。
- 产品质量:评估供应商产品的质量稳定性、批次合格率等。
- 价格竞争力:比较不同供应商的价格,分析价格差异的原因。
- 供应能力:评估供应商的产能、交货周期等。
3. 供应商评估:- 评分标准:根据供应商调研内容,设定评分标准,如质量、价格、供应能力等。
- 评估结果:对每个供应商进行评分,并根据评分结果进行排序。
四、采购策略1. 采购方式:- 直接采购:直接从供应商处采购原料药。
- 代理商采购:通过代理商采购原料药。
- 集团采购:与其他企业联合采购原料药。
2. 采购周期:- 短期采购:根据库存情况,定期采购原料药。
- 长期采购:与供应商签订长期合作协议,确保原料药供应。
3. 风险管理:- 价格波动风险:建立价格风险预警机制,降低价格波动带来的风险。

药厂检验报告单示例成品检验记录 (示例)编号:001 品名乙酰水杨酸规格 25kg/袋(本国品)批号 9007359 数量 25×40=1000kg 取样日期 1990至7月4日来源山东新华制药厂报告日期 1990年7月4日依据中国药典1985版鉴别:呈正反应碳酸钠中不溶物:澄清无色物理外观:好于实样A 游离水杨酸:<0.015%溶液外观:相当l0批无色熔点:138~139℃易炭化物:<对照液毛点:5个/3克重金属:<0.005%异物:无氯化物:<0.005%稳定性后:硫酸盐:<0.02% (游离水杨酸) %残渣:16.925916.9257 =0.02%0.000218.0781 18.0781干燥失重:16.4029 18.0780 =0.01%1.6752 0.0001含量:0.5319 22.25×0.1×0.1802×1000.1308 =99.96%0.40110.40110.5306 22.20×0.1×0.1802×1000.1311 =100.1%0.39950.3995判定:符合中国药典1985版标准复核人检验人附录二成品检验报告书(示例)编号:001 品名乙酰水杨酸包装规格 25kg/袋(本国品)出厂批号9007359 生产批次(检号)数量 25×40=1000kg 取样日期 1990至7月4日负责期限报告日期 1990年7月4日依据中国药典1985版检验结果:鉴别:呈正反应外观色泽:合格含量:100.0%熔点:138~139℃游离水杨酸:<0.015%(优级、合格)干燥失重:0.01%灼烧残渣:0.02%氯化物:<0.005%硫酸盐:<0.02%重金属:<0.0005%溶液外观:合格易炭化物:合格碳酸钠溶液中不溶物:合格毛点:5个/3g异物:合格判定:符合中国药典1985版标准质检科长复核员检验员。

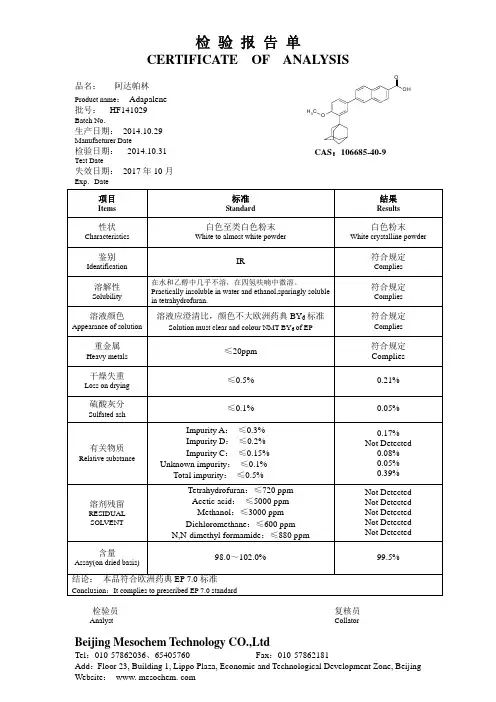
磷酸二氢铵检验报告单
磷酸氢二铵检验报告单
多肽朊检验报告单
工业氨水检测报告单
酵母抽提物检验报告单
磷酸二氢钾检验报告
磷酸氢二钾检验报告单
食用一水葡萄糖检验报告单
十二烷基硫酸钠检验报告单
氯化钾检验报告单
固体工业氢氧化钠检验报告单
活性炭检验报告单
有机硅高温消泡剂检验报告单
甘油(发酵法)检验报告单
NaCL检验报告单
工业甲醛
漂白粉检验报告单
友情提示:范文可能无法思考和涵盖全面,供参考!最好找专业人士起草或审核后使用,感谢您的下载!。

药品产品检验报告单概述本报告旨在对药品产品进行全面检验,以确保其质量符合标准。
本次检验涵盖了药品的原料、生产流程以及最终成品的属性和安全性等方面。
通过严格的测量和测试,我们对药品产品的合规性进行评估,并提供了详细的检验结果和分析。
检验项目原料检验- 检验名称: 原料成分分析- 结果: 合格- 分析说明: 通过对药品原料进行化学成分分析,确认其符合生产规范要求。
生产流程检验- 检验名称: 生产工艺检验- 结果: 合格- 分析说明: 对药品的生产流程进行全面检验,包括原料配比、加工过程等,确保合理的生产标准和操作流程。
成品属性检验外观检验- 检验名称: 外观检查- 结果: 合格- 分析说明: 对药品成品的外观进行检查,确认无明显异物、气味异常等情况。
质量检验- 检验名称: 质量指标测试- 结果: 合格- 分析说明: 对药品成品的质量指标进行测量和测试,包括样品的纯度、含量等关键指标,确保达到生产要求。
安全性检验毒理学检验- 检验名称: 毒性测试- 结果: 合格- 分析说明: 对药品进行毒性测试,了解其潜在的毒副作用和副作用程度,以确保安全性符合要求。
不良反应监测- 检验名称: 不良反应监测- 结果: 合格- 分析说明: 通过临床实验和用户反馈,监测药品在使用过程中是否存在明显的不良反应,以确保安全性符合要求。
结论经过全面检验和分析,本次药品产品检验报告显示,该药品产品在原料、生产流程、成品属性和安全性等方面均符合标准要求,达到了医药监管部门的规定要求。
所有检验结果均为合格。
此检验报告的目的是保障药品质量,为用户和医疗机构提供安全有效的药品。
建议与改进鉴于药品产品质量已符合要求,目前暂无建议与改进。
但为了持续改善和保持稳定的质量,我们建议药品生产企业继续加强质量管理体系,确保药品产品的持续合规性和安全性。
以上报告仅针对本次检验的样品,对于其他批次的药品产品,需要进行独立的检验和评估。
生物制药分析实验张冬青编广东轻工职业技术学院2007.3前言—生物药物分析实验基本要求及注意事项生物药物分析实验是生物药物分析课程的一个重要组成部分。
按教学大纲的规定,实验课教学应做到:通过实验,加深对本学科专业知识的理解;正确掌握实验教材中各类代表性药物的分析方法,熟练掌握各种分析方法和操作技术,培养独立开展生物药物分析工作的能力;全面了解生物药物分析工作的性质和任务,培养严肃认真、实事求是的科学态度和工作作风。
为确保实验教学质量,每个参加实验者应认真做到如下几点:1.上实验课前,必须做好预习,明确每次实验的目的要求,熟悉原理和操作要点,预先安排好实验进程,估计实验中可能发生的问题及处理办法。
每次实验课均应有准备地接受教师的提问。
2.实验前必须按清单清点所用仪器,如发现有破损或缺少,应立即报告实验教师。
实验时,必须认真地按照实验方法和步骤进行,仔细观察实验现象,积极思考,做好原始数据的记录。
3.进入实验室要随带一本预先编好页码的实验记录本。
实验过程中应尊重实验事实,及时做好完整而确切的原始记录。
要用钢笔或圆珠笔书写,字体端正。
应直接记于实验记录本上,绝不允许记于纸条上、手上或其他本子上再誉写,也不允许暂记在脑子里等下一个数据一起记录。
4. 原始记录是实验报告的一部分,尊重原始记录是必要的科学作风。
记录本不准撕页,如记录有误,只能将写错处用双线划去(但要求仍能看清原来写错的数值),在其边上写上正确数据,千万不得涂改,涂改的原始记录无效。
5.为防止试剂、药品污染,取用时应仔细观察标签和取用工具上的标志,杜绝盖错瓶盖或不随手加盖的现象发生。
当不慎发生试剂污染时,应及时报告教师。
公用试剂、药品应在指定位置取用。
此外,取出的试剂、药品不能再倒回原瓶。
6.保持实验室安静、清洁和整齐。
火柴梗、废纸屑、残渣等固体废物应丢入废物桶内,废液应倒在指定的废液缸中,严禁倒入水槽内,以防水槽和水管堵塞或腐蚀。
7.爱护仪器,小心使用,破损仪器应及时登记报告、补发。

药品检验报告书模板一、报告的目的和背景介绍(约100字)本报告旨在对药品进行全面的检验,以确保其质量安全,为药品生产企业提供科学依据,促进合理使用药品,保障患者用药安全。
二、药品基本信息(约100字)药品名称:____________________规格:___________________________生产企业:______________________批号:___________________________样品编号:______________________三、检验项目及方法(约500字)1.目视检查:检查药品外观、颜色、透明度等是否符合规定要求。
2.身份鉴别:采用化学物质鉴定、红外光谱鉴定等方法,确定药品的成分和属性。
3.含量测定:采用高效液相色谱法(HPLC)等方法,测定药品中有效成分的含量是否符合规定标准。
4.无菌检验:采用微生物学培养和检测等方法,检验药品是否符合无菌要求。
5.质量控制指标:依据相关法规和标准,确定药品的质量控制指标,并进行相应检验。
6.其他:根据具体药品的特性和要求,可以增加其他检验项目和方法。
四、检验结果(约500字)1.目视检查结果:药品外观无异常,颜色透明度符合要求。
2.身份鉴别结果:经化学物质鉴定和红外光谱鉴定,样品与标准物质一致,符合要求。
3.含量测定结果:有效成分含量为XXX,符合标准要求。
4.无菌检验结果:样品通过微生物检测,无检出任何微生物,符合无菌要求。
5.质量控制指标结果:样品经检验,各项质量控制指标均符合要求。
五、结论与建议(约200字)根据所做的药品检验结果,结合相关标准要求及法规,可以得出以下结论:药品的质量符合要求,可放行、销售或使用。
建议药品生产企业保持良好的质量管理,加强原材料检验,确保产品质量稳定可靠。
六、检验人员签名和日期检验人员签名:_____________________________日期:_____________检验机构负责人签名:_________________________日期:_____________七、附件1.检验方法说明书及相关标准;2.药品检验原始记录及数据分析;3.其他相关附件。

药品检验报告书模板1. 检验目的本次检验的目的是对药品进行检测,确保其符合相关标准,以确保药品的质量和安全性。
2. 检验对象药品名称批号规格生产日期- -药品A 1234 10mg 2021/01药品B 5678 20mg 2020/12药品C 9012 5mg 2021/023. 检验项目本次检验主要围绕以下项目进行:1. 外观检查2. 可溶性残留物检查3. 化学成分检测4. 微生物检验4. 检验结果4.1 外观检查药品A、B、C的外观均符合规定要求,无明显可见的异物、颜色异常等问题。
4.2 可溶性残留物检查药品A、B、C经可溶性残留物检查,结果如下:- 药品A:检测结果为0.02mg/ml,符合规定要求。
- 药品B:检测结果为0.01mg/ml,符合规定要求。
- 药品C:检测结果为0.03mg/ml,符合规定要求。
4.3 化学成分检测本次化学成分检测主要关注以下几个指标:1. 含量测定:检测各药品中的主要活性成分含量。
2. 原料成分检测:检测药品中是否含有禁用成分或添加其他未声明的成分。
具体的化学成分检测结果如下:药品名称活性成分含量(%)原料成分检测结果药品A 99.8% 合格药品B 98.5% 合格药品C 99.9% 合格4.4 微生物检验微生物检验主要针对药品中是否存在细菌、霉菌等微生物污染。
经过检测,药品A、B、C的微生物检验结果如下:- 药品A:无细菌、霉菌污染。
- 药品B:无细菌、霉菌污染。
- 药品C:无细菌、霉菌污染。
5. 检验结论根据以上检验结果,药品A、B、C均符合相关标准要求,合格通过检验。
药品质量可靠,可以正常投放市场和使用。
6. 检验结论有效期本次检验结论的有效期为一年,即从报告发出之日起的一年内有效。
7.备注(这里可以记录检验过程中的任何异常情况、备注、建议等内容)该药品检验报告书为虚构内容,仅用于参考示例。
实际药品检验报告会根据不同药品的特性、检验要求进行定制。
国产试剂检验报告单模板编号:________
1.产品信息
产品名称:________
产品规格:________
生产日期:________
检验日期:________
送检单位:________
送检人:________
2.检验项目及方法
项目1:________
方法:________
项目2:________
方法:________
...
3.检验结果
项目1:
-结果1:________
-结果2:________
...
项目2:
-结果1:________
-结果2:________
-结果3:________
...
4.结论与建议
根据检验结果,对该国产试剂的质量进行评估:-结论1:________
-结论2:________
-结论3:________
...
建议:
-建议1:________
-建议2:________
-建议3:________
...
5.检验人员
协助人员:________
6.图片附件(如有)
附注:
-说明检测所用的试剂及仪器设备;
-附加其他相关信息。
本报告仅根据送检样品的检测结果生成,若有其他需求请提前告知。
备注:
1.检验结果仅针对报告样品,不能代表整批产品;
3.本报告具有法律效力,未经索引编号的复制无效。
签字:________。
检验报告
样品名称
××××
送检单位 送检日期 2020年 3 月20 日
样品数量 100g×6 抽样人员
检验单位 检验类别 委托检验
检验依据 《中国药典》2015版二部
检验项目 检验数据 标准规定
检验
结论
性 状
本品为白色或类白色结晶或结晶性粉末,无臭、无味,略有引湿性; 本品为白色或类白色结晶或结
晶性粉末,无臭、无味,略有
引湿性;
符合
规定
溶解度
本品在丙酮中溶解,在乙醇、乙酸乙酯、乙腈中略溶,在水中不溶; 本品在丙酮中溶解,在乙醇、
乙酸乙酯、乙腈中略溶,在水
中不溶;
符合
规定
紫外吸收光
谱
取本品,加乙腈制成每1ml中约含10μg的溶液,紫外分光光度计进行扫描,在230nm,238nm与246nm的波长处有最大吸收; 取本品,加乙腈制成每1ml中
约含10μg的溶液,紫外分光光
度计进行扫描,在230nm,238nm
与246nm的波长处有最大吸收;
符合
规定
红外外吸收
光谱
符合
规定
检
查
干燥
失重
0.20%
不得过0.30%
符合
规定
炽灼
残渣
0.17% 不得过0.2%
符合
规定
酸不溶性灰分 0.9% 不得过1.0% 符合
规定
重金
属考察 11.86 ppm 不得过20ppm
符合
规定
含
量测定 高效液相色谱法 100.4% ≥98% 符合
规定
结论:送检样品符合《中国药典》2015版×××质量标准。
检验人: 复核人: