浅谈人卫2008版中专《生物化学》化学结构式书写问题
- 格式:pdf
- 大小:170.39 KB
- 文档页数:2





医学生物化学基础有机化学总复习医学生物化学基础有机化学总复习专题一:有机物的结构和同分异构体:(一)有机物分子式、电子式、结构式、结构简式的正确书写:1、分子式的写法:碳-氢-氧-氮(其它元素符号)顺序。
2、电子式的写法:掌握7种常见有机物和4种基团:7种常见有机物:CH4、C2H6、C2H4、C2H2、CH3CH2OH、CH3CHO、CH3COOH。
4种常见基团:-CH3、-OH、-CHO、-COOH。
3、结构式的写法:掌握8种常见有机物的结构式:甲烷、乙烷、乙烯、乙炔、乙醇、乙醛、乙酸、乙酸乙酯。
(注意键的连接要准确,不要错位。
)4、结构简式的写法:结构简式是结构式的简写,书写时要特别注意官能团的简写,烃基的合并。
要通过练习要能识别结构简式中各原子的连接顺序、方式、基团和官能团。
掌握8种常见有机物的结构简式:甲烷CH4、、乙烷C2H6、乙烯C2H4、、乙炔C2H2、乙醇CH3CH2OH、乙醛CH3CHO、乙酸CH3COOH、乙酸乙酯CH3COOCH2CH3。
(二)同分异构体:要与同位素、同素异形体、同系物等概念区别,注意这四个“同”字概念的内涵和外延。
并能熟练地作出判断。
同位素同素异形体同系物同分异构体项目概念适用对象判断依据性质实例1、同分异构体的分类:碳链异构、位置异构、官能团异构。
2、同分异构体的写法:先同类后异类,主链由长到短、支链由整到散、位置由心到边。
3、烃卤代物的同分异构体的判断:找对称轴算氢原子种类,注意从对称轴看,物与像上的碳原子等同,同一碳原子上的氢原子等同。
专题二:官能团的种类及其特征性质:(一)、烷烃:(1)通式:C n H2n+2,代表物CH4。
(2)主要性质:①、光照条件下跟卤素单质发生取代反应。
②、在空气中燃烧。
③、隔绝空气时高温分解。
(二)、烯烃:(1)通式:C n H2n(n≥2),代表物CH2=CH2,官能团:-C=C-(2)主要化学性质:①、跟卤素、氢气、卤化氢、水发生加成反应。

医学生物化学第一章一、蛋白质的生理功能蛋白质是生物体的基本组成成分之一,约占人体固体成分的45%左右。
蛋白质在生物体内分布广泛,几乎存在于所有的组织器官中。
蛋白质是一切生命活动的物质基础,是各种生命功能的直接执行者,在物质运输与代谢、机体防御、肌肉收缩、信号传递、个体发育、组织生长与修复等方面发挥着不可替代的作用。
二、蛋白质的分子组成特点蛋白质的基本组成单位是氨基酸✧编码氨基酸:自然界存在的氨基酸有300余种,构成人体蛋白质的氨基酸只有20种,且具有自己的遗传密码。
各种蛋白质的含氮量很接近,平均为16%。
✧每100mg样品中蛋白质含量(mg%):每克样品含氮质量(mg)×6.25×100。
氨基酸的分类✧所有的氨基酸均为L型氨基酸(甘氨酸)除外。
✧根据侧链基团的结构和理化性质,20种氨基酸分为四类。
1.非极性疏水性氨基酸:甘氨酸(Gly)、丙氨酸(Ala)、缬氨酸(Val)、亮氨酸(Leu)、异亮氨酸(Ile)、苯丙氨酸(Phe)、脯氨酸(Pro)。
2.极性中性氨基酸:色氨酸(Trp)、丝氨酸(Ser)、酪氨酸(Tyr)、半胱氨酸(Cys)、蛋氨酸(Met)、天冬酰胺(Asn)、谷胺酰胺(gln)、苏氨酸(Thr)。
3.酸性氨基酸:天冬氨酸(Asp)、谷氨酸(Glu)。
4.碱性氨基酸:赖氨酸(Lys)、精氨酸(Arg)、组氨酸(His)。
✧含有硫原子的氨基酸:蛋氨酸(又称为甲硫氨酸)、半胱氨酸(含有由硫原子构成的巯基-SH)、胱氨酸(由两个半胱氨酸通过二硫键连接而成)。
✧芳香族氨基酸:色氨酸、酪氨酸、苯丙氨酸。
✧唯一的亚氨基酸:脯氨酸,其存在影响α-螺旋的形成。
✧营养必需氨基酸:八种,即异亮氨酸、甲硫氨酸、缬氨酸、亮氨酸、色氨酸、苯丙氨酸、苏氨酸、赖氨酸。
可用一句话概括为“一家写两三本书来”,与之谐音。
氨基酸的理化性质✧氨基酸的两性解离性质:所有的氨基酸都含有能与质子结合成NH4+的氨基;含有能与羟基结合成为COO-的羧基,因此,在水溶液中,它具有两性解离的特性。

生物化学教学中如何运用分子结构式
郑云郎
【期刊名称】《卫生职业教育》
【年(卷),期】2005(023)002
【摘要】生物化学与其它学科比较,一个显著不同的地方就是具有众多的分子结构式。
由于分子结构式对教师来讲比较难教,对学生来讲更是难学。
故在生化教学中,对于分子结构式的运用存在一些争论。
有人认为,反正可借用文字和语言来表达,省去结构式可减少麻烦。
持这种观点的人,上课时几乎完全脱离分子结构式,结果学生学完生化,对常见的甚至很简单的分子结构式都不认识,更不会写。
【总页数】2页(P45-46)
【作者】郑云郎
【作者单位】台州学院医学院,浙江,台州,318000
【正文语种】中文
【中图分类】G420
【相关文献】
1.互动教学在《生物化学与分子生物学》教学中的运用技巧 [J], 周海燕;田云;方俊;张学文
2.医学生物化学教学中分子结构式的运用 [J], 于保锋;郭睿;张悦红;解军
3.轻松处理各种生物化学分子结构式 [J], 曾莉;阳东青;余德润
4.中国生物化学与分子生物学会农业生物化学与分子生物学分会成立大会暨第六届全国农业生物化学与分子生物学学术交流会在贵州省贵阳市召开 [J],
5.中国生物化学与分子生物学会中医药生物化学与分子生物学分会中医药普通高等教育“十一五”国家级规划教材《生物化学》定稿会在桂林召开 [J],
因版权原因,仅展示原文概要,查看原文内容请购买。

《生物化学与分子生物学》(人卫第八版)-第一章蛋白质的结构与功能归纳总结第一章蛋白质·蛋白质(protein)是由许多氨基酸(amino acids)通过肽键(prpide bond)相连形成的高分子含氮化合物。
·具有复杂空间结构的蛋白质不仅是生物体的重要结构物质之一,而且承担着各种生物学功能,其动态功能包括:化学催化反应、免疫反应、血液凝固、物质代谢调控、基因表达调控和肌收缩等;就其结构功能而言,蛋白质提供结缔组织和骨的基质、形成组织形态等。
·显而易见,普遍存在于生物界的蛋白质是生物体的重要组成成分和生命活动的基本物质基础,也是生物体中含量最丰富的生物大分子(biomacromolecule)·蛋白质是生物体重要组成成分。
分布广:所有器官、组织都含有蛋白质;细胞的各个部分都含有蛋白质含量高:蛋白质是细胞内最丰富的有机分子,占人体干重的45%,某些组织含量更高,例如:脾、肺及横纹肌等高达80%。
·蛋白质具有重要的生物学功能。
1)作为生物催化剂(酶)2)代谢调节作用3)免疫保护作用4)物质的转运和存储5)运动和支持作用6)参与细胞间信息传递·氧化功能第一节蛋白质的分子组成(The Molecular Structure of Protein)1.组成元素:C(50%-55%)、H(6%-7%)、O(19%-24%)、N(13%-19%)、S(0-4%)。
有些但被指含少量磷、硒或金属元素铁、铜、锌、锰、钴、钼,个别还含碘。
2.各蛋白质含氮量接近,平均为16%。
100g样品中蛋白质的含量(g%)=每克样品含氮克数*6.25*100,即每克样品含氮克数除以16%。
凯氏定氮法:在有催化剂的条件下,用浓硫酸消化样品将有机氮都转化为无机铵盐,然后在碱性条件下将铵盐转化为氨,随水蒸气蒸馏出来并为过量的硼酸液吸收,再以标准盐酸滴定,就可计算出样品中的氮量。
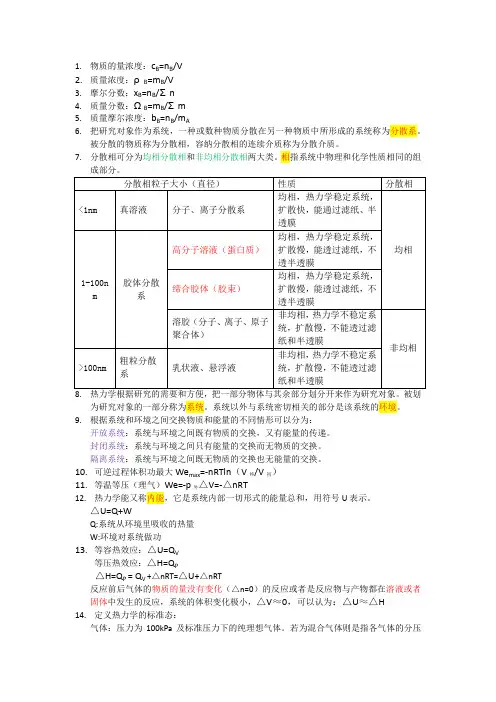
1.物质的量浓度:c B=n B/V2.质量浓度:ρB=m B/V3.摩尔分数:x B=n B/Σn4.质量分数:ΩB=m B/Σm5.质量摩尔浓度:b B=n B/m A6.把研究对象作为系统,一种或数种物质分散在另一种物质中所形成的系统称为分散系。
被分散的物质称为分散相,容纳分散相的连续介质称为分散介质。
7.分散相可分为均相分散相和非均相分散相两大类。
相指系统中物理和化学性质相同的组成部分。
8.热力学根据研究的需要和方便,把一部分物体与其余部分划分开来作为研究对象。
被划为研究对象的一部分称为系统。
系统以外与系统密切相关的部分是该系统的环境。
9.根据系统和环境之间交换物质和能量的不同情形可以分为:开放系统:系统与环境之间既有物质的交换,又有能量的传递。
封闭系统:系统与环境之间只有能量的交换而无物质的交换。
隔离系统:系统与环境之间既无物质的交换也无能量的交换。
10.可逆过程体积功最大We max=-nRTln(V终/V初)11.等温等压(理气)We=-p外△V=-△nRT12.热力学能又称内能,它是系统内部一切形式的能量总和,用符号U表示。
△U=Q+WQ:系统从环境里吸收的热量W:环境对系统做功13.等容热效应:△U=Q V等压热效应:△H=Q P△H=Q P = Q V +△nRT=△U+△nRT反应前后气体的物质的量没有变化(△n=0)的反应或者是反应物与产物都在溶液或者固体中发生的反应,系统的体积变化极小,△V≈0,可以认为:△U≈△H14.定义热力学的标准态:气体:压力为100kPa及标准压力下的纯理想气体。
若为混合气体则是指各气体的分压为标准压力且均为理想气体的性质。
纯液体(或纯固体):标准压力下的纯溶液(或纯固体)溶液:溶液由溶质和溶剂构成,溶质的标准态是指在标准压力溶质浓度(严格应为活度)为1mol/L或质量摩尔浓度为1mol/kg且具有理想溶液性质的溶质;溶剂的标准态则是指标准压力下的纯溶剂。


第一章绪论第二章立体化学1、费歇尔投影式书写原则连接原子或原子团的水平线代表伸向纸面前方的化学键,垂直线代表纸面后方。
2、外消旋体、非对映异构体、内消旋化合物概念(区别和联系)3、R/S构型标记法第四章烷烃和环烷烃一、烷烃1、构象异构(锯架式和纽曼投影式的书写)2、化学性质①稳定性②卤代反应(自由基的反应)链引发——链增长——链终止二、环烷烃1、化学性质取代、开环加成(一般为三元环或四元环)原则(连氢最多和连氢最少的两个碳原子之间)2、构象环己烷的构象:椅式和船式(书写<两种>椅式的顺式和反式以及取代反应的稳定性即优势构象)第五章烯烃和炔烃一、烯烃1、顺反异构及其命名2、化学性质①亲电加成反应(1)与卤素加成(在四氯化碳中进行):反应机制烯烃与氯或溴的加成反应通常生成反式加成产物(2)与卤化氢的加成反应的活性顺序:HI>HBr>HCl>HF 不对称加成(马氏规则)正碳离子的稳定性诱导效应(3)与硫酸加成_______________________________________________________________生成烷基硫酸氢酯在水中加热可以水解生成醇稀硫酸下即可反应,硫酸越浓越不易加成不对称加成也遵循马氏规则(4)与水加成在酸催化下(如磷酸或硫酸)与水加成生成醇②催化加氢常用Pt、Pd、Ni等金属作催化剂主要生成顺式加成产物取代基增多空间位阻增大越不利于加成③自由基加成反应(1)过氧化物存在下加溴化氢只有溴化氢反马氏规则(2)烯烃的自由基聚合反应④氧化反应(1)高锰酸钾氧化酸性条件下、稀冷条件下(顺式、褐色MnO2沉淀)(2)臭氧氧化最终生成醛或酮以及过氧化氢(3)环氧化反应烯烃与过氧酸作用氧化为环氧化合物二、共轭烯烃1、共轭效应2、性质何时1,2加成、何时1,4加成三、炔烃1、化学性质①酸性与硝酸银或氯化亚铜的氨溶液反应②加成反应(1)催化加氢(若催化剂为Lindlar Pd,反应产物为顺式烯烃)(2)与卤素加成(3)与卤化氢加成(马氏规则)(4)与水加成(在汞盐如硫酸汞催化下,稀硫酸溶液中能反应)注:双键与三键同时存在时,若发生亲电加成则先与双键反应;否则先与三键反应③氧化反应与高锰酸钾反应第六章芳香烃1、化学性质①亲电取代反应(1)苯的亲电反应取代机制(2)卤代反应(在三卤化铁或铁粉等催化剂作用下)(3)硝化反应(混酸)(4)磺化反应(发烟硫酸/与浓硫酸共热)磺化反应引进磺酸基可增强水溶性(5)烷基化和酰基化反应(博-克反应)在无水氯化铝等Lewis酸催化剂下,苯与卤代烷反应生成烷基苯,与酰卤反应生成酰基苯在烷基化反应中,卤代烷在三氯化铝的作用下产生亲电试剂烷基正离子。
第二章蛋白质化学在熟记蛋白质生理功能的基础上,论述蛋白质是生命活动的物质基础。
熟记蛋白质元素组成特点;多肽链的基本组成单位——L-α-氨基酸;20种氨基酸三字母缩写符号、结构式及主要特点。
准确描述肽键、多肽链、蛋白质一级结构、高级结构概念。
结合实例论述蛋白质结构与功能的关系。
熟记蛋白质重要理化性质及有关的基本概念,并列举蛋白质性质与医学的关系;结合蛋白质的性质,列举蛋白质分离纯化及测定方法。
第三章核酸化学写出多肽链氨基酸序列分析方法及关键试剂名称。
复述核酸的分类、细胞分布,各类核酸的功能及生物学意义。
记住核酸元素组成特点(与蛋白质比较)。
结合碱基、核苷和核苷酸的化学结构,熟记它们的中文名称及相应的缩写符号。
列举两类核酸(DNA与RNA)分子组成异同。
牢记体内重要的环化核苷酸——cAMP和cGMP。
在理解多核苷酸链结构基础上,牢记单核苷酸之间的连接方式——3’,5’磷酸二酯键及多核苷酸链的方向性(5’ →3’)。
描述DNA的一级结构, DNA二级结构——双螺旋模型要点,碱基配对规律。
简述tRNA二级结构——“三叶草”结构特点。
在熟记二级结构基础上,知道核酸还有更高级结构形式存在。
结合组成成分及结构,熟记核酸的性质及相关重要概念,准确叙述核酸、特别是DNA变性、复性及分子杂交的概念。
写出核酸序列分析的方法名称。
第四章酶✓酶的基本概念、化学本质及酶促反应特点。
✓熟记酶组成、结构有关的基本概念一一酶蛋白、辅助因子(辅酶、辅基)、全酶、酶的活性中心和必需基团等。
结合结构与功能的关系,论述酶原激活的化学本质。
以乳酸脱氢酶(LDH)为例,描述同工酶的概念。
✓列举酶促反应机理学说及要点。
✓熟记影响酶促反应动力学的几种因素及其动力学特点。
默写米式方程,解释米氏常数,学会运用米式方程进行简单计算。
✓叙述别构酶概念、酶促反应动力学特点及意义。
结合酶促反应动力学牢记酶活性测定的基本原则及应用。
叙述酶活性单位的概念。
✓结合酶在医学中应用的实际例子,说明酶与医学的关系。
浅谈《生物化学》教学方法作者:杨小琴来源:《文理导航·教育研究与实践》 2014年第11期重庆市合川职业教育中心杨小琴2013年的中职高考,护理专业除考语文、数学外,专业课增加《组织胚胎学》和《生物化学概论》两门课程。
我是学生物科学出身,因此《生物化学概论》这门课程很自然的就落在了我的肩上,承担起该门课程的教学任务。
在我们中职学校,学生对于不管是生物学还是化学的知识都是非常薄弱的,这不得不让我在教学过程中,探索一些学生能将知识牢固掌握的教学方法。
接下来我就简单的谈谈在教学中,一些自己认为不错的教学方法。
一、蛋白质的分子结构这个知识点其实挺难,特别是它的一、二、三、四级结构的区别,若要给学生描述清楚是难上加难。
不过用我的方法让学生掌握就不会太困难了。
首先蛋白质一级结构,它的概念是:在蛋白质多肽链中氨基酸的排列顺序称为蛋白质的一级结构,在这句话中重要的是“氨基酸排列顺序”这七个字,所以我就要求学生将这几个字着上重点符号,掌握了这七个字也就把蛋白质一级结构的核心掌握了。
单单记住这几个字还不行,还得有形象的记忆,形象记忆比文字记忆更持久。
我将家里母亲戴过的珍珠项链带到了课堂上,用项链来比喻蛋白质的一级结构:一串珍珠代表着一条多肽链,而珍珠则代表一个一个的氨基酸,“珍珠”之间是通过肽键连接起来的,当然这些“珍珠”也是要按照顺序排列的。
如此这样的描述加形象,就能让学生有个直观的感受,也让他们更容易理解蛋白质的一级结构。
其次是蛋白质二级结构(是指多肽链主链进行盘曲、折叠形成的空间结构)同样我用珍珠项链将竖起的食指绕两圈后所形成的状态(α-螺旋态);直接将项链折成波浪状(β-折叠态);将项链对折(β-转角);项链揉捏成一团(无规则卷曲),通过这样直观方式来帮助学生对蛋白质二级结构的理解。
其三是蛋白质三级结构(是指在二级结构的基础上多肽链进一步盘曲折叠、主链和侧链都包括在内所形成的空间结构),我用的材料是筷子和电话线,我将本是螺旋状态的电话线(可视作蛋白质二级结构)绕着筷子再次的缠绕几圈,这时又形成了一个大的螺旋状态,此时的“电话线”便成了蛋白质的三级结构。
大理学院成人高等教育《生物化学》课程作业第一章至第三章一、名词解释1、蛋白质一级结构:指蛋白质中共价连接的氨基酸残基的排列顺序,包括二硫键的位置。
2、蛋白质变性:是指蛋白质在某些物理和化学因素作用下其特定的空间构象被改变,从而导致其理化性质的改变和生物活性的丧失,这种现象称为蛋白质变性。
3、DNA的解链温度(Tm):DNA的变性发生在一定范围内,这个温度范围的中点称为溶解温度,用(Tm)表示。
4、模体:模体(motif)表示具有特定功能的或作为一个独立结构域一部分的相邻的二级结构的聚合体,它一般被称为功能模体(functional motif)或结构模体(structural motif),相当于超二级结构(5、酶:催化特定化学反应的蛋白质、RNA或其复合体。
是生物催化剂,能通过降低反应的活化能加快反应速度,但不改变反应的平衡点。
绝大多数酶的化学本质是蛋白质。
具有催化效率高、专一性强、作用条件温和等特点。
6、酶的活性中心:酶分子中氨基酸残基的侧链有不同的化学组成。
其中一些与酶的活性密切相关的化学基团称作酶的必需基团。
这些必需基团在一级结构上可能相距很远,但在空间结构上彼此靠近,组成具有特定空间结构的区域,能和底物特异结合并将底物转化为产物。
这一区域称为酶的活性中心。
二、简答题1、简述蛋白质二级结构的主要形式及其结构特点。
蛋白质二级结构(secondary structure of protein)指蛋白质多肽链本身的折叠和盘绕的方式。
二级结构主要有α-螺旋、β-折叠、β-转角。
常见的二级结构有α-螺旋和β-折叠。
二级结构是通过骨架上的羰基和酰胺基团之间形成的氢键维持的,氢键是稳定二级结构的主要作用力。
蛋白质在形成立体结构时,其多肽链部分首先折叠成α-型螺旋(α-helix)和β-型(β-sheet)结构,并由此进一步可折叠成球形。
此时,将α螺旋和β型结构称为二级结构。
在蛋白质以外,例如在tRNA有三叶草叶型结构,也可称为二级结构2、简述DNA双螺旋结构模型要点。
《生物化学》知识点总结生物化学是研究生物体的化学组成、结构、功能以及生命过程中化学变化规律的一门科学。
它是生命科学领域的重要基础学科,对于理解生命现象、疾病发生机制以及药物研发等方面都具有重要意义。
以下是对生物化学一些重要知识点的总结。
一、蛋白质化学1、氨基酸氨基酸是蛋白质的基本组成单位,共有 20 种。
按照侧链的性质,可分为非极性脂肪族氨基酸、极性中性氨基酸、芳香族氨基酸、酸性氨基酸和碱性氨基酸。
氨基酸具有两性解离的性质,在不同的 pH 条件下会以不同的离子形式存在。
2、蛋白质的结构蛋白质的一级结构是指氨基酸的线性排列顺序,通过肽键连接。
二级结构包括α螺旋、β折叠、β转角和无规卷曲,主要依靠氢键维持稳定。
三级结构是指整条肽链中全部氨基酸残基的相对空间位置,主要由疏水作用、离子键、氢键和范德华力等维持。
四级结构是指由两条或两条以上具有独立三级结构的多肽链通过非共价键相互结合而成的聚合体。
3、蛋白质的性质蛋白质具有胶体性质、两性解离、变性和复性、沉淀等性质。
变性是指蛋白质在某些物理和化学因素作用下,其特定的空间构象被破坏,从而导致其理化性质的改变和生物活性的丧失。
二、核酸化学1、核酸的分类和组成核酸分为脱氧核糖核酸(DNA)和核糖核酸(RNA)。
DNA 由脱氧核苷酸组成,包括腺嘌呤(A)、鸟嘌呤(G)、胸腺嘧啶(T)和胞嘧啶(C)。
RNA 由核糖核苷酸组成,包括腺嘌呤(A)、鸟嘌呤(G)、尿嘧啶(U)和胞嘧啶(C)。
2、 DNA 的结构DNA 是双螺旋结构,两条链反向平行,碱基之间通过氢键互补配对。
双螺旋结构的稳定因素包括碱基堆积力、氢键和离子键等。
3、 RNA 的种类和功能RNA 包括信使 RNA(mRNA)、转运 RNA(tRNA)和核糖体RNA(rRNA)。
mRNA 是蛋白质合成的模板,tRNA 负责转运氨基酸,rRNA 参与核糖体的组成。
三、酶1、酶的概念和特点酶是具有催化作用的蛋白质或 RNA。
第一章蛋白质·蛋白质(protein)就是由许多氨基酸(amino acids)通过肽键(prpide bond)相连形成得高分子含氮化合物。
·具有复杂空间结构得蛋白质不仅就是生物体得重要结构物质之一,而且承担着各种生物学功能,其动态功能包括:化学催化反应、免疫反应、血液凝固、物质代谢调控、基因表达调控与肌收缩等;就其结构功能而言,蛋白质提供结缔组织与骨得基质、形成组织形态等。
·显而易见,普遍存在于生物界得蛋白质就是生物体得重要组成成分与生命活动得基本物质基础,也就是生物体中含量最丰富得生物大分子(biomacromolecule)·蛋白质就是生物体重要组成成分。
分布广:所有器官、组织都含有蛋白质;细胞得各个部分都含有蛋白质含量高:蛋白质就是细胞内最丰富得有机分子,占人体干重得45%,某些组织含量更高,例如:脾、肺及横纹肌等高达80%。
·蛋白质具有重要得生物学功能。
1)作为生物催化剂(酶)2)代谢调节作用3)免疫保护作用4)物质得转运与存储5)运动与支持作用6)参与细胞间信息传递·氧化功能第一节蛋白质得分子组成(The Molecular Structure of Protein)1、组成元素:C(50%-55%)、H(6%-7%)、O(19%-24%)、N(13%-19%)、S(0-4%)。
有些但被指含少量磷、硒或金属元素铁、铜、锌、锰、钴、钼,个别还含碘。
2、各蛋白质含氮量接近,平均为16%。
100g样品中蛋白质得含量(g%)=每克样品含氮克数*6、25*100,即每克样品含氮克数除以16%。
凯氏定氮法:在有催化剂得条件下,用浓硫酸消化样品将有机氮都转化为无机铵盐,然后在碱性条件下将铵盐转化为氨,随水蒸气蒸馏出来并为过量得硼酸液吸收,再以标准盐酸滴定,就可计算出样品中得氮量。
此法就是经典得蛋白质定量方法。
一、氨基酸——组成蛋白质得基本单位存在于自然界得氨基酸有300余种,但组成人体蛋白质得氨基酸仅有20种,且均属L-氨基酸(甘氨酸除外),手性,具有旋光性(甘氨酸除外,甘氨酸R基团为-H)。