高中化学(人教版,选修5) 第二章烃和卤代烃 第一节第1课时
- 格式:docx
- 大小:151.08 KB
- 文档页数:10

选修5第二章 烃和卤代烃 第一节 脂肪烃学案 第1课时【学习目标】1了解烷烃、烯烃、炔烃物理性质的变化与分子中碳原子数目的关系。
2能以典型代表物为例,理解烷烃、烯烃、炔烃等有机化合物的化学性质。
【重点难点】烷烃 烯烃的结构特点和主要化学性质 【知识回顾】1、烷烃:仅含 键和C —H 键的饱和链烃。
通式: (n≥1)2、烯烃:分子里含有一个 的不饱和链烃叫做烯烃。
通式: (n≥2)(分子里含有两个双键的链烃叫做二烯烃)3、写名称或结构简式CH 3Cl 一氯乙烷 CH 3CH 2Cl 2CH 3CH 2CH 2Cl CH 3CHClCH 3 CH 3CHClCH 2ClCH 3CCl 2CH 3 CH 2=CH —CH=CH 2【教学过程】一、烷烃和烯烃1、物理性质递变规律[思考与交流]P28表2—1和表2—2: 绘制碳原子数与沸点或相对密度变化曲线图:(1)熔、沸点和密度:随着分子里碳原子数的增加,熔、沸点逐渐 。
相对密度逐渐 ,但都比水的密度 。
(2)状态: 由气态(分子中碳原子数n≤ )逐渐过渡到液态(5≤n ≤16)、固态(17≤n)。
(新戊烷在常温下为气态)(3)溶解性: 溶于水,易溶于有机溶剂。
【练习】:下面是我们已经学过的烷烃或烯烃的化学反应,请写出其反应的化学方程式。
(1)乙烷与氯气生成一氯乙烷的反应:_________________;(2)乙烯与溴的反应:_________(3)乙烯与水的反应:___________; (4)乙烯生成聚乙烯的反应:_________________。
★ 自主学习,先学后教,当堂消化。
学案组编人: 张文奇 审核人: 孙文军 编号:GEHXXA5301H u a X u e X u e A n高二化学2、有机基本反应类型(1) 取代反应:有机物分子里的某些 或 被其他原子或原子团所取代的反应。
如烃的卤代反应。
(2) 加成反应:有机物分子中 (三键)两端的碳原子与其他原子或原子团所直接结合生成新的化合物的反应。

第二章烃和卤代烃第一节脂肪烃第1课时烷烃和烯烃目标要求 1.认识烷烃、烯烃物理性质的变化规律,记住它们的化学性质。
2.知道烯烃的顺反异构现象及结构要求。
一、烷烃和烯烃1.烷烃、烯烃的物理性质烷烃和烯烃的物理性质随着分子中碳原子数的递增,呈规律性变化,沸点逐渐____________,相对密度逐渐____________,常温下的存在状态,也由________逐渐过渡到____________。
(1)当烃分子中碳原子数≤4时,常温下呈________。
(2)分子式相同的烃,支链越多,熔沸点越________________________________________________________________________。
例如沸点:CH3(CH2)3CH3>(CH3)2CHCH2CH3>C(CH3)4。
(3)烷烃、烯烃的相对密度______水的密度。
2.烷烃的化学性质——与甲烷相似(1)常温下:性质稳定,不与强酸、强碱、强氧化剂反应。
(2)在特定条件下可发生__________、__________(燃烧)。
3.烯烃的化学性质——与乙烯相似(1)能使KMnO4酸性溶液______。
(2)能燃烧,燃烧通式为__________________________。
(3)加成反应,与____________等加成。
如:CH2===CH-CH3+Br2―→______________________________。
CH2===CH-CH3+HCl―→_________________________________。
(4)加聚反应,如丙烯加聚反应的化学方程式为二、烯烃的顺反异构1.异构现象的产生由于__________不能旋转而导致分子中原子或原子团________________不同所产生的异构现象。
顺式结构:两个相同的原子或原子团排列在双键的______;反式结构:两个相同的原子或原子团分别排列在双键的______。


第二章烃和卤代烃第一节脂肪烃第 1 课时烷烃和烯烃•新知导学物理性质变化规律状态当碳原子数小于或等于4 时,烷烃和烯烃在常温下呈气态,其他的烷烃和烯烃常温下呈或液态( 新戊烷常温下为气态) 。
固态溶解性都不溶于水,易溶于有机溶剂。
沸点随碳原子数的增加,沸点逐渐升高。
碳原子数相同的烃,支链越多,沸点越低。
密度随碳原子数的增加,相对密度逐渐增大。
烷烃、烯烃的密度小于水的密度。
2. 烷烃的化学性质——与甲烷相似(1) 稳定性常温下烷烃很不活泼,与强酸、强碱、强氧化剂等都不发生反应,只有在特殊条件下(如光照或高温) 才能发生某些反应。
(2) 取代反应——特征反应烷烃可与卤素单质在光照下发生取代反应生成卤代烃和卤化氢。
如乙烷与氯气反应生成一氯乙烷,化学方程式为:光照CH3CH3+Cl 2――→CH3CH2Cl +HCl。
(3) 氧化反应——可燃性烷烃。
烷烃可在空气或氧气中燃烧生成CO2 和H2O,燃烧的通式为:3n+1 点燃C n H2 n+2+O――n CO2+( n+1)H 2O。
3.烯烃的化学性质——与乙烯相似(1) 加成反应——特征反应丙烯与溴的四氯化碳溶液反应生成(2) 氧化反应①烯烃能使酸性高锰酸钾溶液的紫色1,2- 二溴丙烷的化学方程式为:CH3—CH===C2H+Br2②可燃性:烯烃燃烧的通式为:褪去。
点燃3nC n H2n+O2――→ n CO2+n H O定条件――→(3) 加聚反应:烯烃加聚反应的通式:n R1—CH===C—H R2 4.烯烃的顺反异构(1) 顺反异构由于碳碳双键不能旋转而导致分子中原子或原子团在空间的排列方式不同所产生的异构现象,称为顺反异构。
两个相同的原子或原子团排列在双键的同一侧的称为顺式结构;两个相同的原子或原子团分别排列在双键的两侧的称为反式结构。
如(2) 形成条件一是具有碳碳双键,二是要求在组成双键的每个碳原子上必须连接两个不同的原子或原子团。
(3) 顺反异构体的化学性质基本相同,物理性质有一定的差异。


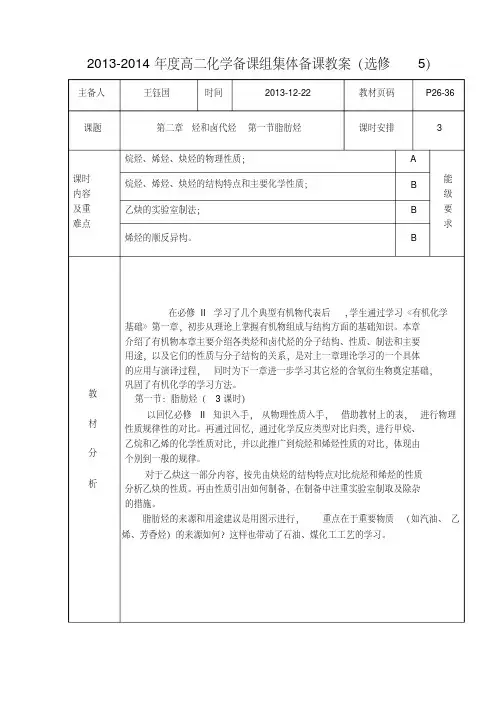
2013-2014年度高二化学备课组集体备课教案(选修5)主备人王钰国时间2013-12-22 教材页码P26-36 课题第二章烃和卤代烃第一节脂肪烃课时安排 3课时内容及重难点烷烃、烯烃、炔烃的物理性质; A能级要求烷烃、烯烃、炔烃的结构特点和主要化学性质; B乙炔的实验室制法; B烯烃的顺反异构。
B教材分析在必修II学习了几个典型有机物代表后,学生通过学习《有机化学基础》第一章,初步从理论上掌握有机物组成与结构方面的基础知识。
本章介绍了有机物本章主要介绍各类烃和卤代烃的分子结构、性质、制法和主要用途,以及它们的性质与分子结构的关系,是对上一章理论学习的一个具体的应用与演译过程,同时为下一章进一步学习其它烃的含氧衍生物奠定基础,巩固了有机化学的学习方法。
第一节:脂肪烃(3课时)以回忆必修II知识入手,从物理性质入手,借助教材上的表,进行物理性质规律性的对比。
再通过回忆,通过化学反应类型对比归类,进行甲烷、乙烷和乙烯的化学性质对比,并以此推广到烷烃和烯烃性质的对比,体现由个别到一般的规律。
对于乙炔这一部分内容,按先由炔烃的结构特点对比烷烃和烯烃的性质分析乙炔的性质。
再由性质引出如何制备,在制备中注重实验室制取及除杂的措施。
脂肪烃的来源和用途建议是用图示进行,重点在于重要物质(如汽油、乙烯、芳香烃)的来源如何?这样也带动了石油、煤化工工艺的学习。
主备教案内容二次备课内容教学目标【知识与技能】1.了解烷烃、烯烃、炔烃的物理性质的规律性变化。
2.了解烷烃、烯烃、炔烃的结构特点。
3.掌握烯烃、炔烃的结构特点和主要化学性质;乙炔的实验室制法【过程与方法】注意不同类型脂肪烃的结构和性质的对比;善于运用形象生动的实物、模型、计算机课件等手段帮助学生理解概念、掌握概念、学会方法、形成能力;要注意充分发挥学生的主体性;培养学生的观察能力、实验能力、探究能力。
【情感、态度与价值观】根据有机物的结果和性质,培养学习有机物的基本方法“结构决定性质、性质反映结构”的思想。




选修5《第二章 绘和卤代桂》全章教案课题:第二章第一节脂肪炷第二章炷和卤代姪第一节脂肪烧 一、烷® (alkane)和烯® (alkene)1、 结构特点和通式:(1) 烷炷:仅含C —C 键和C —H 键的饱和链炷,又叫烷炷。
(若C —C 连成 环状,称为环烷炷。
)通式:CnH 2n+2 (n^l)(2) 烯炷:分子里含有一个碳碳双键的不饱和链绘叫做烯炷。
(分子里含有 两个双键的链炷叫做二烯炷) 通式:C n H 2n (nM2)2、 物理性质(1) 物理性质随着分子中碳原子数的递增,呈规律性变化,沸点逐渐升高, 相对密度逐渐增大;(2) 碳原子数相同时,支链越多,熔沸点越低。
⑶ 常温下的存在状态,也由气态(nW4)逐渐过渡到液态(5WnW16)、固 态(17Wn)。
(4)炷的密度比水小,不溶于水,易溶于有机溶剂。
重 点 难 点烯烧的顺反异构知 识 结 构 与 板 书 设 计教学 目的烯怪的结构特点和化啓性质3、基本反应类型(1)取代反应(substitution reaction):有机物分子里的某些原子或原子团被其他原子或原子团所取代的反应。
如炷的卤代反应。
(2)加成反应(addition reaction):有机物分子中双键(参键)两端的碳原子与其他原子或原子团所直接结合生成新的化合物的反应。
如不饱和碳原子与也、X2>也0的加成。
(3)聚合反应(polymerization reaction):由相对分子质量小的化合物分子结合成相对分子质量较大的高分子化合物的反应。
如加聚反应、缩聚反应。
4、烷坯化学性质(与甲烷相似)烷绘不能使酸性高猛酸钾溶液和漠水褪色(1)取代反应:CH3CH3+ Cl2—— CH3CH2CI + HC1(2)氧化反应:CJk+2 + 3jl±1- 02 3- nC02 +(n+l)H205、烯炷的化学性质(与乙鬲似)(1)加成反应3n(2)氧化反应① 燃烧:CJL+才。
第一节脂肪烃第1课时烷烃和烯烃烯烃的顺反异构[知识梳理]一、烷烃和烯烃1.烷烃和烯烃的物理性质2.烷烃的化学性质(1)稳定性:常温下烷烃很不活泼,与强酸、强碱、强氧化剂等都不发生反应,只有在特殊条件下(如光照或高温)才能发生某些反应。
(2)特征反应——取代反应烷烃可与卤素单质在光照下发生取代反应生成卤代烃和卤化氢。
如乙烷与氯气反应生成一氯乙烷,化学方程式为CH 3CH 3+Cl 2――→光照CH 3CH 2Cl +HCl 。
(3)氧化反应——可燃性烷烃可在空气或氧气中燃烧生成CO 2和H 2O ,其燃烧的通式为C n H 2n +2+3n +12O 2――→点燃n CO 2+(n +1)H 2O 。
(4)分解反应——高温裂化或裂解烷烃受热时会分解产生含碳原子数较少的烷烃和烯烃,如:C 16H 34――→催化剂高温C 8H 16+C 8H 18。
3.烯烃的化学性质 (1)特征反应——加成反应①丙烯与溴的四氯化碳溶液反应生成1,2-二溴丙烷的化学方程式为。
②二烯烃的加成反应(2)氧化反应①烯烃能使高锰酸钾酸性溶液的紫色褪去。
②可燃性烯烃燃烧的通式为C n H 2n +3n 2O 2――→点燃n CO 2+n H 2O 。
(3)加聚反应烯烃加聚反应的通式:n R 1—CH===CH —R 2――→催化剂。
【自主思考】1.从烷烃、单烯烃同系物的分子式分析,烷烃、单烯烃分子式通式分别是什么? 提示 烷烃:C n H 2n +2(n ≥1),单烯烃:C n H 2n (n ≥2)。
2.在光照条件下,等物质的量的乙烷和Cl 2混合发生取代反应生成的有机产物中只有一氯乙烷吗?提示 不是。
乙烷和Cl 2的取代反应是连续的,产物是从一氯乙烷至六氯乙烷的混合物。
二、烯烃的顺反异构 1.产生原因由于碳碳双键不能旋转而导致分子中原子或原子团在空间的排列方式不同。
2.存在条件每个双键碳原子上连接了两个不同的原子或原子团。
一.教案背景时间:3月1日地点:甘南二中(齐齐哈尔市重点高中)人物:教师:朱世亮(年青教师)学生:二年五班,二年七班事件:本节为两课时,本教案是第一节内容,学生需要预习必修二中的甲烷,乙烯的结构特点和性质。
二.教学课题本节内容选自化学选修5第二章«烃和卤代烃»第一节脂肪烃三.教材分析1、本节在教材中的地位选修5是化学新课程体系中系统性较强的模块,第二章第一节脂肪烃是多种烃的衍生物的“母体”,是有机化学中的基础物质,所以学好它,对以后的学习显得尤其重要。
本节在复习必修教材的相关内容的基础上,进一步学习烷烃、烯烃、炔烃的结构、性质,使第一章中比较概念化的知识内容结合了具体物质而得到提升和拓展。
2、教学目标分析(1)、知识及技能①了解脂肪烃沸点和相对密度的变化规律。
以典型的脂肪烃为例,通过对比归纳的方式掌握烷烃、烯烃、炔烃的结构特点以及烷烃、烯烃的主要化学性质。
②根据脂肪烃的组成和结构特点掌握加成、加聚和取代反应等重要的有机反应类型,并能灵活地加以运用。
(2)、过程及方法①运用脂肪烃的分子模型,培养学生的观察能力和空间想象能力。
②通过从甲烷、乙烯的结构和性质推出烷烃和烯烃的结构和性质,培养学生的知识迁移能力。
(3)、情感态度及价值观①通过图片、模型等创设问题情景,激发学生学习的兴趣。
②通过动手做烃的球棍模型,体验模型法在化学中的应用。
【教学重点】脂肪烃的结构特点和烷烃、烯烃的主要化学性质。
【教学难点】烷烃和烯烃的性质四.教学方法在教学流程上采用课前导学,课堂质疑,反馈矫正,迁移创新四步教学法,在具体细节处理上运用的方法主要包括类比法、讲解法、讨论、归纳对比法、、运用多媒体等创建真实的教学情境,让学生带着真实的任务学习,拥有学习的主动权。
同时也充分体现主体性课堂模式,把课堂的时间还给学生。
使学生成为课堂的主人。
五.教学过程[引入]同学们,。
在高一的时候我们接触过几种烃,大家能否举出一些例子?甲烷、乙烯、苯。
第二章烃和卤代烃
第一节脂肪烃
第1课时烷烃和烯烃
目标要求 1.认识烷烃、烯烃物理性质的变化规律,记住它们的化学性质。
2.知道烯烃的顺反异构现象及结构要求。
一、烷烃和烯烃
1.烷烃、烯烃的物理性质
烷烃和烯烃的物理性质随着分子中碳原子数的递增,呈规律性变化,沸点逐渐____________,相对密度逐渐____________,常温下的存在状态,也由________逐渐过渡到____________。
(1)当烃分子中碳原子数≤4时,常温下呈________。
(2)分子式相同的烃,支链越多,熔沸点越
________________________________________________________________________。
例如沸点:
CH3(CH2)3CH3>(CH3)2CHCH2CH3>C(CH3)4。
(3)烷烃、烯烃的相对密度______水的密度。
2.烷烃的化学性质——与甲烷相似
(1)常温下:性质稳定,不与强酸、强碱、强氧化剂反应。
(2)在特定条件下可发生__________、__________(燃烧)。
3.烯烃的化学性质——与乙烯相似
- 1 -
(1)能使KMnO4酸性溶液______。
(2)能燃烧,燃烧通式为__________________________。
(3)加成反应,与____________等加成。
如:
CH2===CH-CH3+Br2―→______________________________。
CH2===CH-CH3+HCl―→_________________________________。
(4)加聚反应,如丙烯加聚反应的化学方程式为
二、烯烃的顺反异构
1.异构现象的产生
由于__________不能旋转而导致分子中原子或原子团________________不同所产生的异构现象。
顺式结构:两个相同的原子或原子团排列在双键的______;
反式结构:两个相同的原子或原子团分别排列在双键的______。
2.形成条件
一是具有__________,二是要求在组成双键的每个碳原子上必须连接__________。
知识点1 烷烃、烯烃的物理性质
1.下列烷烃沸点由高到低顺序正确的是( )
①CH4②C3H8③C5H12④C8H18⑤C12H26
A.①②③④⑤ B.⑤④③②①
C.⑤③④②① D.③④⑤②①
知识点2 烷烃、烯烃的化学性质
- 1 -。