山东省枣庄市峄城区吴林街道中学九年级化学全册 到实验室去-配制一定溶质质量分数的溶液学案
- 格式:doc
- 大小:260.50 KB
- 文档页数:3

3.2 溶液组成的定量表示学习目标:1.掌握溶质质量分数的含义。
能够进行溶质质量分数的简单计算。
2.初步学会配制一定溶质质量分数的溶液。
3.了解溶液组成的定量表示在工农业生产和生活中的重要意义。
知识点(重点、难点):重点:溶质质量分数的含义及其简单计算。
难点:配制一定溶质质量分数的溶液。
实验准备:多媒体素材、托盘天平、药匙、量筒、胶头滴管、烧杯、玻璃棒、氯化钠、蒸馏水板书设计:第二节溶液组成的定量表示一、溶液组成的表示方法1.溶质质量分数:溶质质量分数是溶质与溶液的质量之比。
2.公式:溶质质量①溶质质量分数= ×100%溶液质量②溶液的质量=溶质的质量+溶剂的质量变形公式:①溶质的质量=溶液的质量×溶质的质量分数②溶液的质量=溶质的质量÷溶质的质量分数③溶质的质量=溶液的质量﹣溶剂的质量④溶剂的质量=溶液的质量﹣溶质的质量3. 有关计算二、溶液的配制1.仪器、药品:托盘天平、药匙、量筒、胶头滴管、烧杯、玻璃棒、氯化钠、蒸馏水2.步骤:①计算②称量③溶解④装瓶存放3.误差分析学习过程:师生互动活动意图【创设情景】【投影】你能简便、快速的判断出下列各组所配的A、B溶液中,哪一种更甜?A 溶液B溶液一组5gNaCl与100g水10gNaCl与100g水二组10gNaCl与100g水10gNaCl与50g水三组10gNaCl与90g水5gNaCl与95g水四组5gNaCl与45g水19gNaCl与81g水学生讨论总结:B、B、A、B从实际问题入手,引导学生用数学方法解决化学问题。
激发学生的学习兴趣,使学生带着疑问参与教学过程。
【提问】你是怎么判断出来的?学生回答:1.质量相同的溶剂,看溶质质量;2.质量相同的溶质,看溶剂质量;3.看溶质与溶液的质量比。
【导入新课】大家的思路都很好!这都是表示溶液组成的方法,下面我们共同学习这方面的知识。
【板书课题】第二节溶液组成的定量表示【出示学习目标和重难点】学习目标:1.掌握溶质质量分数的含义。

到实验室去配制一定溶质质量分数的溶液一、选择题1.配制一定溶质质量分数的氯化钠溶液,下列操作错误的是( )2.在实验室配制溶液时,常涉及以下过程:①称量、量取;②过滤;③蒸发结晶、干燥;④计算;⑤溶解。
某同学用10g含杂质10%的食盐(杂质不溶于水)和蒸馏水配制50g 5%的氯化钠溶液,正确的操作顺序是( )A.④①⑤B.④①⑤②③C.②③④①⑤D.⑤②③④①⑤3.配制50克5%的氯化钠溶液,下列操作会使溶液溶质质量分数增大的是( )A.用量筒量水时,俯视读出47.5mL水,并用所量的水配制溶液B.天平调平衡后,移动游码2.5克处,在左盘放上称量纸,加食盐至天平平衡C.溶解时所选用的烧杯壁上有水D.将配制好的溶液倒入试剂瓶时,有一部分溶液流到试剂瓶的外面4.要配制100g溶质的质量分数为10%的氯化钠溶液,下列说法正确的是( )A.称取氯化钠时,应先向托盘天平左盘加氯化钠,再向右盘加砝码B.量取水时,若俯视量筒读数,配得的溶液溶质的质量分数偏小C.将称好的氯化钠和量好的水在烧杯中混合,用玻璃棒搅拌,使氯化钠溶解D.配好的溶液应倒入广口瓶中,盖好瓶塞,并贴上标签二、填空题5.在实验室配制l00g 10%的氯化铵溶液。
请回答有关问题:(l)计算:需氯化铵的质量_______g,水_______mL;(2)称量:用电子天平称取所需的氯化铵,用_______ mL(“50 mL”“l00mL”或“200mL”)的量筒量取所需水的体积;(3)溶解:将上述称量好的氯化铵和水放到烧杯中,用玻璃棒搅拌.搅拌的目的是________。
(4)反思:若称取的氯化铵中含有水分或其它杂质,则所配制的氯化铵溶液的溶质质量分数会_________(填“偏大”、“不变”或“偏小”)。
6.小明同学在实验考试时,抽到的题目是“配置50g质量分数为5%的氯化钠溶液”。
(l)称量氯化钠时,小明将砝码放在托盘天平的左盘上(1g以下用的是游码),所配得溶液中溶质的质量分数_______(填“偏大”、“偏小”或“不变”)。


第七单元《到实验室去探究酸和碱的化学性质》学习目标:1. 通过实验进一步认识酸、碱的化学通性。
2. 初步学会使用酸碱指示剂和pH试纸检验溶液的酸碱性。
3. 初步学会运用间接观察法收集证据,感悟探究物质化学性质的一般思路和方法。
知识点(重点、难点):1. 酸、碱与指示剂作用。
2. 酸碱中和反应。
3. 酸、碱的其他化学性质。
课前准备:1. 你需要准备以下实验用品:(1)石蕊试液、酚酞试液、pH试纸;(2)稀盐酸、稀硫酸、氢氧化钠溶液、氢氧化钙溶液(澄清石灰水);(3)白醋、柠檬汁、肥皂水、蔗糖水、自来水,镁条、石灰石、2%氯化铜溶液、生锈铁钉、2%碳酸钠溶液;(4)试管、烧杯、胶头滴管、点滴板、玻璃片、白瓷板、玻璃棒。
2. 你在开始实验之前需要了解:(1)用胶头滴管取用液体和向试管中滴加液体的操作方法;(2)用pH试纸测定溶液酸碱性的方法。
学习过程:教师活动学生活动活动意图复习旧知为了更好的完成今天的实验课,我们先来复习一下相关知识,检查一下课前准备情况。
1. 用胶头滴管取用液体和向试管中滴加液体的操作方法?2. 用pH试纸测定溶液酸碱性的方法?3. 酸和碱的通性有哪些?4. 酸和碱为什么有通性?。
[导入新课]通过检查同学们课前准备的很充分,对酸和碱的化学性质有了一定的认识,本节课同学们可以通过动手实验进一步认识酸和碱的化学通性。
[板书课题]到实验室去二氧化碳的实验室制取与性质回顾所学过的知识,小组代表起立回答老师提出的问题复习学过的相关内容,激发学生的探究热情,为本机实验课做充分的热身投影揭示本节课的学习目标,师生明确学习的目标和具体的任务,知道学习时的重点和难点。
动手操作,体验快乐一. 酸、碱与指示剂作用。
[自然过渡]今天的实验课分三个部分,我们先来看第一个部分[板书标题]1. 酸、碱与指示剂作用。
[布置任务]下面该同学亲自体验了,程序是:独立阅读步骤——组长分工——合作实验——记录现象——讨论获得结论——反思交流。

山东省枣庄市峄城区吴林街道中学九年级化学全册第七单元第四节第七单元第四节《酸碱中和反应》(第1课时)学习目标:1、通过实验探究和微观图片、flah动画的分析讨论,认识中和反应的实质;学会利用中和反应来改变溶液的酸碱性,书写常见中和反应的化学方程式;2、通过酸和碱反应的探究,提高发现和提出问题的能力,初步学会借助指示剂判断物质是否发生化学反应。
知识点(重点、难点):重点:理解中和反应及其实质;掌握常见中和反应化学方程式的书写。
难点:从微观角度理解中和反应的实质。
实验准备:多媒体;试管架,烧杯,试管(3支),玻璃棒,胶头滴管,白瓷板,0.4%的氢氧化钠溶液,0.4%的盐酸,水,紫色石蕊试液,无色酚酞试液,pH试纸。
学习过程:教师活动情景创设:指导学生对比品尝加醋和没加醋的松花蛋,比较一下味道有什么不同?说出你的疑问?提示:制作松花蛋常用到熟石灰和纯碱等原料。
根据已有知识,做出合理猜想。
肯定学生的想法,提问:其他的酸和碱之间是否也能发生化学反应呢?这节课我们一起来学习——[板书1]§7.4酸碱中和反应探究新知:实验探究:盐酸和氢氧化钠溶液能否发生化学反应?[投影展示1]提出问题:如图所示,用滴管向盛有约2ml、溶质质量分数为0.4%的氢氧化钠溶液的试管中滴加0.4%的盐酸,观察现象。
你认为盐酸和氢氧化钠溶液发生化学反应了吗?学生活动品尝加醋和没加醋的松花蛋。
回答:没加醋的松花蛋有点涩,加醋的松花蛋没有涩味。
活动意图从生活走入化学,创设情景,悬疑激趣,调动学生的学习兴趣和提出问题:为什么加醋参与探究的热情;同时也培养了学的松花蛋不涩了?生大胆质疑、小心求证的科学态度。
做出猜想:可能是食醋中的酸把松花蛋中的碱反应掉了。
动手实验,观察现象;突破平时在教师指导下实验讨论交流,分析原因;提出总有明显现象的惯例,使学生形成猜想:盐酸和氢氧化钠溶液认知冲突,为进一步探究作铺垫;发生了化学反应;或盐酸和培养学生的观察能力,提高发现和氢氧化钠溶液没有发生化提出问题的能力。
第八单元《到实验室去粗盐中难溶性杂质的去除学习目标:1.学会除去少量粗盐中的难溶性杂质的方法。
2.初步学习使用过滤、蒸发的方法对混合物进行分离。
知识点(重点、难点):1.过滤、蒸发等分离提纯物质的基本操作技能。
2. 粗盐中难溶性杂质的去除方法。
课前准备:1. 你需要准备以下实验用品:蒸馏水、粗盐;托盘天平、烧杯、玻璃棒、蒸发皿、坩埚钳、酒精灯、漏斗、药匙、量筒、铁架台(带铁圈)、滤纸、剪刀。
2. 你在开始实验之前需要了解:过滤器的制作和过滤基本操作。
通过刚才的回答可以看出,同学们对本节的准备比较充分。
为了更好的完成本实验我们来看一段视频:/v/b/32868101-1657365745.ht ml三、动手操作,体验快乐[布置任务]这下同学们对过滤操作都熟悉了吧。
下面就请同学们小组之间互相合,亲自体验了。
首先完成第一步——1.溶解。
[投影]1. 溶解用量筒量取10 mL水,倒入烧杯中。
称取3.0 g粗盐,加入水中,用玻璃棒不断搅拌,直至粗盐不再溶解为止。
[交流共享]结合刚才的实验总结用到仪器和观察到的现象。
[探究升级]根据的食盐的溶解度,同学们思考一下:为什么要用10mL水对3g食盐进行溶解,而不是 100mL 水或5mL水?[归纳总结]通过刚才的分析我们发现:20℃时食盐的溶解度为36g,5mL水溶解不了3g食盐,100mL水,蒸发时太浪费。
[自然过渡]溶解好了食盐。
下面开始进行第二步——2.过滤。
[投影]2. 过滤将烧杯中的液体沿玻璃棒倒入过滤器,进行过滤。
若滤液仍浑浊,应再过滤一次。
5.需要的仪器:观看视频进一步熟悉过滤器的制作和过滤的操作要领明确实验过程,小组合作,完成实验并注意总结:1.用到的仪器:烧杯、玻璃棒。
2.看到的现象:大颗粒的食盐消失,液体变浑浊。
思考、讨论展示、交流小组合作制作过滤器并过滤。
在过滤时体会“一贴;二低;三靠。
”培养学生动手操作能力和合作意识加深对溶解度实际应用的理解。
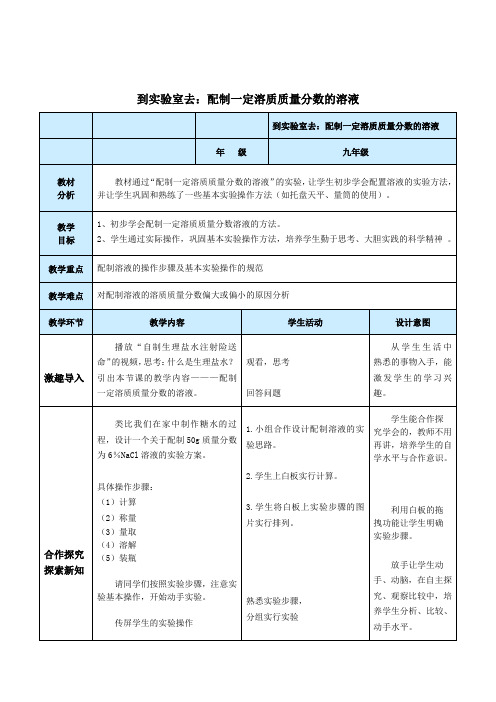
到实验室去:配制一定溶质质量分数的溶液【教学目标】学会配制溶质质量分数一定的溶液的方法。
【教学重难点】掌握配制溶质质量分数一定的溶液步骤。
【教学过程】步骤教师活动复习引入投影展示,合作讨论学生动手实验提问:溶质质量分数的计算公式。
通过知识回顾引出课题。
例题1:配制80g质量分数为10%的氯化钠溶液,所需要的氯化钠质量和水的质量。
通过分析得出配制一定质量分数的溶液的第一步是要进行计算。
一、计算小组合作计算出所需要的溶质质量和溶剂的体积。
二、称量称量,分两个步骤:称与量。
称的时候,引导学生共同回顾托盘天平的使用注意事项,以及使用时的方法。
左物右码,先大后小。
量取液体药品的时候,先提问学生回答使用量筒时的注意事项:倾倒液体时,倾倒到距离刻线一公分左右的时候停止,改用胶头滴管滴加,直到凹液面与刻度相切。
胶头滴管要垂直悬空。
称量好的氯化钠倾倒在烧杯中,量筒中的水要沿杯壁缓缓倒入烧杯中,固体药品要在烧杯中溶解为溶液,也就是第三步,溶解。
三、溶解溶解固体药品的时候应该用玻璃棒搅拌,以加快溶解的速度。
课堂练习及讲解课堂小结溶解后的液体转移到细口瓶中存放,并贴好标签,标签显示出溶液名称以及质量分数。
四、储液讲解结束后,每个同学亲手操作,巡视发现问题并及时纠正,鼓励学生在实验过程中对有疑惑的地方及时提问。
指导学生以小组合作的形式自主探究:用浓溶液配制一定质量分数的稀溶液。
学生自主探究以后,以视频的方式展示整个实验过程,便于学生发现自己实验中的错误及不足之处。
1.配制一定溶质质量分数的氯化钠溶液的一些操作步骤见下图,正确的操作顺序是:回答结束后强调瓶塞倒放的原因,提问如果不倒放会产生什么影响?2.请找出下图中的错误。
实验都会产生误差,那么实验中什么样的操作可能造成误差呢?引导学生通过质量分数的计算公式来分析什么操作能够产生误差,产生什么样的误差。
分析,总结,误差应该从溶质和溶剂的方面来分析。
总结这堂课的重难点以及学生应该掌握的知识要点。
到实验室去-配制一定溶质质量分数的溶液
学习目标:
1、与同学合作配制一定溶质质量分数的溶液。
2、初步学会配制一定溶质质量分数溶液的方法。
3、进一步规范药品的取用、称量、量取、溶解、搅拌等基本操作。
知识点(重点、难点):
重点:溶液的配制、操作的准确性和规范性。
难点:对配制溶液的溶质质量分数偏大或偏小的原因分析
实验准备:多媒体;托盘天平、烧杯、玻璃棒、药匙、量筒(10mL、100mL)、胶头滴管;氯化钠、蒸馏水。
学习过程:
【导入新课】
人注射青霉素时需要做皮试,若配稀可能检测不出是否过敏,
多媒体展示相机拍
学态称量前天平没有调平,且指针向右偏转。
溶解用的烧杯使用前不干燥。
品引起的误差有
质量分数为的溶液,你如何
在配制一定质量分数的氯化钠溶液时,下列出现的操作失误,会引起所配溶液的溶质质量分数降低的将配好的氯化钠溶液转移到细口瓶时,不慎撒出部分溶液
将称量的氯化钠和水倒入烧杯中,为加快氯化钠的溶解速率,常用的方法是
1、通过更加细致、具体方法的指导,使学生形成方法、内化为自己的能力。
2、建议进一步规范基本操作,把握好时间分配。
对配制溶液的溶质质量分数偏大或偏小的原因分析上合理引导。
1.学生动手能力较强,但有的实验小组氯化钠没有完全溶解就装瓶存放,表面上看是缺乏实验耐心,实际上是缺乏严谨的科学态度。