【VIP专享】2014届高考化学总复习 智能考点 归类总结(教材精讲+典型例题+跟踪训练):实验设计与评价
- 格式:pdf
- 大小:629.70 KB
- 文档页数:16

2014年新课标化学部分高考考点梳理二、基本概念、基本理论(一)物质的组成、性质和分类1.了解分子、原子、离子等概念的含义;了解原子团的定义。
分子:保持物质化学性质的一种微粒。
原子:化学变化中的最小微粒。
离子:带电的原子或原子团。
原子团:几个原子形成的集团。
理解:核裂变中、衰变中原子核发生了改变,所以不是化学变化。
原子团包括电中性的基(如羟基、甲基等)、根(碳酸根、铵根等)2.理解:混合物和纯净物、单质和化合物、金属和非金属的概念。
混合物:由多种成分组成的物质。
纯净物:只有一种成分的物质。
单质:只有一种元素组成的物质化合物:由两种或两种以上元素组成的物质金属:金属是一种具有光泽(即对可见光强烈反射)、富有延展性、容易导电、导热等性质的物质。
非金属:通常条件下为气体或没有金属特性的脆性固体或液体,如元素周期表右上部15种元素和氢元素,零族元素的单质。
3.理解酸、碱、盐、氧化物的概念及其相互联系。
酸:电离的阳离子全部是H+的化合物。
碱:电离的阴离子全部是OH-的化合物。
盐:由金属阳离子(包括铵根)和酸根阴离子形成的化合物。
氧化物:由氧元素和另一元素形成的化合物。
分为酸性氧化物(酸酐:如碳酸酐CO2)、碱性氧化物、两性氧化物、不成盐氧化物、复杂氧化物(Na2O2 KO2KO3等)。
联系:八圈图的理解。
如生成盐的反应有:酸碱中和,酸性氧化物与碱,碱性氧化物与酸,两性氧化物与酸碱反应,金属与酸,非金属与碱等。
注意:NaHSO4在水中也能电离出H+,但是NaHSO4不是酸,属于酸式盐。
Mg(OH)Cl属于碱式盐。
OF2为氟化物,而不是氧化物。
4.了解:浊液、溶液和胶体都是常见的分散系。
①了解溶液的含义,了解溶解度、饱和溶液的概念。
②了解浊液、胶体和溶液的区别。
常见的分散系分为溶液、浊液、胶体。
本质区别是分散质粒子的大小。
溶液:溶液中的溶质粒子小于1nm。
浊液:浊液中的粒子大于100nm。
胶体:介于1~100nm的分散系属于胶体。



考点 化学反应的方向及判据Ⅰ.课标要求能用焓变和熵变说明化学反应的方向。
Ⅱ.考纲要求暂未作要求Ⅲ.教材精讲1.本考点知识结构2.反应焓变与反应方向〔1〕多数能自发进行的化学反应是放热反应。
如氢氧化亚铁的水溶液在空气中被氧化为氢氧化铁的反应是自发的,其△H 〔298K 〕==-444.3kJ ·mol—1〔2〕部分吸热反应也能自发进行。
如NH 4HCO 3(s)+CH 3COOH(aq)==CH 3COONH 4(aq)+CO 2(g)+H 2O(l),其△H 〔298K 〕== +37.30kJ ·mol —1。
〔3〕有一些吸热反应在常温下不能自发进行,在较高温度下则能自发进行。
如碳酸钙的分解。
因此,反应焓变不是决定反应能否自发进行的唯一依据。
3.反应熵变与反应方向〔1〕熵:描述大量粒子混乱度的物理量,符号为S ,单位J ·mol —1·K —1,熵值越大,体系的混乱度越大。
〔2〕化学反应的熵变..〔△S 〕:反应产物的总熵与反应物总熵之差。
〔3〕反应熵变与反应方向的关系共同 影响化学反应的方向 反应焓变 反应熵变放热 吸热 熵增 熵减yx—、+—、— +、+ +、—Ⅰ Ⅱ ⅢⅣ①多数熵增加的反应在常温常压下均可自发进行。
产生气体的反应、气体物质的量增加的反应,熵变都是正值,为熵增加反应。
②有些熵增加的反应在常温下不能自发进行,但在较高温度下则可自发进行。
如碳酸钙的分解。
③个别熵减少的反应,在一定条件下也可自发进行。
如铝热反应的△S== —133.8 J ·mol—1·K —1,在点燃的条件下即可自发进行。
4.焓变和熵变对反应方向的共同影响——“四象限法”判断化学反应的方向。
在二维平面内建立坐标系,第Ⅰ象限的符号为“+、+”,第Ⅱ象限的符号为“+、—”,第Ⅲ象限的符号为“—、—”,第Ⅳ象限的符号为“—、+”。
借肋于数学坐标系四个象限的符号,联系焓变与熵变对反应方向的共同影响,可以从热力学的角度快速判断化学反应的方向。

2014高考化学复习:有关水的反应小结1.水在氧化还原反应中的作用(1)、水作氧化剂水与钠、其它碱金属、镁等金属反应生成氢气和相应碱:水与铁在高温下反应生成氢气和铁的氧化物(四氧化三铁):水与碳在高温下反应生成“水煤气”:铝与强碱溶液反应:(2)、水做还原剂水与F2的反应:(3)、水既做氧化剂又做还原剂水电解:(4)、水既不作氧化剂也不作还原剂水与氯气反应生成次氯酸和盐酸水与过氧化钠反应生成氢氧化钠和氧气水与二氧化氮反应生成硝酸和一氧化氮2.水参与的非氧化还原反应:(1)、水合、水化:水与二氧化硫、三氧化硫、二氧化碳、五氧化二磷等酸性氧化物化合成酸。
(能与二氧化硅化合吗?)水与氧化钠、氧化钙等碱性氧化物化合成碱。
(氧化铝、氧化铁等与水化合吗?)氨的水合、无水硫酸铜水合(变色,可检验液态有机物中是否含水)、浓硫酸吸水、工业酒精用生石灰吸水然后蒸馏以制无水酒精、乙烯水化成乙醇(2)、水解:卤代烃水解、乙酸乙酯水解、油脂水解(酸性水解或皂化反应)、水与碳化物——电石反应制乙炔、盐类的水解、氮化物水解、糖类的水解、氢化物——氢化钠水解3.名称中带“水”的物质(一)、与氢的同位素或氧的价态有关的“水”。
蒸馏水—H2O重水—D2O超重水—T2O双氧水—H2O2(二)、水溶液氨水—(含分子:NH3,H2O,NH3·H2O,含离子:NH4+,OH-,H+)氯水—(含分子:Cl2,H2O,HClO,含离子:H+,Cl-,ClO-,OH-)卤水—常指海水晒盐后的母液或粗盐潮解所得溶液,含NaCl、MgCl2、NaBr等王水—浓硝酸和浓盐酸的混合物(1∶3)生理盐水—0.9%的NaCl溶液(三)、其它水银—Hg水晶--SiO2水煤气—CO、H2的混合气、水玻璃—Na2SiO3溶液2014高考化学复习:生成氧气的反应小结(1)、氯酸钾热分解(二氧化锰催化)(2)、高锰酸钾热分解(3)、过氧化氢分解(二氧化锰催化)(4)、电解水(5)、氧化汞热分解(6)、浓硝酸分解(7)、次氯酸分解(光)(8)、氟与水置换反应(9)、过氧化钠与水反应(10)、过氧化钠与二氧化碳反应(11)、光合作用以上1~3适合实验室制取氧气,但一般所谓“实验室制取氧气”是指1、2两种方法。

高中化学重要知识点详细总结一、俗名无机部分:纯碱、苏打、天然碱、口碱:Na2CO3小苏打:NaHCO3大苏打:Na2S2O3石膏(生石膏):CaSO4.2H2O 熟石膏:2CaSO4·.H2O莹石:CaF2重晶石:BaSO4(无毒)碳铵:NH4HCO3 石灰石、大理石:CaCO3生石灰:CaO 熟石灰、消石灰:Ca(OH)2 芒硝:Na2SO4·7H2O (缓泻剂) 烧碱、火碱、苛性钠:NaOH 绿矾:FaSO4·7H2O 明矾:KAl (SO4)2·12H2O 漂白粉:Ca (ClO)2、CaCl2(混和物)泻盐:MgSO4·7H2O 胆矾、蓝矾:CuSO4·5H2O 皓矾:ZnSO4·7H2O 硅石、石英:SiO2水玻璃、泡花碱、矿物胶:Na2SiO3刚玉:Al2O3铁红、铁矿:Fe2O3磁铁矿:Fe3O4黄铁矿、硫铁矿:FeS2铜绿、孔雀石:Cu2(OH)2CO3菱铁矿:FeCO3波尔多液:Ca (OH)2和CuSO4赤铜矿:Cu2O 石硫合剂:Ca (OH)2和S 玻璃的主要成分:Na2SiO3、CaSiO3、SiO2过磷酸钙(主要成分):Ca (H2PO4)2和CaSO4重过磷酸钙(主要成分):Ca (H2PO4)2硫酸亚铁铵(淡蓝绿色):Fe (NH4)2 (SO4)2溶于水后呈淡绿色铝热剂:Al + Fe2O3或其它氧化物。
尿素:CO(NH2) 2天然气、沼气、坑气(主要成分):CH4水煤气:CO和H2光化学烟雾:NO2在光照下产生的一种有毒气体王水:浓HNO3与浓HCl按体积比1:3混合而成。
有机部分:氯仿:CHCl3电石:CaC2电石气:C2H2 (乙炔)TNT:三硝基甲苯酒精、乙醇:C2H5OH氟氯烃:是良好的制冷剂,有毒,但破坏O3层。
醋酸:冰醋酸、食醋 CH3COOH 裂解气成分(石油裂化):烯烃、烷烃、炔烃、H2S、CO2、CO等。
![2014年高考化学考点2[1]](https://img.taocdn.com/s1/m/6645890f3186bceb18e8bb5c.png)
2014年高考化学考点2[1] D93.电解质在水溶液中的电离及导电性94.弱电解质在水溶液中的电离平衡二.一元强酸(碱)和一元弱酸(碱)的比较95.一元强酸(碱)和一元弱酸(碱)的比较低频三.电离平衡常数的应用96.电离平衡常数的应用低频第二节水的电离和溶液的酸碱性一.水电离平衡的影响因素97.水的电离中频98.水的离子积常数二.溶液的pH计算和判断99.溶液的pH计算和判断低频三.中和滴定及其应用的探究100.中和滴定及其应用高频第三节盐类的水解一.盐类水解101.盐类水解的原理低频102.影响盐类水解程度的主要因素103.盐类水解的离子方程式书写二.盐类水解的应用104.盐类水解在生产、生活中的应用低频三.溶液中离子浓度大小105.溶液中离子浓度大小比较高频第三节难溶电解质的溶解平衡一.影响沉淀溶解平衡的因素106.难溶电解质的溶解平衡低频107.沉淀转化的实质二.K sp的应用与计算108.K sp的应用与计算高频第九章电化学基础第一节原电池化学电源一.原电池原理及电极反应式的书写109.原电池原理及电极反应式高频110.化学电源的工作原理及应用二.新型化学电源分析探究111.新型化学电源低频第二节电解池金属的腐蚀与防护一.电解规律及有关计算112.电解规律中频113.离子的放电顺序114.电解池的工作原理二.电解原理应用115.电解原理应用高频116.写出电极反应式和电池反应式三.金属腐蚀的快慢比较117.电化学腐蚀的原因、危害和防护中频第十章有机化合物第一节来自化石燃料中的化工原料-一.甲烷、乙烯、苯结构、性质及应用118.甲烷的结构、性质及在自然界的存在中频119.乙烯的结构和主要性质120.苯的结构特点及其主要性质二.同分异构体121.同分异构体低频三.常见有机物的反应类型比较122.常见有机物的反应类型比较低频第二节生活中的常见有机物一.乙醇、乙酸的化学性质123.乙醇的组成、主要性质和重要应用中频124.乙醇的组成、主要性质和重要应用二.基本营养物质125.糖类的组成、主要性质及重要应用高频126.油脂的组成、主要性质及重要应用127.蛋白质的组成、主要性质及重要应用第十一第一节开发利用金属矿物和海水资源一.金属的冶炼和铝热反应128.常见金属的活动性顺序低频129.金属的冶炼和铝热反应二.海水资源开发利用130.海水资源开发利用低频章化学与自然资源的开发利用第二节资源综合利用环境保护一.煤、石油和天然气的综合应用131.煤、石油和天然气的综合应用中频二.环境保护与绿色化学132.化学与社会、生活的关系中频133.化学与科学、技术的关系134.‘绿色化学’思想第十二章化学实验基础第一节化学实验的常用仪器和基本操作一.试纸的应用135.试纸的应用低频二.常见仪器的使用归纳及组装注意事项136.常见仪器的使用归纳及组装注意事项高频137.加热蒸发、冷却结晶、结晶、过滤、萃取分液、蒸馏(或分馏)、吸气、洗气、沉淀洗涤、气密性检验、溶解和稀释、仪器的洗涤、试剂的存放三.器材的创新使用138.器材的创新使用低频第二节物质的检验、鉴别一.常见物质检验的一般方法139.常见物质检验的一般方法高频二.物质的鉴定与鉴别140.物质的鉴定与鉴别低频第三节常见气体的实验室制备一.气体的实验室制备操作顺序与发生装置的选择141.气体的实验室制备操作顺序与发生装置的选择中频二.气体收集与气密性检验方法归类142.气体收集与气密性检验方法归类中频三.气体的净化与尾气处理装置143.气体的净化与尾气处理装置低频第四节化学实验的设计与评价一.化学实验方案的设计步骤和注意事项144.化学实验方案的设计步骤和注意事项低频二.化学实验方案的评价与改进145.化学实验方案的评价与改进中频三.实验数据的分析或处理146.实验数据的分析或处理中频选修3物质结构与性质第一节原子结构与性质一.核外电子排布的表示方法1.原子核外电子的能级分布中频2.能用电子排布式表示常见元素(1~36号)原子核外电子的排布3.原子核外电子的运动状态二.基态、激发态与电子跃迁4.原子核外电子在一定条件下会发生跃迁及其简单的应用低频三.电离能和电负性的含义及其应用5.用电离能和电负性说明元素的某些性质高频第二节分子的结构与性质一.共价键、等电子原理和配合物6.共价键的主要类型中频7.键能、键长、键角与简单分子的某些性质8.简单配合物的成键情况9.等电子原理二.分子的立体结构10.杂化轨道理论及常见杂化轨道类型(sp,sp2,sp3)中频11.价层电子对互斥理论或者杂化轨道理论推测常见的简单分子或者离子的空间结构12.由化合价推断化学式(或分子式)三.共价键、分子间作用力和分子的极性13.化学键与分子间作用力的区别中频14.氢键对物质性质的影响,能列举含氢键的物质15.分子的极性第三节晶体结构与性质一.晶胞结构及其基本计算16.晶胞结构及其基本计算低频二.四种晶体组成、性质比较17.分子晶体的结构微粒、微粒间作用力的区别高频18.离子晶体的结构微粒及其作用力19.金属晶体的结构微粒及其作用力20.原子晶体的特征21.金属键的含义22.能用金属理论解释金属的一些物理性质23.金刚石、二氧化硅等原子晶体的结构与性质的关系选修5有机化学基础第一节认识有机化合物一.有机化合物的命名和同分异构体24.有机化合物的命名和同分异构体高频二.有机物分子式和结构式的确定25.有机物分子式和结构式的确定高频第二节烃和卤代烃一.烷、烯、炔烃的结构与性质比较26.烷、烯、炔烃的结构与性质比较低频二.苯及苯的同系物结构与性质比较27.苯及苯的同系物结构与性质比较中频三.有机物的共面、共线判断28.有机物的共面、共线判断低频四.卤代烃水解和消去反应29.卤代烃水解和消去反应中频30.卤代烃的组成、结构和性质第三节醇和酚一.醇类催化氧化和消去反应规律31.醇类催化氧化和消去反应规律低频二.含有相同官能团的不同有机物间的性质比较32.含有相同官能团的不同有机物间的性质比较高频33.酚的典型代表物的组成、结构和性质第四节醛酸和酯一.有机化学反应类型34.有机化学反应类型高频二.醛基的检验35.醛基的检验中频三.酯化反应的类型36.酯化反应的类型中频四.重要有机物的转化关系37.卤代烃、醇、酚、醛、羧酸、酯的典型代表物的转化关系高频第五节基本营养物质有机合成一.基本营养物质比较38.基本营养物质比较高频二.高聚物与单体间的互推方法39.高聚物与单体间的互推方法低频三.有机合成的思路与方法40.有机合成的思路与方法高频。

智能考点氧化还原反应Ⅰ.课标要求1.掌握氧化剂和还原剂、氧化反应和还原反应等基本概念。
2.掌握重要的氧化剂、还原剂之间的常见反应。
3.综合运用化合价和电子转移的观点,判断氧化还原反应中电子转移的方向与数目,并能进行一些简单的计算。
4.运用化合价升降关系配平一些简单的氧化还原反应。
5.能够依据一些条件,判断物质氧化性、还原性的强弱。
Ⅱ.考纲要求了解氧化还原反应的本质是电子的转移。
了解常见的氧化还原反应。
Ⅲ.教材精讲一.化学反应的分类1.根据反应物和生成物类别以及反应前后物质种类的多少,可把化学反应分为:无机化学方面:化合反应、分解反应、置换反应、复分解反应。
有机化学方面:取代反应、加成反应、消去反应、聚合反应。
2.根据反应中物质是否得失电子,可把化学反应分为:氧化还原反应和非氧化还原反应。
3.依据是否有离子参加或生成,可把化学反应分为:离子反应和非离子反应二.氧化还原反应1.氧化还原反应:在反应中有元素化合价变化的化学反应叫做氧化还原反应。
2.特征:反应前后元素的化合价发生了变化(外在表现)。
3.本质:反应中有电子转移(内在实质)。
三.氧化还原反应的一些重要概念1.氧化反应与还原反应①氧化反应:反应物所含元素化合价升高(失去电子)的反应。
②还原反应:反应物所含元素化合价降低(得到电子)的反应。
2、氧化剂与还原剂①氧化剂:所含元素的化合价降低(得到电子)的反应物。
②还原剂:所含元素的化合价升高(失去电子)的反应物。
小结:四.中学阶段常见的氧化剂与还原剂小结1.氧化剂:①活泼的非金属单质:如F2、Cl2、Br2、I2、O2、O3 ;②元素处于高价态的化合物:KClO3、KMnO4、K2Cr2O7、HNO3、浓H2SO4;③高价态的金属阳离子:Fe3+、Ag+、Cu2+;④其它:HClO、漂白粉、MnO2、Na2O2、H2O2、NO2、银氨溶液、新制的Cu(OH)2。
2.还原剂:①金属单质:K、Ca、Na、Mg、Al、Fe、Zn等;②某些非金属单质:H2、C、Si等;③元素处于低价态的化合物:CO、SO2、HCl、HBr、HI、H2S、Na2SO3、FeSO4、Fe(OH)2五.氧化性还原性强弱的比较1.氧化性还原性与化合价的关系:元素处于最高价态时,只有氧化性;元素处于最低价态时,只有还原性;元素处于中间价态时,既有氧化性又有还原性。

(完整版)2014高考化学知识点考点总结:氧化还原反应编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((完整版)2014高考化学知识点考点总结:氧化还原反应)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(完整版)2014高考化学知识点考点总结:氧化还原反应的全部内容。
(完整版)2014高考化学知识点考点总结:氧化还原反应编辑整理:张嬗雒老师尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布到文库,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是我们任然希望 (完整版)2014高考化学知识点考点总结:氧化还原反应这篇文档能够给您的工作和学习带来便利。
同时我们也真诚的希望收到您的建议和反馈到下面的留言区,这将是我们进步的源泉,前进的动力.本文可编辑可修改,如果觉得对您有帮助请下载收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为 <(完整版)2014高考化学知识点考点总结:氧化还原反应> 这篇文档的全部内容.考点十氧化还原反应、氧化剂、还原剂、氧化产物、还原产物概念定义注意点氧化反应物质失去电子的反应物质失去电子的外部表现为化合价的升高还原反应物质得到电子的反应物质得到电子的外部表现为化合价的降低被氧化元素失去电子的过程元素失去电子的外部表现为化合价的升高被还原元素得到电子的过程元素得到电子的外部表现为化合价的降低氧化产物通过发生氧化反应所得的生成物氧化还原反应中,氧化产物、还原产物可以是同一种产物,也可以是不同产物,还可以是两种或两种以上的产物。
如反应4FeS2+11O2=2Fe2O3+8SO2中,Fe2O3和SO2均既为氧化产物,又为还原产物。
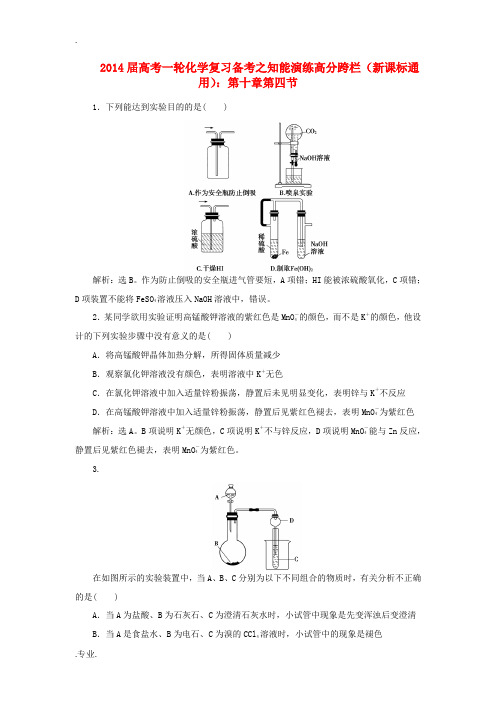
2014届高考一轮化学复习备考之知能演练高分跨栏(新课标通用):第十章第四节1.下列能达到实验目的的是( )解析:选B。
作为防止倒吸的安全瓶进气管要短,A项错;HI能被浓硫酸氧化,C项错;D项装置不能将FeSO4溶液压入NaOH溶液中,错误。
2.某同学欲用实验证明高锰酸钾溶液的紫红色是MnO-4的颜色,而不是K+的颜色,他设计的下列实验步骤中没有意义的是( )A.将高锰酸钾晶体加热分解,所得固体质量减少B.观察氯化钾溶液没有颜色,表明溶液中K+无色C.在氯化钾溶液中加入适量锌粉振荡,静置后未见明显变化,表明锌与K+不反应D.在高锰酸钾溶液中加入适量锌粉振荡,静置后见紫红色褪去,表明MnO-4为紫红色解析:选A。
B项说明K+无颜色,C项说明K+不与锌反应,D项说明MnO-4能与Zn反应,静置后见紫红色褪去,表明MnO-4为紫红色。
3.在如图所示的实验装置中,当A、B、C分别为以下不同组合的物质时,有关分析不正确的是( )A.当A为盐酸、B为石灰石、C为澄清石灰水时,小试管中现象是先变浑浊后变澄清B.当A是食盐水、B为电石、C为溴的CCl4溶液时,小试管中的现象是褪色C.若A为硫酸、B为Na2SO3、C为品红溶液,实验时当小试管中出现褪色现象时,向烧杯中加入沸水,试管中不会产生变化D.若A为浓氨水、B为氧化钙、C为AgNO3和乙醛的混合溶液,实验时当小试管中出现沉淀又恰好溶解时,向烧杯中加入热水,试管中生成光亮的银镜解析:选C。
A项制备的是CO2,通入澄清石灰水先变浑浊后变澄清,正确;B项制备的是C2H2,能使溴的CCl4溶液褪色,正确;C项小试管中品红溶液先褪色,加热后恢复红色,不正确;D项产生的氨气通入硝酸银溶液生成了银氨溶液,小试管中先出现沉淀后沉淀消失,烧杯中加入热水提供水浴加热条件,所以片刻后看到试管壁上生成光亮的银镜,正确。
4.(2011·高考广东卷)某同学通过系列实验探讨Mg及其化合物的性质,操作正确且能达到目的的是( )A.将水加入浓硫酸中得稀硫酸,置镁片于其中探讨Mg的活泼性B.将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成C.将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀D.将Mg(OH)2沉淀转入表面皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体解析:选B。
