中药药品质量标准及其起草说明共40页
- 格式:ppt
- 大小:2.45 MB
- 文档页数:40

《中国药典》中药质量标准起草说明编写细则国家药典委员会中药质量标准起草说明是说明标准起草过程中,制订各个项目的理由及规定各项指标和检测方法的依据;也是对该药品从历史考证,药材的原植(动、矿)物品种,生药形态鉴别,成方制剂的处方、制法,以及它们的理化鉴别,质量控制,临床应用,贮藏等全面资料的汇总。
一、编写原则:1、起草说明不属于药品法规,也不是药典的注释,而是制订各个项目的说明。
内容、文字,特别是名词、术语应力求与药典一致。
计量单位等统一按药典“凡例”中规定要求编写。
2、起草说明包括理论性解释和实践工作中的经验总结。
尤其是对中药的真伪鉴别及质量控制方面的经验和实验研究,即使不太成熟,但有实用意义的也可编写在内。
3、每一篇起草说明均应写明作者、审核人的单位、姓名、职称或职务、日期。
二、编写格式及要求(一)中药材1、来源(历史沿革)扼要说明始载于何种本草,历来本草的考证及历代本草记载中有无品种改变情况,目前使用和生产的药材品种情况,以及历版药典的收载、修订情况。
2、【名称】对正名选定的说明,历史名称、别名或国外药典收载名。
原植(动)物原植(动)物形态按常规描写。
突出重点,同属两种以上的可以前种为主描述,其他仅写主要区别点。
学名有变动的应说明依据。
生境野生或栽培(有无GAP基地)。
主产地主产的省、市、自治区名称,按产量大小次序排列。
地道药材产地明确的可写出县名。
采收时间采收时间与药材质量有密切关系的,采收时间应进行考察,并在起草说明中列入考察资料。
采收加工产地加工的方法,包括与主要主产地不同的方法或有关这方面的科研结果。
3、【性状】(1) 正文描述性状的药材标本来源及彩色照片。
(2)增修订性状的理由,由于栽培发生性状变异,应附详细的质量研究资料。
(3) 未列入正文的某些性状特点及原由。
(4)各药材标本间的差异,多品种来源药材的合写或分写的原由。
(5) 曾发现过的伪品,类似品与本品性状的区别点。
(6) 性状描述中其他需要说明的有关问题。


中药质量标准起草说明编写细则A中药质量标准起草说明是说明标准起草过程中,制订各个项目的理由及规定各项指标和检测方法的依据;也是对该药品从历史考证,药材的原植(动、矿)物品种,生药形态鉴别,成方制剂的处方、制法,以及它们的理化鉴别,质量控制,临床应用,贮藏等全面资料的汇总。
一、编写原则:1、起草说明不属于药品法规,也不是药典的注释,而是制订各个项目的说明。
内容、文字,特别是名词、术语应力求与药典一致。
计量单位等统一按药典“凡例”中规定要求编写。
2、起草说明包括理论性解释和实践工作中的经验总结。
尤其是对中药的真伪鉴别及质量控制方面的经验和实验研究,即使不太成熟,但有实用意义的也可编写在内。
3、每一篇起草说明均应写明作者、审核人的单位、姓名、职称或职务、日期。
二、编写格式及要求(一)中药材1、来源(历史沿革)扼要说明始载于何种本草,历来本草的考证及历代本草记载中有无品种改变情况,目前使用和生产的药材品种情况,以及历版药典的收载、修订情况。
2、【名称】对正名选定的说明,历史名称、别名或国外药典收载名。
原植(动)物原植(动)物形态按常规描写。
突出重点,同属两种以上的可以前种为主描述,其他仅写主要区别点。
学名有变动的应说明依据。
生境野生或栽培(有无GAP基地)。
主产地主产的省、市、自治区名称,按产量大小次序排列。
地道药材产地明确的可写出县名。
采收时间采收时间与药材质量有密切关系的,采收时间应进行考察,并在起草说明中列入考察资料。
采收加工产地加工的方法,包括与主要主产地不同的方法或有关这方面的科研结果。
3、【性状】(1) 正文描述性状的药材标本来源及彩色照片。
(2) 增修订性状的理由,由于栽培发生性状变异,应附详细的质量研究资料。
(3) 未列入正文的某些性状特点及原由。
(4) 各药材标本间的差异,多品种来源药材的合写或分写的原由。
(5) 曾发现过的伪品,类似品与本品性状的区别点。
(6) 性状描述中其他需要说明的有关问题。


附件2中药生产工艺及质量标准通用格式和撰写指南(征求意见稿)起草说明为配合《药品注册管理办法》(国家市场监督管理总局令,第27号)的贯彻实施,药审中心中药民族药药学部组织起草了中药生产工艺及质量标准通用格式和撰写指南。
现将有关情况说明如下:一、背景和目的药品生产工艺和质量标准作为药品注册证书的附件,在技术审评、现场核查、注册检验及上市后监管等工作中发挥积极作用。
为更好的指导申请人规范提交申报资料,根据新《药品管理法》和《药品注册管理办法》的相关要求,结合实际工作,药审中心在已发布的质量标准模板和《中药“生产现场检查用生产工艺的格式和撰写要求”》基础上,组织起草了《中药生产工艺及质量标准通用格式和撰写指南(征求意见稿)》。
二、主要内容本文件分为中药生产工艺通用格式和撰写指南、中药质量标准通用格式和撰写指南两部分。
(一)中药生产工艺通用格式和撰写指南该部分包括“处方”、“原辅料、制备过程中所用材料、直接接触药品的包装材料”、“制备工艺”、“主要设备”、“其他生产信息”和“附件”六个章节,各章节均明确了相应格式和撰写要求。
另外,开头需明确受理号、药品名称、上市许可持有人、生产企业等信息。
(二)中药质量标准通用格式和撰写指南该部分提供了中药质量标准通用格式,明确了中药质量标准撰写要求。
按照《中国药典》要求,中药质量标准一般包括【处方】【制法】【性状】【鉴别】【检查】【浸出物】(如适用)【特征图谱或指纹图谱】(如适用)【含量测定】【功能与主治】【用法与用量】【注意】(如适用)【规格】【贮藏】等项目。
中药质量标准撰写格式和体例应符合《中国药典》的相关规定。
三、情况说明本文件仅就中药生产工艺和质量标准的格式和内容的规范化撰写提供参考,具体品种应根据品种的实际情况和需要撰写。
相关研究可参照相关中药药学技术指导原则。
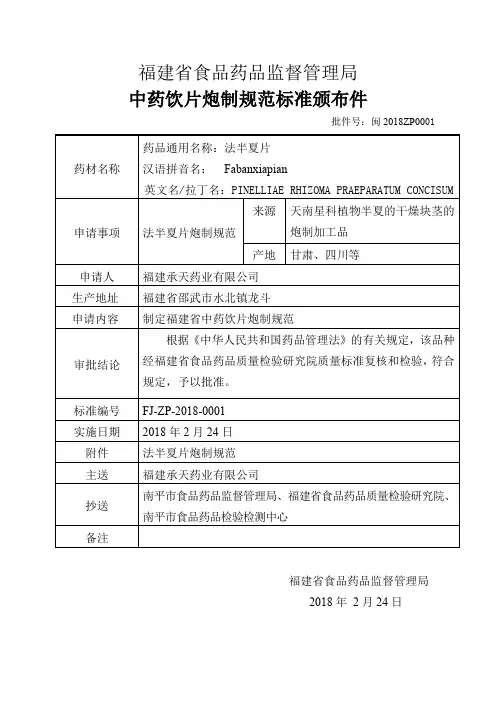
中药饮片炮制规范标准颁布件批件号:闽2018ZP0001福建省食品药品监督管理局2018年2月24日中药饮片炮制规范标准FJ-ZP-2018-0001法半夏片FabanxiapianPINELLIAE RHIZOMA PRAEPARATUM CONCISUM【来源】本品为天南星科植物半夏Pinellia ternata (Thunb.) Breit.的干燥块茎的炮制加工品。
【药材性状】本品呈类球形,有的稍偏斜,直径1〜1.5cm。
表面白色或浅黄色,顶端有凹陷的茎痕,周围密布麻点状根痕;下面钝圆,较光滑。
质坚实,断面洁白,富粉性。
气微,味辛辣、麻舌而刺喉。
【制法】取半夏,大小分开,用水浸泡至内无干心,取出;另取甘草适量,加水煎煮二次,合并煎液,倒入用适量水制成的石灰液中,搅匀,加入上述已浸透的半夏,浸泡,每日搅拌1~2次,并保持浸液pH值12以上,至剖面黄色均匀,口尝微有麻舌感时,取出,洗净,切厚片,阴干或烘干,即得。
每100kg净半夏,用甘草15kg、生石灰10kg。
【成品性状】本品呈椭圆形、类圆形或不规则的片,片厚2〜4mm。
表面淡黄白色、黄色或棕黄色,切面及折断面黄色或淡黄色。
质较松脆或硬脆。
气微,味淡略甘、微有麻舌感。
【鉴别】(1)本品粉末淡黄色至黄色。
淀粉粒甚多,单粒类圆形、半圆形或圆多角形,直径2~20µm,脐点裂缝状、人字状或星状;复粒由2~6分粒组成。
草酸钙针晶束存在于椭圆形黏液细胞中,或随处散在,针晶长20~144µm。
螺纹导管直径10~24µm。
(2)取本品粉末2g,加盐酸2ml,三氯甲烷20ml,加热回流1小时,放冷,滤过,滤液蒸干,残渣加无水乙醇0.5ml使溶解,作为供试品溶液。
另取半夏对照药材2g,同法制成对照药材溶液。
再取甘草次酸对照品,加无水乙醇制成每1ml含1mg的溶液,作为对照品溶液。
照薄层色谱法(《中国药典》2015年版四部通则0502)试验,吸取供试品溶液和对照药材溶液各5µl、对照品溶液2µl,分别点于同一硅胶GF254薄层板上,以石油醚(30~60℃)-乙酸乙酯-丙酮-甲酸(30:6:5:0.5)为展开剂,展开,取出,晾干,置紫外光灯(254nm)下检视。


新药质量标准起草说明制订新药质量标准,还应有一份起草说明。
起草说明是对所制订的质量标准进行解释,并有研究数据,例如该新药的研制工艺,讨论哪一些是属于应该控制的质量指标,哪一些可以不控制,检测方法的原理是什么,检测数据及综合比较等、起草说明在新药申报时,可供卫生行政部门审批时参考,在新药批准后,执行质量标准的过程中可以供查阅,解决一些质量问题,同时对今后修改质量标准也具有重要参考价值.起草说明可以从以下11个方面来写:1.背景材料介绍药品的研制过程,简略地说明实验室研究与临床试验的时间、机构及试验结论。
如果国外已有产品,则要介绍最早投放市场的厂家和时间,目前生产的厂家和采用的商品名称,在其他国家注册登记的情况,并要注意专利权。
对于制订或选用的中、外文名称的理由,应加以解释。
2.药品的制造方法简略说明合成路线、工艺、处方、原辅料的来源及质量要求。
化学合成药要着重说明结晶、精制、干燥等工序的细节。
需要技术保密的工艺、特殊的添加剂、辅料等,可以另外列出,只供有关审批部门审阅查考,并给予保密。
3.理化性质检测结果及讨论对于一类药,不管来自化学合成或从天然来源中提取,一般都应有专题报告证明其结构和理化指标,而且要用精制品测定。
对仿制品,则要有材料证明该物质与被仿制品有相同的理化常数,证明两者为同一物质应有图谱。
4. 鉴别应说明选用的鉴别反应的依据,最好能说明鉴别反应的原理。
5.检查杂质检查,应说明一般杂质检查的倩况,对可能存在的特殊杂质的检查结果,必要时要说明检出灵敏度.对确定的限度的理由要加以解释,经检查后对不必列入标准的杂质检查项目宜说明理由,尤其对国外药典列入的检查项目不订入标准中更要说明理由。
制剂的检查项目如固体制剂的崩解时限、溶出度、缓释和控释制剂的释放度考察数据,热原与安全性试验结果,选择剂量的参考资料、无菌试验的测定结果、微生物检查情况等,都应列出。
6.含量测定应说明测定的原理、测定方法的精密度、准确度,影响测定结果的因素。

汉桃叶的质量标准及起草说明姓名:汪岩学号:S2010210 专业:中药学汉桃叶质量标准【中文名】汉桃叶【汉语拼音】Hantaoye【拉丁名】Scheffera arboricola Hayata【来源】汉桃叶为五加科植物白花鹅掌柴(Scheffiera kwang siensis Merr.ex Li)的根或茎、叶,又名广西鹅掌柴,气微,味微苦涩,全年可采,切段晒干或烘干。
【产地】广西【性状】植株性状:常绿矮小灌木,略带蔓性。
全株无毛。
茎圆柱形,幼枝绿色至绿褐色,有细纵纹及明显环状叶痕。
老茎灰棕色,栓皮灰白色或呈脱落状。
1掌状复叶,小叶5~9片,叶柄长6~12cm,基部扩大抱茎;叶片纸质或咯革质,长圆形至披针形,长5~12cm,宽1.5~5 cm,最宽处在叶基上部1/3处;先端渐尖或少数或尾状渐尖,基部楔形,全缘,边缘向下表面略卷。
叶片上面深绿色,有光泽,下面略淡;网状叶脉向上,下表面稍凸出,侧脉叶柄长5~7对。
伞形花序顶生,圆锥状排列。
苞片卵形,长叶柄长8~l0mm。
花序具花叶柄长5~8朵,总花梗长叶柄长4~l0mm,小花梗长2~5mm。
花萼光滑或具稀疏毛,全缘。
花瓣5,白色或紫色,长1~2mm;雄蕊5,花丝长2~2.5 cm;子房下位,5室,花盘略凸起,柱头5,直立。
核果圆形至卵圆形,长约5mm,宽4~5mm,外具棱线。
花期2~3月,果期3~5月。
生于山坡、灌木丛。
药材性状:茎枝圆柱形,常斜切成厚片或段,长1~3cm,直径0.4~3cm。
外表灰白色至淡黄棕色,具纵皱纹及点状皮孔,有的可见半环状叶痕,栓皮常片状脱落。
质坚实而稍轻。
断面黄白色,皮部薄,木部宽广,致密坚实,放射状纹理明显,髓部质松,或成空洞。
叶多切碎,完整者为掌状复叶。
小叶柄长为掌状复叶,小叶披针形,革质。
先端渐尖,有光泽;,羽状网脉于两面明显凸出;小叶柄长1~3cm。
小叶片革质,完整者长圆形至披针形,长5~12cm,宽1.5~5 cm;先端渐尖,基部楔形,全缘并稍向下反卷。

第六章药品质量标准及其起草说明的制订一、制定质量标准的基础、原则和要求基础:全面、系统的质量研究以及数据的积累一般原则:1. 根据药物的特性,有针对性地确定检测项目。
一般应包括通用性的项目和针对性的项目。
2. 综合评价质量研究的结果和文献资料,抓住控制产品安全性和有效性的关键点,确保项目的全面性。
3. 注意质量标准和品种的一一对应关系,即注意质量标准的个性化。
项目的设置充分考虑具体品种的特点,不能简单的照搬照抄。
4. 在项目的设置上要注意互补性,避免求多求全,不必重复。
5. 注意原料药与制剂质量标准的关联性。
6. 要根据药物研发的不同阶段,以及对药物本质的认识程度,对项目进行调整。
分析方法选择的原则:分析方法应符合“准确、灵敏、简便、快速”的原则,所用的分析方法应经过方法学验证。
1. 常规检验尽量参照《中国药典》附录所收载的方法。
2. 选择方法要有针对性,应根据检测项目的要求选择方法。
3. 分析方法要具有通用性。
4. 分析方法应尽量简便、快速、经济。
限度确定的原则:在保证药品安全、有效的前提下,结合药品在生产、流通、使用中所必须达到的基本要求,确定限度。
1.根据安全性数据、临床研究的数据和人体的耐受性来确定。
2.适度考虑生产的可行性、质量的波动、药品的稳定性以及分析方法的误差来确定。
3. 注意规模化生产与进行安全性、有效性研究样品质量的一致性。
要求:1.格式应与中国药典正文一致,用词要规范,符号、术语应符合药典“凡例”的规定,方法应与中国药典附录有关的方法一致。
2.所用的试液、缓冲液、指示液和滴定液应尽可能与中国药典附录一致,不一致时,应在起草说明中加以说明。
3.试验中的取用量以及限度的规定,应根据选用方法的要求以及可能达到的精度。

附件:《中国药典》中药质量标准起草说明编写细则国家药典委员会中药质量标准起草说明是说明标准起草过程中,制订各个项目的理由及规定各项指标和检测方法的依据;也是对该药品从历史考证,药材的原植(动、矿)物品种,生药形态鉴别,成方制剂的处方、制法,以及它们的理化鉴别,质量控制,临床应用,贮藏等全面资料的汇总。
一、编写原则:1、起草说明不属于药品法规,也不是药典的注释,而是制订各个项目的说明。
内容、文字,特别是名词、术语应力求与药典一致。
计量单位等统一按药典“凡例”中规定要求编写。
2、起草说明包括理论性解释和实践工作中的经验总结。
尤其是对中药的真伪鉴别及质量控制方面的经验和实验研究,即使不太成熟,但有实用意义的也可编写在内。
3、每一篇起草说明均应写明作者、审核人的单位、姓名、职称或职务、日期。
二、编写格式及要求(一)中药材1、来源(历史沿革)扼要说明始载于何种本草,历来本草的考证及历代本草记载中有无品种改变情况,目前使用和生产的药材品种情况,以及历版药典的收载、修订情况。
2、【名称】对正名选定的说明,历史名称、别名或国外药典收载名。
原植(动)物原植(动)物形态按常规描写。
突出重点,同属两种以上的可以前种为主描述,其他仅写主要区别点。
学名有变动的应说明依据。
生境野生或栽培(有无GAP基地)。
主产地主产的省、市、自治区名称,按产量大小次序排列。
地道药材产地明确的可写出县名。
采收时间采收时间与药材质量有密切关系的,采收时间应进行考察,并在起草说明中列入考察资料。
采收加工产地加工的方法,包括与主要主产地不同的方法或有关这方面的科研结果。
3、【性状】(1) 正文描述性状的药材标本来源及彩色照片。
(2) 增修订性状的理由,由于栽培发生性状变异,应附详细的质量研究资料。
(3) 未列入正文的某些性状特点及原由。
(4) 各药材标本间的差异,多品种来源药材的合写或分写的原由。
(5) 曾发现过的伪品,类似品与本品性状的区别点。