简单氢氧燃料电池制备
- 格式:ppt
- 大小:659.50 KB
- 文档页数:6

燃料电池制作工艺流程
燃料电池的制作工艺流程一般包括以下几个步骤:
1. 准备阳极:将阳极材料(常用的是铂催化剂)涂敷在导电基材上,并加热进行焊接。
2. 准备阴极:将阴极材料(常用的是氧化镍催化剂)涂敷在导电基材上,并加热进行焊接。
3. 制备质子交换膜(PEM):将PEM材料切割成合适的尺寸,并进行激活处理以增加其质子导电性能。
4. 组装电池单元:将阳极、阴极和质子交换膜按照顺序叠放在一起,形成电池单元。
5. 制备电极板:将导电基材固定在电极板上,使得阳极和阴极与电子集流体相接触。
6. 组装燃料电池堆:将多个电池单元叠放在一起,并安装好电极板。
7. 与氢气供应系统连接:将燃料电池堆与氢气供应系统连接起来,使得氢气能够进入阳极。
8. 与氧气供应系统连接:将燃料电池堆与氧气供应系统连接起来,使得氧气能够进入阴极。
9. 安装冷却系统:为了控制燃料电池的温度,需要安装冷却系统来散热。
10. 进行性能测试和调整:进行燃料电池的性能测试,并对电流、电压等进行调整和优化。
以上是燃料电池制作的一般工艺流程,具体的工艺流程会因不同类型的燃料电池(如质子交换膜燃料电池、固体氧化物燃料电池等)而有所不同,还会受到具体工艺的变化而有所调整。

一、氢氧燃料电池氢氧燃料电池一般就是以惰性金属铂(Pt)或石墨做电极材料,负极通入H2,正极通入O2,总反应为:2H2 +O2 === 2H2O电极反应特别要注意电解质,有下列三种情况:1.电解质就是KOH溶液(碱性电解质)负极发生得反应为:H2 +2e- ===2H+,2H+ + 2OH—===2H2O,所以:负极得电极反应式为:H2–2e—+2OH—=== 2H2O;正极就是O2得到电子,即:O2+ 4e—===2O2-,O2—在碱性条件下不能单独存在,只能结合H2O生成OH—即:2O2- + 2H2O=== 4OH—,因此,正极得电极反应式为:O2 + H2O+ 4e- === 4OH—。
2。
电解质就是H2SO4溶液(酸性电解质)负极得电极反应式为:H2+2e—===2H+正极就是O2得到电子,即:O2 +4e- ===2O2—,O2—在酸性条件下不能单独存在,只能结合H+生成H2O即:O2—+2 H+=== H2O,因此正极得电极反应式为:O2 +4H++4e- === 2H2O(O2 +4e—=== 2O2—,2O 2- + 4H+=== 2H2O)3、电解质就是NaCl溶液(中性电解质)负极得电极反应式为:H2+2e-=== 2H+正极得电极反应式为:O2 +H2O+4e-===4OH-说明:1、碱性溶液反应物、生成物中均无H+2、酸性溶液反应物、生成物中均无OH—3、中性溶液反应物中无H+ 与OH—4、水溶液中不能出现O2-二、甲醇燃料电池甲醇燃料电池以铂为两极,用碱或酸作为电解质:1. 碱性电解质(KOH溶液为例)总反应式:2CH4O +3O2 +4KOH=== 2K2CO3 +6H2O正极得电极反应式为:3O2+12e-+ 6H20===12OH-负极得电极反应式为:CH4O-6e-+8OH- ===CO32—+ 6H2O2、酸性电解质(H2SO4溶液为例)总反应: 2CH4O +3O2===2CO2 + 4H2O正极得电极反应式为:3O2+12e—+12H+===6H2O负极得电极反应式为:2CH4O-12e-+2H2O ===12H++ 2CO2说明:乙醇燃料电池与甲醇燃料电池原理基本相同三、甲烷燃料电池甲烷燃料电池以多孔镍板为两极,电解质溶液为KOH,生成得CO2还要与KOH反应生成K 2CO3,所以总反应为:CH4 + 2KOH+ 2O2=== K2CO3 + 3H2O。

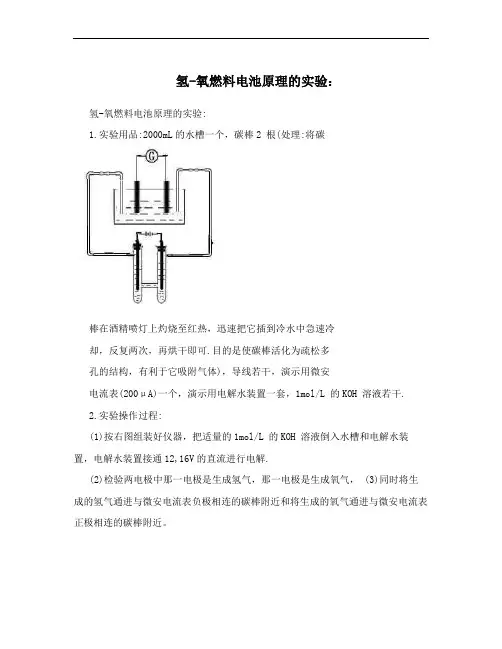
氢-氧燃料电池原理的实验:氢-氧燃料电池原理的实验:1.实验用品:2000mL的水槽一个,碳棒2 根(处理:将碳棒在酒精喷灯上灼烧至红热,迅速把它插到冷水中急速冷却,反复两次,再烘干即可.目的是使碳棒活化为疏松多孔的结构,有利于它吸附气体),导线若干,演示用微安电流表(200μA)一个,演示用电解水装置一套,1mol/L 的KOH 溶液若干.2.实验操作过程:(1)按右图组装好仪器,把适量的1mol/L 的KOH 溶液倒入水槽和电解水装置,电解水装置接通12,16V的直流进行电解.(2)检验两电极中那一电极是生成氢气,那一电极是生成氧气, (3)同时将生成的氢气通进与微安电流表负极相连的碳棒附近和将生成的氧气通进与微安电流表正极相连的碳棒附近。
3(工作原理:电解水时生成的氢气和氧气通入碳棒,有部分吸附在碳棒上,当接上微安电流表形成回路后,电流表指针偏转,说明有电流通过,此装置变身为化学电源了,即氢、氧燃料电池。
原来吸附了氧气的电极作为正极,发生的反应,,,,为O+4e+ 2HO=4OH;吸附了氢气的电极作为负极,发生的反应为H-2e+2OH222==2HO;总反应为:2H + O== 2HO. 22224(构成的条件:燃料电池主要由正极(又称氧化剂电极)、负极(又称燃料电极)和电解质组成。
与其他电池不同,燃料电池的正、负电极本身不包含活性物质,只是催化和集流的转换元件(一般采用具有催化活性的导体做载体,载体吸附气体反应物在其多孔的表面上发生电极反应),也是发生电化学反应的场所。
燃料电池的正、负极活性物质(即氧化剂和燃料)是由外部源源不断地输入到电池的正、负电极上,进行电催化反应,产生电能。
电极接触电解质溶液的层面完全被电解液浸透,接触气体的层面则被气体所充满,在电极内部形成气体、液体、固体电极之间的三相界面,正是在这一界面附近进行着电化学反应。
实验优点:(1)用简单、直观的方法说明了原电池、燃料电池放电的反应原理,学生很清楚地了解到燃料电池不是可燃物燃烧后产电。

简易氢氧燃料电池的制作10111550142 尚云龙一、实验原理水电解时,为了增加其导电能力,加入电解液,如硫酸钠等作为电解液(硫酸、氢氧化钠、硝酸钾等均可),电解时两极发生如下反应:阳极:2H2O →O2↑+4H++4e阴极:4H2O+4e →2H2↑+4OH-总反应:2H2O→2H2↑+O2↑在两极吸附满气体后,拆去外电源,使燃料电池放电,两极发生如下反应:正极:O2+4H++4e →2H2O负极:2H2+4OH-→4H2O+4e总反应:2H2+O2→2H2O二、实验用品仪器:学生电源及导线,发光二极管,烧杯,碳棒2根,煤气灯,固定装置,坩埚钳,石棉网试剂:硫酸钠溶液三、实验步骤1、将石墨碳棒放到酒精喷灯上加热至红热,立即放入装冷自来水的烧杯中,反复3~4次,即形成多孔碳棒。
2、如图装好实验装置,加入硫酸钠为电解液,两碳棒分别接通电源的正、负极,调节电压约5V,电解约1~2min。
3、关闭电源,马上拔下导线与电源相接的一端,将这端与发光二极管相接(注意正负极),二极管即被点亮。
4、记录灯亮时间。
四、实验现象电解后,阴极和阳极周围迅速有气泡产生。
且阴极上的气泡明显比阳极的要多。
(阴极H2,阳极O2,理论体积比2:1)关闭电源后将导线连接到发光二极管,长腿接原来的阳极(红线),短的接阴极(黑线)。
可以看到发光二极管发光,颜色是淡黄绿色的。
灯颜色逐渐变暗,连续发光90s。
五、实验相关讨论电解水的可逆理论电压大约为1.23v,理论上水的分解电压与溶液的pH无关。
但由于过电势、欧姆压降等因素,导致分解电压各不相同,但一般来讲,过电势就2v左右,欧姆压降一般在1v以内,所以实际电压控制在4v。


氢氧燃料电池生产工艺流程氢氧燃料电池是一种透过水和氢气或是其他含氢原料来产生电力的设备。
相较于传统燃料电池,氢氧燃料电池无需热能的参与,因此较为高效且环保。
本文将详细介绍氢氧燃料电池产业生产工艺的流程。
一、前期准备:1. 原料准备:燃料电池生产的主要原料包括氢气、氢气能源贮藏材料、金属膜、电解质、活性材料以及导电材料等,在生产前需要储备充足。
2. 设备准备:需要准备生产燃料电池所需的化学设备、给水设备、电解质设备、测试设备等以及工作场所。
3. 技术人员准备:需要拥有一定的电化学、物理学及材料学知识的技术人员加入生产队伍。
二、制备氢气:1. 氢气制备:燃料电池生产的基础原料之一就是氢气,目前氢气的最常见源是通过水电解得到。
2. 氢气精制:制备出的氢气需要经过精制,包括去除掉杂质、油脂、水份等,确保氢气纯度超过95%。
三、配制电解质:1. 电解质配制:电解质是电池系统中的关键部分,为提高电池效率以及持久性,电解质的选取及调配必须得以保障。
2. 储存电解质:生产前需对电解质进行密闭确保维持纯净,同时需保证电解质储存环境的温度与湿度恰当。
四、预制电池芯片:1. 切割膜材:燃料电池中重要的组成成份为活性材料膜和金属膜,钢化膜需要先进行精细切割好相应的形状。
2. 金属化膜:将准备好的膜材表面铺上很小的金属粉末,使膜在电解质中金属化,以增大电极表面积。
3. 组装电极:将铺好金属粉末的膜和活性材料膜在电解质中组装,形成具有一定结构的电极。
五、预制电堆单元:1. 压制电池芯片:将制好的电极进行压制,使它们与电极压力适当并拼凑在一起。
2. 成型及堆叠:将组装好的电极层和电解质层进行成型和堆叠,制作成电堆的基本单元。
六、燃料电池堆组成:1. 装配电堆:将已制作成电堆的基本单元组装起来,形成燃料电池堆,这是最后的成型阶段。
2. 更换材料:由于材料的被腐蚀和电堆反应的需求,燃料电池堆需要定期的检修及更换其部件。
以上是氢氧燃料电池生产工艺流程的主要步骤,下面对各个环节做进一步的介绍。

实验活动14 制作简单的燃料电池实验目的1.理解燃料电池的工作原理。
2.设计和制作一个氢氧燃料电池。
实验用品U形管、石墨棒(石墨棒使用前应该经过烘干活化处理)、3~6 V的直流电源、鳄鱼夹、导线和开关、电流表(或发光二极管、音乐盒等)。
1 mol·L-1 Na2SO4溶液、酚酞溶液。
实验步骤1.电解水。
在U形管中注入1 mol·L-1 Na2SO4溶液,然后向其中滴入1~2滴酚酞溶液。
在U形管的两边分别插入一根石墨棒,并用鳄鱼夹、导线连接电源。
闭合K1,接通直流电源开始电解,现象为:两极石墨棒均产生气泡,右侧石墨棒附近溶液变红。
2.制作一个氢氧燃料电池。
当上述电解过程进行1~2 min后,打开K1,断开直流电源。
将两根石墨棒用导线分别与电流表(或发光二极管、音乐盒等)相连,闭合K2,现象为:电流表指针发生偏转。
问题和讨论列表比较氢氧燃料电池的工作原理和电解水的原理。
-4e-===4H+阳极:2H O-4e-===O↑+4H+一种微生物燃料电池如图所示,下列关于该电池说法正确的是( )A .a 电极为正极,发生还原反应B .H +由右室通过质子交换膜进入左室C .该电池的工作温度页可以是高温D .b 电极反应式为:3222NO 10e 12H N 6H O --+++=↑+ 【答案】D【分析】b 极上NO 3-→N 2、N 元素的化合价降低,发生还原反应,则b 是正极,电极反应式为2NO 3-+10e −+12H +═N 2↑+6H 2O ;a 电极是负极,负极上葡萄糖发生失电子的氧化反应生成CO 2,原电池工作时,阳离子移向正极,阴离子移向负极;【详解】A .由上述分析可知,b 电极是正极,a 电极是负极,故A 错误;B .原电池工作时,阳离子移向正极,即H +由左室通过质子交换膜进入右室,故B 错误; C .该电池是微生物燃料电池,高温能使蛋白质变性,所以该电池不能在高温下工作,故C 错误;D .b 电极是正极,b 上NO 3-→N 2,则正极反应式为2NO 3-+10e −+12H +═N 2↑+6H 2O ,故D 正确;故选D 。

高中化学氢氧燃料电池教案教学目标:
1. 了解氢氧燃料电池的工作原理;
2. 理解氢氧燃料电池的应用领域;
3. 掌握氢氧燃料电池的制备方法;
4. 能够分析氢氧燃料电池的优缺点。
教学重点:
1. 氢氧燃料电池的原理和应用;
2. 氢氧燃料电池的制备方法。
教学难点:
1. 氢氧燃料电池的工作原理;
2. 氢氧燃料电池的优缺点分析。
教学准备:
1. 实验室器材:氢氧燃料电池组件、电压表、导线等;
2. 实验材料:氢氧燃料电池的电解质溶液、氢氧燃料等;
3. PPT教学课件。
教学过程:
一、导入(5分钟)
1. 介绍氢氧燃料电池的背景和重要性;
2. 提出教学目标和重点。
二、理论讲解(15分钟)
1. 讲解氢氧燃料电池的工作原理和结构特点;
2. 分析氢氧燃料电池的应用领域;
3. 探讨氢氧燃料电池的优缺点。
三、实验操作(30分钟)
1. 制备氢氧燃料电池实验组件;
2. 进行氢氧燃料电池的实验操作;
3. 测量观察氢氧燃料电池的电压输出。
四、讨论与总结(10分钟)
1. 分析实验结果,讨论氢氧燃料电池的性能特点;
2. 总结氢氧燃料电池的优缺点;
3. 提出个人见解和意见。
五、作业布置(5分钟)
1. 通过课外资料了解氢氧燃料电池在各领域的应用;
2. 撰写一份关于氢氧燃料电池的实验报告。
教学结束。
*备注:在教学中要引导学生积极思考问题,提高实验操作能力和实验数据处理能力,加强理论与实践结合,使学生能够全面地了解和掌握氢氧燃料电池的知识。

自制简易氢氧燃料电池作者:宋文国来源:《化学教与学》2013年第08期文章编号:1008-0546(2013)08-0097-01 中图分类号:G633.8 文献标识码:Bdoi:10.3969/j.issn.1008-0546.2013.08.038氢氧燃料电池是一种将氢气和氧气反应的化学能通过电极反应直接转换成电能的装置。
这种装置的最大特点是反应过程中不涉及到燃烧,可以在低温下进行,能量转换效率高,可达60%~80%,实际使用效率则是普通内燃机的2~3倍。
另外,它还具有噪音低、对环境污染小、可靠性及维护性好等优点,因此燃料电池的研究受到各国的重视。
由于燃料电池在电极制作和燃料的储存、携带方面技术要求很高,目前尚未得到普及。
中学化学教科书的大部分版本中关于燃料电池的介绍仅限于文字和示意图,这使得学生对燃料电池的构造和原理缺乏感性认识,从而产生一种神秘感。
而氢氧燃料电池又是高中化学的重要内容,高考中也经常考到氢氧燃料电池,学生对新型的燃料电池也很感兴趣,鉴于此笔者设计了一个氢氧燃料电池的简易装置,仪器要求极其简单,实验效果很好,可供中学化学教学演示使用。
一、实验装置实验装置如图所示:二、装置制作方法1.石墨电极的制作:把从旧电池中取来的石墨棒洗净,在酒精喷灯上加热除去杂物,并淬火多次,即形成多空石墨电极。
2.在石墨电极上焊接上铜导线,然后用热熔胶或石蜡固定密封到玻璃管一端,如右图所示。
3.把两根含电极的玻璃管和第3只玻璃管按右图插入三孔胶塞中,并按右图连接好装置。
图中电源可以用6V-12V电池,也可以用学生直流电源;检验氢氧燃料电池电流可以用电流表、音乐贺卡、玩具小风扇、石英钟等。
(有条件的可以吹制成玻璃的,使用更方便)三、使用方法1.向广口瓶中注入30%的KOH溶液至如图所示的位置,然后用胶塞塞住空玻璃管口,将广口瓶倒立过来使含有电极的玻璃管充满溶液,然后再把广口瓶正立过来,并拿掉空玻璃管的胶塞。

氢氧燃料电池工作原理方程式哎哟,说起这个氢氧燃料电池工作原理方程式,那可真是个高科技的玩意儿。
不过,别看它名字高大上,说穿了其实也就是一个能量转换的小机器。
那天我在实验室闲得蛋疼,就和旁边的同事老张闲聊起来。
老张是个化学博士,谈起这个原理来头头是道。
我就问他:“哎,老张,这氢氧燃料电池的工作原理方程式到底是啥呀?”老张笑了笑,说:“嘿,简单,我来给你解释解释。
”老张说,氢氧燃料电池的工作原理,其实就是一个化学反应过程。
首先,氢气和氧气在电池的正负极上分别发生氧化和还原反应。
这个过程,可以用一个化学方程式来表示,就是:2H₂ + O₂→ 2H₂O哎呀,瞧我这笨嘴拙舌的,解释个方程式都说不明白。
简单点说,就是两个氢分子和一个氧分子,在电池里头进行反应,生成了两个水分子。
这个过程,其实就是把化学能转换成电能。
然后,老张又告诉我,这个反应过程中,氢气在负极上失去电子,变成正离子,通过电解质板跑到正极。
而在正极上,氧气得到电子,变成负离子。
这个过程,就像是一个小小的能量工厂,不断地把化学能转换成电能。
听到这儿,我有点纳闷,问老张:“那这玩意儿有啥好处呢?”老张哈哈一笑,说:“好处多了去了,这氢氧燃料电池的燃料来源广泛,而且产物只有水,无污染,环保又高效。
将来啊,这东西在交通工具、发电等领域都有大用途。
”听着老张的话,我脑海中浮现出一幅美好的画面:大街上,一辆辆氢燃料电池汽车行驶在蓝天白云下,排放的只有水蒸气,多么美好啊!哎,说到底,这氢氧燃料电池工作原理方程式,其实就是一个能源转换的神奇过程。
它让我们看到了,人类对清洁能源的追求,其实从未停歇。
而在这个过程中,我们也在不断探索,创造出一个更加美好的未来。
氢氧燃料的工艺流程英文回答:Hydrogen and Oxygen Fuel Production Process.The production of hydrogen and oxygen fuels involves several key stages, including:Feedstock Preparation:Hydrogen is typically produced from natural gas, coal, or renewable sources such as water electrolysis.Oxygen is obtained from the cryogenic distillation of air.Gasification:Natural gas or coal is converted into synthesis gas (syngas) through gasification, which involves reacting thefeedstock with oxygen and/or steam.Water-Gas Shift Reaction:Syngas is converted into hydrogen-rich gas by shifting the equilibrium of the water-gas shift reaction:CO + H2O <=> CO2 + H2。
Purification:The hydrogen-rich gas is purified to remove impurities such as carbon dioxide, methane, and sulfur compounds.Oxygen Separation:Air is liquefied and distilled to separate oxygen from nitrogen.Electrolysis:Alternatively, hydrogen and oxygen can be producedthrough water electrolysis, which uses electricity to split water into hydrogen and oxygen.Steam Reforming:Methane (CH4) from natural gas is reacted with steamin a steam reformer to produce hydrogen and carbon dioxide:CH4 + H2O <=> CO + 3H2。
一、氢氧燃料电池氢氧燃料电池一般是以惰性金属铂(Pt)或石墨做电极材料,负极通入H2,正极通入O2,总反应为:2H2 + O2 === 2H2O电极反应特别要注意电解质,有下列三种情况:1.电解质是KOH溶液(碱性电解质)负极发生的反应为:H2 + 2e- === 2H+ ,2H+ + 2OH- === 2H2O,所以:负极的电极反应式为:H2 –2e- + 2OH- === 2H2O;正极是O2得到电子,即:O2 + 4e- === 2O2- ,O2- 在碱性条件下不能单独存在,只能结合H 2O生成OH-即:2O2- + 2H2O === 4OH- ,因此,正极的电极反应式为:O2 + H2O + 4e- === 4OH- 。
2.电解质是H2SO4溶液(酸性电解质)负极的电极反应式为:H2 +2e- === 2H+正极是O2得到电子,即:O2 + 4e- === 2O2- ,O2- 在酸性条件下不能单独存在,只能结合H +生成H2O即:O2- + 2 H+ === H2O,因此正极的电极反应式为:O2 + 4H+ + 4e- === 2H2O(O2 + 4e- === 2O2- ,2O2- + 4H+ === 2H2O)3. 电解质是NaCl溶液(中性电解质)负极的电极反应式为:H2 +2e- === 2H+正极的电极反应式为:O2 + H2O + 4e- === 4OH-说明:1.碱性溶液反应物、生成物中均无H+2.酸性溶液反应物、生成物中均无OH-3.中性溶液反应物中无H+ 和OH-4.水溶液中不能出现O2-二、甲醇燃料电池甲醇燃料电池以铂为两极,用碱或酸作为电解质:1.碱性电解质(KOH溶液为例)总反应式:2CH4O + 3O2 +4KOH=== 2K2CO3 + 6H2O正极的电极反应式为:3O2+12e- + 6H20===12OH-负极的电极反应式为:CH4O -6e-+8OH- === CO32-+ 6H2O2. 酸性电解质(H2SO4溶液为例)总反应: 2CH4O + 3O2 === 2CO2 + 4H2O正极的电极反应式为:3O2+12e-+12H+ === 6H2O负极的电极反应式为:2CH4O-12e-+2H2O === 12H++ 2CO2说明:乙醇燃料电池与甲醇燃料电池原理基本相同三、甲烷燃料电池甲烷燃料电池以多孔镍板为两极,电解质溶液为KOH,生成的CO2还要与KOH反应生成K2CO3,所以总反应为:CH4 + 2KOH+ 2O2 === K2CO3 + 3H2O。
化学教学论实验报告——氢氧燃料电池的制作化学系2011级化学2班罗晗 10111550218一、实验方程式、装置:1、电解水时,选用1mol/L硫酸钠溶液作为电解质溶液,两极发生如下反应:阳极:2H2O =O2+4H++4e-阴极:4H2O +4e- =2H2+4OH-2、两极吸附满气体后,拆去外电源,使燃料电池放电,两极发生如下反应:正极:O2+4H++4e- =2H2O负极:2H2+4OH-=4H2O +4e-3、实验装置:二、实验注意事项:1、在实验过程中,燃料电池具有正负极,应当正确判断其正负极,防止二极管的电极接反,最终导致其不能发光。
发光二极管灯脚有正、负极之分,长脚为正极,短脚为负极。
如不能识别,可直接用燃料电池接试,如不发光,说明接反了,交换一下电极即可。
2、由于普通碳棒表面较为光滑,所以在电解过程中难以吸附较多的氢气和氧气,导致发光二极管发光时间较短,实验效果不明显,所以要把普通炭棒置于高温火焰上灼烧到发红,立即投入冷水中使其表面变得粗糙多孔,使其在电解水时可吸附较多的氢、氧气体。
三、实验思考:1、电解质溶液的种类对最终发光二极管的发光时间有何影响?答:经过查阅资料得知,电解质溶液的种类对最终发光二极管的发光时间具有较大影响,设计实验分析其影响大小,实验结果如下表:由此可知,电解质溶液的种类对二极管发光时间具有较大影响,因为不同种溶液电离出的离子种类不同,其最终产生的离子数目也不同,从而导致其导电能力不同,最终的二极管发光时间也就不同了。
如上面实验可以看出,硫酸与氢氧化钠的导电能力相似,其电解出的离子数目相近;而硫酸钠电离出的离子出较多,导电能力较强。
2、为何要将碳棒进行淬火?是否淬火次数越多越好?答:由于普通碳棒表面较为光滑,所以在电解过程中难以吸附较多的氢气和氧气,即最终成为燃料电池所能储存的电能较少,最终的发光二极管发光时间较短,实验效果不明显。
而把普通炭棒置于高温火焰上灼烧到发红,立即投入冷水中使其表面变得粗糙多孔,则会使其在电解水时可吸附较多的氢、氧气体,最终储存的电能较多,发光二极管的发光时间也较长。
氢氧燃料电池的制作燃料电池是一类新型化学电池。
氢气、氧气、甲烷等都可以成为它的原料。
它具有能量转化率高、无污染、节约金属资源等优点,具有巨大的应用价值。
但是,由于这类电池必须用特殊的催化剂,而该类催化剂现在制造困难,价格昂贵,所以,这类电池还不能普及,仅能应用于人造卫星、太空站等高科技领域。
我们运用已学过的原电池、电解池知识,在学校科技活动中,我创新制作了可用于演示的氢氧燃料电池,效果很好.现介绍如下:一.用具和原料U型管,石墨碳棒,分液漏斗,酒精喷灯,低压直流电源,30%的氢氧化钠溶液(或30%的稀硫酸),橡皮塞(双孔),导线等。
二.制作原理用多孔碳棒作燃料电池的正、负极,30%的氢氧化钠溶液作电解质溶液。
负极吸附氢气,正极吸附氧气。
氢氧燃料电池工作时,负极上的氢放出电子,发生氧化反应,正极上的氧得到电子,发生还原反应:负极2H2+4OH-_4e=4H2O正极O2+2H2O+4e=4OH-总反应2H2 + O2= 2H2O三.制作过程1.多孔碳棒的加工将石墨碳棒放在酒精灯喷灯上加热除去其中的胶质,并淬火3---4次,即形成多孔碳棒,也就是多孔碳电极。
2.把多孔碳电极、U型管、分液漏斗、橡皮塞(双孔)按图所示组装;再通过分液漏斗向U型管中注满氢氧化钠溶液,密闭。
3.氢气、氧气的制备调节低压直流电源的电压到6伏,并把其正、负极分别与图装置中的两个碳棒电极相连接;接通电源,电解氢氧化钠溶液制取氢气、氧气,且制得的氢气与氧气的体积比为2:1.去掉电源,上图所示装置就成为一只氢氧燃料电池。
四.氢氧燃料电池的工作氢氧燃料电池的正、负极分别与灵敏电流计的正、负极连接,可以看到电流计指针偏转。
如果把两个氢氧燃料电池并联,再与发光二极管串联,二极管发光。
经实验测定,一只氢氧燃料电池可提供0.1安以上的电流,1.5伏以上的外电压。
果类催熟剂的实验室配制果类植物在开花前新陈代谢非常旺盛,在该时期提高氧气的浓度,对促进果实早熟、提高水果的营养成分和质量具有重要作用。
一、氢氧燃料电池氢氧燃料电池一般是以惰性金属铂(Pt)或石墨做电极材料,负极通入H2,正极通入O2,总反应为:2H2 + O2 === 2H2O电极反应特别要注意电解质,有下列三种情况:1.电解质是KOH溶液(碱性电解质)负极发生的反应为:H2 + 2e—=== 2H+ ,2H+ + 2OH- === 2H2O,所以:负极的电极反应式为:H2 –2e- + 2OH- === 2H2O;正极是O2得到电子,即:O2 + 4e- === 2O2- ,O2- 在碱性条件下不能单独存在,只能结合H2O生成OH—即:2O2—+ 2H2O === 4OH- ,因此,正极的电极反应式为:O2 + H2O + 4e- === 4OH—。
2.电解质是H2SO4溶液(酸性电解质)负极的电极反应式为:H2 +2e—=== 2H+正极是O2得到电子,即:O2 + 4e—=== 2O2—,O2- 在酸性条件下不能单独存在,只能结合H+生成H2O即:O2- + 2 H+ === H2O,因此正极的电极反应式为:O2 + 4H+ + 4e- === 2H2O(O2 + 4e- === 2O2- ,2O2—+ 4 H+ === 2H2O)3. 电解质是NaCl溶液(中性电解质)负极的电极反应式为:H2 +2e—=== 2H+正极的电极反应式为:O2 + H2O + 4e- === 4OH—说明:1.碱性溶液反应物、生成物中均无H+2.酸性溶液反应物、生成物中均无OH—3。
中性溶液反应物中无H+ 和OH-4.水溶液中不能出现O2—二、甲醇燃料电池甲醇燃料电池以铂为两极,用碱或酸作为电解质:1.碱性电解质(KOH溶液为例)总反应式:2CH4O + 3O2 +4KOH=== 2K2CO3 + 6H2O正极的电极反应式为:3O2+12e- + 6H20===12OH-负极的电极反应式为:CH4O —6e-+8OH- === CO32—+ 6H2O2。