制碱工业
- 格式:ppt
- 大小:554.00 KB
- 文档页数:17


制碱工业发展史一、古代制碱工业古代制碱工业可以追溯到5000多年前,早在公元前3500年,古巴比伦和苏美尔人就已掌握了制碱的技术。
其后,古埃及人也开始制碱的生产。
他们利用尼罗河的沉淀物和碳酸钠制取碱,这种碱在制皂和玻璃等行业中得到广泛应用。
古代中国也有制碱的传统,早在春秋战国时期,中国已经开始用木灰和石灰等物质制取碱。
古代希腊罗马时期,碳酸钠已经成为一种重要的商品,使用范围涵盖了许多领域,包括皂类、玻璃类、冶金工业等。
在制碱生产方面,古代人凭借其丰富的实践经验,探索出了一些简单的工艺方法。
这些方法虽然没有现代化工生产技术那么复杂,但通过长期实践和总结,实现了古代社会对碱的需求。
二、近代制碱工业的兴起16世纪后,伴随着工业革命的兴起和科学研究的发展,制碱工业进入了一个新的发展阶段。
这一时期,以法国为代表的欧洲国家开始了制碱工业的兴起。
法国科学家Leblanc于1791年成功发明了蒸馏盐法,这一方法将盐从海水中提取出来,并通过一系列的反应制取出了碳酸钠。
这种方法成为了当时最主要的碱生产工艺。
很快,英国、德国、美国也开始效仿法国的方法大规模生产碱。
在19世纪初期,随着化学工业的发展,碱的需求量逐渐增加,制碱工业也迎来了全面的发展。
当时的制碱工艺主要有盐湖蒸发法、蒸馏法和氯化钠电解法等。
其中氯化钠电解法的发明,开辟了新型制碱工艺的先河。
三、现代制碱工业的发展20世纪初,随着化学工业的迅速发展和科学技术的进步,制碱工业进入了现代化生产阶段。
在20世纪30年代,氯化钠电解法逐渐成为了主流的碱生产工艺。
这种技术具有高效、节能、环保的特点,使得生产成本大大降低,质量也得到了进一步提升。
同时,氯化钠电解法也拓宽了碱的应用领域,使得碱可以广泛应用于化工、冶金、轻工、建材等领域。
20世纪中叶,我国的碱业也逐渐发展起来,成为了国民经济的重要支柱产业。
中国的碱业以天然碱为主,主要有盐湖提碱和碱性泉水提碱两大类。
其中,盐湖提碱主要分布在青海和内蒙古等地,以镁盐、钠硫盐等为原料;碱性泉水提碱主要分布在重庆、西藏、贵州等地,以温泉和电泳泉为原料。

候德榜制碱法
候德榜制碱法(Haber-Bosch process)是一种工业制碱法,用于合成氨气(NH3)和尿素(CO(NH2)2)。
它是由德国化学家弗里茨·候德榜(Fritz Haber)和卡尔·博世(Carl Bosch)于20世纪初开发的。
该制碱法基于一系列化学反应,主要包括氮气和氢气在高温高压条件下催化反应生成氨气。
具体反应过程如下:
N2 + 3H2 → 2NH3
在这个过程中,氮气从空气中提取,然后与氢气在催化剂的存在下反应生成氨气。
该反应通常在高温(约400-500°C)和高压(约100-200大气压)下进行。
催化剂通常使用铁或铁-铝合金。
制得的氨气可以进一步用于合成尿素。
尿素是一种重要的肥料原料,广泛用于农业和植物园艺。
候德榜制碱法的发展对农业和化学工业产生了深远影响。
通过合成氨气和尿素,人类能够大规模地生产肥料,以支持粮食和作物的生产。
这种制碱法也被广泛应用于其他化学工艺中,例如合成塑料和合成氨基酸等。


侯氏制碱的工业流程## Industrial Flow of the Hou Process for Alkali Production.Introduction.The Hou process is an industrial process developed in China in the early 20th century to produce sodium carbonate (soda ash) from salt. It is based on the Solvay process, which is the main industrial process for producing soda ash worldwide. However, the Hou process has some advantages over the Solvay process, such as lower energy consumption and no production of ammonium chloride as a by-product.Process Flow.The Hou process consists of the following steps:1. Brine preparation.Seawater or natural brine is purified to remove impurities such as calcium and magnesium ions. This is done by adding lime (calcium oxide) to the brine, which precipitates the impurities as insoluble carbonates. The clarified brine is then concentrated by evaporation.2. Ammoniation.The concentrated brine is cooled and then saturated with ammonia gas. This forms ammonium bicarbonate, which precipitates out of solution.3. Carbonation.The ammonium bicarbonate is heated in a reactor with carbon dioxide gas under pressure. This converts the ammonium bicarbonate to sodium bicarbonate, which is insoluble in water and precipitates out of solution.4. Calcination.The sodium bicarbonate is filtered out of the solutionand then calcined in a kiln at high temperature. This drives off the carbon dioxide and water, leaving behind sodium carbonate.5. Causticization.The sodium carbonate is dissolved in water to form a solution of sodium hydroxide (caustic soda). This solution is then concentrated by evaporation.Advantages of the Hou Process.The Hou process has several advantages over the Solvay process, including:Lower energy consumption.The Hou process requires less energy than the Solvay process because it does not require the production of ammonium chloride.No production of ammonium chloride as a by-product.Ammonium chloride is a by-product of the Solvay process, and it can be difficult to dispose of. The Hou process does not produce ammonium chloride, so this problem is avoided.Higher purity of the sodium carbonate product.The sodium carbonate produced by the Hou process is of higher purity than that produced by the Solvay process.This is because the Hou process does not produce any ammonium chloride, which can contaminate the sodium carbonate product.Disadvantages of the Hou Process.The Hou process also has some disadvantages, including:Higher capital cost.The Hou process requires a more complex reactor thanthe Solvay process, which increases the capital cost.Longer production time.The Hou process takes longer to produce sodium carbonate than the Solvay process.Overall, the Hou process is a viable alternative to the Solvay process for the production of sodium carbonate. It has several advantages, but it also has some disadvantages. The choice of which process to use depends on the specific needs of the producer.## 侯氏制碱工业流程。
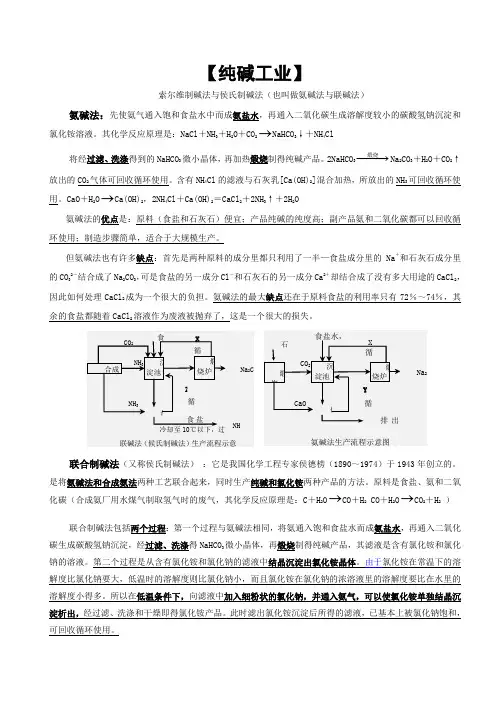
【纯碱工业】索尔维制碱法与侯氏制碱法(也叫做氨碱法与联碱法)氨碱法:先使氨气通入饱和食盐水中而成氨盐水,再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液。
其化学反应原理是:NaCl+NH3+H2O+CO2→NaHCO3↓+NH4Cl将经过滤、洗涤得到的NaHCO3微小晶体,再加热煅烧制得纯碱产品。
2NaHCO3−−−→煅烧Na2CO3+H2O+CO2↑放出的CO2气体可回收循环使用。
含有NH4Cl的滤液与石灰乳[Ca(OH)2]混合加热,所放出的NH3可回收循环使用。
CaO+H2O→Ca(OH)2,2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O氨碱法的优点是:原料(食盐和石灰石)便宜;产品纯碱的纯度高;副产品氨和二氧化碳都可以回收循环使用;制造步骤简单,适合于大规模生产。
但氨碱法也有许多缺点:首先是两种原料的成分里都只利用了一半—食盐成分里的Na+和石灰石成分里的CO32-结合成了Na2CO3,可是食盐的另一成分Cl-和石灰石的另一成分Ca2+却结合成了没有多大用途的CaCl2,因此如何处理CaCl2成为一个很大的负担。
氨碱法的最大缺点还在于原料食盐的利用率只有72%~74%,其余的食盐都随着CaCl2溶液作为废液被抛弃了,这是一个很大的损失。
联合制碱法(又称侯氏制碱法):它是我国化学工程专家侯德榜(1890~1974)于1943年创立的。
是将氨碱法和合成氨法两种工艺联合起来,同时生产纯碱和氯化铵两种产品的方法。
原料是食盐、氨和二氧化碳(合成氨厂用水煤气制取氢气时的废气,其化学反应原理是:C+H2O→CO+H2 CO+H2O→CO2+H2)联合制碱法包括两个过程:第一个过程与氨碱法相同,将氨通入饱和食盐水而成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,经过滤、洗涤得NaHCO3微小晶体,再煅烧制得纯碱产品,其滤液是含有氯化铵和氯化钠的溶液。
第二个过程是从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵晶体。

纯碱制造工艺的发展历程纯碱,化学名叫做碳酸钠,俗名苏打。
化学式:Na2CO3,普通情况下为白色粉末,为强电解质。
密度为2.532g/cm3,熔点为851℃,易溶于水,具有盐的通性。
纯碱是一种重要的基本化工原料,广泛应用于建材、轻工、化工、冶金、纺织等工业部门和人们的日常生活。
在建材方面主要用于制造平板玻璃;在轻工方面主要用于洗衣粉、三聚磷酸钠、保温瓶、灯泡、白糖、塘瓷、皮革、日用玻璃、造纸等;在化工方面主要用于苛化烧碱、小苏打、红矾钠、硝酸钠、亚硝酸钠、硅酸钠、硼砂等;在冶金方面主要用作冶炼助熔剂等。
另外,纯碱还可用于显像管、石油、医药、国防军工等部门。
早期纯碱都是取自天然的植物碱或矿物碱,由于技术落后,产量很低,渐渐地无法满足人们的生活需求。
随着18世纪中期工业革命从英国开始后,纺织、印染、造纸、制皂和玻璃等工业需求的碱量剧增,单靠从植物碱和矿物碱提取的碱明显不足,人工制碱在这个时候诞生了。
一、吕布兰法1.产生背景1783年,法国科学院以1200法郎高额奖金悬赏征求制造纯碱的方法。
1789年,法国奥尔良地区封建主公爵的侍从医生吕布兰(N.Leblanc,1742—1806)成功地创造了一种制碱的方法,1791年获得专利,建立起日产250—300 kg的碱厂。
吕布兰制碱法所用的原料主要有食盐、硫酸、木炭和石灰石。
直到20世纪20年代被索尔维法所取代。
2.生产工艺第一步利用硫酸将食盐转变为硫酸钠:2NaCl + H2SO4===Na2SO4 + 2HCl第二步将硫酸钠与木炭、石灰石在炉中共热。
炉中硫酸钠与木炭作用后生成硫化钠和一氧化碳:Na2SO4 + 4C===Na2S + 4CO↑接着硫化钠与石灰石(CaCO3)进行反应,生成碳酸钠和硫化钙:Na2S + CaCO3===Na2CO3 + CaS由于产物中混有未反应的黑炭,因此产物成黑色灰状物,称为黑灰。
黑灰中含40%—45%的碳酸钠。
第三步将黑灰用水浸取,溶液经浓缩后碳酸钠结晶析出。



纯碱制碱工艺和产量
纯碱,也被称为碳酸氢钠或碳酸钠,是一种重要的化工原料,
广泛应用于玻璃、化肥、造纸、洗涤剂等行业。
它的制备工艺主要
包括氯化铵法、氯化钠法和天然碱法。
氯化铵法是一种较为常见的制碱工艺。
该工艺首先将氯化铵和
石灰石混合,并加热分解生成氨气和氯化钠。
接着,氨气和二氧化
碳反应生成碳酸铵,再经过加热分解得到纯碱。
这种工艺具有较高
的产量和纯度,但同时也存在原料成本较高的缺点。
氯化钠法是另一种常用的制碱工艺。
该工艺利用氯化钠和石灰
石作为原料,经过反应生成碳酸钠。
这种工艺相对简单,且原料成
本较低,但产量较低且纯度较低。
天然碱法则是利用天然碱矿石(如纯碱矿石)进行提取和加工,得到纯碱。
这种工艺的优点是原料资源丰富,但成本较高且产量受限。
关于产量,纯碱的产量取决于原料的质量和工艺的控制。
一般
来说,氯化铵法和氯化钠法的产量较高,而天然碱法的产量相对较
低。
此外,随着生产技术的不断改进和提高,纯碱的产量也在不断提升。
总的来说,纯碱的制备工艺和产量受到多种因素的影响,包括原料成本、工艺复杂度、资源可持续性等。
随着科技的发展和工艺的改进,相信纯碱的制备工艺和产量会不断得到提升和完善。

工业制碱的三种方法工业制碱是指利用化学反应的方法大规模生产碱性物质的过程。
在工业生产中,制碱的方法有多种,其中比较常用的有盐湖卤水法、氯碱法和氧化铝法。
下面将分别介绍这三种工业制碱的方法。
一、盐湖卤水法盐湖卤水法是利用含有丰富盐碱资源的盐湖卤水进行制碱的方法。
具体步骤如下:1. 提取盐湖卤水:将盐湖卤水提取出来,通常采用蒸发结晶或离心等方式。
2. 氯化钙反应:将提取的盐湖卤水与氯化钙反应,生成氯化钠和氯化镁。
3. 碳酸钠析出:将氯化钠溶液与二氧化碳反应,生成碳酸钠溶液。
4. 结晶分离:将碳酸钠溶液进行蒸发结晶,得到固体碳酸钠。
盐湖卤水法的优点是原料丰富,生产成本低,但同时也存在一些问题,如资源的限制和环境污染等。
二、氯碱法氯碱法是利用氯气和氢气通过电解盐溶液制取碱性物质的方法。
具体步骤如下:1. 电解盐溶液:将盐溶液注入电解槽中,通入氯气和氢气。
2. 电解反应:在电解槽中,氯气在阳极上发生氧化反应,生成氯气和氧气,氢气在阴极上发生还原反应,生成氢气。
3. 氢氧化钠析出:由于阴极反应生成的氢气和氢氧化钠反应,生成氢氧化钠溶液。
氯碱法是目前工业生产碱性物质最常用的方法之一,因其原料广泛,生产过程稳定,成本相对较低。
三、氧化铝法氧化铝法是利用氧化铝和碳酸钠反应制取碱性物质的方法。
具体步骤如下:1. 氧化铝制备:将铝矾土经过破碎、煅烧等工艺制成氧化铝。
2. 碳酸钠反应:将氧化铝与碳酸钠溶液反应,生成氢氧化铝和碳酸钠溶液。
3. 氢氧化铝析出:将碳酸钠溶液进行蒸发结晶,得到固体氢氧化铝。
氧化铝法在工业生产中应用较少,因为其原料稀缺,生产成本较高。
盐湖卤水法、氯碱法和氧化铝法是工业制碱的三种常用方法。
每种方法都有其特点和适用范围。
随着科技的发展,工业制碱的方法也在不断改进和创新,以提高生产效率和降低成本,为人们的生活和工业生产提供更多碱性物质的需求。
纯碱的生产工艺一、纯碱的工艺简述纯碱工艺简述:化学名称:碳酸钠;俗名:纯碱、重灰或轻灰;分子式:Na2CO3;分子量:105.99(按79年国际原子量);生产原料原盐、氨(NH3)、二氧化碳、水;生产基本原理:该厂采用联合制碱法生产纯碱和氯化氨。
联碱法生产采用一次加盐,两次吸氨,一次碳化,两次取出的冷法流程。
生产分为两个过程进行:?过程为纯碱生产过程,?过程为氯化氨生产过程。
两个过程构成一个封闭循环系统,不断投入原料(NH3、NaCl、H2O、CO2),同时不断地生产出纯碱和氯化氨两种产品。
联碱过程,即?和?过程:主要化学反应:N a Cl+NH3+H2O+CO2?NH4Cl+NaHCO3?+95.05kJ/mol二、纯碱工程设计中非金属管道材料的选用纯碱生产中的工作介质多为腐蚀性介质或冲刷磨损性介质,以往有的金属管道在使用较短时间就会损坏或泄漏,严重影响生产连续性,恶化了工艺指标。
从而加了大管道维护、检修工作量,增加了产品成本。
非金属管道与金属管道相比具有如下优点:?非金属管道没有电化学腐蚀,耐腐蚀性能好,不需对其进行防腐处理,维修费用低,寿命长;?非金属管道较金属管道更有内壁光滑,流体阻力小,不易结疤;?非金属管道重量轻,安装检修方便。
因此,为了改善生产条件,提高经济效益和竞争力,合理地选用新型非金属材料势在必行。
三、纯碱工业的发展纯碱是重要的工业原料,广泛应用于玻璃、化工、轻工、冶金等行业。
有人称纯碱是工业之母,其消费水平可以衡量一个国家的工业化水平,其实并不过分。
事实上,我国的民族工业也正是从范旭东先生创建永利碱厂起步的。
目前,我国的纯碱产量在国内化工产品中仅次于合成氨、化肥、硫酸,而列第四位。
在美国,尽管纯碱的产值在整个国民产值中比例很小,但由于其终端用户如汽车业、建筑业,对整个国民经济举足轻重,因此,联邦储备局将其月产量纳入工业生产经济指数,足见纯碱在国民经济中的重要性。
四、纯碱装置碳化塔的温度控制铵盐水吸收二氧化碳的碳酸化过程俗称碳化,碳化是纯碱生产过程中的一个关键工序。
工业上制取烧碱的化学方程式烧碱,我们也称之为氢氧化钠,是一种重要的化学物质,它广泛应用于化工、制纤、造纸、电子、制药等行业。
制取烧碱的方法有很多种,其中常用的有电解法、氨法、卤化物法等。
下面我们将介绍电解法制取烧碱的化学方程式。
电解法制取烧碱的化学方程式如下:
在电解槽中,向溶液中通入稀盐酸,使其电离成H+和Cl-,同时在阳极上通入直流电流,使Cl-被氧化成Cl2释放出来。
2Cl- → Cl2 + 2e-
在阴极上反应发生了还原反应,也就是水被还原成氢气和氢氧化物。
2H2O + 2e- → H2 + 2OH-
氢氧化物会和钠离子结合成氢氧化钠。
因为氢氧化钠是强碱,因此电解槽中的溶液就变成了烧碱溶液。
Na+ + OH- → NaOH
以上的反应方程式就是电解法制取烧碱的过程。
需要注意的是,在电解过程中,电解槽需要使用钛制成的负极和钢制成的阳极,因为氢氧化钠会腐蚀许多金属,而钛和钢可以抵御腐蚀。
电解法制取烧碱是目前应用最广泛的方法之一,主要因为此法产品成本较低,而且生产规模灵活,可以很好地满足市场需求。
此法虽然转化效率较低,但由于阳极与阴极设置的比例可以灵活调整,可以在一定程度上控制反应速率,从而实现更大规模的制碱生产。
总之,电解法制取烧碱的化学方程式为:
2Cl- → Cl2 + 2e-
2H2O + 2e- → H2 + 2OH-
Na+ + OH- → NaOH
烧碱的制取从根本上改变了许多行业的生产方式,有助于提高生产效率和降低成本,同时也推动了化工行业的快速发展。
盐制碱生产工艺是一种重要的化工生产技术,它利用盐湖中的盐类矿物为原料,经过一系列的化学反应,生产出碱类产品,广泛应用于化工、纺织、造纸、食品等工业领域。
生产工艺流程大致可以分为以下几个步骤:
1. 原料准备:收集足够的盐湖中的盐类矿物,包括氯化钠、硫酸钠、氯化钙等,并经过破碎、筛选、清洗等工序,得到符合要求的原料颗粒。
2. 盐类转化:将收集到的盐类矿物放入转化锅中,加入适量的水,经过加热、搅拌等操作,使其中的可溶性盐类转化为碱溶液。
3. 澄清处理:将转化得到的碱溶液进行澄清处理,去除其中的杂质,得到较为纯净的碱液。
4. 蒸发浓缩:将得到的碱液进行蒸发浓缩,使其中的水分逐渐减少,形成固态的碱产品。
5. 干燥脱水:将浓缩后的碱产品进行干燥脱水,去除其中的水分,得到所需的碱类产品。
6. 包装储存:将生产的碱类产品进行包装,并储存在符合安全要求的仓库中,以便于运输和销售。
在生产过程中,需要注意以下几点:
1. 原料的质量和数量直接影响着转化率和产品质量,因此需要严格控制原料的品质和数量。
2. 加热和搅拌的均匀性对于盐类转化的效率有着重要的影响,因此需要操作人员认真执行操作规程。
3. 蒸发浓缩和干燥脱水过程中,需要注意温度和湿度的控制,以防止产品变质或污染。
4. 包装材料的选择和储存环境也需要符合相关安全标准,以保障产品的安全和品质。
总之,盐制碱生产工艺是一种重要的化工生产技术,需要严格控制生产过程中的各个环节,以确保产品的品质和安全。
同时,随着科技的不断发展,盐制碱生产工艺也在不断改进和创新,以适应市场的需求和技术的进步。