2001年复旦大学无机化学和分析化学考研真题及详解(圣才出品)
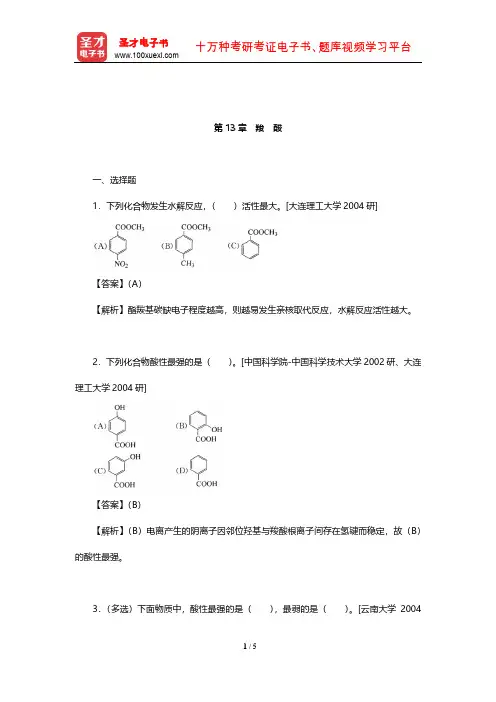
- 格式:pdf
- 大小:2.27 MB
- 文档页数:11

第12章卤素一、选择题1.I2在下述溶液中溶解度最大的是()。
A.水B.KI水溶液C.NaCl水溶液D.NaF水溶液【答案】B【解析】I2在KI溶液中,溶解度增大,这主要是由于生成了I3-的缘故:I2+I- I3-2.ICl2 的几何形状为直线形,其中心原子I的轨道杂化类型为()。
A.spB.sp2C.sp3dD.sp3d2【答案】C【解析】中心原子的价层电子对数是5,故I的轨道杂化类型为sp3d杂化。
3.在常温下,卤素单质与NaOH溶液作用产物正确的是()。
A.Br2生成NaBr、NaBrOB.Cl2生成NaCl、NaClOC.I2生成NaI、NaIOD.Cl2生成NaCl、NaClO3【答案】B【解析】Cl2、Br2、I2在碱中的歧化反应产物与温度有关。
A项,常温下,Br2生成NaBr 和NaBrO3;C项,I2生成NaI和NaIO3;D项,Cl2生成NaCl和NaClO,在加热条件下则生成NaCl和NaClO3。
4.下列卤离子形成的配合物中,最稳定的是()。
A.[PbCl4]2-B.[PbI4]2-C.[HgCl4]2-D.[HgI4]2-【答案】D【解析】Hg2+为软酸,I-为软碱,二者结合力大,形成的[HgI4]2-的稳定常数最大,稳定。
5.下列卤素氧化物中,最稳定的是()。
A.F2OB.ClO2C.I2O5D.Cl2O7【答案】C6.氢氟酸最好储存于()。
A.塑料瓶中B.无色玻璃瓶中C.金属容器中D.棕色玻璃【答案】A【解析】氢氟酸可与玻璃、金属反应。
7.下列各组溶液,按pH增大顺序排列的是()。
A.HI<HBr<HCl<HFB.HClO4<HClO3<HClOC.HClO<HBrO<HIOD.三者都是【答案】D【解析】A项,氢卤酸中的HF是弱酸,HI、HBr和HCl均为强酸,其酸性随卤离子半径的增大和电子层数的增多而增强;B项,氯的含氧酸的酸性随含氧酸中氯的氧化值升高而升高;C项,所有的次卤酸都是弱酸,并随卤原子半径的增大而酸性减弱。

张祖德《无机化学》(修订版)配套模拟试题及详解一、选择题(每题3分,共30分)1.在400℃时,把1mol N 2,3mol H 2和2mol NH 3通入1dm 3烧瓶里,如果反应N 2+3H 2→2NH 3的平衡常数K Θ在400℃时等于0.5。
这时若有反应的话,预期是什么反应( )。
A .从左向右的反应B .从右向左的反应C.体系处于平衡状态D .无法判断【答案】A【解析】设转化率为x ,则平衡常数为解得x =0.0144>0,反应向右进行。
2.下列有关反应速率常数k 的各种叙述,不正确的是( )。
A .速率常数k 值与反应物的本性、反应温度等有关B .速率常数k 是各反应物单位浓度时的反应速率C.反应物起始浓度愈大,速率常数k值愈大D.同一反应,如用不同浓度单位表示时,速率常数k值不同【答案】C【解析】反应速率常数k与反应物的本性、反应温度有关,与反应物浓度无关。
3.根据酸碱电子理论,下列物质不可作为路易斯碱的是()。
A.Cl-B.NH3C.Fe2+D.CO【答案】C【解析】酸碱电子理论认为:凡是能够接受外来电子对的分子、离子或原子团称为路易斯酸,即电子对接受体,简称受体;凡是能够给出电子对的分子、离子或原子团称为路易斯碱,即电子对给予体,简称给体。
4.已知EΘ(Sn4+/Sn2+)=0.15V,EΘ(Fe3+/Fe2+)=0.77V,则此两电对中,最强的还原剂是()。
A.Sn4+B.Sn2+C.Fe3+D.Fe2+【答案】B【解析】标准电极电势值的符号和大小,反映了该电极与氢电极相比较的氧化还原能力的强弱。
数值越小,其还原态越易失去电子,还原性越强;数值越大,其氧化态越易得到电子,氧化性越强。
5.化合物K3FeF6的磁矩为5.9B.M.,而K3Fe(CN)6的磁矩为2.4B.M.,磁矩相差较大的原因是()。
A.两种化合物的中心离子的氧化数不同B.配位体的场强CN->F-C.K3FeF6是简单盐而K3Fe(CN)6是配合物D.F的电负性大于N【答案】B【解析】由K3FeF6的磁矩为5.9B.M.,可知Fe3+的d5组态电子没有发生重排,属于外轨型配合物;而K3Fe(CN)6的磁矩为2.4B.M.,可知Fe3+的d5组态电子发生重排,属于内轨型化合物。






第1章气体、液体和溶液的性质1.1 复习笔记一、气体的性质1.理想气体理想气体必须符合两个条件:(1)气体分子之间的作用力很微弱,一般可以忽略;(2)气体分子本身所占的体积远小于气体的体积。
即气体分子之间作用力可以忽略,分子本身的大小可以忽略。
2.理想气体定律(1)波义耳定律在温度和气体的量恒定时,气体的压力与体积的乘积是一个常数。
可用代数式表示:n,T不变时,pV=C(常数)或者①(2)查理定律在气体的物质的量和压力不变时,气体的体积与温度成正比。
必须说明的是,此温度要用开尔文温标,它与摄氏温标有如下的关系:查理定律可用代数式表示:n,P不变时,(常数)或者②(3)Avogadro假设在同温同压下,相同体积的不同气体含有相同的粒子数。
Avogadro假设可用代数式表示:T,P不变时,③由①,②,③式可以联立成即,引入比例系数R,得pV=nRT该式为理想气体状态方程式。
式中,R为通用气体常数,简称气体常数。
3.理想气体方程式的应用一般情况下,在实验中确定温度和压力(只要是敞开体系,反应体系的压力与外界大气压相同),测得某气体的密度,就可以求得该气体的摩尔质量。
4.实际气体(1)压缩因子Z压缩因子Z表示实际气体的实验值与理想值的偏差。
即(2)气体的内聚力气体的内聚力是指实际气体分子之间存在的吸引力。
(3)实际气体分子之间的相互作用力的类型与分子之间的距离有关。
①实验证明a.两个氩原子核之间距离时,f排斥起主要作用;b.时,f 引力起主要作用;c.时,氩原子之间的作用忽略。
②复杂分子的作用对复杂分子的作用,呈现出近程排斥,中程吸引,远程为零的规律性。
a.当排斥力起主要作用时,,因为在排斥力的作用下,即使增大一定的压力,由于排斥力的抵抗,气体的体积也不会变小,所以V实际偏大,产生正偏差,故;b.当吸引力起主要作用时,,由于分子之间存在的吸引力,使分子对外界的压力变小,所以P实际偏小,产生负偏差,故(4)修正的气态方程式式中,a,b称为van der Waals常数,由实验确定。

中国科学院地球化学研究所2001年无机化学考研试题(1)一、选择题(每题1分,共25分)1.下列离子中能较好地掩蔽水溶液中fe3+离子的是①f-,②cl-,③br-,④i-2.下列物质中有较强还原能力的一元含氧酸是①hpo3,②h2po3,③(c)h3po2,④h3po43.下列物质中与浓碱作用能产生氧气的是①p,②as,③c,④s4.下列物质最易发生爆炸的是①kclo4,②mg(clo4)2,③ca(clo4)2,④fe(clo4)25.氢原子的nd轨道的简并度是①0,②1,③3,④56.xeof4分子的几何构型为①四方锥,②三角锥,③五方锥,④四面体7.基态mn原子的价电子构型是①3d7,②3d74s2,③3d54s2,④3d98.一个离子使另一个离子变形能力增大的特性是①电荷高,半径大②电荷高,半径小③电荷大,半径大④电荷低,半径小9.下列元素中,化学性质最活泼的是①pt,②pd,③rh,④os10.维生素b12的中心金属离子是①fe(ⅱ),②fe(ⅲ),③co(ⅱ),④co(ⅲ)11.下列硫酸盐中最难热分解的是①cr2(so4)3,②mnso4,③feso4,④niso412.下列离子中最难生成酸式碳酸盐的是①k+,②na+,③ca2+,④ba2+13.质量为210的钋同位素进行β放射,经14天后,同位素的活性降低6.85%,其半衰期为①3.62天,②137天,③147天,④157天14.经分析某化合物组成为:cr21.37%,nh334.93%,cl43.70%。
称取该化合物0.2434g,以适量水溶解,然后加入适量的agno3(aq),得白色沉淀,经干燥称重,获得0.2866g沉淀,则该化合物的正确的化学式为agcl式量=143.4,cr原子量=52.00①[cr(nh3)4cl2]cl,②[cr(nh3)5cl]cl2,③[cr(nh3)6]cl3,④[cr(nh3)3cl3]15.下列化合中属于非离子型化合物的是①bf3,②alf3,③gaf3,④inf316.往硫化砷(ⅲ)溶液中加入下列试剂,胶体凝结效果最好的是①nacl,②cacl2,③na3po4,④al2(so3)317.在cuso4?5h2o晶体中铜离子的配位数是①4,②5,③6,④818.下列元素中属于人造元素的是①sm,②pm,③ho,④tm19.下列离子中最易形成简单水合离子的是①sn4+,②ti4+,③ce4+,④th4+20.下列配体与hg2+离子最难配位的配体是①nh3,②cl-,③br-,④i-21.用硝酸盐的热分解来制备no2时,应选择①pb(no3)2,②nano3,③kno3,④nh4no322.乙酰丙酮基(acac-)能与一些金属离子生成螯合物。
第16章硼族元素16.1 复习笔记一、硼及其化合物硼的化学性质与Si有某些相似之处(对角线相似原则),通常硼呈现+3氧化态,负氧化态的情况很少。
硼与金属形成非化学计量化合物,如等。
1.单质硼(1)单质硼的晶体结构单质硼有两种同素异形体。
无定形硼为棕色粉末,晶态硼呈黑灰色。
硼的熔沸点高,晶态硼的硬度很大,在单质中仅次于金刚石。
晶态硼有很多种复杂的结构,他们都以B12正二十面体为基本的结构单元(如图16-1所示)。
图16-1 硼的基本结构单元(2)单质硼的化学性质硼和硅一样,在常温下较惰性,仅与F2反应。
相对于单质硼而言,晶态硼惰性较大,无定形硼比较活泼。
①在高温下,硼与N2、O2、S、卤素等反应。
②硼能从许多稳定的氧化物(等)中夺取氧。
③硼不与盐酸反应,但与氧化性的酸反应,生成H3BO3。
④在有氧化剂存在时,硼与碱共熔得到偏硼酸盐。
(3)单质硼的制备①金属还原法②工业上的碱法碱法步骤如下:a.用浓碱溶液来分解硼镁矿,得到偏硼酸钠:b.通入CO2调节碱度,分离出硼砂:c.用H2SO4调节酸度,可析出溶解度小的硼酸晶体:d.加热,使硼酸脱水生成B2O3:e.用Mg或Al还原成粗硼:③工业上的酸法酸法用硫酸分解硼镁矿,一步制得硼酸。
此法虽然简单,但需要耐酸设备等条件,不如碱法好。
④精制粗硼可将碘化硼在灼热(1000~1300 K)的钽丝上热解,可得到纯度达99.95%的α-菱形硼。
2.硼的化合物(1)硼的氢化物硼的氢化物的物理性质相似于烷烃,故称硼烷。
多数硼烷的组成是,少数为。
但最简单的硼烷是B2H6。
①硼的氢化物的制备方法a.质子置换法b.氢化法c.氢负离子置换法②硼烷的结构硼烷是缺电子化合物,B原子采取sp3杂化,位于一个平面的BH2原子团,以二中心二电子键连接,位于该平面上、下且对称的H原子与硼原子分别形成三中心二电子键,即氢桥键,如图16-2所示。
图16-2 硼烷B2H6的结构③硼烷的物理性质常温下,为气体,至为液体,及其他高级硼烷都是固体。
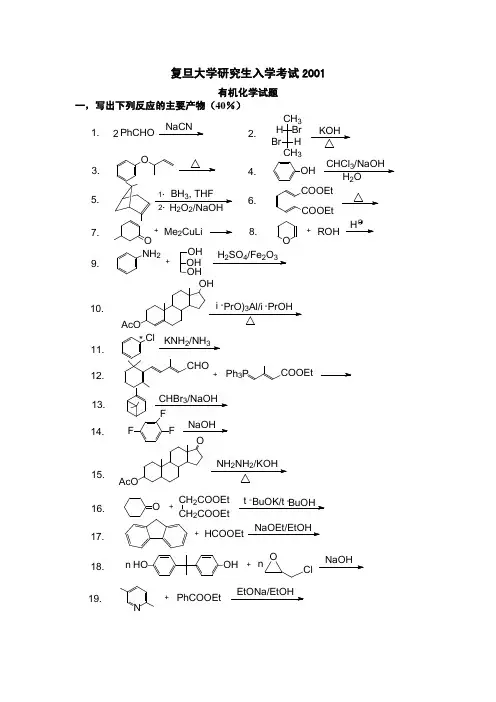
复旦大学无机化学考研试题一完成并配平下列反应式:1 BrO3- + XeF2 + H2O →2 SnS + (NH4)2S2 →3 BF3 + H2O →4 K2MnO4 + H2O →5 FeC2O4→6 [Co(NH3)6]2+ + O2 + H2O →7 BF3 + LiAlH4 →8 Pb(OH)3- + ClO- →9 Bi(OH)3 + Cl2 + NaOH →10 XeO3 + O3 + H2O →11 (NH4)2Cr2O7 →12 CaCO3 + H2O + Cl2→13 Pb3O4 + HCl →14 NH3 + CO2 →15 Zn + NH3 + H2O →二用反应式表示下列制备过程,注明必要反应条件及步骤,辅助原料自选。
1 以为NaNO3主要原料制备NaNO2;2 以SO2,NaOH,锌粉为原料制备保险粉;3 由CuCl2制备CuCl;4 利用配体取代反应制备cis-[PtCl2(NH3)2]。
可供选择的原料为[Pt(NH3)4]SO4、Na2[PtCl4]、NH3、NH4Cl,说明选择原料的依据;5 以H3PO4和NaOH为原料制备三聚磷酸钠;6 以粗硅为原料制取超纯硅;7 以Ba(IO3)2为原料制备偏高碘酸;8 试举两例实验室制备CO的合理方法。
三简答题:1 为什么硼砂(Na2B4O5(OH)4.8H2O))溶液具有缓冲作用?2 如何制取纯HD?(D=21H)3 锝在周期表中处于什么位置?写出锝最高氧化态的含氧酸的分子式。
4 稀土元素的离子和化合物的颜色主要是由什么引起的?稀土元素作为优良磁性材料的依据是什么?5 多硼烷中可能存在哪几种类型的化学键?丁硼烷(B4H10)中有哪几种类型的化学键?6 写出[PtCl2(NO2)(NH3)(en)]Cl的名称,并画出内界可能的几何异构体。
7 如何解释NH3是Lewis碱而NF3却不具有Lewis碱性?8 何谓沸石分子筛?以人工合成A型分子筛为代表,讨论它们的组成、结构、性质和应用。
复旦大学无机化学期末试卷班级 姓名 分数一、选择题 ( 共11题 20分 ) 1.第二电离能最大的原子,应该具有的电子构型是……………………………………( )(A) 1s 22s 22p 5 (B) 1s 22s 22p 6(C) 1s 22s 22p 63s 1 (D) 1s 22s 22p 63s 22. 应用式[H ][S][H S]+222= K a1K a2的条件是……………………………………………… ( )(A) 只适用于饱和H 2S 溶液 (B) 只适用于不饱和H 2S 溶液(C) 只适用于有其它酸共存时的H 2S 溶液 (D) 上述3种情况都适用 3.当一个化学反应处于平衡时,则………………………………………………………( ) (A) 平衡混合物中各种物质的浓度都相等 (B) 正反应和逆反应速率都是零(C) 反应混合物的组成不随时间而改变 (D) 反应的焓变是零 4.下列离子半径大小顺序正确的是…………………………………………………… ( )(A) F - > Na + > Mg 2+ > Al 3+ > O 2- (B) O 2- > F - > Na + > Mg 2+ > Al 3+(C) O 2- > F - > Al 3+ > Mg 2+ > Na + (D) Na + > Mg 2+ > Al 3+ > F - > O 2- 5.有可逆反应(假设是基元反应) A + 2B= 2C ,已知某温度下,正反应速率常数k正= 1,逆反应速率常数k 逆 = 0.5,下述体系中处于平衡状态的是………………………………( )(A) [A] = 1 mol ·dm -3 [B] = [C] =2 mol ·dm -3(B) [A] = 2 mol ·dm -3 [B] = [C] =1 mol ·dm -3(C) [A] = [C] =2 mol ·dm -3 [B] = 1 mol ·dm -3 (D) [A] = [C] =1 mol ·dm -3 [C] = 2 mol ·dm -3 6.已知 N 2(g) + 3H 2(g)2NH 3(g);N 2(g) +21H 2(g)NH 3(g) 和N 2(g) + H 2(g)2/3NH 3(g) 的平衡常数分别为K 1、K 2和K 3,则它们的关系是…( )(A) K 1 = K 2 = K 3 (B) K 1 = (K 2)2 = (K 3)3(C) K 1 =21K 2 =31K 3 (D) K 1 = (K 2)1/2 = (K 3)1/3 7.电子的波动性是……………………………………………………………………… ( ) (A) 一种机械波 (B) 一种电磁波(C) 一种概率波 (D) 电子运动时呈波浪式的前进 8.相同的反应物转变成相同的产物时,如果反应分两步进行,那么要比一步进行时( ) (A) 放热多 (B) 熵增加多 (C) 内能增加多 (D) 焓、熵、内能变化相同 9.在298K ,下列反应中m r H ∆与m r G ∆最接近的是…………………………………( )(A) CCl 4(g) + 2H 2O(g)= CO 2(g) + 4HCl(g) (B) CaO(s) + CO 2(g) = CaCO 3(s)(C) Cu 2+(aq) + Zn(s) = Cu(s) + Zn 2+(aq)(D) Na(s) + H +(aq) + H 2O(l) = Na +(aq) +21H 2(g) + OH -(aq)10.按分子轨道理论,-2O 的键级是………………………………………………………( ) (A) 1 (B) 2 (C) 1 (D) 2 11.硫酸铜有多种不同水合物,它们脱水反应的K p 分别为 1/2 CuSO 4·5H 2O(s)1/2 CuSO 4·3H 2O(s) + H 2O(g) K p 1 1/2 CuSO 4·3H 2O(s)1/2 CuSO 4·H 2O(s) + H 2O(g) K p 2 CuSO 4·H 2O(s) CuSO 4(s) + H 2O(g) K p 3 为了使CuSO 4·H 2O 晶体保持稳定(不风化也不潮解),容器中水蒸气压OH 2p 应为……( )(A) K p 1 <OH 2p < K p 3(B)OH 2p 必须恰好等于K p 2(C) K p 1 >O H 2p > K p 2(D) K p 2 >O H 2p> K p 3二、填空题 ( 共 7题 20分 ) 12.13.反应2A + B2D 的K p =B 2D/p p ,升高温度和增大压力都使平衡逆向移动,则正反应是_______ 热反应,K c 的表达式是_____________。
第4章配合物4.1 复习笔记一、配合物的基本概念1.配合物的定义配位化合物简称配合物,又称络合物,是一大类化合物的总称。
2.配合物的组成(1)形成体①中心离子(或中心原子)称为配合物的形成体;②中心离子大多数是带正电荷的金属阳离子,以过渡金属离子居多,如Mn2+、Fe3+、Co2+、Ni2+、Cu2+、Ag+等;少数高氧化态的非金属元素也可作中心离子,如[BF4]-、[SiF6]2-中的B(Ⅲ)、Si(Ⅳ)等;③中心原子如[Ni(CO)4]、[Fe(CO)5]中的Ni、Fe原子。
(2)配位个体、配体及配位原子①由形成体结合一定数目的配体所形成的结构单元称为配位个体,即配合物的核心部分;②在配合物中与形成体结合的离子或中性分子称为配体;③在配体中提供孤电子对与形成体形成配位键的原子称为配位原子。
(3)配体分类根据配体中所含配位原子数目的不同,可分为单齿配体和多齿配体。
①单齿配体:一个配体中只有一个配位原子,如NH3、OH-、X-、CN-、SCN-等;②多齿配体:一个配体中有两个或两个以上的配位原子。
(4)配位数①定义配位数是指在配位个体中与一个形成体形成配位键的配位原子的总数。
②配位数与配体的关系a.由单齿配体形成的配合物,中心离子的配位数等于配体的数目;b.若配体是多齿的,那么配体的数目不等于中心离子的配位数。
③形成体和配体的性质对配位数的影响a.中心离子正电荷越多,配位数越大;b.中心离子半径较大时,其周围可容纳较多的配体,易形成高配位的配合物,但是中心离子半径若过大时,有时配位数反而减小;c.配体的负电荷越多,配位数减小;d.配体的半径增大时,中心离子周围可容纳的配体数减少,配位数减小;e.配体浓度大、反应温度低,易形成高配位配合物。
(5)配离子的电荷配离子的电荷为形成体和配体电荷的代数和。
3.配合物的化学式及命名(1)配合物的化学式①含配离子的配合物,其化学式中阳离子写在前,阴离子写在后;②配位个体中,先列出形成体的元素符号,再依次列出阴离子和中性配体;③无机配体列在前面,有机配体列在后面,将整个配位个体的化学式括在方括号内;④在括号内同类配体的次序,以配位原子元素符号的英文字母次序为准。
中国科学院地球化学研究所2001年无机化学考研试题(1)一、选择题(每题1分,共25分)1.下列离子中能较好地掩蔽水溶液中fe3+离子的是①f-,②cl-,③br-,④i-2.下列物质中有较强还原能力的一元含氧酸是①hpo3,②h2po3,③(c)h3po2,④h3po43.下列物质中与浓碱作用能产生氧气的是①p,②as,③c,④s4.下列物质最易发生爆炸的是①kclo4,②mg(clo4)2,③ca(clo4)2,④fe(clo4)25.氢原子的nd轨道的简并度是①0,②1,③3,④56.xeof4分子的几何构型为①四方锥,②三角锥,③五方锥,④四面体7.基态mn原子的价电子构型是①3d7,②3d74s2,③3d54s2,④3d98.一个离子使另一个离子变形能力增大的特性是①电荷高,半径大②电荷高,半径小③电荷大,半径大④电荷低,半径小9.下列元素中,化学性质最活泼的是①pt,②pd,③rh,④os10.维生素b12的中心金属离子是①fe(ⅱ),②fe(ⅲ),③co(ⅱ),④co(ⅲ)11.下列硫酸盐中最难热分解的是①cr2(so4)3,②mnso4,③feso4,④niso412.下列离子中最难生成酸式碳酸盐的是①k+,②na+,③ca2+,④ba2+13.质量为210的钋同位素进行β放射,经14天后,同位素的活性降低6.85%,其半衰期为①3.62天,②137天,③147天,④157天14.经分析某化合物组成为:cr21.37%,nh334.93%,cl43.70%。
称取该化合物0.2434g,以适量水溶解,然后加入适量的agno3(aq),得白色沉淀,经干燥称重,获得0.2866g沉淀,则该化合物的正确的化学式为agcl式量=143.4,cr原子量=52.00①[cr(nh3)4cl2]cl,②[cr(nh3)5cl]cl2,③[cr(nh3)6]cl3,④[cr(nh3)3cl3]15.下列化合中属于非离子型化合物的是①bf3,②alf3,③gaf3,④inf316.往硫化砷(ⅲ)溶液中加入下列试剂,胶体凝结效果最好的是①nacl,②cacl2,③na3po4,④al2(so3)317.在cuso4?5h2o晶体中铜离子的配位数是①4,②5,③6,④818.下列元素中属于人造元素的是①sm,②pm,③ho,④tm19.下列离子中最易形成简单水合离子的是①sn4+,②ti4+,③ce4+,④th4+20.下列配体与hg2+离子最难配位的配体是①nh3,②cl-,③br-,④i-21.用硝酸盐的热分解来制备no2时,应选择①pb(no3)2,②nano3,③kno3,④nh4no322.乙酰丙酮基(acac-)能与一些金属离子生成螯合物。