一种手性甾体酰胺化合物的蛋白结合特征研究
- 格式:pdf
- 大小:237.58 KB
- 文档页数:4

甾体化合物的立体化学甾体化合物分子中碳环的顺、反稠和方式及手性碳原子所连基团的空间取向,决定了它的构型。
在甾体母核中有七个手性碳原子(5、8、9、10、13、14、17、20),这些手性碳原子都是处于两环共用的位置(C-17除外)。
虽然这七个手性碳理论上应有128个旋光异构体,但由于稠环的限制以及所引起的空间位阻影响,使得甾体化合物实际存在的旋光异构体数目大大减少。
手性碳原子所连的基团在空间有不同的取向,位于纸平面前者习惯上称β-构型,以实线或粗线表示;位于纸平面后者称α-构型,以虚线相连表示。
波纹线则表示所连基团构型待定,或概括α、β两种构型,命名时则用希腊字母ξ表示。
天然甾类化合物C、C、C取代基均为β型,其他位置的氢与取代基的空间取向与它们在同一方向的为β型,相反者为α型。
所以A/B以顺式相稠合者为5β-H,称正系,A/B环以反式相稠合者为5α-H,称别系。
天然甾体化合物的B/C环、C/D环之间多是以反式稠合(除强心苷基、蟾酥毒素及C甾类的C/D环之间是以顺式稠合外),因此实际现在已知的大多数天然甾体化合物只有两种构型,即5β系5α系,故书写和命名时5-H的构型要表示出来。
而代表B环和C环、C环和D环之间稠合方式的8β-H、9α-H、14α-H在书写和命名时则常常省去。
它们的结构如下:甾体母核是由三个环己烷与一个环戊烷稠合而成,分子中的环己烷都以稳定的椅式构象存在,两环之间的稠合方向与顺式十氢萘及反式十氢萘相似。
5α系与5β系甾体母核的构象式如下:由于在5α系与5β系甾体母核中都有反式稠合环,故与反十氢萘一样无转环作用,分子中α键与e键不能互换,故甾体化合物分子中处于α键的基团与处于e键的基团在化学方面的行为差异显著,常被作为研究构象基本规律的对象。

手性药物拆分的研究进展许多药物具有光学活性(opitical activeity)。
一般显示光学活性的药物分子,其立体结构必定是手性(chirality)的,即具有不对称性。
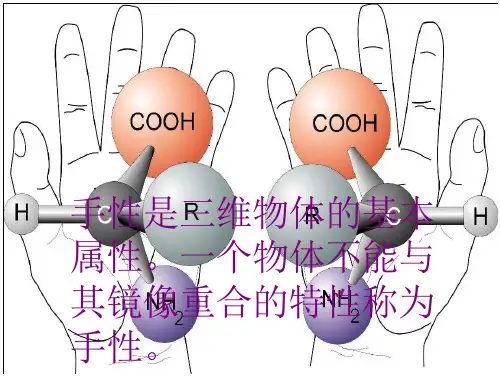
手性是指其分子立体结构和它的镜像彼此不能重合。
互为镜像关系而又不能重合的一对分子结构称为对映体(enantiomer)。
虽然对映异构体药物的理化性质基本相同,但由于药物分子所作用的受体或靶位是由氨基酸、核苷、膜等组成的手性蛋白质和核酸大分子等,后者对与之结合的药物分子的空间立体构型有一定的要求。
因此,对映异构体在动物体内往往呈现出药效学和药动学方面的差异。
鉴于此,美国食品药品监督管理局规定,今后研制具有不对称中心的药物,必须给出手性拆分结果,欧盟也提出了相应的要求。
因此,手性拆分已成为药理学研究和制药工业迫切需要解决的问题。
目前,利用酶法、超临界流体色谱(SFC)法、化学法、高效液相色谱(HPLC)法、气相色谱(GC)法、毛细管电泳(capillary electrophoreisis,CE)法和分子烙印法拆分对映体,已成为新药研究和分析化学领域的重要课题。
笔者在本文综述了近年来利用上述方法拆分手性药物的研究进展。
1酶法酶的活性中心是一个不对称结构,这种结构有利于识别消旋体。
在一定条件下,酶只能催化消旋体中的一个对映体发生反应而成为不同的化合物,从而使两个对映体分开。
该法拆分手性药物已有较久的历史,反应产物的对映过剩百分率可达100%。
酶催化的反应大多在温和的条件下进行,温度通常在0~50℃,pH 值接近7.0。
由于酶无毒、易降解、不会造成环境污染,适于大规模生产。
酶固定化技术、多相反应器等新技术的日趋成熟,大大促进了酶拆分技术的发展。
脂肪酶、酯酶、蛋白酶、转氨酶等多种酶已用于外消旋体的拆分。
脂肪酶是最早用于手性药物拆分的一类酶,是一类特殊的酯键水解酶,具有高度的选择性和立体专一性,反应条件温和,副反应少,适用于催化非水相递质中的化学反应,在B 一受体阻滞药、非甾体类抗炎药和其他多种药物的手性拆分中都有广泛的应用。



第八章手性技术8.1 手性技术概述一、手性化合物的发现及发展1808年,法国物理学家Malus通过方解石晶体的研究发现了偏振光现象,1815年,法国物理学家Biot发现一些天然有机物的溶液可以使偏振光旋转。
人们也发现,人工合成的化合物全部都是非光学活性的,天然存在的化合物有相当一部分是具有光学活性的。
二、手性化合物的特征及重要性手性药物的重要特征是立体构型专一性,构型改变则物质活性改变或丧失,甚至产生相反性质(毒性)。
另外,因为生命本身是手征性的,所以手性化合物的立体构型对生命物质有着非凡的识别能力和选择性。
实例:健康糖S,S型—甜味(蔗糖2400倍)S,R型—苦味反应停(Thalidomide,沙利度胺)—50年代德国一种消除妊娠反应药。
S型——镇静剂,不致畸R型——无镇静作用,致畸该药早期以消旋体上市,药效良好。
但1961年发现了服药后产下的婴儿多四肢残缺——称为“海豹儿”。
从1959~1963年,诞生1万2千多名畸形儿。
直到1965年,人们才发现R-构型产物无镇静作用而且致畸,S-构型不致畸。
后来的研究发现,S-构型在生理pH条件下,可发生消旋化。
其他实例:SS构型——抗结核菌抗结核药丁胺乙醇RR构型——抗结核菌极差,且导致失明S构型——治疗心脏病心得安(普萘洛尔)R构型——抑制性欲RR构型——抗菌氯霉素SS构型——抗菌极低90年代发现的紫杉醇,为多手性中心药物三、手性化合物的发展20世纪80年代以后,手性化合物的合成及分析技术方面有了突破性发展,使手性化合物的深入研究成为可能。
进入21世纪,手性药物的发展较为迅速。
20世纪90年代初,欧、美、日等国家在药物开发方面,对于手性问题有了一些具体立法。
1992年3月,美国食品和药品管理局(FDA)发布了手性药物指导原则,明确要求对一个含有手性因素的化学药物,必须说明它的不同对映体在人体内的不同生理活性、药物作用、代谢过程和药物动力学情况,以考虑是否以单一对映体形式供药。


收稿日期:2009-09-10作者简介:孙璐(1974-),女(汉族),辽宁沈阳人,副教授,博士,主要从事药物代谢和药物动力学研究,T e:l (024)23986369,E -ma i:l lisun l u @ 。
文章编号:1005-0108(2009)06-0498-04手性药物的立体选择性药物动力学孙璐,杨亚楠,严静(沈阳药科大学药学院,辽宁沈阳110016)摘 要:人体的手性环境造成了手性药物对映体的立体选择性药物动力学。
由于体内生物大分子常常具有不同的立体构型,药物分子空间排列上的微小改变,可导致与生物大分子亲和力的明显差异,对映体之间表现出不同的药物动力学特征。
药物动力学的立体选择性表现在手性药物的吸收、分布、代谢和排泄4个过程的差异,该文对影响这些差异的因素进行逐一的分析。
关键词:手性药物;对映体;药物动力学;立体选择性中图分类号:R 914 文献标志码:AStereoselectivity phar macoki netics of chiral drugsS UN Lu ,YANG Y a -nan ,YAN Ji n g(Schoo l o f Pha r m a cy,Shenyang Pha r m ace u tica l University,She nyang 110016,Ch i n a )Abst ract :Ch iral env ironm ent o f the hum an body result stereo se lecti v ity phar m acokine tics o f ch ira l drug enantio -m ers .A s bio log icalm acrom o l e cu l e s i n v i v o o ften have different three -di m ensiona l confo r m ati o n ,any change o f s patial structure in drug m o l e cu l e s w ill lead to dr ug -receptor obv ious differ ent affi n ity .The enantio -m ers o f chiral drug m ay hav e different pr operti e s i n abso rption ,distribution ,m etabo lis m and excreti o n .Th is article discusse s the facto rs tha t cause these differences .K ey w ords :chira l drug ;enantio m er ;phar m acoki n etics ;stereo se lecti v ity 手性(chirality )是生物系统的基本特征,例如,构成机体的氨基酸、糖类等物质是手性的,机体代谢和调控过程所涉及的酶、受体和某些细胞表面物质也是手性的,这就形成了体内的手性环境。



一、绪论(一)生物催化手性合成的产生与发展手征性是一切生命的基础。
因此人体及动植物对药物等有精确的手性识别作用。
旋光性化合物通常只有一种对映体具有特定的生理活性,其它异构体则无此活性,甚至有毒副作用。
60年代欧洲和日本一些孕妇因服用镇静剂外消旋沙利度胺而造成数千计的胎儿畸形,成为医药史上一个悲剧[1]。
随着社会的发展,人们对单一旋光物质的需求将会越来越高。
在这种需求下,生物催化技术得到了进一步的应用。
生物催化的手性合成是指利用纯酶或生物有机体催化无手性、潜手性化合物转变成为手性产物的过程。
生物催化中常用的有机体主要是微生物,其本质是利用微生物细胞内的酶催化非天然有机化合物的生物转化。
固定化酶和固定化细胞技术可使生物催化反应在固定床内连续进行生物转化,这将使生物催化法具有工业化应用价值。
因为生物催化的手性合成具有反应条件(温度、压力和pH值)温和、环境友好、效率高和高选择性的特点,使它成为当今手性合成方法研究的热点和发展方向。
人类利用细胞内酶作为生物催化剂实现生物转化已有几千年的历史了。
我国劳动人民在距今约8000年至4500年间,已发明了制曲酿酒工艺,在2500年前的春秋战国时期,已能制酱和醋。
在酿酒工艺中,利用霉菌淀粉酶对谷物淀粉进行糖化,然后利用酵母菌进行酒精发酵。
真正对酶的认识和应用还要归功于近代科学技术的发展。
酶这一术语在1867年由库内创造用以表述催化活性。
1894年,菲舍尔提出了“锁钥学说”用来解释酶作用的立体专一性。
1897年布赫奈纳等发现酵母的无细胞提取物也具有发酵作用,可以使葡萄糖转化为乙醇和二氧化碳[2]。
这些工作为近代酶学奠定了基础。
1858年,巴斯得研究发现外消旋酒石酸铵在微生物酵母或灰绿青霉生物转化下,天然右旋光性(+)-酒石酸铵盐会逐渐被分解代谢,而非天然的(-)-酒石酸铵盐被积累而纯化,该过程被称为不对称分解作用,而巴斯得也成为手性化合物研究的先驱。
1906年,瓦尔堡采用肝脏提取物水解消旋体亮氨酸丙酯制备L-亮氨酸。
有机合成反应中的不对称催化研究近年来,有机合成反应中的不对称催化研究备受关注。
不对称催化是合成有机分子的重要方法之一,其能够有效地提高化学反应的产率和立体选择性。
本文将探讨不对称催化的原理、种类以及其在有机合成反应中的应用。
一、不对称催化的原理不对称催化是指在化学反应中引入手性催化剂,通过左右手的对映体选择性催化反应,从而得到手性有机化合物。
这种反应具有效率高、立体选择性好等优点,已成为许多有机合成反应的重要手段。
二、不对称催化的种类1. 手性配体催化:手性配体是催化剂中的一个重要组成部分,其通过与底物形成配位键,将手性信息传递给反应中心,从而实现手性诱导。
常见的手性配体催化包括醛缩反应、羰基化合物还原等。
2. 酶催化:酶是一类天然的催化剂,能够高效催化生物体内的化学反应。
酶催化反应中的手性诱导主要依赖于酶的立体构象。
酶催化可以实现高度立体选择性的合成,是不对称催化研究的一个重要方向。
3. 金属催化:金属催化是一类具有广泛应用前景的不对称催化方法。
通过引入金属催化剂,可以在化学反应中实现手性诱导,从而合成手性有机分子。
三、不对称催化在有机合成中的应用1. 手性药物合成:不对称催化在手性药物合成中起到了重要作用。
通过合成手性药物,可以提高药效,减少副作用,为新药的研发提供了可行的途径。
不对称催化可用于合成多种手性药物分子,如β-肾上腺素受体拮抗剂、非甾体类抗炎药等。
2. 天然产物合成:不对称催化在天然产物合成中亦有广泛应用。
许多天然产物具有复杂的结构和手性特征,传统的合成方法难以合成这些化合物。
而通过不对称催化,可以实现高效、高立体选择性的天然产物全合成。
3. 功能材料合成:不对称催化还可以应用于功能材料的合成。
例如,一些手性聚合物可以通过催化剂引发的不对称聚合反应得到,从而具有特殊的光学、电学性能,可应用于显示技术、光电器件等领域。
总结:不对称催化在有机合成反应中的研究与应用不断取得了重要进展,为合成手性有机化合物提供了高效、高立体选择性的方法。
手性药物拆分的研究进展许多药物具有光学活性(opitical activeity)。
一般显示光学活性的药物分子,其立体结构必定是手性(chirality)的,即具有不对称性。
手性是指其分子立体结构和它的镜像彼此不能重合。
互为镜像关系而又不能重合的一对分子结构称为对映体(enantiomer)。
虽然对映异构体药物的理化性质基本相同,但由于药物分子所作用的受体或靶位是由氨基酸、核苷、膜等组成的手性蛋白质和核酸大分子等,后者对与之结合的药物分子的空间立体构型有一定的要求。
因此,对映异构体在动物体内往往呈现出药效学和药动学方面的差异。
鉴于此,美国食品药品监督管理局规定,今后研制具有不对称中心的药物,必须给出手性拆分结果,欧盟也提出了相应的要求。
因此,手性拆分已成为药理学研究和制药工业迫切需要解决的问题。
目前,利用酶法、超临界流体色谱(SFC)法、化学法、高效液相色谱(HPLC)法、气相色谱(GC)法、毛细管电泳(capillary electrophoreisis,CE)法和分子烙印法拆分对映体,已成为新药研究和分析化学领域的重要课题。
笔者在本文综述了近年来利用上述方法拆分手性药物的研究进展。
1酶法酶的活性中心是一个不对称结构,这种结构有利于识别消旋体。
在一定条件下,酶只能催化消旋体中的一个对映体发生反应而成为不同的化合物,从而使两个对映体分开。
该法拆分手性药物已有较久的历史,反应产物的对映过剩百分率可达100%。
酶催化的反应大多在温和的条件下进行,温度通常在0~50℃,pH 值接近7.0。
由于酶无毒、易降解、不会造成环境污染,适于大规模生产。
酶固定化技术、多相反应器等新技术的日趋成熟,大大促进了酶拆分技术的发展。
脂肪酶、酯酶、蛋白酶、转氨酶等多种酶已用于外消旋体的拆分。
脂肪酶是最早用于手性药物拆分的一类酶,是一类特殊的酯键水解酶,具有高度的选择性和立体专一性,反应条件温和,副反应少,适用于催化非水相递质中的化学反应,在B 一受体阻滞药、非甾体类抗炎药和其他多种药物的手性拆分中都有广泛的应用。
手性有机化合物的合成与应用研究手性有机化合物是有机化学中一类十分重要且引人关注的研究领域。
它们具有分子结构的镜像异构体,即左旋和右旋两种形式。
这种手性性质在生命分子、药物、催化剂等领域中有着广泛的应用价值。
在本文中,我们将探讨手性有机化合物的合成方法以及它们在不同领域中的应用研究。
合成手性有机化合物通常有两种方法:一是通过化学合成,即有机合成领域中使用手性诱导试剂或催化剂来制备手性分子;二是利用生物合成反应或酶催化合成方法。
化学合成方法中,手性诱导试剂的应用广泛,如手性酰胺、手性醇、手性酸等,它们可以引导产生手性反应中间体,从而得到手性有机化合物。
此外,催化剂也是合成手性有机化合物的重要手段,如金属有机催化剂、酶催化剂等,它们可以提供立体选择性和催化反应的速度选择性。
生物合成反应和酶催化合成方法则利用生物体内的酶系统来合成手性有机化合物,具有环境友好、高效可持续等优点。
手性有机化合物在药物领域中具有重要的应用价值。
由于手性分子与生物体内的手性受体或酶相互作用,其活性和代谢行为往往可能产生巨大差异。
因此,在药物研发中合成纯度高的手性有机化合物是非常重要的。
例如,此前市场上销售的几乎所有非甾体类抗炎药是通过化学手段得到的光学混合物,而在1930年代末发现的非甾体抗炎药“拜瑞妥”,由于其真正的有效成分是其左旋体,因而具有更好的抗炎作用。
除了药物领域,手性有机化合物在农药、化妆品、食品添加剂等领域也有广泛应用。
例如,将手性化合物应用于农药中可以提高其活性和选择性。
在农药中,手性有机化合物可以提高杀虫剂的作用效果,减少对环境的污染,它们被广泛用于农作物保护。
此外,手性有机化合物还广泛应用于食品添加剂的合成,例如防腐剂和甜味剂等。
通过合成手性有机化合物,可以获得更加纯度高、活性好、环境友好的化合物,从而提高产品的效果和品质。
手性有机化合物的研究对于理解生命的起源和生命分子的结构活性关系也具有重要意义。
通过研究手性有机化合物的合成和性质,可以揭示手性决定性的起源及其在生物领域和其他领域的作用机制。
摘要氨基酸酰胺色谱分离和亚磺酰胺不对称催化摘要大多数天然产物具有手性。
随着对手性物质研究的深入,越来越多的手性化合物在药物、精细化学品以及材料等方面得到了广泛的使用。
手性化合物中的对映异构体具有很多相近的理化性质,但是,不同手性的对映体在生命体内的表现有很大的差别。
因此,获得对生命体有益作用的异构体对人们来说变得尤其重要。
获得这些单一光学纯异构体的一般方法是手性拆分、手性试剂合成、不对称催化和生物合成。
本文将分为两大部分,分别对手性化合物的高效液相色谱的手性拆分和新型手性配体的合成及其不对称催化进行论述。
第一部分:手性氨基酸酰胺衍生物的液相色谱分离。
在众多的手性分离方法中,高效液相色谱手性固定相法使用越来越普遍,手性化合物大多能通过这种手段进行拆分。
手性氨基酸酰胺类衍生物是一种应用广泛的手性药物中间体,但是使用手性固定相对氨基酸酰胺衍生物进行拆分的报道还很少,所以对它进行拆分研究很有意义。
首先,采用课题组以前报道合成方法对10种氨基酸酰胺衍生物进行合成,然后对这10种氨基酸酰胺衍生物通过高效液相色谱手性固定相法进行手性拆分研究。
在正相色谱条件下,改变不同的色谱条件,选出最优分离条件。
其次,在优化后的色谱条件下,根据不同条件下的参数进行比较分析,根据化合物结构的差别解释不同基团对分离效果的影响,对手性拆分机理进行简要的阐述。
第二部分:N-芳基亚磺酰胺-烯手性配体的不对称催化。
手性配体在不对称催化研究中扮演着十分重要的角色。
目前,使用比较普遍的是具有“优势结构”的膦、亚砜以及亚磺酰胺类等手性配体。
本次实验通过合成结构简单的亚磺酰胺配体进行催化反应研究。
首先,在以前实验的基础上合成了几种手性亚磺酰胺-烯配体。
这些手性配体用于铑催化的芳基硼酸对环状α,β-不饱和酮的共轭加成反应。
以环己烯酮和芳基硼酸作为底物分别对手性配体、碱和溶剂的种类进行条件优化。
其次,在最优的实验条件下,分别对α,β-不饱和酮、硝基苯乙烯、苯偶酰、三氟苯乙酮等与一系列的芳基硼酸化合物进行反应普适性的考察。
药物分析实验论文手性药物拆分技术研究进展专业制药工程班级制药工程101班姓名苏阳学号 3100822018二零一三年七月目录手性药物拆分技术研究进展 (1)摘要 (1)1. 结晶法 (2)2. 组合拆分 (5)3. 复合拆分技术 (5)4. 色谱拆分技术 (6)5. 手性液-液萃取拆分法 (9)6. 膜分离法 (9)7. 酶法拆分技术 (10)8. 总结与期望 (10)手性药物拆分技术研究进展苏阳(西安理工大学应用化学系,西安 710048)【摘要】手性药物在当今世界的药物市场上发展十分迅猛,其根本原因即为当下很多手性药物都具有非常高的药理活性,在对抗一些恶性疾病上发挥着重要的作用。
而由于手性物质的不同对映体对生物体的生理活性有差异,这种差异不但遏制了手性药物的发展,更让人们付出了极大的代价。
基于此,手性药物的合成、分离又变得火热起来。
本文目的即在于综述前人对手性药物的分离方法,如色谱法、结晶法等,总结各种方法的优缺点,并关注当今世界前沿的拆分新技术,以求让手性药物能更好地为人类服务。
关键词:手性药物;拆分分离;外消旋体;Advances in the chiral drug resolutionsSU Yang(Faculty of Applied Chemistry, Xi’an University of Technology, Xi’an 710048China)Abstract There is a fast development of chiral drugs in the modern medicine market throughout the world, for the essencial reason that so many chiral drugs have a high performance in treating diseases, which other ingredients can’t replace. Whereas the chiral substances, which is called raceme, contain two different enantiomorphs that have distinctive effect on our body. Based on the condition, the essay is to trace the approaches that have discovered for separation as well as the lastest technology of chiral drugs’split. All in all, my aim is to make a clear summary of every way for its disadvantages or drawback and make the full use of the chiral medicine.Key Words: chiral drug; separation ; raceme;所谓手性,是指其分子的立体结构与它的镜像彼此不能互相重合的性质;而对映体则是指互为镜像关系且不能重合的一对分子。
⼿性与药物药物分⼦的⼿性与其功能综述华南师范⼤学莫晓东 20110006018摘要:⼿性是⾃然界的普遍特征。
构成⽣物⼤分⼦及⼩分⼦虽然从原⼦组成来看是⼀模⼀样,但其空间结构却成镜⾯关系,所以叫做⼿性分⼦。
⼿性药物的也就是化学组成⼀样,但它们各⾃药效、⽣理活性和药理存在差异的分⼦。
关键字:⼿性药物对映异构旋光异构体外消旋体药效治疗作⽤⼿性药物是指其分⼦⽴体结构和它的镜像彼此不能够重合,将互为镜像关系⽽⼜不能重合的⼀对药物结构称为对映体,对映体各有不同的旋光⽅向:左旋、右旋、外消旋,分别⽤(- )、(+)、(±)符号表⽰。
1.⼿性分⼦存在药效的差异⾃然状况下⼤多数分⼦的左旋和右旋各占50%,两种对映异构体等量混合表现为⽆旋光性,所以⼜称为外消旋体。
但不同空间异构的分⼦却可能存在截然相反的药效,往往只有其中的⼀种具有活性,另外⼀种甚⾄具有毒性。
如右图1,为药物沙利度胺(thalidomide俗称:反应停)的两种⼿性异构分⼦,有图可见仅⼀个碳上⾯连接的基团不同,具有完全不同的药效。
该药20世纪50年代最先在德国上市,作为镇静剂和⽌痛剂,主要⽤于治疗妊娠恶⼼、呕吐,因其疗效显著,不良反应轻且少,⽽迅速在全球⼴泛使⽤。
但是仅其中的R- 异构体有良好的镇静作⽤。
其中的S- 异构体,不但没有镇静作⽤还有其他严重的副作⽤。
上世纪50年代中期,欧洲和⽇本的孕妇服⽤外消旋的“反应停”⽽引起成千上万个婴⼉畸形。
服⽤过此药的孕妇中有不少产下海豚状畸形⼉,成为震惊国际医药界的悲惨事件。
这时间之后许多国家药政部门已对单⼀对映体作为药物的开发研究、专利申请和注册登记等都已开始作出相应的法律规定。
对具有⼿性分⼦的药物提出了指导原则。
说明药物中所含的对映体各⾃的药理作⽤、毒性和临床效果。
2、不同的⼿性分⼦的作⽤关系通过上⾯的沙利度胺的例⼦得出⼿性药物可能具有不同的药效,事实上⼿性药物还具有其他的相互作⽤。
2.1两种对映体⼀种有治疗药理活性,另⼀种产⽣毒副作⽤2.2两种对映体的药理活性可相互协同,具有互补作⽤2.3两种对映体⼀种有治疗药理活性,另⼀种产⽣毒副作⽤2.4对映体具有相反的活性。