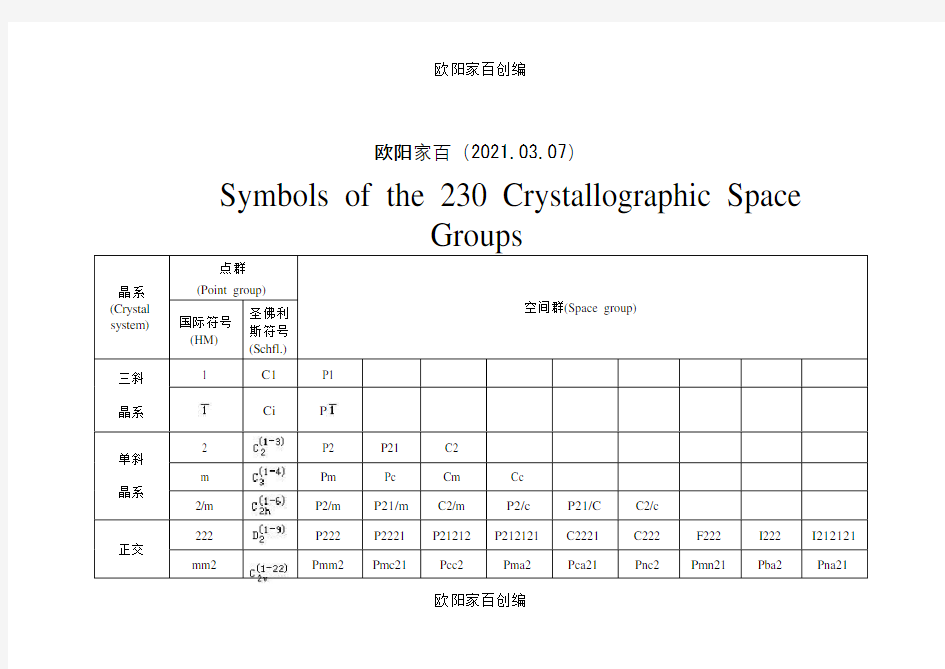
欧阳家百(2021.03.07)
Symbols of the 230 Crystallographic Space
晶系(Crystal system)
点群
(Point group)
空间群(Space group) 国际符号
(HM)
圣佛利
斯符号
(Schfl.)
三斜晶系1 C1P1
Ci P
单斜晶系
2 P2 P21 C2
m Pm Pc Cm Cc
2/m P2/m P21/m C2/m P2/c P21/C C2/c
正交
222 P222 P2221 P21212 P212121 C2221 C222 F222 I222 I212121
mm2 Pmm2 Pmc21 Pcc2 Pma2 Pca21 Pnc2 Pmn21 Pba2 Pna21
欧阳家百创编
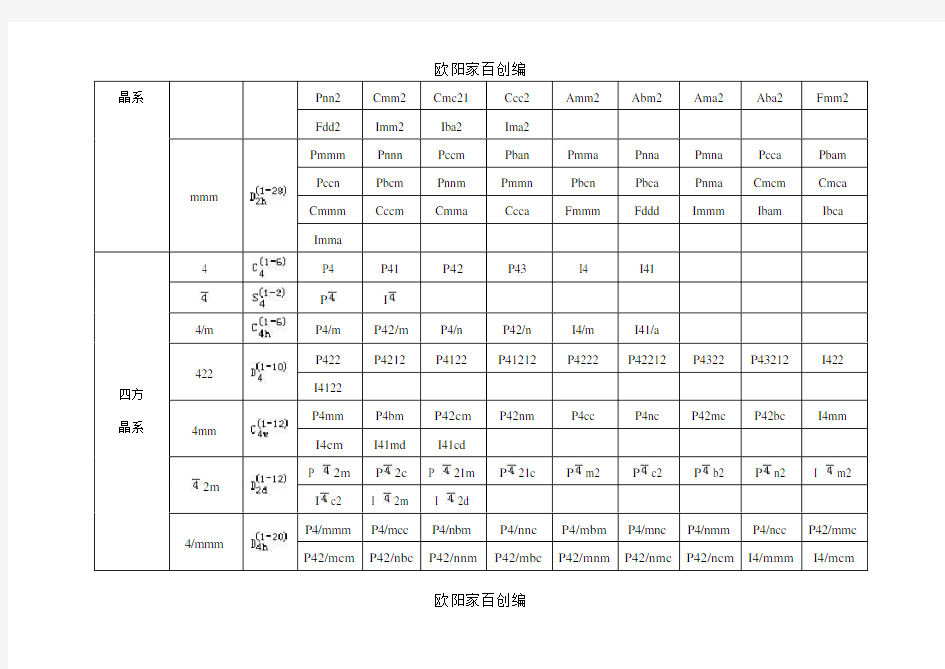
晶系Pnn2 Cmm2 Cmc21 Ccc2 Amm2 Abm2 Ama2 Aba2 Fmm2
Fdd2 Imm2 Iba2 Ima2
mmm Pmmm Pnnn Pccm Pban Pmma Pnna Pmna Pcca Pbam Pccn Pbcm Pnnm Pmmn Pbcn Pbca Pnma Cmcm Cmca Cmmm Cccm Cmma Ccca Fmmm Fddd Immm Ibam Ibca Imma
四方晶系
4 P4 P41 P42P43 I4 I41
P I
4/m P4/m P42/m P4/n P42/n I4/m I41/a
422
P422 P4212 P4122 P41212 P4222 P42212 P4322 P43212 I422
I4122
4mm
P4mm P4bm P42cm P42nm P4cc P4nc P42mc P42bc I4mm
I4cm I41md I41cd
2m
P 2m P2c P 21m P21c P m2 P c2 P b2 P n2 I m2
I c2 I 2m I 2d
4/mmm
P4/mmm P4/mcc P4/nbm P4/nnc P4/mbm P4/mnc P4/nmm P4/ncc P42/mmc
P42/mcm P42/nbc P42/nnm P42/mbc P42/mnm P42/nmc P42/ncm I4/mmm I4/mcm
欧阳家百创编
I41/amd I41/acd
三方晶系
3 P3 P31P32R3
P R
32 P312 P321 P3112 P3121 P3212 P3221 R32 3m P3m1 P31m P3c1 P31c R3m R3c
m P1m P 1c P m1 P c1 R m R c
六方晶系
6 P6 P61P65P62P64P63
P
6/m P6/m P63/m
622 P622 P6122 P6522 P6222 P6422 P6322 6mm P6mm P6cc P63cm P63mc
m2P m2 P c2 P 2m P2c
6/mmm P6/mmm P6/mcc P63/mcm P63/mmc
立方晶系23 P23 F23 I23 P213 I213
m Pm3 Pn3 Fm3 Fd3 Im3 Pa3 Ia3
432 P432 P4232 F432 F4132 I432 P4332 P4132 I4132 3m P 3m F 3m I3m P3n F3c I 3d
欧阳家百创编
m m Pm m Pn n Pm n Pn m Fm m Fm c Fd m Fd c Im m Ia d
1P 12P 13P 24P 215 C 2 6P m7P c8 C m9 C c10P 2/m
11P
21/
m
12 C 2/m13P 2/c14P 21/c15 C 2/c
16P 2
2 2
17P 2 2 2118
P 21
21 2
19
P 21 21
21
20 C 2 2 21
21C 2
2 2
22 F 2 2 223
I 2 2
2
24I 21 21 2125P m m 2
26P m
c 21
27P c c 228
P m
a 2
29P c a 2130P n c 2
31P m
n 21
32P b a 233
P n a
21
34P n n 235 C m m 2
36C m
c 21
37 C c c 238
A m
m 2
39 A b m 240 A m a 2
41A b
a 2
42 F m m 243
F d d
2
44I m m 245I b a 2
46I m 47P m m 48P n n 49P c c m50P b a n
欧阳家百创编
a 2m n
51P m
m a
52P n n a53
P m
n a
54P c c a55P b a m
56P c c
n
57P b c m58
P n n
m
59P m m n60P b c n
61P b c
a
62P n m a63
C m
c m
64 C m c a65 C m m m
66C c
c m
67 C m m a68
C c c
a
69 F m m m70 F d d d
71I m
m m
72I b a m73
I b c
a
74I m m a75P 4
76P 4177P 4278P 4379I 480I 41
81P 482I 483P
4/m
84P 42/m85P 4/n
86P
42/n
87I 4/m88
I
41/a
89P 4 2 290P 4 21 2
91P 41
2 2
92
P 41 21
2
93
P 42
2 2
94P 42 21 295P 43 2 2
96P 43
21 2
97I 4 2 298
I 41
2 2
99P 4 m m100P 4 b m
欧阳家百创编
101P 42
c m
102
P 42 n
m
10
3
P 4 c
c
104P 4 n c105P 42 m c
106P 42
b c
107I 4 m m
10
8
I 4 c
m
109I 41 m d110I 41 c d
111P 4
2 m
112P 4 2 c
11
3
P 4
21 m
114P 4 21 c115P 4 m 2
116P 4 c
2
117P 4 b 2
11
8
P 4 n
2
119I 4 m 2120I 4 c 2
121I 4 2
m
122I 4 2 d
12
3
P
4/m
m m
124P 4/m c c125P 4/n b m
126P
4/n
n c
127
P 4/m b
m
12
8
P
4/m
n c
129P 4/n m m130P 4/n c c
131P
42/
m m
c
132
P 42/m
c m
13
3
P
42/n
b c
134
P 42/n n
m
135P 42/m b c
136P
42/
m n
m
137
P 42/n
m c
13
8
P
42/n
c m
139I 4/m m m140I 4/m c m
欧阳家百创编
141I
41/a
m d
142
I 41/a c
d
14
3
P 3144P 31145P 32
146R 3147P 314
8
R 3149P 3 1 2150P 3 2 1
151P 31
1 2
152P 31 2 1
15
3
P 32
1 2
154P 32 2 1155R 3 2
156P 3
m 1
157P 3 1 m
15
8
P 3 c
1
159P 3 1 c160R 3 m
161R 3
c
162P 3 1 m
16
3
P 3 1
c
164P 3 m 1165P 3 c 1
166R 3
m
167R 3 c
16
8
P 6169P 61170P 65
171P 62172P 6417
3
P 63174P 6175P 6/m
176P
63/
m
177P 6 2 2
17
8
P 61
2 2
179P 65 2 2180P 62 2 2
181P 64
2 2
182P 63 2 2
18
3
P 6
m m
184P 6 c c185P 63 c m
186P 63 187P 6 m 218P 6 c 189P 6 2 m190P 6 2 c
欧阳家百创编
m c82
191P
6/m
m m
192
P 6/m c
c
19
3
P
63/m
c m
194
P 63/m m
c
195P 2 3
196F 2
3
197I 2 3
19
8
P 21
3
199I 21 3200P m 3
201P n
3
202 F m 3
20
3
F d 3204I m 3205P a 3
206I a 3207P 4 3 220
8
P 42
3 2
209 F 4 3 2210 F 41 3 2
211I 4 3
2
212P 43 3 2
21
3
P 41
3 2
214I 41 3 2215P 4 3 m
216F 4
3 m
217I 4 3 m
21
8
P 4 3
n
219 F 4 3 c220I 4 3 d
221P m
3 m
222P n 3 n
22
3
P m
3 n
224P n 3 m225 F m 3 m
226F m
3 c
227 F d 3 m
22
8
F d 3
c
229I m 3 m230I a 3 d
欧阳家百创编
晶体结构与性质 一、晶体的常识 1.晶体与非晶体 得到晶体的途径:熔融态物质凝固;凝华;溶质从溶液中析出 特性:①自范性;②各向异性(强度、导热性、光学性质等) ③固定的熔点;④能使X-射线产生衍射(区分晶体和非晶体最可靠的科学方法) 2.晶胞--描述晶体结构的基本单元.即晶体中无限重复的部分 一个晶胞平均占有的原子数=1 8×晶胞顶角上的原子数+1 4×晶胞棱上的原子+1 2×晶胞面上的粒子数+1×晶胞体心内的原子数 思考:下图依次是金属钠(Na)、金属锌(Zn)、碘(I 2)、金刚石(C)晶胞的示意图.它们分别平均含几个原子? eg :1.晶体具有各向异性。如蓝晶(Al 2O 3·SiO 2)在不同方向上的硬度不同;又如石墨与层垂直方向上的电导率和与层平行方向上的电导率之比为1:1000。晶体的各向异性主要表现在( ) ①硬度 ②导热性 ③导电性 ④光学性质 A.①③ B.②④ C.①②③ D.①②③④ 2.下列关于晶体与非晶体的说法正确的是( ) A.晶体一定比非晶体的熔点高 B.晶体一定是无色透明的固体 C.非晶体无自范性而且排列无序 D.固体SiO 2一定是晶体 3.下图是CO 2分子晶体的晶胞结构示意图.其中有多少个原子?
二、分子晶体与原子晶体 1.分子晶体--分子间以分子间作用力(范德华力、氢键)相结合的晶体 注意:a.构成分子晶体的粒子是分子 b.分子晶体中.分子内的原子间以共价键结合.相邻分子间以分子间作用力结合 ①物理性质 a.较低的熔、沸点 b.较小的硬度 c.一般都是绝缘体.熔融状态也不导电 d.“相似相溶原理”:非极性分子一般能溶于非极性溶剂.极性分子一般能溶于极性溶剂 ②典型的分子晶体 a.非金属氢化物:H 2O、H 2 S、NH 3 、CH 4 、HX等 b.酸:H 2SO 4 、HNO 3 、H 3 PO 4 等 c.部分非金属单质::X 2、O 2 、H 2 、S 8 、P 4 、C 60 d.部分非金属氧化物:CO 2、SO 2 、NO 2 、N 2 O 4 、P 4 O 6 、P 4 O 10 等 f.大多数有机物:乙醇.冰醋酸.蔗糖等 ③结构特征 a.只有范德华力--分子密堆积(每个分子周围有12个紧邻的分子) CO 2 晶体结构图 b.有分子间氢键--分子的非密堆积以冰的结构为例.可说明氢键具有方向性 ④笼状化合物--天然气水合物
1.3 晶体学基础(空间点阵) 金属及非金属材料在固态通常都是晶体,它们的许多特性都与其结晶状态有关。因此,作为材料科学工作者,首先要熟悉晶体的特征及其描述方法。本节将扼要地介绍晶体学的基础知识,包括以下几方面内容: (1)空间点阵及其描述、晶系和点阵类型。 (2)晶体取向的解析描述:晶面和晶向指数。 (3)晶体中原子堆垛的几何学,堆垛次序,四面体和八面体间隙。 熟练地掌握以上内容,关键是要多练习、多应用。以上内容不仅是学习材料课程的基础,也是学习其他许多专业课程(如X射线衍射、电子衍射、固体物理等)的基础。因此,要求学生对这些内容,能掌握得非常透彻、非常熟练。 一、晶体与非晶体 1 晶体的定义 物质的质点(分子、原子或离子)在三维空间作有规律的周期性重复排列所形成的物质叫晶体。 图1 金属及其他许多材料的长程有序排列 2 非晶体 非晶体在整体上是无序的,但原子间也靠化学键结合在一起,所以在有限的小范围内观察还有一定规律,可将非晶体的这种结构称为近程有序。 图 2 水蒸气的短程有序玻璃的短程有序 3 晶体的特征 (1)周期性 固态物质按其原子或分子的聚集状态可分为两大类,一类是晶体,另一类是非晶体。晶体的一个基本特征就是其中的原子或原子集团都是有规律地排列的,这个规律就是周期性,即不论沿晶体的哪个方向看去,总是相隔一定的距离就出现相同的原子或原子集团。这个距离也称为周期。显然,沿不同的方向有不同的周期。非晶体不具有上述特征。在非晶体中原子(或分子、离子)无规则地堆积在一起。液体和气体都是非晶体。在液体中,原子也处于相对紧密聚集的状态,但不存在长程的周期性排列。对于金属液体的结构,我们在学习后面的内容时将会有进一步的了解。 固态的非晶体实际上是一种过冷状态的液体,只是它的物理性质不同于通常的液体。玻璃是一个典型的固态非晶体,所以,往往将非晶态的固体称为玻璃态。 (2)有固定的凝固点和熔点 晶体还有一些其他的特点。例如,从液体到固态晶体的转变是突变的,有一定的凝固点
Symbols of the 230 Crystallographic Space Groups 晶系(Crystal system) 点群 (Point group) 空间群(Space group) 国际符号 (HM) 圣佛利斯 符号 (Schfl.) 三斜晶系1 C1P1 C i P 单斜晶系 2 P2 P21 C2 m P m P c C m C c 2/m P2/m P21/m C2/m P2/c P21/C C2/c
正交晶系222 P222 P2221 P21212 P212121 C2221 C222 F222 I222 I212121 mm2 Pmm2 Pmc21 Pcc2 Pma2 Pca21 Pnc2 Pmn21 Pba2 Pna21 Pnn2 Cmm2 Cmc21 Ccc2 Amm2 Abm2 Ama2 Aba2 Fmm2 Fdd2 Imm2 Iba2 Ima2 mmm Pmmm Pnnn Pccm Pban Pmma Pnna Pmna Pcca Pbam Pccn Pbcm Pnnm Pmmn Pbcn Pbca Pnma Cmcm Cmca Cmmm Cccm Cmma Ccca Fmmm Fddd Immm Ibam Ibca Imma 四方晶系4 P4 P41 P42P43 I4 I41 P I
4/m P4/m P42/m P4/n P42/n I4/m I41/a 422 P422 P4212 P4122 P41212 P4222 P42212 P4322 P43212 I422 I4122 4mm P4mm P4bm P42cm P42nm P4cc P4nc P42mc P42bc I4mm I4cm I41md I41cd 2m P 2m P2c P 21m P21c P m2 P c2 P b2 P n2 I m2 I c2 I 2m I 2d 4/mmm P4/mmm P4/mcc P4/nbm P4/nnc P4/mbm P4/mnc P4/nmm P4/ncc P42/mmc P42/mcm P42/nbc P42/nnm P42/mbc P42/mnm P42/nmc P42/ncm I4/mmm I4/mcm
个六元环共有。每个六元环实际拥有的碳原子数为 ______个。C-C键夹角:_______。C原子的杂化方式是______ SiO2晶体中,每个Si原子与个O原子以共价键相结合,每个O原子与个Si 原子以共价键相结合,晶体中Si原子与O原子个数比为。晶体中Si原子与Si—O键数目之比为。最小环由个原子构成,即有个O,个Si,含有个Si-O键,每个Si原子被个十二元环,每个O被个十二元环共有,每个Si-O键被__个十二元环共有;所以每个十二元环实际拥有的Si原子数为_____个,O原子数为____个,Si-O键为____个。硅原子的杂化方式是______,氧原子的杂化方式是_________. 知该晶胞中实际拥有的Na+数为____个 Cl-数为______个,则次晶胞中含有_______个NaCl结构单元。 3. CaF2型晶胞中,含:___个Ca2+和____个F- Ca2+的配位数: F-的配位数: Ca2+周围有______个距离最近且相等的Ca2+ F- 周围有_______个距离最近且相等的F——。 4.如图为干冰晶胞(面心立方堆积),CO2分子在晶胞中的位置为;每个晶胞含二氧化碳分子的个数为;与每个二氧化碳分子等距离且最近的二氧化
碳分子有个。 5.如图为石墨晶体结构示意图, 每层内C原子以键与周围的个C原子结合,层间作用力为;层内最小环有 _____个C原子组成;每个C原子被个最小环所共用;每个最小环含有个C原子,个C—C键;所以C原子数和C-C键数之比是_________。C原子的杂化方式是__________. 6.冰晶体结构示意如图,冰晶体中位于中心的一个水分子 周围有______个位于四面体顶角方向的水分子,每个水分子通过 ______条氢键与四面体顶点上的水分子相连。每个氢键被_____个 水分子共有,所以平均每个水分子有______条氢键。 7.金属的简单立方堆积是_________层通过_________对 _________堆积方式形成的,晶胞如图所示:每个金属阳离子的 配位数是_____,代表物质是________________________。 8.金属的体心立方堆积是__________层通过 ________对________堆积方式形成的,晶胞如图: 每个阳离子的配位数是__________.代表物质是 _____________________。
1 1. 金刚石晶体结构(硅单质相同) 1mol 金刚石中含有 mol C —C 键, 最小环是 元环,(是、否) 共平面。 每个C-C 键被___个六元环共有,每个C 被_____ 个六元环共有。每个六元环实际拥有的碳原子数为 ______个。C-C 键夹角:_______。C 原子的杂化方式是______ SiO 2晶体中,每个Si 原子与 个O 原子以共价键相结合, 每个O 原子与 个Si 原子以共价键相结合,晶体中Si 原子与 O 原子个数比为 。 晶体中Si 原子与Si —O 键数目之比 为 。最小环由 个原子构成,即有 个O , 个Si ,含有 个Si-O 键,每个Si 原子被 个十二元环,每 个O 被 个十二元环共有,每个Si-O 键被__个十二元环共 有;所以每个十二元环实际拥有的Si 原子数为_____个,O 原子数为____个,Si-O 键为____个。硅原子的杂化方式是______,氧原子的杂化方式是_________. 2 . 在NaCl 晶体中,与每个Na +等距离且最近的Cl -有 个, 这些Cl -围成的几何构型是 ;与每个Na +等距离且最近的 Na +有 个。由均摊法可知该晶胞中实际拥有的Na +数为____个 Cl -数为______个,则次晶胞中含有_______个NaCl 结构单元。 3. CaF 2型晶胞中,含:___个Ca 2+和____个F - Ca 2+的配位数: F -的配位数: Ca 2+周围有______个距离最近且相等的Ca 2+ F - 周围有_______个距离最近且相等的F ——。
2 4.如图为干冰晶胞(面心立方堆积),CO 2分子在晶胞 中的位置为 ;每个晶胞含二氧化碳分子的 个数为 ;与每个二氧化碳分子等距离且最 近的二氧化碳分子有 个。 5.如图为石墨晶体结构示意图, 每层内C 原子以 键与周围的 个C 原子结合,层间作用力为 ; 层内最小环有 _____个C 原子组成;每个C 原子被 个最小环所共用;每个 最小环含有 个C 原子, 个C —C 键;所以C 原子数和C-C 键数之比是_________。C 原子的杂化方式 是__________. 6. 冰晶体结构示意如图 ,冰晶体中位于中心的一个水分子 周围有______个位于四面体顶角方向的水分子,每个水分子通过 ______条氢键与四面体顶点上的水分子相连。每个氢键被_____个 水分子共有,所以平均每个水分子有______条氢键。 7. 金属的简单立方堆积是_________层通过_________对 _________堆积方式形成的,晶胞如图所示:每个金属阳离子的 配位数是_____,代表物质是________________________。 8. 金属的体心立方堆积是__________层通过 ________对________堆积方式形成的,晶胞如图: 每个阳离子的配位数是__________.代表物质是 _____________________ 。
晶体结构与性质 一、晶体的常识1.晶体与非晶体 晶体与非晶体的本质差异 晶体非晶体 自范性 有(能自发呈现多面体外形)无(不能自发呈现多面体外形) 微观结构 原子在三维空间里呈周期性有序排列 原子排列相对无序 晶体呈现自范性的条件:晶体生长的速率适当 得到晶体的途径:熔融态物质凝固;凝华;溶质从溶液中析出特性:①自范性;②各向异性(强度、导热性、光学性质等)③固定的熔点;④能使X-射线产生衍射(区分晶体和非晶体最可靠的科学方法)2.晶胞--描述晶体结构的基本单元,即晶体中无限重复的部分 一个晶胞平均占有的原子数=8×晶胞顶角上的原子数+4×晶胞棱上的原子+2×晶胞面上的粒子数+1×晶胞体心内的原子数 思考:下图依次是金属钠(Na)、金属锌(Zn)、碘(I2)、金刚石(C)晶胞的示意图,它们分别平均含几个原子? 1 1 1
eg:1.晶体具有各向异性。如蓝晶(Al2O3·SiO2)在不同方向上的硬度不同;又如石墨与层垂直方向上的电导率和与层平行方向上的电导率之比为1:1000。晶体的各向异性主要表现在() ①硬度②导热性③导电性④光学性质 A.①③ B.②④ C.①②③ D.①②③④ 2.下列关于晶体与非晶体的说法正确的是() A.晶体一定比非晶体的熔点高 B.晶体一定是无色透明的固体 C.非晶体无自范性而且排列无序 D.固体SiO2一定是晶体 3.下图是CO2分子晶体的晶胞结构示意图,其中有多少个原子? 二、分子晶体与原子晶体 1.分子晶体--分子间以分子间作用力(范德华力、氢键)相结合的晶体注意:a.构成分子晶体的粒子是分子 b.分子晶体中,分子内的原子间以共价键结合,相邻分子间以分子间作用力结合 ①物理性质 a.较低的熔、沸点 b.较小的硬度 c.一般都是绝缘体,熔融状态也不导电 d.“相似相溶原理”:非极性分子一般能溶于非极性溶剂,极性分子一般能溶于极性溶剂 ②典型的分子晶体 a.非金属氢化物:H2O、H2S、NH3、CH4、HX等 b.酸:H2SO4 、HNO3、
专题八分子结构与晶体结构 ★双基知识 1.几个基概念 化学键:相邻的两个或多个原子间强烈的相互作用 共价键:原子间通过共用电子对所形成的相互作用 离子键:阴、阳离子通过静电作用所形成的化学键 极性键:由不同元素的原子所形成的共价键 非极性键:由相同元素的原子所形成的共价键 金属键:金属阳离子与自由电子之间较强烈的作用叫金属键。 氢键: 范德华力(分子间作用力) 极性分子非极性分子 离子晶体分子晶体 原子晶体金属晶体 2.常见几种晶体的结构分析(点、线、面、体) (1)氯化钠晶体(2)氯化铯晶体(3)二氧化碳晶体(4)白磷分子的结构(5)C n的结构(6)金刚石晶体(7)二氧化硅晶体(8)石墨晶体 ★巧思巧解 (1)异类晶体:原子晶体(离子晶体)分别大于分子晶体
一般地,原子晶体>离子晶体>分子晶体 (2)同种类型晶体:构成晶体质点间的作用力大,则熔、沸点高,反之则小。 ①离子晶体:离子所带的电荷数越高,离子半径越小,离子键越强,则熔、沸点越高。 ②分子晶体:对于组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越大,则熔、沸点越高。 在同分异构体中,一般地,支链越多,熔、沸点越低。 ③原子晶体:原子半径越小,键长越短、键能越大,则熔、沸点越高 ④金属晶体:金属阳离子半径越小,离子所带的电荷越多,则金属键越强,金属熔、沸点越高 ★例题精析 [例1]:下列性质中,可以证明某化合物内一定存在离子键的是:( ) A .可以溶于水 B.具有较高的熔点 C .水溶液能导电 D.熔融状态能导电 [例2]:下列化合物中阴离子半径和阳离子半径之比最大的是: A .LiI B. NaBr C. KCl D. CsF [例3]:食盐晶体如右下图所示。在晶体中●表示Na +,○表示Cl - ,已知食盐的密度为ρg/cm 3, NaCl 的摩尔质量为M g/mol ,阿佛加得罗常数为N ,则在食盐晶体是Na +离子和Cl - 离子的 间距大约是: A . B. 3 2N M C. D. [例4]:根据石墨晶体结构示意图及提供的数据计算(保留三位有效数值)。有关公式、数据见框图。⑴12 g 石墨中,正六边形的数目有多少? ⑵求石墨密度。 ⑶求12克石墨的体积。
晶体对称性与空间群表 表3.1.七个晶系 三斜 triclinic a≠b ≠c; α≠β≠γ 单斜 monoclinic a≠ b≠ c; α = γ = 90o,β≠ 90o 正交 orthorhombic a≠b≠c; α= β = γ = 90o 四方 tetragonal a = b≠c; α = β = γ = 90o 六方 hexagonal a = b≠c;α = β = 90o, γ = 120o 三方 trigonal a = b = c; α=β= γ≠ 90o 立方 cubic a = b = c; α= β= γ= 90o 注释:表中“≠”仅指不需要等于。 表3.2.七个晶系的特征对称元素 晶系特征对称元素 三斜无 单斜一个二次对称轴或对称面 正交三个互相垂直的二次对称轴或两个互相垂直的对称面四方有一个四次对称轴 六方有一个六次对称轴 三方有一个三次对称轴 立方四个立方体对角线上有三次轴 注:对称轴包括旋转、螺旋轴;对称面包括镜面和滑移面。
cP cF cI 图3.5.14种Bravais晶格。aP = 三斜(triclinic), mP = 简单单斜(monoclinic primitive), mC = 底心单斜(monoclinic C-centered),oP = 简单正交(orthorombic primitive),oC = C 底心正交(orthorombic C-centered,取轴方法不同,可以相当于A心底),oI = 体心正交(orthorombic body-centered),oF = 面心正交(orthorombic face-centered),tP = 简单四方(tetragonal primitive),tI = 体心四方(tetragonal body-centered),hP = 简单三方或六方(trigonal or hexagonal primitive),hR = 菱面体、按六方取晶胞(Rhombohedral hexagonal setting),cP = 简单立方(cubic primitive),cI = 体心立方(cubic body-centered),cF = 面 心立方(cubic face-centered)。
第六章分子结构与晶体结构 教学内容: 1.掌握杂化轨道理论、 2.掌握两种类型的化学键(离子键、共价键)。 3.了解现代价键理论和分子轨道理论的初步知识,讨论分子间力和氢键对物质性质的影响。 教学时数:6学时 分子结构包括: 1.分子的化学组成。 2.分子的构型:即分子中原子的空间排布,键长,键角和几何形状等。 3.分子中原子间的化学键。 化学上把分子或晶体中相邻原子(或离子)之间强烈的相互吸引作用称为化学键。化学键可 分为:离子键、共价键、金属键。 第一节共价键理论 1916年,路易斯提出共价键理论。 靠共用电子对,形成化学键,得到稳定电子层结构。 定义:原子间借用共用电子对结合的化学键叫做共价键。 对共价键的形成的认识,发展提出了现代价键理论和分子轨道理论。 1.1共价键的形成 1.1.1 氢分子共价键的形成和本质(应用量子力学) 当两个氢原子(各有一个自旋方向相反的电子)相互靠近,到一定距离时,会发生相互作用。每个H原子核不仅吸引自己本身的1s电子还吸引另一个H原子的1s电子,平衡之前,引力>排斥力,到平衡距离d,能量最低:形成稳定的共价键。 H原子的玻尔半径:53pm,说明H2分子中两个H原子的1S轨道必然发生重叠,核间形成一个 电子出现的几率密度较大的区域。这样,增强了核间电子云对两核的吸引,削弱了两核间斥力,体系能量降低,更稳定。(核间电子在核间同时受两个核的吸引比单独时受核的吸引要小,即位能低,∴能量低)。
1.1.2 价键理论要点 ①要有自旋相反的未配对的电子 H↑+ H↓ -→ H↑↓H 表示:H:H或H-H ②电子配对后不能再配对即一个原子有几个未成对电子,只能和同数目的自旋方向相反的未成对电子成键。如:N:2s22p3,N≡N或NH3 这就是共价键的饱和性。 ③原子轨道的最大程度重叠 (重叠得越多,形成的共价键越牢固) 1.1.3 共价键的类型 ①σ键和π键(根据原子轨道重叠方式不同而分类) s-s :σ键,如:H-H s-p :σ键,如:H-Cl p-p :σ键,如:Cl-Cl π键, 单键:σ键 双键:一个σ键,一个π键 叁键:一个σ键,两个π键 例:N≡N σ键的重叠程度比π键大,∴π键不如σ键牢固。 σ键π键 原子轨道重叠方式头碰头肩并肩 能单独存在不能单独存在 沿轴转180O符号不变符号变 牢固程度牢固差 含共价双键和叁键的化合物的重键容易打开,参与反应。
空间点阵型式:14种布拉维格子-兰州大学结构化学 在七大晶系基础上, 如果进一步考虑到简单格子和带心格子, 就会产生14种空间点阵型式, 也叫做14种布拉维格子. 不过, 格子是否带心并不能从宏观上发现, 所以, 空间点阵型式属于微观对称性的范畴. 为什么要考虑带心格子呢? 原因是: 有些点阵中的格子, 如果取成某种复格子就能充分表现出它固有的较高对称性,但若取成素格子, 某些对称性就可能被掩盖,表现为较低的对称性. 我们宁愿观察一个高对称性的复格子, 也不愿观察一个低对称性的素格子. 所以, 选取正当格子时, 首先照顾高对称性, 其次才考虑点阵点尽可能少. 前面以NaCl型晶体的格子为例讲过, 若取素格子, 只能表现三方对称性(这是一种三方R,现已不用); 若取作立方面心复格子,就表现出了立方对称性. 当然, 这并不是说格子的选取方式能够改变点阵本身的对称性, 只是说, 点阵固有的较高对称性, 在素格子上被掩盖而不易表现出来. 图6-42 NaCl型晶体的立方面心复格子(正当格子)与素格子那么, 任何点阵都能通过取带心格子表现出更高的对称性吗? 否! 例如, 在三斜晶体的点阵中, 无论取多少点, 格子的对称性也仍是三斜. 我们当然不去徒劳无益地选择带心格子. 下面给出在七大晶系基础上进一步考虑简单和带心格子所产生的14种空间点阵型式, 即14种布拉维格子: 图6-43 14种空间点阵型式(布拉维格子)对于以上两种六方格子需要特别说明几点:(1)图中只有蓝色线条围成的部分才是六方格子,而灰白色部分只是为了便于观察其对称性才画出的,因为六方格子也必须是平行六面体而不能是六棱柱;(2)六方晶系的晶体按六方晶胞表达只能抽象出六方简单(hP)格子,而三方晶系的晶体按六方晶胞表达时则能抽象出六方简单(hP)和六方R
分子结构与晶体结构 ★双基知识 几个基概念 化学键:相邻的两个或多个原子间强烈的相互作用 共价键:原子间通过共用电子对所形成的相互作用 离子键:阴、阳离子通过静电作用所形成的化学键 极性键:由不同元素的原子所形成的共价键 非极性键:由相同元素的原子所形成的共价键 金属键:金属阳离子与自由电子之间较强烈的作用叫金属键。 氢键: 范德华力(分子间作用力) 极性分子非极性分子 离子晶体分子晶体 原子晶体金属晶体 2.常见几种晶体的结构分析(点、线、面、体) (1)氯化钠晶体(2)氯化铯晶体(3)二氧化碳晶体(4)白磷分子的结构 (5)Cn的结构(6)金刚石晶体(7)二氧化硅晶体(8)石墨晶体★巧思巧解 2.四种晶体的比较
晶体类型离子晶体原子晶体分子晶体金属晶体 存在粒子 粒子间作用 熔、沸点 硬度 溶解性 导电性 实例 3.晶体熔、沸点比较 (1)异类晶体:原子晶体(离子晶体)分不大于分子晶体 一样地,原子晶体>离子晶体>分子晶体 (2)同种类型晶体:构成晶体质点间的作用力大,则熔、沸点高,反之则小。 ①离子晶体:离子所带的电荷数越高,离子半径越小,离子键越强,则熔、沸点越高。 ②分子晶体:关于组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越大,则熔、沸点越高。 在同分异构体中,一样地,支链越多,熔、沸点越低。 ③原子晶体:原子半径越小,键长越短、键能越大,则熔、沸点越高 ④金属晶体:金属阳离子半径越小,离子所带的电荷越多,则金属键越强,金属熔、沸点越高 ★例题精析 [例1]:下列性质中,能够证明某化合物内一定存在离子键的是:()A.能够溶于水 B.具有较高的熔点 C.水溶液能导电 D.熔融状态能导电 [例2]:下列化合物中阴离子半径和阳离子半径之比最大的是: A.LiI B. NaBr C. KCl D. CsF [例3]:食盐晶体如右下图所示。在晶体中●表示Na+,○表示Cl-,已知食盐的密度为ρg/cm3,NaCl的摩尔质量为M g/mol,阿佛加得罗常数为N,则在食盐晶体是Na+离子和Cl-离子的间距大约是:
1.2 晶体的对称性:晶系,点群,空间群 一. 对称性的概念 二. 晶体中允许的对称操作 三. 晶体宏观对称性的表述:点群 四. 七个晶系和14种晶体点阵 五. 晶体的微观对称性:空间群 六. 点群对称性和晶体的物理性质 参考:黄昆书1.5-1.7 节 阎守胜 2.2 节 ?除去晶体点阵外,晶体的结构还能够用什么样的语言方便地描述?
一.对称性的概念: 一个物体(或图形)具有对称性,是指该物体(或图形)是由两个或两个以上的部分组成,经过一定的空间操作(线性变换),各部分调换位置之后整个物体(或图形)保持不变的性质。对称操作:维持整个物体不变而进行的操作称作对称操作。即:操作前后物体任意两点间的距离保持不变的操作。 点对称操作:在对称操作过程中至少有一点保持不动的操作。有限大小的物体,只能有点对称操作。对称元素:对称操作过程中保持不变的几何要素:点,反演中心;线,旋转轴;面,反映面等。
● ●
以上,考察在一定几何变换之下物体的不变性,使用的几何变换(旋转和反射)都是正交变换——保持两点距离不变的变换:1112 132122 233132 33'''x a a a x y a a a y z a a a z ? ???????????=??? ???????????????i 11 121321 222331 3233i j a a a A a a a a a a ????=?????? 其中A ij 为正交矩阵从解析几何知道,符合正交 变换的是:绕固定轴的转动 (Rotation about an axis) 绕z 轴旋转θ角cos sin 0sin cos 0001i j A θ θθ θ?????=?????? 数学上可以写作:
第七章分子结构与晶体结构 第一节离子键 一、离子键的形成和特征 1、离子键的形成 电负性I1或Y1(KJ/mol) 电离能很小的金属原子:Na 0.9 496 K 0.8 419 电子亲合能很大的非金属原子:Cl 3.0 -348.8 O 3.5 -141 电负性相差大的元素相遇,一失电子,一得电子,它们之间以静电引力相结合,形成离子键。 ④:阳阴离子间具有静电引力,两原子的电子云间存在排斥力,两原子核间存在相互排斥力,当两原子接近到一定距离,引力=斥力,(此时整个体系能量最低),形成离子键。 2、离子键的特征 ① 本质:阴、阳离子间的静电引力 ② 无方向性、饱和性 只要空间允许,尽可能多地吸引带相反电荷的离子(任何方向,尽可能多)。但总体来说,有一定比例。 二、离子的特性 1、离子的电荷 离子化合物AmBn:A n+,B m- +n﹥+3,很少见 2、离子的电子层结构 简单阴离子的电子构型,一般与同周期希有气体原子电子层构型相同。 简单的阳离子构型:
3、离子半径 将阴阳离子看成是保持着一定距离的两个球体。 d = r+ + r-单位:pm(10-12m) 规律: ①同一元素: 负离子半径>原子半径>正离子半径 低价负离子半径>高价负离子半径 低价正离子半径>高价正离子半径 例: ②同一周期 从左到右,阳离子:正电荷数↑,半径↓ 阴离子:负电荷数↓,半径↓ ③同一主族 电荷数基本相同,从上到下,半径↑(∵电子层增加) 离子半径↓,离子间引力↑,离子键强度↑,熔、沸点↑,硬度↑ 第二节共价键理论 1916年,路易斯提出共价键理论。 靠共用电子对,形成化学键,得到稳定电子层结构。 定义:原子间借用共用电子对结合的化学键叫作共价键。 对共价键的形成的认识,发展提出了现代价键理论和分子轨道理论。
高中化学竞赛 晶体结构中的空间点阵 空间点阵到底有多少种排列形式?按照“每个阵点的周围环境相同”的要求,在这样一个限定条件下,法国晶体学家布拉菲(A. Bravais)曾在1848年首先用数学方法证明,空间点阵只有14种类型。这14种空间点阵以后就被称为布拉 菲点阵。 空间点阵是一个三维空间的无限图形,为了研究方便,可以在空间点阵中取一个具有代表性的基本小单元,这个基本小单元通常是一个平行六面体,整个点阵可以看作是由这样一个平行六面体在空间堆砌而成,我们称此平行六面体为单胞。当要研究某一类型的空间点阵时,只需选取其中一个单胞来研究即可。在同一空间点阵中,可以选取多种不同形状和大小的平行六面体作为单胞,如图1-8 所示。一般情况下单胞的选取有以 图1-8 空间点阵及晶胞的不同取法图1-9面心立方阵胞中的固体物理原胞
图1-10晶体学选取晶胞的原则 下两种选取方式: 1.固体物理选法 在固体物理学中,一般选取空间点阵中体积最小的平行六面体作为单胞,这样的单胞只能反映其空间点阵的周期性,但不能反映其对称性。如面心立方点阵的固体物理单胞并不反映面心立方的特征,如图1-9所示。 2.晶体学选法 由于固体物理单胞只能反映晶体结构的周期性,不能反映其对称性,所以在晶体学中,规定了选取单胞要满足以下几点原则(如图1-10所示): ①要能充分反映整个空间点阵的周期性和对称性; ②在满足①的基础上,单胞要具有尽可能多的直角; ③在满足①、②的基础上,所选取单胞的体积要最小。 根据以上原则,所选出的14种布拉菲点阵的单胞(见图1-12)可以分为两大类。一类为简单单胞,即只在平行六面体的 8个顶点上有结点,而每个顶点处的结点又分属于 8个相邻单胞,故一个简单单胞只含有一个结点。另一类为复合单胞(或称复杂单胞),除在平行六面体顶点位置含有结点之外,尚在体心、面心、底心等位置上存在结点,整个单胞含有一个以上的结点。14种布拉菲点 阵中包括7个简单单胞,7个复合单胞。
第2~3章 分子结构与晶体结构 1、已知下列表中数据,求KCl 晶格能 2、写出氯酸根离子 ClO 3- 的路易斯结构式. Cl 原子的电负性小于O 原子,意味着不存在 O -O 之间的键合. 合理的排布应该如下所示: ClO 3-离子中价电子总数等于26(四个原子的价电子数相加再加1), 扣除3个单键的6个电子,余下的20个电子以孤对方式分配给四个原子, 使它们均满足八隅律的要求. 3、判断 OF 2、XeF 4分子的基本形状. 写出路易斯结构式, 并读出中心原子周围价电子对的总数:中心原子价层有4对电子. 4 对价电子的理想排布方式为正四面体, 但考虑到其中包括两个孤对, 所以分子的实际几何形状为角形, 相当于 AB 2E 2 型分子. E D I S H U U E D I S H -+++?-=∴-+-++ +=?21 )()(2 1 θf θf Cl O O O Cl O O O F — O —
XeF4中心原子价层有6 对电子. 理想排布方式为正八面体, 但考虑到其中包括两个孤对, 所以分子的实际几何形状为平面四方形, 相当于AB4E2 型 分子. 苯、二氧化碳、臭氧、碳酸根分子的化学键(1)、苯分子中的p-p大π键苯分子中碳原子采用sp2杂化,3个杂化轨道分别用于形成3个σ键,故苯分子有键角为120 °的平面结构的σ骨架,苯分子的每个碳原子尚有一个未参加杂化的p轨道,垂直于分子平面而相互平行,6 个“肩并肩”的平行p轨道上共有6个电子在一起形成弥散在整个苯环的p-p大π键,符号为π 6 6(2)、二氧化碳分子里的大π键 分子中碳原子采用sp杂化,形成直线型的分子σ骨架O-C- O ,每个碳原子尚有二个未参加杂化的p轨道,其空间取向为相互垂直且与sp杂化轨道的 轴呈正交关系。形成两套3原子4电子符号为π 3 4的p-p大π键(3)、臭氧中的大π键 分子的中心氧原子采用sp2杂化,形成平面三角形,中心氧原子尚有一个未参加杂化的p轨道,垂直于分子平面,端位的2个氧原子也各有一个垂直于 分子平面的p轨道,“肩并肩” 形成符号为π 3 4的p-p大π键(4)、碳酸根中的大π键分子中碳原子采用sp2杂化,形成平面三角形,碳原子尚有一个未参加杂化的p轨道,垂直于分子平面,端位的3个氧原子也各有一个垂直于分子 平面的p轨道,“肩并肩” 形成符号为π 46的p-p大π键(1)CO 2 、CNS-、NO 2 +、N 3-通式AX 2 ,价电子数16,直线型,2个л4 3 (2)CO 3 2-、NO 3 -、SO 3 通式AX 3,总价电子数24,平面三角形,1个л6 4 (3)SO 2 、O 3 、NO 2 -通式 AX 2 ,价电子数18,V字型, (4)SO 42-、PO 4 3-通式AX 4 ,价电子数32,正四面体(5)PO 3 3-、SO 3 2-、 ClO 3-通式AX 3 ,价电子数26,三角锥型
1 空间点阵与晶体结构的异同 空间点阵晶体结构 人为的、抽象的几何图形客观的 具有具体的物质内容,其基本的单元是结构单元(原子或离子)组成空间点阵的结点是没有物质内容的几何点 结构单元与结点在空间排列的周期是一致的,或者说它们具有同样的T矢量; 抽象的空间点阵不能脱离具体的晶体结构而单独存在,所以它不是一个无物质基础的纯粹的几何图形。这种抽象能更深入地反映事物的本质与规律,因此是一个科学的抽象。 空间点阵只是一个几何图形,它不等于晶体内部具体的格子构造,是从实际晶体内部结构中抽象出来的无限的几何图形。虽然对于实际晶体来说,不论晶体多小,它们所占的空间总是有限的,但在微观上,可以将晶体想象成等同点在三维空间是无限排列的。 2 在同一行列中结点间距是相等的; 在平行的行列上结点间距是相等的; 不同的行列,其结点间距一般是不等的(某些方向的行列结点分布较密;另一些方向行列结点的分布较疏。) 3 面网密度:面网上单位面积内结点的数目面网间距:任意2个相邻面网的垂直距离相互平行的面网的面网密度和面网间距相等面网密度大的面网其面网间距也大 4 宏观晶体中对称要素的集合,包含了宏观晶体中全部对称要素的总和以及它们相互之间的组合关系 (1)对称变换的集合——对称变换群 (2)对称要素的集合——对称要素群合称对称群 在宏观晶体中所存在的对称要素都必定通过晶体的中心,因此不论对称变换如何,晶体中至少有一个点是不变的,所以将对称型称为点群,该点称为点群中心 5 点阵几何元素的表示法 ☆坐标系的确定 任一点阵结点------------坐标原点单位平行六面体的三个互不平行的棱---坐标轴点阵常数a、b、c所代表的三个方向---x、y、z轴坐标单位:a、b、c ☆结点的位置表示法 以它们的坐标值来表示的。 6 晶向的表示法 晶向—空间点阵中由结点连成的结点线和平行于结点线的方向 晶向指数uvw—通过原点作一条直线与晶向平行,将这条直线上任一点的坐标化为没有公约数的整数。 晶向符号:[uvw] B点坐标:111 OB的晶向符号:[111] A点坐标:1 2/3 1 OA的晶向符号:[323] 负值表示为:[32-3] X-轴方向为[100] Y-轴方向为[010] Z-轴方向为[001] 7 晶面的表示法 点阵中的结点全部分列在一系列平行等距离的平面上,这样的平面——晶面 显然,点阵中的平面可以有无数组 对于一组平行的等距离的晶面,可用密勒(miller)指数表示 令这组平行晶面中的一个面通过原点,其相邻面与x、y、z轴截距分别为r、s、t 然后取倒数h=1/r,k=l/s,l=l/t
第七章分子结构与晶体结构 序言 第一节离子键 第二节共价键理论 第三节杂化轨道理论与分子几何构型第四节晶体的特征 第五节离子晶体 第六节原子晶体 第七节分子间力和氢键 第八节金属晶体 第九节离子极化 第十节混合型晶体
序言: v原子怎样结合成为分子?-化学键?离子键 Link ?共价键 ?金属键 v分子的形状?-分子构型 ?价电子对互斥理论 v分子怎样组成物质材料?-分子间作用力v固体材料的结构? -晶体结构 -无定型结构
价电子(Valence electrons )·····H ·He ::N ··O ·:Cl ·K ·Mg: :Ne :· ·········K ·+ :Cl ·→K +[:Cl:]- ····失或得电子→稳定结构(主族) Loss or gain electrons →octet rule 为什么惰性气体稳定? n s 2n p 6 八电子层结构 ????
化学键—分子中的两个(或多个)原子之间的相互作用 第一节离子键 1916 年德国科学家Kossel( 科塞尔) 提出离子键理论 一离子键的形成(以NaCl为例) 第一步电子转移形成离子: Na -e ——Na+,Cl+ e ——Cl- 相应的电子构型变化: 2s 2 2p 6 3s 1——2s 2 2p 6 ,3s 2 3p 5 ——3s 2 3p 6 形成Ne和Ar的稀有气体原子的结构,形成稳定离子。
第二步靠静电吸引,形成化学键。 体系的势能与核间距之间的关系如图所示: V Vr0 r0r 横坐标核间距r ;纵坐标体系的势能V。 纵坐标的零点当r 无穷大时,即两核之间无限远时的势能。 下面来考察Na+和Cl-彼此接近的过程中,势能V 的变化。 ,当r 减小时,正负离子靠静电相互吸图中可见:r > r 引,势能V 减小,体系趋于稳定。
1 普化无机试卷(分子结构和晶体结构四) 答案 一、问答题 1. (9990) (1) +0.5,变短;(2) -0.5,变长;(C) +0.5,变短 2. (9991) 在一般的分子或离子中,作为端基氧经常与中心成双键,故氧提供2个电子,即一对电子,但在处理双键时,要在电子对数上减去1,其结果与认为氧提供电子数为零,与不按双键处理是一致的。 3. (9992) 中心原子不带孤对电子时,五配位主族元素的化合物分子采用三角双锥结构,如PX 5、X:卤素等;反之,若中心原子有一对孤对电子,化合物分子将采用四方锥结构,如BrF 5和XeOF 4等。 4. (9993) 因BF 3分子中B —F 间除形成σ 键外还生成了∏46大π 键,因而使B —F 键比B —F 平均 键长要短。 5. (9994) 以x 轴为键轴,ns - ns 、np x - np x 重叠形成σ键,其化学键的强弱与原子核间的距离和轨道重叠大小有关。s 轨道是球型对称的,而p x 轨道具有方向性,因此,一般是np x - np x 形成的化学键强。但H 的原子半径特别小,H 2分子的核间距离小,1s - 1s 能有效重叠,而F 的原子半径小有孤对电子对,F 2分子中孤对电子之间排斥作用大,导致2p x - 2p x 形成化学键的键能小。 6. (9995) (1) 八面体,五角双锥体 (2) IF 7 + SbF 5?→? [IF 6][SbF 6] 7. (9996) 乙腈的结构式为CH 3—C ≡N ,甲胩的结构式为CH 3—N ≡C ,CH 3CN 更稳定 ( m f H ?(CH 3CN) = -150 kJ ·mol -1, m f H ?(CH 3NC) = -88 kJ ·mol -1)。两种分子中化学键的键数相同,但C —C 键比C —N 键稳定,故CH 3CN 更稳定。 8. (9997) NF 3 BF 3 ClF 3 N 以sp 3杂化 B 以sp 2杂化 Cl 以sp 3d 杂化 三角锥 平面三角形 近似T 型 取向力,诱导力,色散力 色散力 取向力,诱导力,色散力 9. (9998) (1) (2) (3) (4) (5) BF 3 →BF 4- H 2O → H 3O + PCl 5 →PCl 4 + PCl 5 →PCl 6- AlCl 3 → Al 2Cl 6 Sp 2 → sp 3 sp 3 → sp 3 sp 3d → sp 3 sp 3d → sp 3d 2 sp 2 → sp 3 平面三角形 → 正四面体 V 形 → 三角锥形 三角双锥形 → 正四面体形 三角双锥形 → 正八面体形 平面三角形 → 两个正四面体共棱
第六章分子结构和晶体结构P116 1) 指出下列分子的中心原子可能采用的杂化轨道类型,并写出它们的空间构型以及分子的偶极矩(是否为零)。 ① SiH4; ② BBr3; ③ BeH2; ④ PH3; ⑤ H2S。 解: 分子空间构型分子偶极矩化合物名称中心原子杂化轨道类 型 ① SiH4sp3等性杂化正四面体m=0 ② BBr3sp2等性杂化平面三角形m=0 ③ BeH2sp等性杂化直线型m=0 ④ PH3sp3不等性杂化三角锥形m≠0 ⑤ H2S sp3不等性杂化V型m≠0 2) 解释H2S 和BeCl2都是三原子分子,为何前者为V形,后者为直线形? 答:因为H2S 中S是sp3不等性杂化,BeCl2中Be是sp等性杂化。 3) 指出下列各分子之间存在哪几种分子间作用力(包括氢键)。①H2分子间;②H2O分子间;③ H2O-O2分子间;④ HCl-H2O分子间;⑤ CH3Cl分子间。 解:① H2分子间;(非极性分子间)只有色散力 ② H2O分子间;(极性分子间)取向力,诱导力,色散力,氢键 ③ H2O-O2分子间;诱导力和色散力 ④ HCl-H2O分子间;色散力,取向力,诱导力 ⑤ CH3Cl分子间。取向力,诱导力,色散力 4) 写出下列各离子的外层电子构型,并说明各离子分别属于哪一类电子构型(8电子,18电子,18+2电子,9~17电子构型)。 ① Mg2+;② Fe2+;③ Ag+;④ Cu2+;⑤ Zn2+;⑥ Sn2+。 解: 离子外层电子构型电子构型
① Mg2+2s22p68e ② Fe2+2s22p63d69~17e ③ Ag+4s24p64d1018e ④ Cu2+3s23p63d99~17e ⑤ Zn2+3s23p63d1018e ⑥ Sn2+4s24p64d105s218+2e 5) 判断下列各组中两种物质的溶点高低。 ① NaCl和MgO;② BaO和CaO;③ SiC和SiH4;④ NH3和PH3。 解:① MgO>NaCl (Z+?Z-MgO>NaCl) ② CaO>BaO (r+?r-BaO>CaO) ③ SiC>SiH4 (SiC 原子晶体SiH4 分子晶体) ④ NH3>PH3 (NH3 分子间氢键PH3 无分子间氢键) 6) 为什么①室温下CH4为气体,CCl4为液体;而CI4为固体? ② H2O的沸点高于H2S,而CH4的沸点却低于SiH4? 解:①因为从CH4、CCl4 到CI4 分子量增大,色散力逐渐增大,分子间作用力增大;所以室温下CH4为气体,CCl4为液体;而CI4为固体。②因为H2O分子间存在氢键,所以其沸点高于H2S;CH4和SiH4 分子间都不存在氢键,只有正常分子间作用力。SiH4 因其分子量大,分子间色散力强,所以其沸点高于CH4。 7) 试判断下列各种物质各属何种晶体类型以及晶格结点上微粒间作用力,并写出熔点从高到低的顺序。① KCl;② SiO2;③ HCl;④ CaO。 解:熔点由高到低的顺序为: ② SiO2;>④ CaO;>① KCl;>③ HCl 晶体类型:②原子晶体;④离子晶体;①离子晶体;③分子晶体。 晶格结点上微粒间作用力:②共价键;④离子键;①离子键;③分子间力。 8) 乙醇和二甲醚(CH3OCH3)的组成相同,但前者的沸点为78.5 oC,而后者的沸点为-23 oC。为什么? 解:乙醇和二甲醚为同分异构体,同属极性分子,但乙醇分子间因存在氢键而使其沸点高于二甲醚。