
业务知识
我公司主要经销产品:镀锌板、彩钢板
一、金属的分类:
铁(Fe)、钢
二、铁的分类:
有色金属、黑色金属、稀有金属、贵重金属
三、钢的分类:
1、按形态分:型材、管材、板材及金属制品
2、按含碳量分:低碳钢、中碳钢、高碳钢(碳含量分别为≤0.25% 0.25~0.6% ≥0.6%)
3、按生产方法分:热轧钢板、冷轧钢板
4、按表面特征分:镀锌板、镀锡板、彩涂板
⑴镀锡板的主要用途:马口铁
5、按用途分:桥梁、锅炉、造船、汽车、电工(硅钢片=矽钢)
四、铁的五大元素:
Fe:C、Si、S、P、Mn
延伸知识:C决定加工性和机械性能及硬度
其他元素决定用途
Mn含量高的一般用于化工
五、生产顺序:
铁矿石(矿粉)——钢坯——热轧——酸洗——冷轧——镀锌板——彩钢板
六、热轧钢板(卷):
1、钢板与钢卷的区别:卷,以卷曲的形态,长度不限;板,长度有限。
2、规格:厚度1—8mm 宽度840—1600mm 吨位8—16吨
窄带<600mm 宽带(带钢)>600mm
七、酸洗卷:以热轧卷为基板
1、定义,热轧卷用一定比例浓度配制的盐酸洗带钢,酸洗后带钢表面呈银白色。
2、酸洗前热轧卷表面的红锈成分为FeO、Fe
2O
3
、Fe
3
O
4
八、冷轧卷:以酸洗卷为基板
1、分类:冷轧板、轧硬板区别:冷轧板经过退火,轧硬板未经退火。
2冷轧机组:
压力滚
(12辊轧机)
(20辊轧机)
辊数多少决定冷轧卷薄厚。
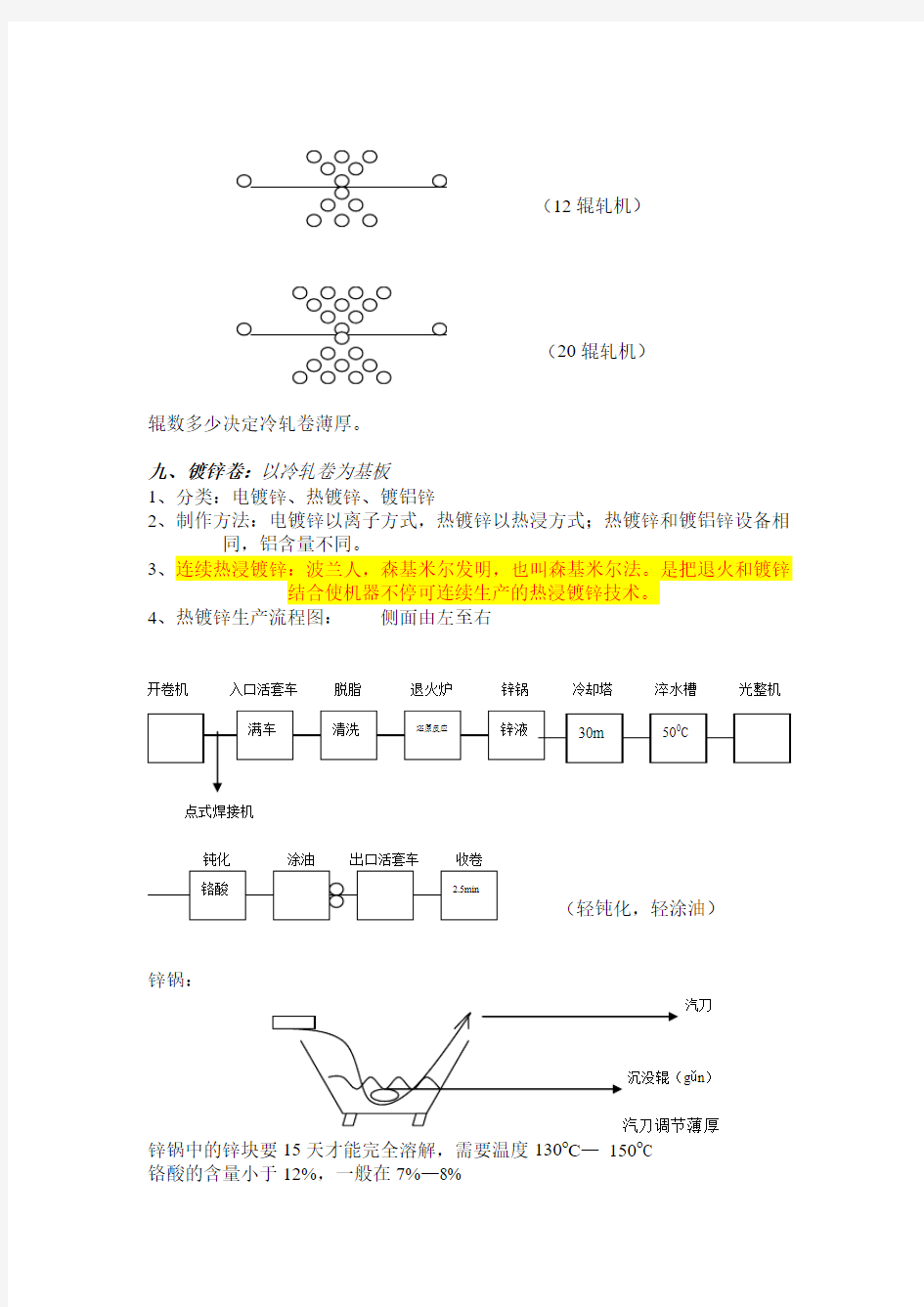
九、镀锌卷:以冷轧卷为基板
1、分类:电镀锌、热镀锌、镀铝锌
2、制作方法:电镀锌以离子方式,热镀锌以热浸方式;热镀锌和镀铝锌设备相
同,铝含量不同。
3、连续热浸镀锌:波兰人,森基米尔发明,也叫森基米尔法。是把退火和镀锌
结合使机器不停可连续生产的热浸镀锌技术。
4、热镀锌生产流程图: 侧面由左至右
开卷机 入口活套车 脱脂 退火炉 锌锅 冷却塔 淬水槽 光整机
点式焊接机
钝化 涂油 出口活套车 收卷
(轻钝化,轻涂油)
锌锅:
汽刀
g ǔn )
锌锅中的锌块要15天才能完全溶解,需要温度130o C — 150o C
铬酸的含量小于12%,一般在7%—8%
5、区别:锌层:1M2内双面镀锌的重量;转化层+油漆层=锌层厚度。
电镀锌:锌层≤50g≈4—6μm;无锌花;一般用于镀锌工具
热镀锌:锌层≥50g 用途:彩基料民用,一般用带锌花的。
镀铝锌(镀铝锌硅):含量,铝55%、锌43.5%、硅1.5%。其中硅决定表面不规
则晶格。使用寿命是热镀锌的5—8倍。主要用于工业、高
压电柜。铝隔热效果好600o C。做彩涂板的优势,不影响出
米数。
6、表面处理:①钝化 L ②涂油 Y ③耐指纹 N 轻钝化,轻涂油
7、表面结构的分类及代号:E:正常锌花G:光整N:无锌花
X:小锌花GX:光整小锌花R:锌铁合金8、锌花:
锌花的形成:枝晶由铅组成,枝晶长短和冷却程度有关;锌花的中心点由锑组成。锌锅中加入铅和锑形成锌花。
大锌花3—5公分
锌花的作用:就是美观
有锌花的地方是镀锌板中最薄的地方,无锌花的镀锌板附着好。
我公司主要销售:大锌花的热镀锌板
9、镀锌板的缺陷:
⑴产生锌粒:现象:在镀锌板表面上分布有类似米粒的小颗粒。
原因:A锌锅温度过高4800C以上(正常4550C—4650C)
B锌锅内底渣过多,被沉没辊搅动浮起,附着在锌板表面上
C铝含量过高,产生底渣多
B、C为人为可控制因素,3—4天捞一次锌渣
⑵厚边:现象:镀锌板两侧厚,中间薄。
原因:A高速厚边,汽刀对吹形成110—120米/Min
B低速厚边,汽刀压力小于40米/Min
被锌渣堵塞
⑸锌浪:现象:镀层表面产生像水波一样的波纹
原因:铝含量低,锌锅温度高厚板出现居多0.45以上
⑹抖动条纹:现象:镀锌板上出现了有规律的横向条纹
原因:A 沉没辊不圆
B 光整机辊某一点压力差异
直流电机导致上下压力差异
(每个生产线有7道张紧辊)
十、彩钢板:彩色涂层钢板和钢带是以金属底材为基材,在其表面涂以各类有机
涂料的产品。(也叫彩涂钢板)
1、常见颜色:绯红、海蓝、白灰 (常见是指厂家有库存,常生产) 北方地区
2、涂层机构:两涂两烘2/2 、 两涂一烘2/1 烘:烤,术语叫固化。
京华、科龙采用2/1 加工时单板必须2/2,复合板可2/1
3、涂漆厚度:12μm ——18μm 1μm=1/1000mm
4、钢板生产流程图; 侧面由左至右
开卷机 入口活套车 清洗 涂层室 流平室 烘烤炉 出口活套车 收卷
点式焊接机
挤干 喷码机
流平室长短影响质量
油漆槽:
钢板
①
~~~~~~~②~~~~~~
①涂层液 ②沾料液
5、彩板涂料:
⑴聚酯类:最常用面漆。价格实惠
⑵丙烯酸类:面漆。
⑶环氧类:背漆。成膜后表面粗糙,一般用于做复合板。
⑷聚氨酯类:背漆
⑸乙烯树脂:背漆
⑹硅改性聚酯:面漆
⑺氟碳:面漆。最贵,可做电饭锅内胆涂层
⑻塑料溶胶:PVC
6、涂料的组成:
⑴树脂成膜剂:清漆。是涂料的主体
⑵颜料:决定颜色
⑶溶剂:A 填充剂:滚到滚不到的地方
B 流平剂:使流平性能增加
C 分散剂:使漆膜流动均匀 提高彩钢板板面质量
D 固化剂:使油漆快速固化
E 消泡剂:使搅动中油漆气泡消失
7、彩涂板的缺陷:
⑴局部漏涂:现象:经涂后,部分表面未涂上漆或部分薄或露底
原因:A 基板凹陷
B 涂层辊、沾料辊,辊形不好或变形
C 涂层辊涂料供料不足
D 涂层辊与沾料辊的比速不当 人为
E 劣质涂料流平性差
⑵膜厚不均:现象:板面涂料附着不均匀,沿带钢运行方向有鱼鳞状或树皮状波
纹,带钢板面漆膜厚度明显不同。
原因:A 涂层辊状态不良,涂层辊上料不足所致
B 涂层辊呈椭圆形或涂层辊与粘料辊之间不平行
⑶辊绞: 现象:沿带钢运行方向有不规则的细条纹,时隐时现,有时像毛刷
刷过一样的痕迹。
原因:A 在涂层辊上有凹凸不平的纹路传递到带钢表面上
B 涂料施工粘度不适当,稀释剂没有对涂料溶解或因涂料中
的颜料出现返粗。(返粗:变质的表现)
C 涂层辊硬度过高,涂层辊与线速度、速比速不合理。
(线速度:生产线速度)
⑷色差: 现象:与标准板对比颜色不同,光泽也有差别
原因:A 膜厚不均
B 炉烘烤不当
C 涂料搅拌不彻底,两批涂料
搅拌
涂层辊
⑸板面发花:现象:涂层表面产生光泽斑。(亮度不一样)
原因:A 涂料粘度差异较大时,连续涂层。(清漆染料搅拌不均)
B 两种涂料
C 温度差异大时出现
D 涂料盘太浅,涂料供料口离粘料辊太近
⑹针孔状气泡:现象:漆膜表面,由于溶剂蒸发或膨胀而形成的小孔。
(不影响使用) 原因:A 在炉内烘烤时溶剂在漆膜表面迅速挥发,气体猛烈
出漆膜表面
B因涂料流平性差而形成气孔(局部过厚)
C稀释剂使用不当(浮色大)
D漆膜过厚形成火山口状小气孔(整体过厚)
⑺颗粒残泡:现象:表面不平滑,板面有颗粒状物
只有泡没有眼原因:A颗粒和异物混入涂料中
B涂料质量差,存放过久,自行凝聚,反粗等
⑻凸起:状物
原因:A
B涂层辊为擦干净,有油状物
C涂料消泡性能差
D有溶剂、水珠滴在板面上
十一、牌号(材质):日本牌号
热卷:
SPHC 可做一般用途的热轧钢板
S:steel钢P:pute板H:hot热C:commerce一般
可做简单的折弯、压型,不能做3600折弯、压型。
SPHD D:冲压
SPHE E:深冲等级最高、最贵的热卷,可做深加工
冷卷:
SPCC 可做一般用途的冷轧钢板
S:steel钢P:pute板C:cold 冷C:commerce一般SPCD
SPCE
我国的牌号Q235=SPCE 08AL=SPCD
标准:国际:GB 日本:JIS 国际通用:ISO
十二、商标:
品名:彩钢板规格:0.35X1000XC 颜色:绯红
等级:A(B)重量:3650Kg 净重:不含任何包装交易重量长度:参考长度卷号:年月日生产组几号货来料号:基板
生产日期:厂名:厂址:
电话:质检:标准:GB
等级A:可处理质量异议(商标一般为彩色)
等级B:不处理质量异议(商标一般为黑色)
宝钢、鞍钢、首钢商标中不含长度
十三、开卷方向:
十四、换算方法:
重量=体积X密度铁的密度:7.85
举例:0.35X1000mmXC 求,一吨的长度
1000Kg=0.35X1XxX7.85
X=364m
公式:1000mm 127.38÷厚度1200mm 106÷厚度
十五、公差:
正公差(上差):少于理论长度
负公差(下差):多于理论长度
0公差:等于理论长度
延伸知识:兰天的板子基本0公差
客户要求出米数多的板子指的是每吨出的米数
做钢结构的板子要求板子比较标准
十六、成品性能不良的现象:
1、抗划伤性能差现象:漆膜易划伤,漆膜之间相互摩擦,漆膜就会被划破、
脱落
原因:A炉温太低,未达到涂料固化温度
B预处理液涂层薄量不足(转化层)
C基板粗糙度不够
D涂料质量差,固化剂、催化剂量不足
E用冷板作为基板
2、反粘:现象:卷取后,由于张力影响,在开卷时会轻微的发出啪啪
的响声,严重的漆膜剂剥离,相互粘连
新厂新线易发生原因:A涂层后卷取前冷却水温过高
B冷却水量不足,卷取时板温过高
C涂层后烘烤时炉温过低,漆膜未固化
D涂料中固化剂、催化剂量不够
3、耐(MEK)擦拭性差:现象:漆膜硬度不够,用MEK擦拭很快露底
丁酮原因:A预处理层未涂或涂层薄
B炉温太低未达到涂料固化
C涂层漆膜太薄
D过期涂料
十七、术语:
1、锯齿边(裂边):深度:国家允许≤2mm
2、浪边:从侧面看边缘呈波浪形国家标准1M内≤5mm (瓢曲度)
收卷方式:A错边收卷:出现浪边情况下使用
B齐边收卷:有浪边用这种收卷方法就会形成喇叭卷塔形卷
3、内径椭圆度:国家标准≤25mm
4、尺寸公差:宽度±5mm 厚±0.001mm(不合乎标准不能做复合板)
面(上)
苯板
背(下)
5、材质单:(产品质量证明书)
材质 C Si Mn P S
SPCC ≤0.1 ≤0.03 0.2—0.4 ≤0.03 ≤0.03
SPCD ≤0.06 ≤0.03 0.08—0.3 ≤0.03 ≤0.03
0.8AL
铁
2+3+2+
五、“铁三角”: 六、 涉及铁及其化合物的几个与量有关的离子方程式 1.铁与稀HNO 3反应: (1)Fe + 4HNO 3 = Fe(NO 3)3 + NO↑+ 2H 2O ------------------------------------① (2)3Fe + 8HNO 3 = 3Fe(NO 3)2 + 2NO↑+ 4H 2O--------------------------------② (3)2Fe(NO 3)3 + Fe = 3Fe(NO 3)2---------------------------------------------------------------------------③ C 6H 5OH 红色 溶液 、Fe 、 、S 2-、 、SO 2、 + 3+
【1】当4 1 )()(3≤ HNO n Fe n 时,按反应①进行; 【2】当 8 3 )()(3≥HNO n Fe n 时,按反应②进行; 【3】当8 3 )()(4 13< < HNO n Fe n 时,则反应①、②都发生。 上述反应可以认为先发生反应①,若有Fe 剩余则发生③,合并①、③即可得到反应②,所以无论是反应①还是反应②,被还原的HNO 3都占参与反应HNO 3的4 1。 2.Cl 2与FeBr 2溶液反应: 由于还原性Fe 2+ >Br - ,Cl 2应先氧化Fe 2+ ,待Fe 2+ 被氧化完全后再氧化Br - 。 ①当Cl 2少量,只氧化Fe 2+ 时,即n(Cl 2) :n (FeBr 2) ≤1:2时,离子方程式为: Cl 2 +2Fe 2+ ==2Fe 3+ +2Cl - ②当Cl 2过量,Fe 2+ 、Br - 全被氧化时,即n(Cl 2) :n (FeBr 2) ≥3:2时,离子方程式为: 3Cl 2 +2Fe 2++4Br -== 2Fe 3+ +6Cl - +2Br 2 ③当Cl 2 将Fe 2+ 全部氧化,Br - 部分氧化时,即1:2<n(Cl 2):n (FeBr 2)<3:2时,离子方程式写为: 2Cl 2+2Fe 2++2Br -== 2Fe 3+ +4Cl - +Br 2等多种,依具体用量而定。 3.Cl 2与FeI 2溶液反应: 由于还原性I - >Fe 2+ ,Cl 2应先氧化I - ,待I - 完全被氧化后再氧化Fe 2+ 。 ①当Cl 2少量,只氧化I - 时,即n(Cl 2) :n (FeI 2) ≤1:1时,离子方程式为: Cl 2 +2I -== 2Cl - + I 2 ②当 Cl 2过量,I - 、Fe 2+ 全被氧化时,即n(Cl 2) :n (FeI 2) ≥3:2时,离子方程式为: 3Cl 2 +2Fe 2+ +4I -== 2Fe 3+ +6Cl - +2I 2 ③当Cl 2将I - 全部氧化,Fe 2+ 部分氧化时,即1:1<n(Cl 2) :n (FeI 2)<3:2时,离子方程式可写为: 4Cl 2 +2Fe 2+ +6I -== 2Fe 3+ +8Cl - +3I 2等多种,依具体用量而定。
铁及其化合物知识点 一.化学性质: 1.与非金属反应 4Fe+3O2 2Fe3O4 2Fe+3Cl2(Br2) 2FeCl3 2.与水反应3Fe + 4H2O(g) Fe3O4 + 4 H2↑(置换) 3 与酸反应 1)与非氧化性酸反应 Fe +2H+== Fe2+ + H2 2)与氧化性酸反应 a)常温下,铁在冷浓硫酸,浓硝酸中发生钝化 b)与浓硫酸反应:2Fe +6 H2SO4(浓)Fe2(SO4)3 +3SO2 +6 H2O 4.与盐反应2Fe 3++ Cu = 2Fe 2++ Cu 2 Fe + 2Fe3+ = 3 Fe2+ Fe + Cu2+ = Fe2+ + Cu 二、铁的化合物 1、铁的氧化物 FeO Fe2O3Fe3O4 铁的化合价+2+3+2、+3 颜色、状态黑色粉末红棕色粉末黑色晶体 俗名铁红磁性氧化铁 水溶性不溶于水不溶于水不溶于水 氧化物类别碱性氧化物碱性氧化物 与非氧化性酸反应FeO+2H + =Fe2+ +H2O Fe2O3+6H + =2Fe3+ +3H2O Fe3O4+8H+ =2Fe3+ + Fe2++4H2O 与还原剂反应(H2、CO、Al等)FeO+CO Fe+CO2Fe2O3+3CO 2Fe+3CO2 3Fe3O4+8Al 9Fe+4Al2O3 用途用作红色油漆和涂料; 赤铁矿是炼铁原料
2、铁的氢氧化物 (1)Fe(OH)2的制备 Fe(OH)2易被氧化,在制备时应注意:⑴ FeS O4晶体中不能有 Fe3+;⑵配制后的FeSO4溶液中要 加入少量铁粉;⑶配制溶液的蒸馏水以及所用NaOH溶液均须煮沸以除去其中溶解的氧气; 实验:FeSO4溶液中加NaOH. ①现象:生成白色沉淀,后又迅速转变为灰绿色,最后生成红褐色 ③为了防止滴加NaOH时带入空气,可将吸收NaOH的长滴管伸入FeSO4溶液液面下,再挤出NaOH溶液. ④为了防止Fe2+被氧化,还可以向盛有FeSO4溶液的试管中加入少量煤油或其它密度比水小但不溶于水的有机物以隔绝空气. 化学方程式: FeSO4 + 2NaOH = Fe(OH)2↓+Na2SO4 Fe2++ 2OH -= Fe(OH)2↓(白色) 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3(红褐色) (白色→灰绿色→红褐色) (2)Fe(OH)3胶体的制备 向加热沸腾的蒸馏水中加入FeCI3溶液,待出现红褐色时,停止加热,便可得到 Fe(OH)3胶体。 制备时要注意:⑴不可长时间加热,因为加热会使胶体凝聚;⑵不能用自来水,因为自来水中的电 解质也可使胶体凝聚。 3.铁的两种氢氧化物的比较 化学式Fe(OH)2Fe(OH)3 色、态白色固体红褐色固体 溶解性难溶于水难溶于水 热稳定性分解产物复杂2Fe(OH)3 Fe2O3 +3H2O 四.铁盐和亚铁盐 (1)Fe3+、Fe2+的检验: ○1.Fe3+的检验: +盐溶液中滴加KSCN溶液。现象是溶液变红色,反应方程式:FeCl3+3KSCN= Fe(SCN)3+3KCl Fe 3++3SCN -= Fe(SCN)3(红色)
钠铝及重要化合物知识点小结(★为必背方程式) 一、钠及其化合物 (一)钠 Na 1、单质钠的物理性质:钠质软、银白色、熔点低、密度比水的小但比煤油的大。★ 2、单质钠的化学性质: ① 钠与O 2反应 常温下:4Na + O 2=2Na 2O ★(新切开的钠放在空气中容易变暗) 加热时:2Na + O 2==Na 2O 2 ★(钠先熔化后燃烧,发出黄色火焰,生成淡黄色固体Na 2O 2。) 钠在空气中的变化过程:Na ―→Na 2O ―→NaOH ―→Na 2CO 3·10H 2O (结晶)―→Na 2CO 3(风化),最终得到是一种白色粉末。一小块钠置露在空气中的现象:银白色的钠很快变暗(生成Na 2O ),跟着变成白色固体(NaOH),然后在固体表面出现小液滴(NaOH 易潮解),最终变成白色粉未(最终产物是Na 2CO 3)。 ② 钠与H 2O 反应 2Na +2H 2O =2NaOH +H 2↑ ★离子方程式:2Na ++2H 2O =2Na ++2OH -+H 2↑(注意配平) 实验现象:钠浮在水面上,熔成小球,在水面上游动,有哧哧的声音,最后消失,在反应后的溶液中滴加酚酞,溶液变红。“浮——钠密度比水小;游——生成氢气;响——反应剧烈;熔——钠熔点低;红——生成的NaOH 遇酚酞变红”。 ③ 钠与盐溶液反应 如钠与CuSO 4溶液反应,应该先是钠与H 2O 反应生成NaOH 与H 2,再和CuSO 4溶液反应,有关化学方程式:2Na +2H 2O =2NaOH +H 2↑ CuSO 4+2NaOH =Cu(OH)2↓+Na 2SO 4 总的方程式:2Na +2H 2O +CuSO 4=Cu(OH)2↓+Na 2SO 4+H 2↑ 实验现象:钠熔成小球,在液面上四处游动,有蓝色沉淀生成,有气泡放出 K 、Ca 、Na 三种单质与盐溶液反应时,先与水反应生成相应的碱,碱再和盐溶液反应 ④ 钠与酸反应:2Na +2HCl =2NaCl +H 2↑(反应剧烈) 离子方程式:2Na +2H +=2Na ++H 2↑ 3、钠的存在:以化合态存在。 4、钠的保存:保存在煤油或石蜡中。 5、工业制钠:电解熔融的NaCl :2NaCl(熔融) 2Na + Cl 2↑★ 6、钠的用途:① 在熔融的条件下钠可以制取一些金属,如钛、锆、铌、钽等; ② 钠钾合金是快中子反应堆的热交换剂; ③ 钠蒸气可作高压钠灯,发出黄光,射程远,透雾能力强。 (二)氧化钠和过氧化钠 1、Na 2O Na 2O + H 2O == 2NaOH , ★Na 2O + CO 2 == Na 2CO 3, ★Na 2O + 2HCl == 2NaCl + H 2O .★ 另外:加热时,2Na 2O + O 2 == 2Na 2O 2 2、Na 2O 2:淡黄色固体是复杂氧化物,易与水和二氧化碳反应。 2Na 2O 2 + 2H 2O == 4NaOH + O 2 ★;2Na 2O 2 + 2CO 2 == 2Na 2CO 3 + O 2 ★(作供氧剂)。 因此Na 2O 2常做生氧剂,同时,Na 2O 2还具有强氧化性,有漂白作用。如实验:Na 2O 2和水反应后的溶液中滴加酚酞,变红后又褪色。 通电 白色固体,是碱性氧化物,具有碱性氧化物的通性:
铁和铁的化合物知识点归纳 一、铁的结构和性质 1、铁是26号元素,位于第四周期第Ⅷ族,属于过渡元素。 原子结构示意图: 2.铁的物理性质:纯净的铁是光亮的银白色金属,密度为7.86g/㎝3,熔沸点高,有较好的导电、传热性,能被磁铁吸引,也能被磁化。还原铁粉为黑色粉末。 3.铁的化学性质:鉄是较活泼的金属,在金属活动性顺序表中排在氢的前面。 ①跟非金属反应:与氧气: 与氯气: 与硫: ②跟水反应: ③跟酸作用: (遇冷浓硝酸、浓硫酸钝化;与氧化性酸反应不产生H ,且氧化性酸过量时生成Fe3+) 2 ④与部分盐溶液反应:与硫酸铜溶液反应 与氯化铁溶液反应 二、铁的氧化物和氢氧化物 三、Fe、Fe2+和Fe3+之间相互转化及检验 1.具体反应有: (1)Fe2+→Fe3+
①2Fe2++Cl 2 =2Fe3++2Cl-(在亚铁盐溶液中通入氯气,溶液由浅绿色变为棕黄色)。 ②3Fe2++NO 3-+4H+=3Fe3++2H 2 O+NO↑ ③2Fe2++H 2O 2 +2H+=2Fe3++2H 2 O (2)Fe3+→Fe2+ ①2Fe3++Fe=3Fe2+,在FeSO 3 溶液中往往要加铁的原因是可以防止Fe2+被氧化为Fe3+。 ②2Fe3++Cu=2Fe2++Cu2+,电路板的制作是利用FeCl 3 溶液与裸露的铜反应。 ③2Fe3++2I-=2Fe2++I 2 2.Fe2+和Fe3+的检验 (1)Fe2+的检验: 方法一:滴加KSCN溶液,无明显现象,再滴加新制氯水,溶液立即变红色。 方法二:滴加NaOH溶液,生成白色絮状沉淀,该沉淀迅速变为灰绿色,最后变为红褐色。 (2)Fe3+的检验: 方法一:滴加KSCN溶液或NH 4 SCN溶液,溶液立即变为血红色。 方法二:滴加NaOH溶液,出现红褐色沉淀。 3.例题精讲 例1.把铜粉和过量的铁粉加入到热的浓硝酸中,充分反应后,溶液中大量存在的金属阳离子是() A.只有Fe2+ B.只有Fe3+ C.有Fe2+和Cu2+ D.有Fe3+和Cu2+ 例2.由FeO、Fe 2O 3 和Fe 3 O 4 组成的混合物,测得其中铁元素与氧元素的质量比 为21:8,,则这种混合物中FeO、Fe 2O 3 和Fe 3 O 4 的物质的量之比是()。 A.1:2:1 B. 2:1:1 C. 1:1:1 D. 1:1:3 例3.将8gFe 2O 3 投入150mL某浓度的稀硫酸中,再投入7g铁粉收集到1.68LH 2 (标准状况),同时,Fe和Fe 2O 3 均无剩余,为了中和过量的硫酸,且使溶液中铁元 素完全沉淀,共消耗4mol/L的NaOH溶液150mL。则原硫酸的物质的量浓度为()。 A.1.5mol/L B.0.5mol/L C.2mol/L D.1.2mol/L 4.实战演练 一、选择题 1.(2002年全国高考题)铁屑溶于过量的稀硫酸,过滤后向滤液中加入适量硝酸,再加入过量的氨水,有红褐色沉淀生成。过滤,加热沉淀物至质量不再发生变 化,得到红棕色的残渣。上述沉淀和残渣分别为 A.Fe(OH)3;Fe2O3 B.Fe(OH)2;FeO C.Fe(OH)2、Fe(OH)3;Fe3O4 D.Fe2O3;Fe(OH)3 2.要证明某溶液中不含Fe3+而可能含有Fe2+进行如下实验操作时最佳顺序为 ①加入足量氯水②加入足量KMnO4溶液③加入少量NH4SCN溶液
1. 现代交通运输方式有铁路、公路、水运、航空和管道,其中管道暂不适用于 旅客运输。 2. 运输业的产品是旅客和货物的空间位移,计量单位分别是人公里和吨公里; 统计周转量时,1换算吨公里=1旅客人公里=1货物吨公里。 3. 铁路线路包括路基、桥隧建筑物和轨道三大部分。 4?我国铁路线路分为三个等级:1级铁路、U级铁路和川级铁路。 5.车站线路的种类:正线,站线(到发线、牵出线、调车线、货物线、机走线和机待线 等),段管线,岔线和特别用途线(安全线和避难线)。 6?线路平面是由直线和曲线(包括圆曲线和缓和曲线)所组成。 7?线路纵断面是由平道和坡道所组成。 8?铁路基本限界有机车车辆限界和建筑物接近限界两种。 9.最常见的两种路基形式是路堤和路堑。 10?桥隧建筑物主要包括桥梁、涵洞和隧道。 11. 轨道的组成包括钢轨、轨枕、道床、联结零件、防爬设备及道岔六个主要部 分。 12. 钢轨的断面形状为工字形,有轨头、轨腰和轨底三部分。 13. 钢轨类型是用其单位长度的重量来表示的。我国现行的标准钢轨类型有75 kg/m、60 kg/m、50 kg/m、43 kg/m和38kg/m等,后两种基本已经淘汰。 14. 目前我国钢轨的标准长度有12. 5m和25m两种。 15. 轨枕按其制作材料的不同,主要有木枕和钢筋混凝土枕两种。 16. 我国铁路普通轨枕的长度为2. 5m,岔枕及桥枕长度为2.6?4.85m多种规格。 17 .每公里线路铺设轨枕的数量一般在1440?1840根之间。 18. 道岔的形式主要有:普通单开道岔、对称道岔、三开道岔及交分道岔。 19. 轨距是两股钢轨轨头顶面向下16mm范围内两股钢轨作用边之间的最小距 离。 20?我国和大多数国家一样主要采用1435mm的标准轨距。与标准轨距相对应的
三、铁 1、单质铁 (1)铁与氧气:3Fe+2O2====Fe3O4(点燃)现象:剧烈燃烧,火星四射,生成黑色物质 (2)铁与硫:Fe+S===FeS (3)铁与氯气:2Fe+3Cl2====2FeCl3 (点燃) (4)铁与水:铁不能和冷水热水反应,但能与水蒸气反应。3Fe+4H2O(g)==Fe3O4+4H2(高温) 不稳定,在空气里加热迅 速被氧化:6FeO+O2 2Fe3O4 Fe x O y+y CO x Fe+y CO2 222232 定存在的寿命只有几秒钟,在实验室中制取Fe(OH)2时,一定要用新制的Fe2+盐(比如用Fe 粉和盐酸新制取的FeCl2,或用Fe粉和稀硫酸新制取的FeSO4)和先加热驱赶O2后的NaOH 溶液,且胶头滴管末端插入试管内的液面下(其他情况不允许),再滴加NaOH溶液,也可以在反应液面上滴加植物油或苯等物质进行液封,减少Fe(OH)2与O2接触.
4、铁三角 (1)Fe→Fe2+ ①条件:铁与氧化性比较弱的非金属(如S、I2)、非氧化性酸(如盐酸、稀H2SO4)、不活泼金属的盐溶液(如CuSO4溶液)反应. ②实验:Fe+CuSO4===Cu+FeSO4;Fe+2FeCl3===3FeCl2;Fe+2H+===Fe2++H2↑. (2)Fe→Fe3+ ①条件:铁与强氧化剂,如Cl2、H2O2、KMnO4(H+)、HNO3、浓H2SO4在一定条件下反应都会实现这种转化. ②实例:2Fe+3Cl22FeCl3 (3)Fe2+→Fe ①条件:比较活泼的金属(如Al、Zn)、CO、H2、C等能从亚铁化合物中置换出铁来. ②实例:CO+FeO Fe+CO2 (4)Fe2+→Fe3+ ①条件:Fe2+被强氧化剂氧化为Fe3+,如Cl2、Br2、H2O2、浓H2SO4、酸性高锰酸钾溶液、HNO3等. ②实例:2Fe2++Cl2===2Fe3++2Cl- (5)Fe3+→Fe ①条件:可加入较强还原剂来实现,如Al、Zn、H2、CO等. ②实例:2Al+Fe2O32Fe+Al2O3 (6)Fe3+→Fe2+ ①条件:Fe3+与比较强的还原剂反应,如Cu、Fe、S2-(或H2S)、I-(或HI)等. ②实例:2Fe3++Fe===3Fe2+,2Fe3++Cu===Cu2++2Fe2+,2Fe3++H2S===2Fe2++S↓+2H+,2Fe3++2I-===2Fe2++I2 5、应用 (1)离子共存 ①Fe3+:与HCO-3、CO2-3、AlO-2等(双水解反应);S2-、I-、SO2-3(氧化还原反应);SCN -(络合反应);OH-等不能大量共存. ②Fe2+:与CO2-3、OH-、S2-、NO-3(H+)、MnO-4(H+)、ClO-等不能大量共存. (2)试剂的存放 ①亚铁盐溶液(如FeCl2溶液):保存时加入少量铁屑以防止Fe2+被氧化,滴入少量相应的酸溶液(如盐酸)以防止Fe2+水解. ②铁盐溶液[如Fe2(SO4)3溶液]:保存时加入少量相应的酸(如H2SO4)以防止Fe3+水解. 6、Fe3+的检验
铁和铜及其化合物知识 点 文件管理序列号:[K8UY-K9IO69-O6M243-OL889-
铁及其化合物知识点 一.化学性质: 1.与非金属反应 4Fe+3O 2 2Fe 3O 4 2Fe+3Cl 2(Br 2) 2FeCl 3 2.与水反应 3Fe + 4H 2O(g) Fe 3O 4 + 4 H 2 ↑(置换) 3 与酸反应 1)与非氧化性酸反应 Fe +2H +== Fe 2+ + H 2 2)与氧化性酸反应 a )常温下,铁在冷浓硫酸,浓硝酸中发生钝化 b )与浓硫酸反应:2Fe +6 H 2SO 4(浓) Fe 2(SO 4)3 +3SO 2 +6 H2O 4.与盐反应 2Fe 3++ Cu = 2Fe 2++ Cu 2 Fe + 2Fe 3+ = 3 Fe 2+ Fe + Cu 2+ = Fe 2+ + Cu 二、铁的化合物 1、铁的氧化物 FeO Fe 2O 3 Fe 3O 4 铁的化合价 +2 +3 +2、+3 颜色、状态 黑色粉末 红棕色粉末 黑色晶体 俗名 铁红 磁性氧化铁 水溶性 不溶于水 不溶于水 不溶于水 氧化物类 碱性氧化物 碱性氧化物
别 与非氧化性酸反应FeO+2H + =Fe2+ +H 2 O Fe 2 O 3 +6H + =2Fe3+ +3H 2 O Fe 3 O 4 +8H + =2Fe3+ + Fe2++4H 2 O 与还原剂反应(H 2 、CO、Al 等)FeO+CO Fe+CO 2 Fe 2 O 3 +3CO2Fe+3CO 2 3Fe 3 O 4 +8Al9Fe+4Al 2 O 3 用途用作红色油漆和涂 料;赤铁矿是炼铁原 料 2、铁的氢氧化物 (1)Fe(OH) 2 的制备 Fe(OH) 2易被氧化,在制备时应注意:⑴ FeS O 4 晶体中不能有 Fe3+;⑵配制 后的FeSO 4 溶液中要加入少量铁粉;⑶配制溶液的蒸馏水以及所用NaOH溶液均 须煮沸以除去其中溶解的氧气; 实验:FeSO 4 溶液中加NaOH. ①现象:生成白色沉淀,后又迅速转变为灰绿色,最后生成红褐色 ③为了防止滴加NaOH时带入空气,可将吸收NaOH的长滴管伸入FeSO 4 溶液液面下,再挤出NaOH溶液. ④为了防止Fe2+被氧化,还可以向盛有FeSO 4 溶液的试管中加入少量煤油或其它密度比水小但不溶于水的有机物以隔绝空气.
纯铁基础知识普及 碳含量小于0.04%的钢称为工业纯铁,工业纯铁的纯度在99.6%~99.8%之间。按照用途分类,纯铁分为电磁纯铁和原料纯铁两大类,其中电磁纯铁主要用作各种直流磁性原件,原料纯铁主要作为各种炉料使用。 1、国内外纯铁发展情况 国外对于纯铁研究比较早的是美国、西德、前苏联、日本。其中日本在七十年代到九十年代电磁纯铁发展迅猛。随着冶炼低碳钢技术的发展,电磁纯铁开始在电工用钢领域占据了独特的地位。由于它在直流磁场下具有磁性能优势,因此,在磁屏蔽、直流电机等方面得到充分应用。 我国从一九五五开始研发,并逐步研制成具有中国特色的产品。从1955年开始,在国内太钢最早研制纯铁,且一直是国内纯铁科研和生产的主要单位,太钢纯铁的发展基本上代表了中国电磁纯铁的发展。 近年来,随着我国电子、电讯等产业的迅速发展,纯铁已广泛应用于日常生活,电力、机械、交通等各个领域,成为了现代社会电子、计算机、通信等高技术产业的物质基础。同时,纯铁产品在气象、医疗、军事等领域也发挥着越来越重要的作用。目前国内生产原料纯铁的厂家主要有太钢、首钢、鞍钢,生产电磁纯铁的厂家主要有太钢、宝武钢铁。 2、太钢纯铁简介 工业纯铁是太钢的传统名牌产品,有将近50年的研制历史,曾多次荣获省、部、国家银奖和金奖,在国内具有很高的知名度,历年产品开发量及市场占有率居国内第一位。电磁纯铁、原料纯铁国家标准均由太钢负责起草。 作为国内主要纯铁生产企业,太钢纯铁在国内树立了良好的品牌形象。太钢工业纯铁品种齐全,用途广泛,其中电磁纯铁DT4系列作为质优价廉的软磁材料用于继电器、电声器、磁及盘、电磁阀、直流电机、充磁机、粒子加速器、仪表(如电镜、示波器、显像管)、磁屏蔽(如电讯及机要场所防干扰屏蔽车、屏蔽室,核磁共振屏蔽室等)以及自动控制系统,另外用于武器装备及控制系统(如9910工程、航空、航天——如“神舟宇宙飞船”用材料等);电磁纯铁DT8和高真空气密性纯铁DT9用于尖端科技领域;原料纯铁用于超低碳不锈钢、粉末冶金、铝镍钴和钕铁硼永磁材料等。
儿童性教育知识大全 目录 ?性教育:说实话不要说瞎话 ?家庭性教育的作用 ?他山之石:借鉴国外性教育经验 ?对孩子进行性教育有讲究 ?儿童性教育该从什么时候开始 展开 性教育:说实话不要说瞎话 对婴幼儿的性教育中,语言的定位非常关键。因为婴幼儿的周围有同龄人,也有长者和老者。他们在与所有的人进行沟通,他们就像一台新的计算机,容量很大,但存进去的内容尚不多,因此他们在拼命地“吃”知识。 记得小时候(大约3岁多),有一次在公共厕所发现一位阿姨小便处向下滴血(来月经了),我十分恐惧,以为她病了,并想像着她可能昏倒,于是不肯从厕所离去,并一直盯着她看。姥姥把我拉了出来。我问姥姥:“那个阿姨怎么了?”姥姥说:“她做了坏事,所以流血了。”“她做了坏事?”我闷闷地想呀想,“为什么做了坏事就要那个地方流血呢?”这个问题困扰了我很久。每当我认为我做了坏事(自认为不对
的地方),就担心自己那个地方流血,并拼命进行自我检讨。回想起来,很像教徒在做祷告。 直到青春发育期我第一次来月经,今天仍记得十分清楚,那是一个夏天的早晨,我比往日醒来得早些,感觉内裤处非常不对劲,起来一看,啊!血!我惊呆了!我当时简直就要吓昏了,好像天要塌下来,天啊!报应终于来了!我做了什么坏事? 事隔这么多年来,我想起来都要大笑。因为害怕,不敢告诉家长,自己找来一些卫生纸垫着,因为弄不好,上学时弄在外裤上,放学后不敢回家,一直在教室里坐着,直到天黑,把书包挡在屁股上拼命往家跑。这样尴尬的事直到有一天被姐姐发现,才得到解决。 当我们知道了我们的语言会被孩子无限拓展,我们才能明白为什么性教育中不要说瞎话。 收起全文↑ 家庭性教育的作用 性教育越来越受到人们的关注。然而更多的家长期望由学校来进行这方面的工作。学校是性教育的合适场所。然而学校单方面的教育是远远不够的,需要学校、家庭、社会的密切配合,尤其在目前学校性教育还有待于完善的情况下。
铁 1、铁的物理性质:银白色金属光泽,质软,有良好的延性和展性,是电和热的导体。 2、铁生绣实际上是铁、氧气和水等物质相互作用,铁锈的主要成分是氧化铁Fe2O3(红棕色)。全世界每年因生绣损失的钢铁约占世界年产量的。 3、防止铁制品生绣的方法:①保持铁制品表面的洁净和干燥,②在铁制品的表面涂上一层保护膜。具体操作是:①在其表面刷油漆,②在其表面涂油,③金属制品表面镀上其它金属,④通过化学反应使铁制品的表面生成致密的氧化膜。 4、黑色金属:Fe、Mn、Cr(铬)有色金属:除前三种以外都是,如Cu、Zn、Al 5、合金(混合物):是由一种金属与其它一种或几种金属(或非金属)一起熔合而成的具有金属特性的物质。铁的合金有:生铁和钢(混合物) 生铁的含碳量在2%—4.3%之间,钢的含碳量在0.03%—2%之间。 生铁分为白口铁、灰口铁和球墨铸铁,球墨铸铁具有很高的机械强度,某些场合可以代替钢。钢分为碳素钢和合金钢。 6、炼铁的主要设备是高炉,主要原料是铁矿石、焦炭和石灰石。原理:在高温条件下,用还原剂一氧化碳从铁的氧化物中将铁还原出来。(不能:置换) 炼钢设备:转炉、电炉、平炉。原理:在高温条件下,用氧气或铁
的氧化物把生铁中所含的过量的碳和其它杂质转变为气体和炉渣而除去。
7、白口铁的用途:用于炼钢、灰口铁的用途制造化工机械和铸件。低碳钢和中碳钢用来制造机械零件,钢管。高碳钢用来制刀具、量具和模具。 8、锰钢中合金元素为锰,韧性好,硬度大;不锈钢中合金元素为铬、镍,抗腐蚀性好;硅钢中合金元素为硅,导磁性好;钨钢中合金元素为钨,耐高温,硬度大。 9、导电性:银>铜>铝,铝和锌在空气中能形成一层致密的氧化物薄膜,可阻止进一步氧化。铜生锈是铜和水、氧气、二氧化碳发生的反应。钛耐腐蚀性好。 如有侵权请联系告知删除,感谢你们的配合!
铁及其化合物知识点 一.物理性质:银白色,具有金属光泽;质地较软,有良好的导电性、延展性。密度7.86 g/cm3,熔沸点较高。 位置:第四周期,第Ⅷ 族 二.化学性质:1.与非金属反应 1)Fe+S (I 2) FeS (FeI 2) 2)4Fe+3O 2 2Fe 3O 4 3)2Fe+3Cl 2(Br 2) 2FeCl 3 弱氧化剂 Fe 3+、H +、I 2、S 、铁后的金属阳离子(置换)… Fe 2+ Fe 3+ 2.与水反应 3Fe + 4H 2O(g) Fe 3O 4 + 4 H 2 ↑(置换) 注意:铁在常温下不会和水发生反应,但在水和空气中O 2和CO 2的共同作用下,铁却很容易被腐蚀(生锈/电化学腐蚀) 3 与酸反应 1)与非氧化性酸反应 Fe +2H + == Fe 2+ + H 2 2)与氧化性酸反应 a )常温下,铁在冷浓硫酸,浓硝酸中发生钝化 b )与浓硫酸反应:2Fe +6 H 2SO 4(浓) Fe 2(SO 4)3 +3SO 2 +6 H2O c)与稀硝酸反应:①当Fe 少量时,离子方程式为:Fe + 4H + + NO 3-== Fe 3++NO↑+2H 2O ②当Fe 过量时,,离子方程式为:3Fe+8H ++2NO 3-== 3Fe 2++2NO↑+4H 2O ③当1:4<n( Fe) :n (HNO 3)<3:8 时,此情况下,Fe 3+ 和Fe 2+ 共存。 4.与盐溶液反应 2Fe 3++ Cu = 2Fe 2++ Cu 2+ Fe + 2Fe 3+ = 3 Fe 2+ Fe + Cu 2+ = Fe 2+ + Cu 三、铁的化合物
环保知识大全集 小盛齐天 1,环境污染主要有哪些? 答:大气污染,水污染,土壤污染,食品污染,放射性污染,噪音污染。 2,工业“三废”和生活“三废”各指什么? 答:工业三废是指:废水,废气,废渣。生活三废是指:粪便,垃圾,污水。 3,通过污染食品对人体造成危害的农药主要有哪些? 答:有机氯农药,有机磷农药,有机汞农药。 4,水污染常说的“五毒”物质是什么? 答:酚,氰,汞,铬,砷。 5,对绿色植物损伤最大的五种气体是什么? 答:氧化氮,乙烯,氯气,氟化物,二氧化硫。 6,十大垃圾食品分别是什么? 答:油炸食品,罐头类食品,腌制食品,加工的肉类食品,肥肉和动物内脏类食物,奶油制品,方便面,烧烤类食品,冷冻甜点,果脯话梅和蜜饯类食品。 7,垃圾食品的危害具体有哪些? 答:“三高三低”:高热量,高钠,高脂肪;低纤维,低维生素,低矿物质。钠盐或糖类含量过高,含致癌物质等特点,长期食用会对人体的健康造成巨大影响。 8,雾霾形成的要素有哪些? 答:雾霾形成要素主要有3个:一是生成颗粒型扬尘的物理基源。我国有世界上最大的黄土高原地区,其土壤质地最易生成颗粒性扬尘微粒。二是运动差造成扬尘。三是扬尘基源和运动差过程集聚在一定空间范围内,颗粒最终与水分子结合聚集成霾。9,简述“六五”世界环境日的来历。 答:在世界各国环保呼声日益高涨的形势下,1972年6月5日,联合国在瑞典首都斯德哥尔摩召开了有113个国家参加的人类首次环境大会,通过了《人类环境宣言》和《人类环境行动计划》,成立了联合国环境规划署,并将每年6月5日定为“世界环境日”。 10,我国七大水系都受到不同程度的污染,请你按污染的严重程度顺序排列。 答:依次是:辽河,海河,淮河,黄河,松花江,珠江,长江。 11,噪声有哪些危害? 答:噪声对人的听觉器官,神经系统,心血管和消化系统都会产生危害。 12,生态系统是由哪些要素组成的? 答:生产者,消费者,分解者,非生命物质和能量五大部分组成。 13,1997年我国首批6个城市被定为国家环境保护模仿城市,这6个城市是? 答:厦门,大连,珠海,深圳,威海,海口。 14,城市主要环境问题有哪些? 答:大气污染,水污染,固体废弃物,噪声污染。 15,至今我国已颁布了六部环境保护法律,请至少说出四部法律。 答:《环境保护法》《水污染防治法》《大气污染防治法》《海洋保护法》《噪声
铁矿石基础知识汇总 一、铁矿石品种 1、PB粉、块(Pb Fines/Pb Lumps):产于澳大利亚,又称皮尔巴拉混合矿(必和必拓公司经营),粉的品位在61.5%左右,部分褐铁矿,烧结性能较好;块的品位在62.5%左右,属褐铁矿,还原性好,热强度一般。PB粉和块可由汤姆普赖斯矿、帕拉布杜矿、马兰杜矿、布鲁克曼矿、那牟迪矿和西安吉拉斯矿等矿山的粉矿混匀成。 2、杨迪粉(Yandi Fines):产于澳大利亚(必和必拓公司经营),品位在58%左右,铝含量低,属褐铁矿,结晶水较高,混合制料所需水分要求较高,因其结构疏松,烧结同化性和反应性较好,因此可部分替代纽曼山粉矿或巴西粉矿。含相对低的Al2O3,而且这两种矿粉都比哈默斯利矿粉粗,它们都有合理的冶炼性能,但烧结性能不佳。 3、麦克粉(Mac Fines):MAC粉的正常品位在61.5%左右,目前供给中国市场多为58%左右的品位,部分属褐铁矿,烧结性能较好,含有5%左右的结晶水,炼铁时烧损较高,随其配比加大,烧结矿的烧成率逐步下降。经钢厂研究,MAC粉配比在15%-20%时烧结矿小于5mm级水平较低,配比为20%的烧结成品率最高。 4、纽曼粉、块矿(Newman Fines/Newman Lumps):产于澳大利亚的东皮尔巴拉的纽曼镇的纽曼山矿,属赤铁矿,烧结性能较好,粉的品位在62.5%左右,块的品位在65%左右,由澳大利亚西澳州必和必拓公司生产。 5、罗布河粉、块(Robe River Fines/Robe River Lumps):产于澳大利亚的罗布河铁矿联合公司;品位在57.5%左右,含3%-5%的复合水,这会导致高燃料率及低生产率;属于褐铁矿,烧结性能不好,但其烧结矿的冶炼性能很好。 6、火箭粉:又称FMG(福蒂斯丘金属集团(Fortescue metal Group (FMG)))粉,由澳大利亚第三大铁矿石生产商FMG公司生产;据说用作火箭发动机燃料的一种成分,故称火箭粉,其品位在58.5%左右,硅4左右,铝1.5左右,属于褐铁矿,烧结性能较好,储量大且单烧品位高,结晶水在8%左右。FMG粉矿化学成分优于扬迪粉,但烧结性能和造球性能不如扬迪粉。 7、火箭特粉:由FMG公司生产的品位57.5%左右的火箭粉,硅5个左右,铝2个左右,其它冶炼性能同火箭粉。超特粉的品位低于火箭特粉1个品位,在56.5%左右,硅6左右,铝3个左右,结晶水在8.5%左右,其它冶炼性能类似。 8、阿特拉斯粉块:由澳大利亚第四大铁矿石生产商Atlas Iron公司生产的位于澳大利亚皮尔巴拉矿山的铁矿石,品位在57.5%,属褐铁矿,结晶水在9%左右,硅含量高,在8%左右,物理化学性能和冶炼性能跟火箭粉的超特粉相近。 9、KMG粉:由澳大利亚私人矿业公司KMG生产,该矿位于澳大利亚珀斯,是距离中国最近的西澳矿山,紧邻西澳最北的港口。矿山预计两年内产矿6700万吨,为58-59%的低品位粗粉赤铁矿为主,硅8%,铝3%,磷0.08%,硫0.03%。性能类似于火箭特粉,但比火箭特粉的硅高很多。 10、CSN粉、块:巴西CSN公司(全称为巴西国有黑色金属公司)生产的铁矿石,铁含量在65%以上,硅含量在1%-2%。 11、SSFT粉,巴西淡水河谷公司专门为中国市场配制的烧结粉,SSFT的铁含量在65%左右,硅含量在4.4%左右。 12、卡粉:卡拉加斯粉的简称,英文简称SFCJ粉,全称SINTER FEED Carajas,铁含量在65%以上(65-67%),硅含量在1%-2%。铝1%左右,磷0.033-0.045%,烧损1.6%左右,水分8-9%,产于巴西卡拉加斯矿的铁矿石,因为该地方的粉矿的质量优异,不会像南部矿源那样参差,所以在国际市场上十分受欢迎,价格也高于南部矿源。 13、巴西南部粉:该矿位于巴西有南部矿源“铁四角”,又称巴西南部粉,南部矿区主要矿山有Itabira、Mariana、Mihas Centrals、Paraopebal、Vargem Grande、Itabiritos,均处于巴西铁四角地区,南部矿区主要开采方式为露天开采。这一带以铁英岩为主,赤铁矿含量较高,含铁量在66%左右。主要包括SSFG粉(巴西南部标准烧结粉,铁品位65%,硅3.2-3.8%,铝1.2-1.8%,磷0.049-0.065%,锰0.25-0.40%,水6.5-8.5%,烧损1.7%左右),SFOT粉等。 14、巴粗:指巴西粗颗粒粉矿,是巴西粗粉的统称,包括卡粉、SSFT粉、CSN粉、南部粉等。品位从65%-58%不等,其中东南部铁四角生产的矿粉冶炼性能最好。 15、印粉:指印度细颗粒粉矿,但不符合印粗的颗粒度标准。品位从40%-63.5%不等,属赤铁矿,高品位冶炼性能优良,低品位硅铝成分较高,具有较高的冶炼价值。 二、铁矿石粒度分类
一、高炉生产概述 1、生铁的定义及种类? 生铁与熟铁、钢一样,都是铁碳合金,它们的区别是含碳量的多少不同。一般把含碳量小于0.2%的叫熟铁,含碳量0.2—1.7%的叫钢,含碳1.7%以上的叫生铁。生铁一般分三类:炼钢铁、铸造铁以及作铁合金用的高炉锰铁和硅铁。 2、高炉炼铁的工艺流程由哪几部分组成? 在高炉炼铁的生产中,高炉是工艺流程的主体,从其上部装入的铁矿石、燃料和溶剂向下运动;下部鼓+入空气燃烧燃料,产生大量的还原气体向上运动;炉料经过加热、还原、熔化、造渣、渗碳、脱硫等一系列物理化学过程,最后生成液态保护渣和生铁,它的工艺流程系统除高炉主体外,还有上料系统、装料系统、送风系统、回收煤气与除尘系统、渣铁处理系统、喷吹系统以及为这些系统服务的动力系统。 3、上料系统包括哪些部分? 包括:贮矿场、贮矿仓、焦仓、仓上运料皮带、矿石与焦碳的槽下筛分设备、返矿和返焦运输皮带、入炉矿石和焦碳的称量设备、将炉料运送至炉顶的设备等。 4、装料系统包括哪些部分? 受料罐、上下密封阀、截流阀、中心喉管、布料溜槽、旋转装置和液压传动设备等。高压操作的高炉还有均压阀和均压放散阀。 5、送风系统包括哪些部分? 鼓风机、冷风管道、放风阀、混风阀、热风炉、热风总管、环管、支管、直到风口。 6、煤气回收与除尘系统包括哪些部分? 包括炉顶煤气上升管、下降管、煤气截断阀或水封、重力除尘器、布袋除尘器。 7、高炉生产有哪些产品和副产品? 高炉生产的产品是生铁,副产品是炉渣、高炉煤气和炉尘(瓦斯灰)。 8、高炉煤气用途? 高炉煤气一般含有20%以上一氧化碳、少量的氢和甲烷,发热值一般为2900—3800kJ/m3,是一种很好的低发热值气体燃料,除用来烧热风炉以外,还可供炼焦、均热炉和烧锅炉用。 9、高炉炉尘有什么用途? 炉尘是随高速上升的煤气带离高炉的细颗粒炉料。一般含铁30—50%,含碳10—20%,经煤气除尘器回收后,可用作烧结原料。 10、高炉炼铁有哪些技术经济指标?
1、两个拳头的周长是脖子的周长。 2、七个脚长是身体的高度。 3、一生心跳25亿至30 亿次。 4、每天吞口水580次左右。 5、人不睡觉10天就会死亡。 6、人在下午没有灵感、越到晚上越聪明、沐浴时更有创造性。 7、人的左右鼻孔三小时替换呼吸一回,感冒了才知道哦。 8、肌肉能是人体的发动机。 9、早上帮助消化的胰岛素活跃,所以一定要吃早饭。 10、一辈子手指屈伸2500次。 11、人平均每年小便时间为十二小时。 12、肠子长度是身高的4——5倍。 13、血液循环一周只需20秒。 14、血管长度可绕地球两周。 15、人的大脑记忆相当4G容量的电脑。 16、人的睡眠周期为90分钟,赖床30分钟后会进入下一个周期。 17、自然分娩的大部分时间是下午5点到6点左右,有60%以上是在下午6点左右分娩。 18、下午六点人体分泌肾上腺素的高峰、此时应付困难最有能力。 19、左耳受右脑控制,右脑主导情感,因此左耳接受到甜言蜜语时比右耳敏捷。 20、原始分工使女性的视野几乎是男性的6倍,男性喜欢盯住一个目标,目光更远,但
没有女性 眼观6路的视野宽阔。 21、人在性色,金钱,美味巧克力刺激大脑的是同一个区域,使人在金钱抉择上受性色的影响, 会冒险投入的比例大好多。 22、智力比身体衰老的慢。 23、傍晚锻炼、此时人的味觉、视觉、听觉敏感、协调能力强,心律于血压较平稳。 24、人的心搏次数在一生是固定的次数。 25、人在潜意识处理一闪而过的负面信息时,反应敏捷,如危险、绝望、暴力。 26、人平均只需7分钟就可入睡。 27、打喷嚏时无法睁着眼睛。 28、睡眠时的脑比看电视时活跃。 29、大拇指的指甲长的最慢,中指的指甲长的最快。 30、睡眠时耗费的热量比看电视更多。 31、出生时眼睛多大,现在还是多大,但是鼻子鱼耳朵一直在长。 32、舌头有一万个味蕾。 33、惯用右手的人比惯用左手的人长命可大9年。 34、舌纹与指纹一样,每个人都不同。 35、如果月亮在人的正上方,人的体重会稍微减轻。 36、人平均每天使用洗手间6次。 37、人体每平方英寸的皮肤包含有20英尺长的血管。 38、出生时有360块骨骼,成人后只有206块。
铁知识点总结-CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN
铁 二、氧化物:
2+3+2+
五、“铁三角”: 六、 涉及铁及其化合物的几个与量有关的离子方程式 1.铁与稀HNO 3反应: 3+ C 6H 5OH 紫色 溶液 红色 溶液 、、 、S 2- +
(1)Fe + 4HNO 3 = Fe(NO 3)3 + NO↑+ 2H 2O ------------------------------------① (2)3Fe + 8HNO 3 = 3Fe(NO 3)2 + 2NO↑+ 4H 2O--------------------------------② (3)2Fe(NO 3)3 + Fe = 3Fe(NO 3)2---------------------------------------------------------------------------③ 【1】当4 1 )()(3≤ HNO n Fe n 时,按反应①进行; 【2】当 8 3 )()(3≥HNO n Fe n 时,按反应②进行; 【3】当8 3 )()(4 13< < HNO n Fe n 时,则反应①、②都发生。 上述反应可以认为先发生反应①,若有Fe 剩余则发生③,合并①、③即可得到反应②,所以无论是反应①还是反应②,被还原的HNO 3都占参与反应HNO 3的4 1。 2.Cl 2与FeBr 2溶液反应: 由于还原性Fe 2+>Br -,Cl 2应先氧化Fe 2+,待Fe 2+被氧化完全后再氧化Br -。 ①当Cl 2少量,只氧化Fe 2+时,即n(Cl 2) :n (FeBr 2) ≤1:2时,离子方程式为: Cl 2 +2Fe 2+ ==2Fe 3+ +2Cl - ②当Cl 2过量,Fe 2+、Br -全被氧化时,即n(Cl 2) :n (FeBr 2) ≥3:2时,离子方程式为: 3Cl 2 +2Fe 2++4Br -== 2Fe 3+ +6Cl -+2Br 2 ③当Cl 2 将Fe 2+全部氧化,Br -部分氧化时,即1:2<n(Cl 2):n (FeBr 2)<3:2时,离子方 程式写为:2Cl 2+2Fe 2++2Br -== 2Fe 3+ +4Cl -+Br 2等多种,依具体用量而定。 与FeI 2溶液反应: 由于还原性I - >Fe 2+,Cl 2应先氧化I -,待I -完全被氧化后再氧化Fe 2+。 ①当Cl 2少量,只氧化I -时,即n(Cl 2) :n (FeI 2) ≤1:1时,离子方程式为: Cl 2 +2I -== 2Cl -+ I 2 ②当 Cl 2过量,I - 、Fe 2+全被氧化时,即n(Cl 2) :n (FeI 2) ≥3:2时,离子方程式为: 3Cl 2 +2Fe 2+ +4I -== 2Fe 3+ +6Cl -+2I 2 ③当Cl 2将I -全部氧化,Fe 2+部分氧化时,即1:1<n(Cl 2) :n (FeI 2)<3:2时,离子方程式 可写为:4Cl 2 +2Fe 2+ +6I -== 2Fe 3+ +8Cl -+3I 2等多种,依具体用量而定。
专题复习八 ----铁及其化合物 一.物理性质:银白色,具有金属光泽;质地较软,有良好的导电性、延展性。密度7.86 g/cm3,熔沸点较高。位置:第四周期,第Ⅷ族 二.化学性质:1.与非金属反应 1)Fe+S(I2) FeS(FeI2) 2)4Fe+3O2 2Fe3O4 3)2Fe+3Cl2(Br2) 2FeCl3 弱氧化剂Fe3+、H+、I2、S、铁后的金属阳离子(置换)… Fe2+ Fe3+ 2.与水反应 3Fe + 4H2O(g) Fe3O4 + 4 H2↑(置换) 注意:铁在常温下不会和水发生反应,但在水和空气中O2和CO2的共同作用下,铁却很容易被腐蚀(生锈/电化学腐蚀) 3 与酸反应1)与非氧化性酸反应 Fe +2H+== Fe2+ + H2 2)与氧化性酸反应 a)常温下,铁在冷浓硫酸,浓硝酸中发生钝化 b)与浓硫酸反应:2Fe +6 H2SO4(浓)Fe2(SO4)3 +3SO2 +6 H2O c)与稀硝酸反应: 4.与盐溶液反应2Fe 3++ Cu = 2Fe 2++ Cu 2+ Fe + 2Fe3+ = 3 Fe2+ Fe + Cu2+ = Fe2+ + Cu 三、铁的化合物 Fe+CO+3CO+8Al
2、铁的氢氧化物 (1)Fe(OH)2的制备 Fe(OH)2易被氧化,在制备时应注意:⑴ FeS O 4晶体中不能有 Fe 3+ ;⑵配制后的FeSO 4溶液中要加入少量铁粉;⑶配制溶液的蒸馏水以及所用NaOH 溶液均须煮沸以除去其中溶解的氧气; 实验:FeSO 4溶液中加NaOH. ①现象: 生成白色沉淀,后又迅速转变为灰绿色,最后生成红褐色 ②Fe 2+ 容易被氧化,所以FeSO 4溶液要新配制. ③为了防止滴加NaOH 时带入空气,可将吸收NaOH 的长滴管伸入FeSO 4溶液液面下,再挤出NaOH 溶液. ④为了防止Fe 2+ 被氧化,还可以向盛有FeSO 4溶液的试管中加入少量煤油或其它密度比水小但不溶于水的有机物以隔绝空气. 化学方程式: FeSO 4 + 2NaOH = Fe(OH)2↓+Na 2SO 4 Fe 2++ 2OH -= Fe(OH)2↓(白色) 4Fe(OH)2 + O 2 + 2H 2O = 4Fe(OH)3(红褐色) (白色→灰绿色→红褐色) (2)Fe(OH)3的制备 实验:FeCl 3溶液中加NaOH 溶液. ①现象:生成红褐色沉淀 ②化学方程式:FeCl 3+3NaOH= Fe(OH) 3↓+3NaCl Fe 3++ 3OH -= Fe(OH)3↓(红褐色) ③热稳性:Fe(OH)3对热不稳定,受热能失去水生成红棕色的Fe 2O 3粉末. 化学方程式: 2Fe(OH)3 Fe 2O 3 +3H 2O [小结]难溶性或微溶性的碱受热不稳定,容易分解。生成相应的氧化物和水 (3)Fe (OH )3胶体的制备 向加热沸腾的蒸馏水中加入FeCI 3溶液,待出现红褐色时,停止加热,便可得到 Fe(OH)3胶体。制备时要注意:⑴不可长时间加热,因为加热会使胶体凝聚;⑵不能用自来水,因为自来水中的电解质也可使胶体凝聚。 四.铁的两种氢氧化物的比较 化学式 Fe(OH)2 Fe(OH)3 色、态 白色固体 红褐色固体 溶解性 难溶于水 难溶于水 物质类别 二元弱碱 三元弱碱 与非氧化性酸的 反应 Fe(OH)2+H 2SO 4=FeSO 4+2H 2O Fe(OH)2+2H + =Fe 2+ +2H 2O 2Fe(OH)3+3H 2SO 4=Fe 2(SO 4)3+6H 2O Fe(OH)3+3H + =Fe 3+ +3H 2O 与氧化性酸的反 应 3Fe(OH)2+10HNO 3(稀)=3Fe(NO 3)3+NO ↑+8H 2O 3Fe(OH)2+10H + +NO 3 -=3Fe 3+ +NO ↑+8H 2O Fe(OH)3+3HNO 3(稀)=Fe(NO 3)3+3H 2O Fe(OH)3+3H +=Fe 3+ +3H 2O 与还原性酸的反 应 Fe(OH)2+2HI=FeI 2+2H 2O Fe(OH)2+2H + =Fe 2+ +2H 2O 2Fe(OH)3+6HI=2FeI 2+6H 2O+I 2 2Fe(OH)3+6H + +2I -=2Fe 2++6H 2O+I 2 热稳定性 分解产物复杂 2Fe(OH)3 Fe 2O 3 +3H 2O