有机化学
一、烯烃
1、卤化氢加成 (1)
CH
CH 2
R
HX
CH 3R
X
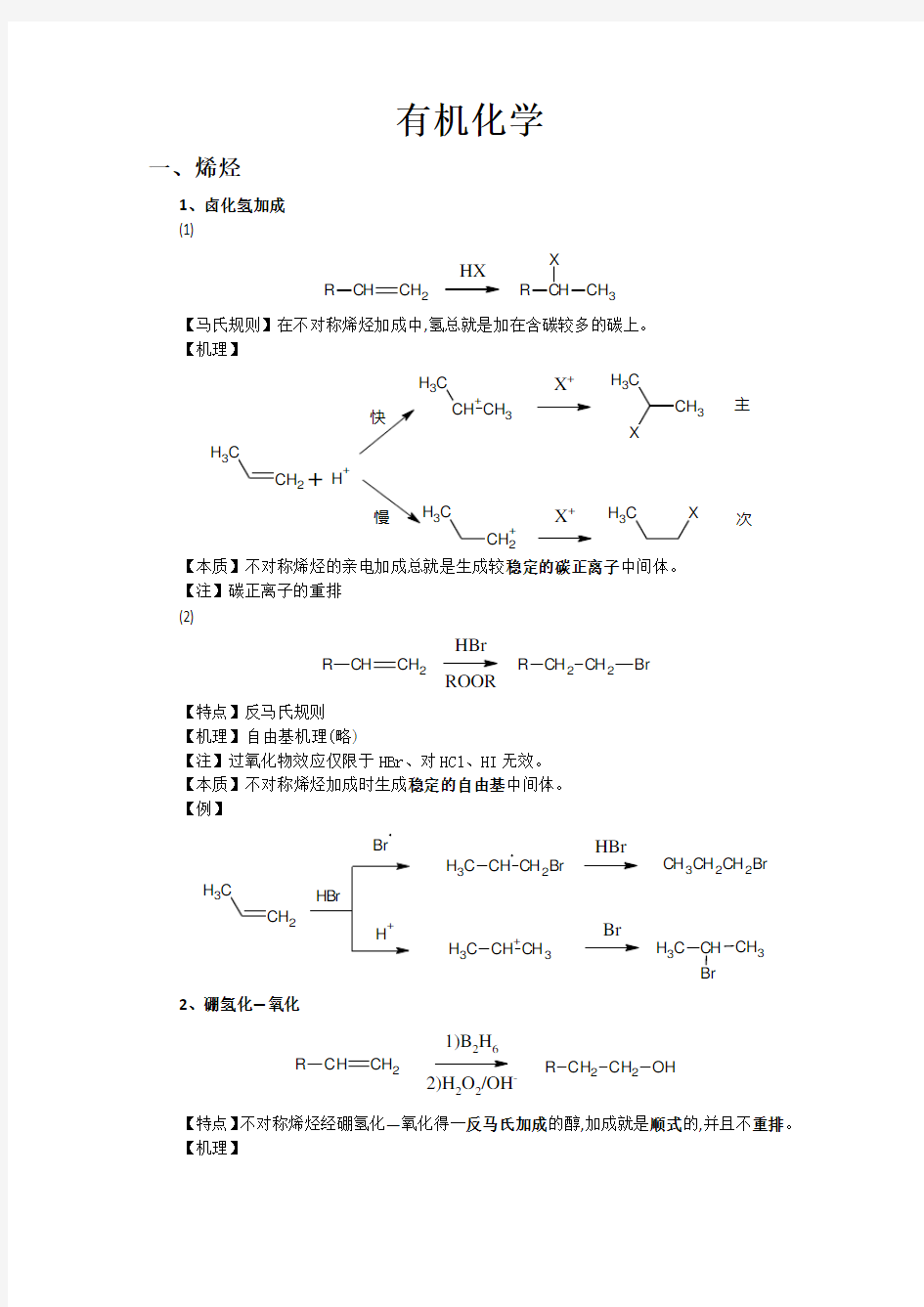
【马氏规则】在不对称烯烃加成中,氢总就是加在含碳较多的碳上。 【机理】
CH 2
C
H 3+
CH 3
C
H 3X +
CH 3
C
H 3
+H +
CH 2
+C
3X +
C
H 3X
主
次
【本质】不对称烯烃的亲电加成总就是生成较稳定的碳正离子中间体。 【注】碳正离子的重排 (2)
CH
CH 2
R
CH 2CH 2
R Br
HBr
ROOR
【特点】反马氏规则 【机理】 自由基机理(略)
【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。 【本质】不对称烯烃加成时生成稳定的自由基中间体。 【例】
CH 2
C
H
3Br
CH CH 2Br
C H 3CH +
CH 3
C H 3HBr
Br
CH 3CH 2CH 2Br
CH CH 3
C H 3
2、硼氢化—氧化
CH
CH 2
R CH 2CH 2R OH
1)B 2H 62)H 2O 2/OH
-
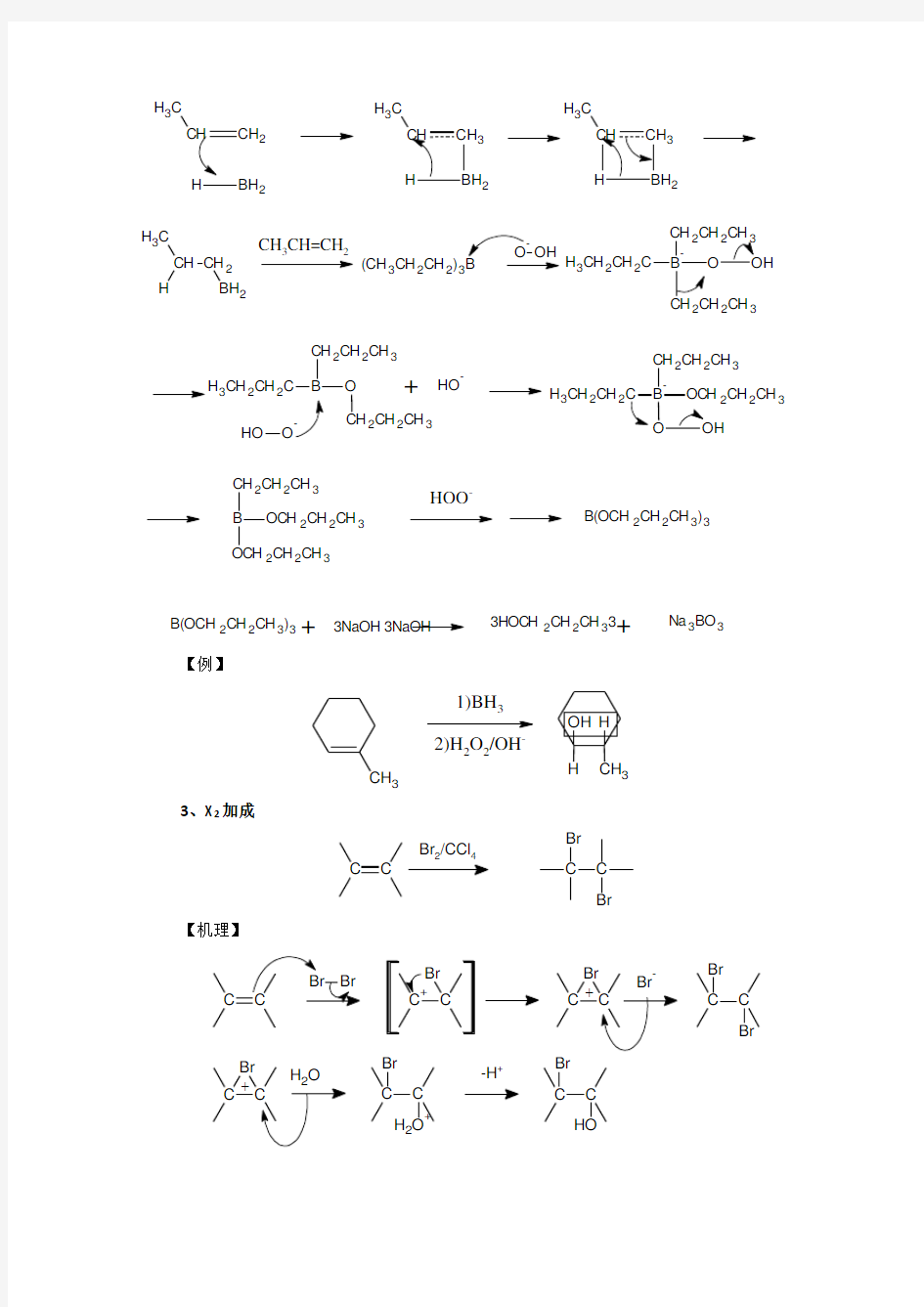
【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成就是顺式的,并且不重排。 【机理】
2
C
H3
3
H3
2
3
H3
2 CH CH2
C
H3
H
BH2
CH CH=CH
(CH3CH2CH2)3
-
H3CH2CH2C
22
CH3
CH2
B O
CH2CH2CH3
H3CH2CH2C
2
CH2CH3
+O H-
O
H
B
-
OC H2CH2CH3
CH2CH2CH3
H3CH2CH2
B O
C H2CH2CH3
CH2CH2CH3
H2CH2CH3
HOO-
B(OCH2CH2CH3)3 B(OCH2CH2CH3)3+3NaOH3NaOH3HOC H2CH2CH33+Na3BO3
2
【例】
CH3
1)BH
3
2)H
2
O
2
/OH-
CH3
H
H
OH
3、X2加成
C C
Br/CCl
C C
Br
【机理】
C
C
C C
Br
Br C
Br
+C C
Br
O
H2+
-H+
C C
Br
O
H
【注】通过机理可以瞧出,反应先形成三元环的溴鎓正离子,然后亲与试剂进攻从背面进攻,不难瞧出就是反式加成。不对称的烯烃,亲核试剂进攻主要取决于空间效应。
【特点】反式加成 4、烯烃的氧化
1)稀冷高锰酸钾氧化成邻二醇。
3
H 33
H
3稀冷KMnO 433M n O O
O
O
H 2O 3
H 33H 3 2)热浓酸性高锰酸钾氧化
C C H R R 2
R 1
KMnO 4
H +
C
R
R 1
O +
R 2C
O
3)臭氧氧化
C C H R R 2
R 1
C
R
R 1
O +
R 2C
H
O
1)O 32)Zn/H 2O
4)过氧酸氧化
C C
R R 2
1
ROOOH
21
C C
R R 2
1
2
1
Ag
+
O 2
5
、烯烃的复分解反应
CH 2R
CH 2
R 1
+
C H 2CH 2R
R 1
【例】
O
H
2CH 2
C 6H 5
O
C 6H 5
+
C H 2CH 2
6、共轭二烯烃 1)
卤化氢加成
CH C
H 2HX
C
H 3X
C
H 23
X
高温
1,4加成为主
低温
1,2加成为主
2)狄尔斯-阿德尔(Diels-Alder)反应
【描述】共轭二烯烃与烯烃在加热的条件下很容易生成环状的1,4加成产物。 【例】
CH 2
CH 2
+
O O
苯
?
O O
CH 2
CH 2
+
苯?
C H O
2
C H
O
二、脂环烃
1、环丙烷的化学反应
【描述】三元环由于张力而不稳定,易发生加成反应开环
,类似碳碳双键。
H /Ni CH 2CH 2CH 2CH 2CH 2CH 2CH 2CH 2CH 2CH 2CH 2CH 2
【特点】环烷烃都有抗氧化性,可用于区分不饱与化合物。 【注】遵循马氏规则 【例】
CH
3
CH 2CH CH 2CH 3
2、环烷烃制备 1)武兹(Wurtz)反应
【描述】通过碱金属脱去卤素,制备环烷烃。 【例】
C C C 2H 5OH
C
C
2X
CH 2
X 双键的保护
2)卡宾
①卡宾的生成
A 、多卤代物的α消除
X 3C
H
+
-
N aOH a,R -Li
C X
+
X
-
+
H Y
B 、由某些双键化合物的分解
CO H 2C :N 2H 2C :
Cl 2H 2C :
Cl
-
H
2
O H
2+
Cl 2C +++
+
CO 2
②卡宾与烯烃的加成反应 【特点】顺式加成,构型保持 【例】
Cl CH/NaOH
相转移催化剂
Cl Cl
CH 3
C
H 3Br CH/KOC(CH )3
HOC(CH 3)3
3H 3
③类卡宾
【描述】类卡宾就是一类在反应中能起到卡宾作用的非卡宾类化合物,最常用的类卡宾就是ICH 2ZnI 。
C H 2
I 2
C u(Zn)
I C
H 2ZnI
+制备
【特点】顺式加成,构型保持 【例】
CH I Zn(Cu)
CH 3
C
H 3
CH I 3
H 3
三、炔烃
1、还原成烯烃 1)、顺式加成
R 2
R 1R 1
R
2
Cat=[P b/BaSO 4,P b/CaC O 3,Ni 3B...]
(CH 3COO)2Ni
NaBH 4
Ni 3B
H 2
Cat
2)、反式加成
R 2
R 1H 2Cat
R 1
2
Cat=[Na/ 液氨...]
2、亲电加成 1)、加X 2
R 2
R 1
Br 2
R 2
R 1Br Br
【机理】
中间体Br
+
R 2R 1
【特点】反式加成 2)、加HX
CH
R
2HBr
C CH 3
Br
C
H 3
R
R HBr
R Br
(一摩尔的卤化氢主要为反式加成)
3)、加H 2O
CH
R
H 2O
HgSO 4/H
2SO 4
O 3
R
CH R
O
重排
【机理】
CH R
C
+
Hg
+
R
Hg
2+
H 2O
R H
Hg +
O
H 2+
-H
+
R H
Hg +
O
H R Hg +
H
H +
O 3
R
重排
【特点】炔烃水合符合马式规则。
【注】只有乙炔水合生成乙醛,其她炔烃都生成相应的酮。
3、亲核加成 1)、
C
H 3C
H CH
+
O
C
H 3Zn(CH 3COO)
C
H 2CH O
CH 3
O
CH 3OH
+
CH 3COOCH 3
HCHO H
+
2
维尼纶合成纤维就是用聚乙烯醇甲酯
2)、
C H CH
+
HC N
NH 4Cl,CuCl 2aq
C
H 2CN
N CH 3
C H 3H 3CH 3
CN C
H 2CN
2CH
人造羊毛
3)、
C
H CH
+
C 2H 5OH
碱
150℃~180℃/压力
C
H 2CH
OC 2H 5
C
H CH
2Cu 2Cl 2NH 4Cl C
H 2CH C CH
C H CH
3Cu 2Cl 2NH 4Cl
C
H 2CH CH
CH 2
C H CH
3金属羰基化合物
C H CH
3
Ni(CN)2
5、端炔的鉴别
C CH R
C
C -R
Ag
C CH R
C C -
R Cu
Cu(NH )+
Ag(NH )+
白色红色
【注】干燥的炔银与炔铜受热或震动时易发生爆炸,实验完毕,应立即加浓硫酸把炔化物分解。
6、炔基负离子
C
C -
R
Na
+
1°烷基
(2)H 2O
R -L(L=X,OTs)R 1:(1)O
R R O
(1)(2)H 2O
C C
R R 1
C
C
R
CH 2R 1
OH
C
C
R
C R 1
OH
2
C
H CH NaNH
C
H C
-
Na
+
CH3
C
H3
O
H O
C
H C OH
CH3
3 H
Pb/BaSO
4
3
C
H2
CH3
OH
Al O
3
C
2
CH2
三、芳烃
1
、苯的亲电取代反应
1)卤代
+
FeBr
3
Br
+Br H
Br
2
2)硝化
+
NO2
+H2O
HN O3
浓
H
2
SO
4
浓
3)磺化
+
SO3H
+H2O
H2SO
( 7%SO3 )
SO3
H
H+
4)傅-克(Friedel-Crafts)
反应
①傅-克烷基化反应
+R Cl
AlCl
3
R
R
Cl
+
AlCl 3
AlC l 4
+
+
R CH 2
+
R
CH 2
+
+
H
R
++
H
R
+
+
+
AlC l 4
+
R
+
+
HC l
AlC l 3
【注】碳正离子的重排,苯环上带有第二类定位基不能进行傅-克反应。
【例】
+
C
H 3Cl
AlCl 3
CH 3
CH
3
+
C
H 3Cl
H 3CH 3
AlCl 3
CH 3
CH 3
CH
3
CH 2Cl 2
+
2
AlCl
3
CH 1Cl 3
+
3
AlCl
3
②傅-克酰基化反应
+R Cl AlCl3
O
R
+
O
O O
R
R
AlCl
3
O
R
+RCOOH 【例】
CH
3
CH
2
COCl
AlCl
3
CH3
O
Zn-Hg
HCl
浓
CH
3 +O
O
AlCl
3COOH
O
2、苯环上取代反应的定位效应
1)第一类定位基,邻对位定位基,常见的有:
NR2NH R NH
2
OH HN R
O
OR R
O
O
R Ar X(F,C l,Br,I)
2)第二类定位基,间位定位基, 常见的有:
NR3NO2CF
3
Cl3COOH OR
O
CN SO3H CH O
COR
【注】第一类定位基除卤素外,均使苯环活化。第二类定位基使苯环钝化。卤素比较特殊,为弱钝化的第一类定位基。
3、苯的侧链卤代
CH
3
Fe
h
CH 3
Cl
CH 3
+
CH 2Cl
CH 3
NBS
CH 2Br
【机理】自由基机理 4、苯的侧链氧化
1)用高锰酸钾氧化时,产物为酸。 【描述】苯环不易被氧化,当其烷基侧链上有α氢的时候,则该链可被高锰酸钾等强氧化剂氧化,不论烷基侧链多长。结果都就是被氧化成苯甲酸。
C
H
KMnO H +
COOH
【例】
C 3
CH 3
C
H 3CH 3
KMnO H C 3
CH 3
C
H 3COOH
2)用CrO 3+Ac 2O 为氧化剂时,产物为醛。 【例】
CH 3
NO 2
CrO /Ac O
CH(OAc)
NO 2
CHO
NO 2
3)用MnO 2为氧化剂时,产物为醛或酮。
CH 3
MnO H 2SO 4
CHO
CH 2
CH 3
MnO H 2SO 4
CH 3O
5、萘
α
β
【特点】萘的亲电取代反应,主要发生在α位,因为进攻α位,形成的共振杂化体较稳定,反应速度快。
【例】
HNO 3H 2SO 4
NO
2
Br 2CCl 4
Br
H
2
SO
4
SO3H
SO3H
CH3
HNO
3
HOAc
CH3
2
CH3
HNO
3
HOAc
CH3
NO2
NO2
HNO
3
H
2
SO
4
NO2
NO2NO
2
2
+
四、卤代烃
1、取代反应
(1)水解
R X
OH-
R OH
R X R SH
SH-
(2)醇解
R X
R
O
R 1
R 1ONa
R X
R
S
R 1
R 1SNa
(3)氰解
R
R S R
1
CN -C 2H 5OH
(4)氨解
R
X R
NH 2
NH 3
R
X
NH 3
R 3N
(5)酸解
R X
R
1
COOR R 1COO -
(6)与炔钠反应
R X
+
R 1
C
C
-
C C R
R 1
(7)卤素交换反应
R
X
NaI
丙酮
R I
2、消除反应 (1)脱卤化氢 ①β-消除
CH CH 2R
Cl
H
α
β
NaOH
乙醇
RCH
CH 2
【注】当有多种β-H 时,其消除方向遵循萨伊切夫规律,即卤原子总就是优先与含氢较少的β碳上的氢一起消除。
【例】
CH 3
C
H 3Br
KOH
乙醇
CH 3
C
H 3CH 2
C
H 3+
81%
19%
CH 3
C
H 3Br
C
H 2KOH
乙醇
CH 3
C
H 3C
H 2
C C R
1
R
Cl
H Cl H
KOH
乙醇
C
C
R
R
1
②α-消除
C H
Cl Cl
NaOH
CCl 2
(2)脱卤素
C C R R
1
R
3
R
2
Zn,?
乙醇
3
R 2
R R
1
R
CH 2Br 2Br
Zn ?
R
3、与活泼金属反应 (1)与金属镁反应
RX
+
Mg
无水乙醚
RM gX
(格式试剂)
(2)与金属钠反应 武兹(Wurtz)反应
2RX
Na
R
R
(3)与金属锂反应
RX
+Li
无水乙醚
RLi
2RLi
+
CuI
无水乙醚
R 2CuLi
2+
LiX
+LiI
【注】二烷基铜锂主要就是与卤代烃偶联成烷烃
2R
1
X
R
R 1
4、还原反应
R
X
+
Zn+HCl
RH
5、氯甲基化
+
C
H O
H
+
Cl
H ZnCl 2
CH 3Cl
五、醇
1、卢卡斯(Lucas)试剂
无水氯化锌与浓盐酸的很合溶液叫卢卡斯试剂,用于鉴别伯、仲、叔醇
Lucas 试剂
很快反应
反应很慢
反应很快立即混浊几分钟内混浊长时间不出现混浊叔醇仲醇伯醇
2、把羟基变成卤基
(1)、醇与卤化磷(PX 5、PX 3)
R OH
PX 3
R
X
(2)、醇与亚硫酰氯(SOCl 2)
R OH
R
Cl SOCl 2
3、醇的氧化
(1)沙瑞特(Sarret)试剂
R
H
OH CrO 3(C 5H 5N)2
R
H
O
【注】沙瑞特试剂,就是CrO 3与吡啶的络合物。它可以把伯醇的氧化控制在生成醛的阶段上,产率比较高,且对分子中的双键无影响。
(2)琼斯(Jones)试剂
R
1
OH R
1
O CrO 3-
H 2SO 4
【注】琼斯试剂就是把CrO 3溶于稀硫酸中,滴加到醇的丙酮溶液中,在室温下就可以得到很高的产率的酮。同样对分子中的双键无影响。
【例】
CH 3
O
H CH 3O
CrO 3-H 2SO 4
丙酮
(3)邻二醇被高碘酸氧化
OH
R
R 1
OH
+
I OH
O
O
-H 2O
R
CHO
R 1CHO
+
HIO 3
4、频哪醇重排(pinacol rearrangement)
C C R
R 1
OH
R 2R 3
OH
H
+
C C
R
R 1
R 2
O R 3
【机理】
C R R 2
+
R 2R 3
C C R R 1
R 2R 3
H
+
-H 2O
C R R 1
R 2R 3
C C R R 1
R 3
OH
+
R 2
-H +
C C
R R 1
2
O R
3
【注】
①羟基脱水,总就是优先生成较稳定的碳正离子。 ②在不同的烃基中,总就是芳基优先迁移。不同的芳基,苯环上连有给电子基团的优先迁移。
③要注意立体化学,离去基团所连的碳原子(如有手性的话)
构型发生转化,因为就是一
个协同反应,准确的机理描述就是
C C R R 1
R 2
R 3
H +C
R 2+
23
-H
+
C C
R R 1
2
O R 3
④频哪醇重排再有机中就是非常普遍的重排反应,只要在反应中形成
C
+
C H 结
构的碳正离子(即带正电荷的碳原子的邻近碳上连有羟基),都可以发生频哪醇重排。
【例】
C C P h C
H 3P h CH 3
H +
C P h C
H 3P O CH 3
C C C H 3C
H 3CH 3CH 3
极性溶剂
-I
C
C O
C
H 3CH 3CH 3
3
C CH C H 3P h
CH 3
2
NaNO 2H +
O
C
H 3P h CH 3
5、制醇 (1)烯烃制备 ①酸性水合
R 2
R 21
H 2SO 4
C R 1
3
R 2OH
【注】碳正机理,生成稳定的碳正离子,可能重排。 ②羟汞化-脱汞反应
CH 2
R
Hg(OAc)2/H 2O NaBH 4
CH 3
R
H
【特点】反应不发生重排,因此常用来制备较复杂的醇,特别就是有体积效应的醇。 ③硼氢化-氧化法
R R 2R 2
R 1
C R 1
3
R 2OH 1)B 2H 6
2)H 2O 2/OH
-
【特点】反马氏规则,所以可合成伯醇,上两种方法无法合成。 (2)格式试剂