
2019年全国统一高考化学试卷(新课标Ⅰ)
一、选择题:共7小题,每小题6分,满分42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.(6分)陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。下列说法错误的是()
A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁
B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成
C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐
D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点
2.(6分)关于化合物2﹣苯基丙烯(),下列说法正确的是()
A.不能使稀高锰酸钾溶液褪色
B.可以发生加成聚合反应
C.分子中所有原子共平面
D.易溶于水及甲苯
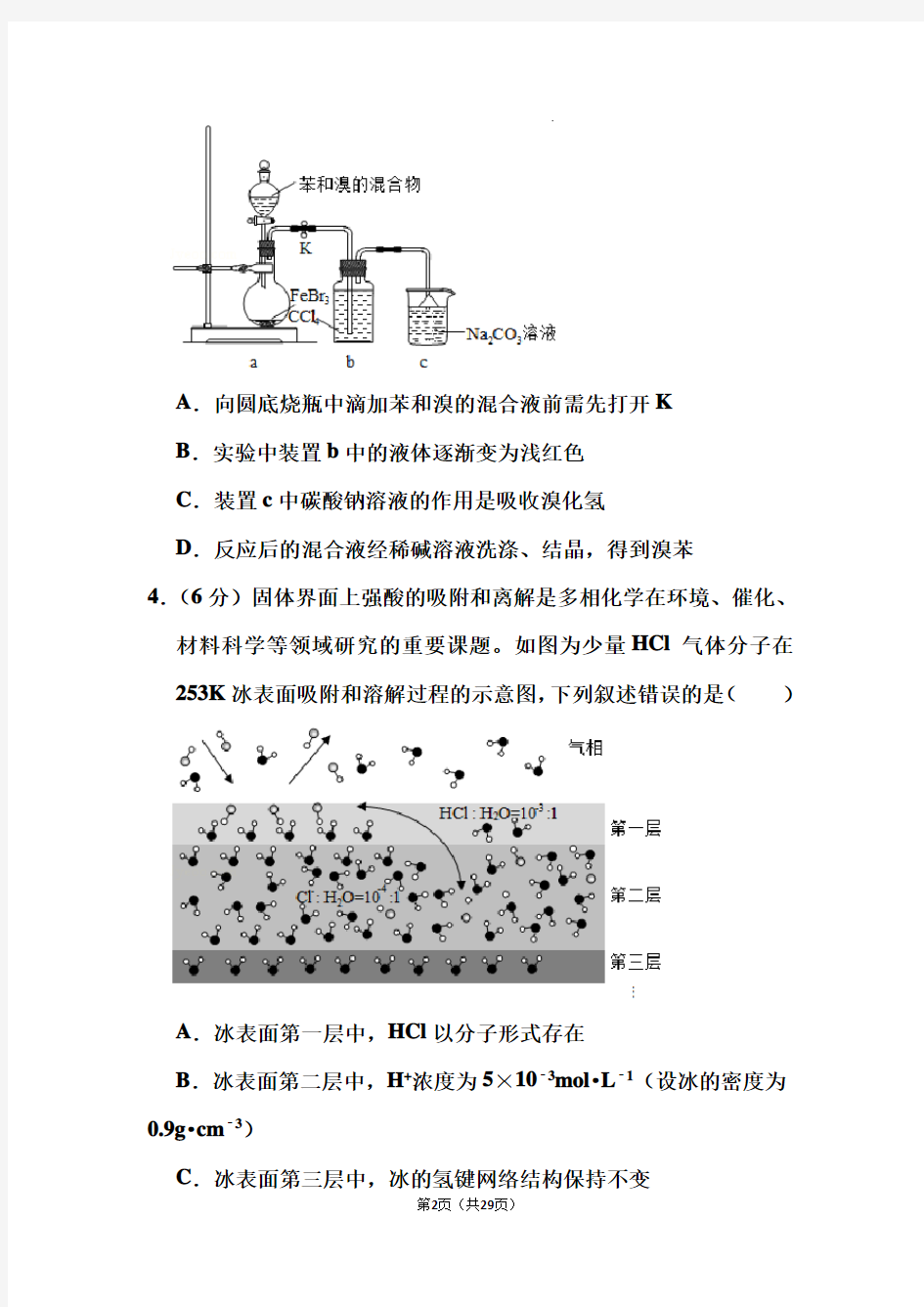
3.(6分)实验室制备溴苯的反应装置如图所示,关于实验操作或叙述错误的是()
A.向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B.实验中装置b中的液体逐渐变为浅红色
C.装置c中碳酸钠溶液的作用是吸收溴化氢
D.反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
4.(6分)固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。如图为少量HCl气体分子在253K冰表面吸附和溶解过程的示意图,下列叙述错误的是()
A.冰表面第一层中,HCl以分子形式存在
B.冰表面第二层中,H+浓度为5×10﹣3mol?L﹣1(设冰的密度为0.9g?cm﹣3)
C.冰表面第三层中,冰的氢键网络结构保持不变
D.冰表面各层之间,均存在可逆反应HCl?H++Cl﹣
5.(6分)NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的K a1=1.1×10﹣3,K a2=3.9×10﹣6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是()
A.混合溶液的导电能力与离子浓度和种类有关
B.Na+与A2﹣的导电能力之和大于HA﹣的
C.b点的混合溶液pH=7
D.c点的混合溶液中,c(Na+)>c(K+)>c(OH﹣)
6.(6分)利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是()
A.相比现有工业合成氨,该方法条件温和,同时还可提供电能
B.阴极区,在氢化酶作用下发生反应H2+2MV2+═2H++2MV+
C.正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D.电池工作时质子通过交换膜由负极区向正极区移动
7.(6分)科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是()
A.WZ的水溶液呈碱性
B.元素非金属性的顺序为X>Y>Z
C.Y的最高价氧化物的水化物是中强酸
D.该新化合物中Y不满足8电子稳定结构
二、非选择题:共43分。第8~10题为必考题,每个试题考生都必须作答。第11~12为选考题,考生根据要求作答。(一)必考题:8.(14分)硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工业。一种以硼镁矿(含Mg2B2O5?H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:
回答下列问题:
(1)在95℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为。
(2)“滤渣1”的主要成分有。为检验“过滤1”后的滤液中是否含有Fe3+离子,可选用的化学试剂是。
(3)根据H3BO3的解离反应:H3BO3+H2O?H++B(OH)4﹣,K a =5.81×10﹣10,可判断H3BO3是酸;在“过滤2”前,将溶液pH调节至3.5,目的是。
(4)在“沉镁”中生成Mg(OH)2?MgCO3沉淀的离子方程式为,母液经加热后可返回工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是。
9.(15分)硫酸铁铵[NH4Fe(SO4)2?xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如图:
回答下列问题:
(1)步骤①的目的是去除废铁屑表面的油污,方法是。
(2)步骤②需要加热的目的是,温度保持80﹣95℃,采用的合适加热方式是。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为(填标号)。
(3)步骤③中选用足量的H2O2,理由是。分批加入H2O2,同时为了,溶液要保持pH小于0.5。
(4)步骤⑤的具体实验操作有,经干燥得到硫酸铁铵晶体样品。
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150℃时失掉1.5个结晶水,失重5.6%.硫酸铁铵晶体的化学式为。
10.(14分)水煤气变换[CO(g)+H2O(g)═CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴Co(s),平衡后气体中H2的物质的量分数为0.0250。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO
H2(填“大于”或“小于”)。
(2)721℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为(填标号)。
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。
可知水煤气变换的△H0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=eV,写出该步骤的化学方程式。
(4)Shoichi研究了467℃、489℃时水煤气变换中CO和H2分压随时间变化关系(如图所示)。催化剂为氧化铁,实验初始时体系中的和p CO相等、和相等。
计算曲线a的反应在30~90min内的平均速率(a)=kPa ?min﹣1.467℃时和p CO随时间变化关系的曲线分别是、。489℃时和p CO随时间变化关系的曲线分别是、。
(二)选考题:共15分。请考生从2道化学题中任选一题作答。如果多做,则按所做的第一题计分。[化学--选修3:物质结构与性质] 11.(15分)在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要材料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是(填标号)。
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、
碳的杂化类型分别是、
。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是,其中与乙二胺形成的化合物稳定性相对较高的是(填“Mg2+”或“Cu2+”)。
(3)一些氧化物的熔点如下表所示:
氧化物Li2O MgO P4O6SO2
熔点/℃1570280023.8﹣75.5
解释表中氧化物之间熔点差异的原因。
(4)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu.图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x=pm,Mg原子之间最短距离y=pm.设阿伏加德罗常数的值为N A,则MgCu2的密度是g?cm﹣3(列出计算表达式)。
[化学--选修5:有机化学基础]
12.化合物G是一种药物合成中间体,其合成路线如下:
回答下列问题:
(1)A中的官能团名称是。
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。写出B的结构简式,用星号(*)标出B中的手性碳。(3)写出具有六元环结构、并能发生银镜反应的B的同分异构体的结构简式。(不考虑立体异构,只需写出3个)
(4)反应④所需的试剂和条件是。
(5)⑤的反应类型是。
(6)写出F到G的反应方程式。
(7)设计由甲苯和乙酰乙酸乙酯(CH3COCH2COOC2H5)制备的合成路线(无机试剂任选)。
2019年全国统一高考化学试卷(新课标Ⅰ)
答案与解析
一、选择题:共7小题,每小题6分,满分42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.【分析】A.氧化铁为红棕色固体,陶瓷以青色为主,原因是烧瓷原料中含有氧化铁的色釉,在烧制的过程中还原成青色;
B.黏土是制作砖瓦和陶瓷的主要原料,经高温烧结得到陶瓷制品;C.传统硅酸盐产品包括:普通玻璃、陶瓷、水泥,含有硅酸根离子的盐属于硅酸盐,陶瓷是应用较早的人造材料;
D.陶瓷是陶器和瓷器的总称,是以粘土为主要原料以及各种天然矿物经过粉碎混炼、成型和煅烧制得的材料以及各种制品。
【解答】解:A.瓷器着色如雨过天晴,为青色,瓷器的原料高岭矿或高岭土中普遍含有铁元素,青瓷的烧制过程就是将含有红棕色氧化铁的色釉在火里烧,再经过还原形成青色,此时铁不再是三价铁,而是二价铁,故A错误;
B.陶瓷的传统概念是指所有以黏土等无机非金属矿物为原材料,经过高温烧制而成的产品,闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成,故B正确;
C.以含硅元素物质为原料通过高温加热发生复杂的物理、化学变化制得硅酸盐产品,传统硅酸盐产品包括:普通玻璃、陶瓷、水泥,陶瓷,是用物理化学方法制造出来的最早的人造材料,一万多年以
前,它的诞生使人类由旧石器时代进入了新石器时代,故C正确;D.陶瓷有:日用陶瓷、卫生陶瓷、建筑陶瓷、化工陶瓷和电瓷、压电陶瓷等,共性为具有抗氧化、抗酸碱腐蚀、耐高温、绝缘、易成型等优点,故D正确;
故选:A。
2.【分析】该有机物中含有苯环和碳碳双键,具有苯和烯烃性质,能发生加成反应、取代反应、加聚反应、氧化反应,据此分析解答。【解答】解:A.含有碳碳双键,所以具有烯烃性质,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,故A错误;
B.含有碳碳双键,所以能发生加聚反应生成高分子化合物,故B 正确;
C.苯分子中所有原子共平面、乙烯分子中所有原子共平面,甲烷分子为正四面体结构,有3个原子共平面,该分子中甲基具有甲烷结构特点,所以该分子中所有原子不能共平面,故C错误;D.该物质为有机物,没有亲水基,不易溶于水,易溶于甲苯,故D错误;
故选:B。
3.【分析】A.K关闭时难以加入苯和溴的混合液;
B.液溴易挥发,溴的四氯化碳溶液呈浅红色;
C.碳酸钠溶液能够HBr反应;
D.洗涤后混合液分层,应该用分液、蒸馏法分离。
【解答】解:A.向圆底烧瓶中滴加苯和溴的混合液前,需先打开
K才能平衡压强,以便加入混合液,故A正确;
B.挥发出的HBr中含有溴,溴溶于四氯化碳呈浅红色,故B正确;
C.HBr为污染物,需要用碳酸钠溶液吸收,故C正确;
D.溴苯中含有剩余的苯,混合液分层,经稀碱溶液洗涤后应先分液再蒸馏,故D错误;
故选:D。
4.【分析】A.由图可知,冰表面第一层中存在HCl分子;
B.冰表面第二层中,Cl﹣:H2O=10﹣4:1,设水的体积为1L,以此计算;
C.冰表面第三层中,仍存在H2O分子;
D.由图可知,只有第二层存在HCl气体分子在冰表面吸附和溶解过程。
【解答】解:A.由图可知,冰表面第一层中存在HCl分子,则HCl以分子形式存在,故A正确;
B.冰表面第二层中,Cl﹣:H2O=10﹣4:1,设水的体积为1L,溶液体积近似为1L,则H+浓度为=5×10﹣3mol ?L﹣1,故B正确;
C.冰表面第三层中,仍存在H2O分子,则冰的氢键网络结构保持不变,故C正确;
D.由图可知,只有第二层存在HCl气体分子在冰表面吸附和溶解过程,第一、三层不存在,故D错误;
故选:D。
5.【分析】A.由图象可知a、b、c点的离子种类、浓度不同,且导电能力不同;
B.a点溶液主要成分为KHA,b点主要成分为Na2A、K2A;C.b点溶质为为Na2A、K2A,溶液呈碱性;
D.c点NaOH过量,且溶液呈碱性。
【解答】解:A.溶液的导电能力取决于电荷浓度的大小,由图象可知a、b、c点的离子种类、浓度不同,可知混合溶液的导电能力与离子浓度和种类有关,故A正确;
B由图象可知b点钾离子浓度较小,b点导电能量较大,b点存在Na+与A2﹣,可知Na+与A2﹣的导电能力之和大于HA﹣的,故B正确;
C.由题给数据可知H2A为二元弱酸,b点溶质为为Na2A、K2A,为强碱弱酸盐,溶液呈碱性,则pH>7,故C错误;
D.c点NaOH过量,则n(NaOH)>n(KHA),溶液呈碱性,可知c(Na+)>c(K+)>c(OH﹣),故D正确。
故选:C。
6.【分析】生物燃料电池的工作原理是N2+3H22NH3,其中N2在正极区得电子发生还原反应,H2在负极区失电子发生氧化反应,原电池工作时阳离子向正极区移动,据此分析判断。【解答】解:A.利用生物燃料电池在室温下合成氨,既不需要高温加热,同时还能将化学能转化为电能,故A正确;
B.原电池的负极区,氢气在氢化酶的作用下,发生氧化反应,反应式为H2+2MV2+═2H++2MV+,故B错误;
C.N2在正极区得电子发生还原反应,生成NH3,故C正确;D.燃料电池工作时,负极区生成的H+透过质子交换膜进入正极区,故D正确;
故选:B。
7.【分析】W、X、Y、Z为同一短周期元素,根据图知,X能形成4个共价键、Z能形成1个共价键,则X位于第IV A族、Z位于第VIIA族,且Z核外最外层电子数是X核外电子数的一半,Z 最外层7个电子,则X原子核外有14个电子,X为Si元素,Z 为Cl元素,该阴离子中Cl元素为﹣1价、X元素为+4价,根据化合价的代数和为﹣1价,Y为﹣3价,所以Y为P元素,根据阳离子所带电荷知,W为Na元素,通过以上分析知W、X、Y、Z分别是Na、Si、P、Cl元素,结合题目分析解答。
【解答】解:通过以上分析知,W、X、Y、Z分别是Na、Si、P、Cl元素,
A.WZ为NaCl,NaCl是强酸强碱盐,其水溶液呈中性,故A错误;
B.同一周期元素非金属性随着原子序数增大而增强,则非金属性Cl>P>Si,所以非金属性Z>Y>X,故B错误;
C.Y为P元素,Y的最高价氧化物的水合物是H3PO4为中强酸,故C正确;
D.Y为P元素,其最外层有5个电子,P原子形成2个共价键且该阴离子得到W原子一个电子,所以P原子达到8电子结构,即Y原子达到8电子结构,故D错误;
故选:C。
二、非选择题:共43分。第8~10题为必考题,每个试题考生都必须作答。第11~12为选考题,考生根据要求作答。(一)必考题:8.【分析】硼镁矿(含Mg2B2O3?H2O、SiO2及少量Fe2O3、Al2O3)加入硫酸铵溶液,得到气体,根据硼镁矿和硫酸铵化学式知,得到的气体为NH3,用NH4HCO3吸收NH3,发生反应NH3+NH4HCO3=(NH4)2CO3,根据过滤2及沉镁成分知,过滤1中得到的滤渣为难溶性的SiO2、Fe2O3、Al2O3,调节溶液pH=
3.5时得到H3BO3,滤液中含有MgSO4,沉镁过程发生的反应为
2Mg2++3CO32﹣+2H2O=Mg(OH)2?MgCO3↓+2HCO3﹣,加热分解可以得到轻质MgO;母液中含有(NH4)2SO4,
(1)氨气为碱性气体,能和酸式铵盐吸收生成正盐;
(2)滤渣1为难溶性的SiO2、Fe2O3、Al2O3;Fe3+和KSCN溶液混合得到血红色液体;
(3)H3BO3能发生一步电离,且电离平衡常数很小,为一元弱酸;在“过滤2”前,将溶液pH调节至3.5,有利于析出H3BO3;(4)在“沉镁”中镁离子和碳酸根离子发生水解和复分解反应生成Mg(OH)2?MgCO3沉淀,同时还生成碳酸氢根离子离子;在母液中得到(NH4)2SO4,在溶浸时需要加入(NH4)2SO4,碱
式碳酸镁高温易分解得到氧化物、水和二氧化碳。
【解答】解:硼镁矿(含Mg2B2O3?H2O、SiO2及少量Fe2O3、Al2O3)加入硫酸铵溶液,得到气体,根据硼镁矿和硫酸铵化学式知,得到的气体为NH3,用NH4HCO3吸收NH3,发生反应NH3+NH4HCO3=(NH4)2CO3,根据过滤2及沉镁成分知,过滤1中得到的滤渣为难溶性的SiO2、Fe2O3、Al2O3,调节溶液pH=3.5时得到H3BO3,滤液中含有MgSO4,沉镁过程发生的反应为2Mg2++3CO32﹣+2H2O =Mg(OH)2?MgCO3↓+2HCO3﹣,加热分解可以得到轻质MgO;母液中含有(NH4)2SO4,
(1)氨气为碱性气体,能和酸式铵盐吸收生成正盐,反应方程式为NH3+NH4HCO3=(NH4)2CO3,
故答案为:NH3+NH4HCO3=(NH4)2CO3;
(2)滤渣1为难溶性的SiO2、Fe2O3、Al2O3;Fe3+和KSCN溶液混合得到血红色液体,所以可以用KSCN溶液检验铁离子,
故答案为:SiO2、Fe2O3、Al2O3;KSCN;
(3)H3BO3能发生一步电离,且电离平衡常数很小,所以为一元弱酸;在“过滤2”前,将溶液pH调节至3.5,有利于析出H3BO3,如果溶液pH较大,得不到硼酸而得到硼酸盐,
故答案为:一元弱;转化为H3BO3,促进析出;
(4)在“沉镁”中镁离子和碳酸根离子发生水解和复分解反应生成Mg(OH)2?MgCO3沉淀,同时还生成碳酸氢根离子离子,离子方程式为2Mg2++3CO32﹣+2H2O=Mg(OH)2?MgCO3↓+2HCO3
﹣;在母液中得到(NH4)2SO4,在溶浸时需要加入(NH4)2SO4,所以母液经加热后可返回溶浸工序循环使用,碱式碳酸镁高温易分解得到氧化物、水和二氧化碳,所以高温焙烧就可以得到轻质氧化镁,
故答案为:2Mg2++3CO32﹣+2H2O=Mg(OH)2?MgCO3↓+2HCO3﹣;溶浸;高温焙烧。
9.【分析】废铁屑中含有油污,油污在碱性条件下水解,且碱和Fe 不反应,所以可以用碱性溶液除去废铁屑中的油污,将干净铁屑进入稀硫酸中并加热,稀硫酸和Fe发生置换反应生成硫酸亚铁和氢气,过滤除去废渣得到滤液,滤液中含有未反应的稀硫酸和生成的硫酸亚铁,然后向滤液中加入H2O2,Fe2+被氧化生成Fe3+而得到硫酸铁溶液,然后向硫酸铁溶液中加入硫酸铵固体,然后通过加热浓缩、冷却结晶、过滤、洗涤、干燥得到硫酸铁铵固体;(1)油污在碱性条件下水解;
(2)温度越高化学反应速率越快;低于100℃的加热需要水浴加热;铁屑中含有少量硫化物,反应产生的气体需要净化处理,硫化物和稀硫酸反应生成H2S,H2S属于酸性气体,用碱液吸收,且要防止倒吸;
(3)H2O2具有氧化性,能氧化Fe2+,且双氧水被还原生成水;Fe3+水解导致溶液呈酸性,所以酸能抑制Fe3+水解;
(4)从溶液中获取晶体采用蒸发浓缩、冷却结晶、过滤、洗涤、干燥的方法;
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150℃时失掉1.5个结晶水,失去结晶水的式量=18×1.5=27,失重 5.6%,则该晶体式量==482,x=
。
【解答】解:废铁屑中含有油污,油污在碱性条件下水解,且碱和Fe不反应,所以可以用碱性溶液除去废铁屑中的油污,将干净铁屑进入稀硫酸中并加热,稀硫酸和Fe发生置换反应生成硫酸亚铁和氢气,过滤除去废渣得到滤液,滤液中含有未反应的稀硫酸和生成的硫酸亚铁,然后向滤液中加入H2O2,Fe2+被氧化生成Fe3+而得到硫酸铁溶液,然后向硫酸铁溶液中加入硫酸铵固体,然后通过加热浓缩、冷却结晶、过滤、洗涤、干燥得到硫酸铁铵固体;(1)油污在碱性条件下水解生成羧酸盐和甘油,羧酸盐和甘油都易溶于水,然后水洗,从而除去油污,
故答案为:碱煮水洗;
(2)温度越高化学反应速率越快,缩短反应时间,所以步骤②需要加热的目的是加快反应;低于100℃的加热需要水浴加热,所以温度保持80﹣95℃,采用的合适加热方式为热水浴;铁屑中含有少量硫化物,反应产生的气体需要净化处理,硫化物和稀硫酸反应生成H2S,H2S属于酸性气体,用碱液吸收,且要防止倒吸,
BD不能防止倒吸且A溶解硫化氢能力较弱,所以选取C,
故答案为:加快反应;热水浴;C;
(3)H2O2具有氧化性,能氧化Fe2+生成铁离子且双氧水被还原生
成水,不引进杂质,所以选取双氧水作氧化剂;Fe3+水解导致溶液呈酸性,H+能抑制Fe3+水解,为防止Fe3+水解需要溶液的pH保持0.5,
故答案为:将Fe2+全部氧化为Fe3+,不引入杂质;防止Fe3+水解;(4)从溶液中获取晶体采用蒸发浓缩、冷却结晶、过滤、洗涤、干燥的方法,所以步骤⑤中从溶液中获取晶体的步骤为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,
故答案为:蒸发浓缩、冷却结晶、过滤、洗涤;
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150℃时失掉1.5个结晶水,失去结晶水的式量=18×1.5=27,失重5.6%,则该晶体式量==482,x=
=12,所以其化学式为NH4Fe(SO4)2?12H2O,
故答案为:NH4Fe(SO4)2?12H2O。
10.【分析】(1)①使纯H2缓慢地通过处于721℃下的过量的氧化钴CoO(s),氧化钴部分被还原为金属钴Co(s),平衡后气体中H2的物质的量分数为0.0250。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。
相同条件下还原反应达到平衡状态后,反应前后气体物质的量都是不变的反应,一氧化碳物质的量分数小于氢气物质的量分数,说明一氧化碳进行的程度大;
(2)CO(g)+H2O(g)=CO2(g)+H2(g),等物质的量的一
2018年普通高等学校招生全国统一考试试卷全国I卷化学可能用到的相对原子质量H 1 Li 7 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Ar 40 Fe 56 I 127 一、选择题本题共6个小题每小题6分。在每小题给出的四个选项中只有一项是符合 题目要求的。 7硫酸亚铁锂LiFePO4电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧硫酸亚铁锂电 池正极片中的金属其流程如下 下列叙述错误的是 A合理处理废旧电池有利于保护环境和资源再利用 B从“正极片”中可回收的金属元素有Al、Fe、Li C“沉淀”反应的金属离子为Fe3+ D上述流程中可用硫酸钠代替碳酸钠 8下列说法错误的是 A蔗糖、果糖和麦芽糖均为双糖 B酶是一类具有高选择催化性能的蛋白质 C植物油含不饱和脂肪酸酯能使Br?/CCl4褪色 D淀粉和纤维素水解的最终产物均为葡萄糖 9在生成和纯化乙酸乙酯的实验过程中下列操作未涉及的是 10NA是阿伏加德罗常数的值下列说法正确的是 A16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 NA B22.4 L标准状况氨气含有的质子数为18NA C92.0 g甘油丙三醇中含有羟基数为1.0NA D 1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA 11环之间共用一个碳原子的化合物称为螺环化合物螺[2,2]戊烷 是最简单的一种。下列关于 该化合物的说法错误的是 A与环戊烯互为同分异构体 B二氯代物超过两种 C所有碳原子均处同一平面 D生成1 mol C5H12至少需要2 mol H2 12主族元素W、X、Y、Z的原子序数依次增加且均不大于20。W、X、Z最外层电子数之和为10W 与Y同族W与Z形成的化合物可与浓硫酸反应其生成物可腐蚀玻璃。下列说法正确的是 A常温常压下X的单质为气态 B Z的氢化物为离子化合物 C Y和Z形成的化合物的水溶液呈碱性 D W与Y具有相同的最高化合价 13最近我国科学家设计了一种CO2+H2S协同转化装置实现对天然气中CO2和H2S的高效去除。示意图 如图所示其中电极分别为ZnO@石墨烯石墨烯包裹的ZnO和石墨烯石墨烯电极区发生反应 为 ①EDTA-Fe2+-e-=EDTA-Fe3+ ②2EDTA-Fe3++H2S=2H++S+2EDTA-Fe2+ 该装置工作时下列叙述错误的是
2019年全国卷Ⅱ化学高考试题 可能用到的相对原子质量:H 1 C 12 N 14 O 16 F 19 Na 23 S 32 Cl35.5 As 75 I 127Sm 150 7.“春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句,下列关于该诗句中所涉及物质的说法错误的是 A.蚕丝的主要成分是蛋白质 B.蚕丝属于天热高分子材料 C.“蜡炬成灰”过程中发生了氧化反应 D.古代的蜡是高级脂肪酸酯,属于高分子聚合物 8.已知N A是阿伏加德罗常数的值,下列说法错误的是 A.3g 3He含有的中子数为1N A B.1 L 0.1 mol·L?1磷酸钠溶液含有的PO3-4数目为0.1N A C.1 mol K2Cr2O7被还原为Cr3+转移的电子数为6N A D.48 g正丁烷和10 g异丁烷的混合物中共价键数目为13N A 9.今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是 A.原子半径:W 2019年普通高等学校招生全国统一考试 语文 本试卷共22题,共150分,共10页。 一、现代文阅读(36分) (一)论述类文本阅读(本题共3小题,9分) 阅读下面的文字,完成1-3题。 杜甫之所以能有集大成之成就,是因为他有可以集大成之容量。而其所以能有集大成之容量,最重要的因素,乃在于他生而禀有一种极为难得的健全才性——那就是他的博大、均衡与正常。杜甫是一位感性与理性兼长并美的诗人,他一方面具有极大极强的感性,可以深入到他接触的任何事物,把握住他所欲攫取的事物之精华;另一方面又有着极清明周至的理性,足以脱出于一切事物的蒙蔽与局限,做到博观兼美而无所偏失。 这种优越的禀赋表现于他的诗中,第一点最可注意的成就,便是其汲取之博与途径之正。就诗歌体式风格方面而言,古今长短各种诗歌他都能深入撷取尽得其长,而且不为一体所限,更能融会运用,开创变化,千汇万状而无所不工。我们看他《戏为六绝句》之论诗,以及与当时诸大诗人,如李白、高适、岑参、王维、孟浩然等,酬赠怀念的诗篇中论诗的话,都可看到杜甫采择与欣赏的方面之广;而自其《饮中八仙歌》《曲江三章》《同谷七歌》等作中,则可见到他对各种诗体运用变化之神奇工妙;又如从《自京赴奉先县咏怀五百字》《北征》及“三吏”“三别”等五古之作中,可看到杜甫自汉魏五言古诗变化而出的一种新面貌。就诗歌内容方面而言,杜甫更是无论妍媸巨细,悲欢忧喜,宇宙的一切人物情态,都能随物赋形,淋漓尽致地收罗笔下而无所不包,如写青莲居士之“飘然思不群”,写空谷佳人之“日暮倚修竹”;写丑拙则“袖露两肘”,写工丽则“燕子风斜”;写玉华宫之荒寂,予人以一片沉哀悲响;写洗兵马之欢忭,写出一片欣奋祝愿之情、其涵蕴之博与变化之多,都足以为其禀赋之博大、均衡与正常的证明。 其次值得注意的,则是杜甫严肃中之幽默与担荷中之欣赏,我以为每一位诗人对于其所面临的悲哀与艰苦,都各有其不同的反应态度,如渊明之任化,太白之腾跃,摩诘之禅解,子厚之抑敛。东坡之旷观,六一之遣玩,都各因其才气性情而有所不同,然大别之,不过为对悲苦之消融与逃避。其不然者,则如灵均之怀沙自沉,乃完全为悲苦所击败而毁命丧生,然而杜甫却独能以其健全的才性,表现为面对悲苦的正视与担荷。所以天宝的乱离,在当时诗人中,唯杜甫反映者为独多,这正因杜甫独具一份担荷的力量,所以才能使大时代的血泪,都成为了他天才培育的浇灌,而使其有如此强大的担荷之力量的,则端赖他所有的一份幽默与欣赏的余裕。他一方面有极主观的深入的感情,一方面又有极客观的从容的 2019年高考语文真题及答案(全国卷) 注意事项: 1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。 2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的 答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。 回答非选择题时,将答案写在答题卡上。写在本试卷上无效。 3.考试结束后,将本试卷和答题卡一并交回。 一、现代文阅读 (一)论述类文本阅读 阅读下面的文字,完成下列小题。 对城市而言,文明弹性是一个城市体在生存、创新、适应、应变等 方面的综合状态、综合能力,是公共性与私人性之间、多样性与共同 性之间、稳定性与变迁性之间、柔性与刚性之间的动态和谐,过于绵 柔、松散,或者过于刚硬、密集,都是弹性不足或丧失的表现,是城 市体出现危机的表征。当代城市社会,尤其需要关注以下文明弹性问 题。 其一,空间弹性。城市具有良好空间弹性的一个重要表现,是空间 的私人性与公共性关系能够得到较为合理的处理。任何城市空间都是 私人性与公共性的统一,空间弹性的核心问题,就是如何实现空间的 公共性与私人性的有机统一、具体转换。片面地强调空间的公共性或 片面地强调空间的私人性,都会使城市发展失去基础,目前,人们更 多地要求空间的私人性,注重把空间固化为永恒的私人所有物、占有 物。这种以私人化为核心的空间固化倾向,造成城市空间弹性不足,正在成为制约城市发展的一个重要原因。 其二,制度弹性,一种较为理想的、有弹性的城市制度,是能够在秩序与活力、生存与发展间取得相对平衡的制度。城市有其发展周期、发展阶段,对一个正在兴起的城市而言,其主要任务是聚集更多的发展资源、激活发展活力,而对一个已经发展起来的城市而言,人们会更为注重城市制度的稳定功能。但问题在于,即使是正在崛起的城市,也需要面对秩序与稳定的问题;即使是一个已经发展起来的城市,也需要面对新活力的激活问题。过于注重某种形式的城市制度,过于注重城市制度的某种目标,都是城市制度弹性不足,走向僵化的表现,都会妨害城市发展。 其二,制度弹性。一种较为理想的、有弹性的城市制度,是能够在秩序与活力、生存与发展间取得相对平衡的制度。城市有其发展周期、发展阶段,对一个正在兴起的城市而言,其主要任务是聚集更多的发展资源、激活发展活力。而对一个已经发展起来的城市而言,人们会更为注重城市制度的稳定功能。但问题在于,即使是正在崛起的城市,也需要面对秩序与稳定的问题;即使是一个已经发展起来的城市,也需要面对新活力的激活问题。过于注重某种形式的城市制度,过于注重城市制度的某种目标,都是城市制度弹性不足、走向僵化的表现,都会妨害城市发展。#网 其三,意义弹性。所谓城市的意义弹性,是指城市能够同时满足多样人群的不同层面的意义需要,并能够使不同的意义与价值在总体上 2018年全国统一高考化学试卷(新课标Ⅰ) 一、选择题(共7小题,每小题6分,满分42分) 1.(6分)磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一,采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程如下: 下列叙述错误的是() A.合理处理废旧电池有利于保护环境和资源再利用 B.从“正极片”中可回收的金属元素有Al、Fe、Li C.“沉淀”反应的金属离子为Fe3+ D.上述流程中可用硫酸钠代替碳酸钠2.(6分)下列说法错误的是() A.蔗糖、果糖和麦芽糖均为双糖 B.酶是一类具有高选择催化性能的蛋白质C.植物油含不饱和脂肪酸酯,能使Br2/CCl4褪色 D.淀粉和纤维素水解的最终产物均为葡萄糖 3.(6分)在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是() A.B. C.D. 4.(6分)N A是阿伏加德罗常数的值,下列说法正确的是() A.16.25gFeCl3,水解形成的Fe(OH)3为胶体粒子数为0.1N A B.22.4L(标准状况)氩气含有的质子数为18N A C.92.0g甘油(丙三醇)中含有羟基数为1.0N A D.1.0molCH4与Cl2在光照下生成CH3Cl的分子数为1.0N A 5.(6分)环之间共用一个碳原子的化合物称为螺环化合物,螺(2,2)戊烷()是最单的一种,下列关于该化合物的说法错误的是() A.与环戊烯互为同分异构体 B.二氯化物超过两种 C.所有碳原子均处同一平面 D.生成1molC5H12,至少需要2molH2 6.(6分)主族元素W、X、Y、Z的原子序数依次增加,且均不大于20.W、X、Z最外层电子数之和为10;W与Y同族;W与Z形成的化台物可与浓硫酸反应,其生成物可腐蚀玻璃。下列说法正确的是() A.常温常压下X的单质为气态 B.Z的氢化物为离子化合物 C.Y和Z形成的化合物的水溶液呈碱性 D.W与Y具有相同的最高化合价 7.(6分)最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。示意图如右所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为: ①EDTA﹣Fe2+﹣e﹣=EDTA﹣Fe3+ ②2EDTA﹣Fe3++H2S=2H++S+2EDTA﹣Fe2+该装置工作时,下列叙述错误的是() A.阴极的电极反应:CO2+2H++2e﹣═CO+H2O B.协同转化总反应:CO2+H2S═CO+H2O+S C.石墨烯上的电势比ZnO@石墨烯上的低 D.若采用Fe3+/Fe2+取代EDTA﹣Fe3+/EDTA﹣Fe2+,溶液需为酸性 二、解答题(共3小题,满分43分) 8.(14分)醋酸亚铬[(CH3COO)2Cr?2H2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价络;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示。回答下列问题: (1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是仪器a的名称是。(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置。打开K1、K2,关闭K3。 ①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为 ②同时c中有气体产生,该气体的作用是 (3)打开K3,关闭K1和K2.c中亮蓝色溶液流入d,其原因 是;d中析出砖红色沉淀。为使沉淀充分析出并 分离,需采用的操作是、洗涤,干燥。 (4)指出装置d可能存在的缺点 2019年高考英语全国 2卷含答案 -CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN 2019年普通高等学校招生全国统一考试(全国卷Ⅱ) 英语 注意事项: 1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。 2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上,写在本试卷上无效。 3.考试结束后,将本试卷和答题卡一并交回。 第一部分听力(共两节,满分30分) 做题时,先将答案标在试卷上。录音内容结束后,你将有两分钟的时间将试卷上的答案转涂到答题卡上。 第一节(共5小题;每小题1.5分,满分7.5分) 听下面5段对话。每段对话后有一个小题,从题中所给的A、B、C三个选项中选出最佳选项。听完每段对话后,你都有10秒钟的时间来回答有关小题和阅读下一小题。每段对话仅读一遍。 例:How much is the shirt? A. £19.15. B. £9.18. C. £9.15. 答案是C。 1. Where does the conversation probably take place? A. In a library. B. In a bookstore. C. In a classroom. 2. How does the woman feel now? A. Relaxed. B. Excited. C. Tired. 3. How much will the man pay? A. $520. B. $80. C. $100. 4. What does the man tell Jane to do A. Postpone his appointment. B. Meet Mr. Douglas. C. Return at 3 o’clock. 5. Why would David quit his job 2018年全国统一高考化学试卷(新课标Ⅱ) 一、选择题:本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。 1.(6分)化学与生活密切相关,下列说法错误的是() A.碳酸钠可用于去除餐具的油污 B.漂白粉可用于生活用水的消毒 C.氢氧化铝可用于中和过多胃酸 D.碳酸钡可用于胃肠X射线造影检查 2.(6分)研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如图所示)。下列叙述错误的是() A.雾和霾的分散剂相同 B.雾霾中含有硝酸铵和硫酸铵 C.NH3是形成无机颗粒物的催化剂 D.雾霾的形成与过度施用氮肥有关 3.(6分)实验室中用如右图所示的装置进行甲烷与氯气在光照下反应的实验。 光照下反应一段时间后,下列装置示意图中能正确反映实验现象的是() A. B.C.D. 4.(6分)W、X、Y和Z为原子序数依次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同,下列叙述正确的是() A.X与其他三种元素均可形成两种或两种以上的二元化合物 B.Y与其他三种元素分别形成的化合物中只含有离子键 C.四种元素的简单离子具有相同的电子层结构 D.W的氧化物对应的水化物均为强酸 5.(6分)N A代表阿伏加德罗常数的值,下列说法正确的是() A.常温常压下,124gP4中所含P一P键数目为4N A B.100 mL 1mol?L﹣1FeCl3溶液中所含Fe3+的数目为0.lN A C.标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2N A D.密闭容器中,2 mol SO2和1molO2催化反应后分子总数为2N A 6.(6分)我国科学家研发了一种室温下“可呼吸”的Na﹣CO3二次电池,将NaClO4溶于有机溶剂作为电解液。钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na ?2Na2CO3+C,下列说法错误的是() A.放电时,ClO4﹣向负极移动 B.充电时释放CO2,放电时吸收CO2 C.放电时,正极反应为:3CO2+4e﹣═2CO32﹣+C D.充电时,正极反应为:Na++e﹣═Na 7.(6分)下列实验过程可以达到实验目的是() 编号实验目的 实验过程 A 配制 0.4000mol?L﹣1的 NaOH溶液 称取4.0g固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至250mL容量瓶中定容 B 探究维生素C的还原性向盛有2mL黄色氯化铁溶液的试管中滴加浓的维生素C 溶液,观察颜色变化 C 制取并纯化氢气向稀盐酸中加入锌粒,将生成的气体依次通过NaOH溶液、 浓硫酸和KMnO4溶液 D 探究浓度对反应速率的 影响 向2支盛有5mL不同浓度 NaHSO3溶液的试管中同时加入2mL5%H2O2溶液,观察实验现象 二、非选择题:每个试题考生必须作答。 8.(14分)我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示: 相关金属离子[c0(M n+)=01mol?L﹣1]形成氢氧化物沉淀的pH范围如下: 绝密★启用前 2019年普通高等学校招生全国统一考试 理科数学 本试卷共23题,共150分,共5页。考试结束后,将本试卷和答题卡一并交回。 注意事项:1.答题前,考生先将自己的姓名、准考证号码填写清楚,将条形码准确粘贴在条形码区域内。 2.选择题必须使用2B 铅笔填涂;非选择题必须使用0.5毫米黑色字迹的签字笔书写,字体工整、笔迹清楚。 3.请按照题号顺序在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。 4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。 5.保持卡面清洁,不要折叠、不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。 一、选择题:本题共12小题,每小题5分,共60分。在每小题给出的四个选项中,只有一项是符合题目要求的。 1.设集合A ={x |x 2-5x +6>0},B ={ x |x -1<0},则A ∩B = A .(-∞,1) B .(-2,1) C .(-3,-1) D .(3,+∞) 2.设z =-3+2i ,则在复平面内z 对应的点位于 A .第一象限 B .第二象限 C .第三象限 D .第四象限 3.已知AB u u u r =(2,3),AC uuu r =(3,t ),BC uuu r =1,则AB BC ?u u u r u u u r = A .-3 B .-2 C .2 D .3 4.2019年1月3日嫦娥四号探测器成功实现人类历史上首次月球背面软着陆,我国航天事业取得又一重大成就,实现月球背面软着陆需要解决的一个关键技术问题是地面与探测器的通讯联系.为解决这个问题,发射了嫦娥四号中继星“鹊桥”,鹊桥沿着围绕地月拉格朗日L 2点的轨道运行.L 2点是平衡点,位于地月连线的延长线上.设地球质量为M 1,月球质量为M 2,地月距离为R ,L 2点到月球的距离为r ,根据牛顿运动定律和万有引力定律,r 满足方程: 121 223 ()()M M M R r R r r R +=++. 设r R α=,由于α的值很小,因此在近似计算中3453 2 333(1)ααααα++≈+,则r 的近似值为 A 2 1 M R M B 2 1 2M R M C 2 3 1 3M R M D 2 3 1 3M R M 5.演讲比赛共有9位评委分别给出某选手的原始评分,评定该选手的成绩时,从9个原始评分中去掉1个最高分、1个最低分,得到7个有效评分.7个有效评分与9个原始评分相比,不变的数字特征是 A .中位数 B .平均数 C .方差 D .极差 6.若a >b ,则 A .ln(a ?b )>0 B .3a <3b C .a 3?b 3>0 D .│a │>│b │ 7.设α,β为两个平面,则α∥β的充要条件是 A .α内有无数条直线与β平行 B .α内有两条相交直线与β平行 2019年全国卷Ⅱ理综化学 可能用到的相对原子质量:H 1 C 12 N 14 O 16 F 19 Na 23 S 32 Cl 35.5 As 75 I 127 Sm 150 一、选择题:本题共13个小题,每小题6分。共78分,在每小题给出的四个选项中,只有一项是符合题 目要求的。 7.“春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句,下列关于该诗句中所涉及物质的说法错误的是 A.蚕丝的主要成分是蛋白质 B.蚕丝属于天热高分子材料 C.“蜡炬成灰”过程中发生了氧化反应 D.古代的蜡是高级脂肪酸酯,属于高分子聚合物 8.已知N A是阿伏加德罗常数的值,下列说法错误的是 A.3g 3He含有的中子数为1N A PO 数目为0.1N A B.1 L 0.1 mol·L?1磷酸钠溶液含有的3 4 C.1 mol K2Cr2O7被还原为Cr3+转移的电子数为6N A D.48 g正丁烷和10 g异丁烷的混合物中共价键数目为13N A 9.今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是 A.原子半径:W C 向盛有饱和硫代硫酸钠溶液的试管中滴加稀 盐酸 有刺激性气味气体产生,溶液变浑浊 D 向盛有FeCl3溶液的试管中加过量铁粉,充分 振荡后加1滴KSCN溶液 黄色逐渐消失,加KSCN后溶液颜色不变11.下列化学方程式中,不能正确表达反应颜色变化的是 A.向CuSO4溶液中加入足量Zn粉,溶液蓝色消失 Zn+CuSO4Cu+ZnSO4 B.澄清的石灰水久置后出现白色固体 Ca(OH)2+CO2CaCO3↓+H2O C.Na2O2在空气中放置后由淡黄色变为白色 2Na2O22Na2O+O2↑ D.向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀 3Mg(OH)2+2FeCl32Fe(OH)3+3MgCl2 12.绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是 A.图中a和b分别为T1、T2温度下CdS在水中的溶解度 B.图中各点对应的K sp的关系为:K sp(m)=K sp(n) 2019年高考全国2 卷地理试题及答案 一、选择题 在城镇化进程中,城市人口,土地利用和产业需要协调发展。根据协调发展水平,将长江三角洲城市群的城市由高到低分为I,II,III,IV 四个等级类型。图 1 为2001 年至2016年长江三角洲城市群的城市协调发展水平变化, 图2示意长江三角洲城市群的范围及城市分布. 据此完成1~3 题。 1.2016 年协调发展水平I 型中的多数城市 A.海港规模大 B.沿长江分布 C.集聚长江口 D. 行政等级较高 2.以上海为核心,协调发展水平IV 型的城市, 在空间分布上呈现 A. 均衡性 B.边缘性 C.集中性 D.对称性 3.与2001年相比,2016 年协调发展水平上升的城市,多数与上海 A. 空间位置邻近 B.发展模式相同 C. 城市性质相似D:产业部门接近 美国某快递公司最大的空运枢纽设在路易斯维尔机场. 该机场是美国主要的货运机场之一在机场周边聚集了诸如美国红十宇会应急救援中心、汽车配件中心, 以及乳制品. 珠宝,手 机制造等100多家企业.据此完成4~5题. 4.该快递公司在路易斯维尔机场附近需要配建大型的货物 A. 生产中心 B. 分拣中心 C.销售中心 D.质检中心 5.多家企业在路易斯维尔机场附近集聚,主要是为了 A.利用机场的基础设施 B.降低交通运输成本 C.方便企业间产品交换 D.快速响应客户需求 积云为常见的一类云, 其形成受下垫面影响强烈,空气在对流过程中, 气流携带来自下垫面的水汽上升, 温度不断下降, 至凝结温度时,水汽凝结成 云. 水汽开始凝结的高度即为积云 的云底高度. 据此完成6~8 题 6.大气对流过程中上升气流与下沉气流相间分布, 因此积云常常呈 A. 连续层片状 B.鱼鳞状 C.间隔团块状 D.条带状 7.积云出现频率最高的地带是 A. 寒温带针叶林地带 B.温带落叶阔叶林地带 C.亚热带常绿阔叶林地带 D. 热带雨林地带 8.在下垫面温度决定水汽凝结高度的区域, 积云的云底高度低值多出现在 A. 日出前后 B. 正午 C.日落前后 D.午夜 霍林河发源于大兴安岭, 为山前半干旱区及部分半湿润区的平原带来了流水及泥沙. 受上 游修建水库和灌溉的影响, 山前平原河段多年断流. 断流期间, 山前平原上的洼地增多增大据此完成9~11 题. 9.修建水库前, 营造该地区山前平原地表形态的力主要来自 A.构造运动 B. 流水 C.冰川 D.风 10.断流期间,山前平原上的洼地增多増大是由于 A.地面沉降 B. 流水侵蚀 C.风力侵蚀 D.冻融塌陷 11.伴随着洼地增多增大, 周边地区可能出现 A.水土流失 B. 沼泽化 C.土地沙化 D.盐碱化 36.阅读图文材料; 完成下列要求.(24 分)云南省宾川县位于横断山区边缘,高山地区气候凉湿,河谷地区气候干热,为解决河谷地区农业生产的缺水问题,该县曾在境内山区实施小规模调水,但效果有限。1994 年,“引洱(海)入宾(川)”工程竣工通水,加之推广节水措施,当地农业用水方得以保障。近些年来,宾川县河谷地区以热带、亚热带水果为主的经济作物种植业蓬勃发展。图 4 示意宾川县的地形。 2019年普通高等学校招生全国统一考试 理科综合能力测试化学 可能用到的相对原子质量:H 1 C 12 N 14 O 16 Mg 24 S 32 Fe 56 Cu 64 一、选择题:本题共13个小题,每小题6分。共78分,在每小题给出的四个选项中,只有一项是符合题 目要求的。 7.陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。下列说法错误的是 A. “雨过天晴云破处”所描述的瓷器青色,来自氧化铁 B. 闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成 C. 陶瓷是应用较早的人造材料,主要化学成分是硅酸盐 D. 陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点 8.关于化合物2?苯基丙烯(),下列说法正确的是 A. 不能使稀高锰酸钾溶液褪色 B. 可以发生加成聚合反应 C. 分子中所有原子共平面 D. 易溶于水及甲苯 9.实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是 A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开K B. 实验中装置b中的液体逐渐变为浅红色 C. 装置c中的碳酸钠溶液的作用是吸收溴化氢 D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯 10.固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。下图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图。下列叙述错误的是 A. 冰表面第一层中,HCl以分子形式存在 B. 冰表面第二层中,H+浓度为5×10?3 mol·L?1(设冰的密度为0.9 g·cm?3) C. 冰表面第三层中,冰的氢键网格结构保持不变 噲?H++Cl? D. 冰表面各层之间,均存在可逆反应HCl垐? 11.NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸氢钾H2A的K a1=1.1×10?3 ,K a2=3.9×10?6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是 A. 混合溶液的导电能力与离子浓度和种类有关 B. Na+与A2?的导电能力之和大于HA?的 C. b点的混合溶液pH=7 D. c点的混合溶液中,c(Na+)>c(K+)>c(OH?) 12.利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是 A. 相比现有工业合成氨,该方法条件温和,同时还可提供电能 B. 阴极区,氢化酶作用下发生反应H2+2MV2+2H++2MV+ C. 正极区,固氮酶催化剂,N2发生还原反应生成NH3 D. 电池工作时质子通过交换膜由负极区向正极区移动 13.科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数 绝密★启用前 2019 年普通高等学校招生全国统一考试 理科数学 本试卷共23 题,共150 分,共 5 页。考试结束后,将本试卷和答题卡一并交回。 注意事项:1.答题前,考生先将自己的姓名、准考证号码填写清楚,将条形码准确粘贴在条形码区域内。 2.选择题必须使用2B 铅笔填涂;非选择题必须使用0.5 毫米黑色字迹的签字笔书写,字体工整、笔迹清楚。 3.请按照题号顺序在各题目的答题区域内作答,超出答题区域书写的答案无效; 在草稿纸、试题卷上答题无效。 4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。 5.保持卡面清洁,不要折叠、不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。 一、选择题:本题共12 小题,每小题 5 分,共60 分。在每小题给出的四个选项中,只有一 项是符合题目要求的。 2 -5x+6>0} ,B={ x|x-1<0} ,则A∩B= 1.设集合A={ x|x A.(-∞,1)B.(-2,1)C.(-3,-1)D.(3,+∞)2.设z=-3+2i,则在复平面内z 对应的点位于 A.第一象限B.第二象限C.第三象限D.第四象限 3.已知AB =(2,3), AC =(3,t),BC =1,则AB BC = A.-3 B.-2 C.2 D.3 4.2019 年1 月3 日嫦娥四号探测器成功实现人类历史上首次月球背面软着陆,我国航天事业取得又一重大成就,实现月球背面软着陆需要解决的一个关键技术问题是地面与探测 器的通讯联系.为解决这个问题,发射了嫦娥四号中继星“鹊桥”,鹊桥沿着围绕地月拉格朗日L2 点的轨道运行.L2 点是平衡点,位于地月连线的延长线上.设地球质量为M 1,月球质量为M2,地月距离为R,L2 点到月球的距离为r,根据牛顿运动定律和万有引力定律,r 满足方程: M M M 1 2 1 2 2 ( ) 3 R r (R r)r R . 设r R ,由于的值很小,因此在近似计算中 3 4 5 3 3 2 (1 ) 3 3 ,则r 的近似 值为 A.M 2 M 1 R B. M 2 1 R C. 3 3M 2 M 1 R D. 3 M 2 1 R 可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Ar 40 Fe 56 I 127 7.陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。 下列说法错误的是 A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁 B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成 C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐 D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点 8.关于化合物2?苯基丙烯(右图),下列说法正确的是 A.不能使稀高锰酸钾溶液褪色 B.可以发生加成聚合反应 C.分子中所有原子共平面 D.易溶于水及甲苯 9.实验室制备溴苯的反应装置如下图所示, 关于实验操作或叙述错误的是 A.向圆底烧瓶中滴加苯和溴的混合液前需先打开K B.实验中装置b中的液体逐渐变为浅红色 C.装置c中的碳酸钠溶液的作用是吸收溴化氢 D.反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯 10.固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。下图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图。下列叙述错误的是 A.冰表面第一层中,HCl以分子形式存在 B.冰表面第二层中,H+浓度为5×10?3 mol·L?1(设冰的密度为0.9 g·cm?3) C.冰表面第三层中,冰的氢键网格结构保持不变 D.冰表面各层之间,均存在可逆反应HCl H++Cl? 11.NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的K a1=1.1×10?3 ,K a2=3.9×10?6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是 A.混合溶液的导电能力与离子浓度和种类有关 B.Na+与A2?的导电能力之和大于HA?的 C.b点的混合溶液pH=7 D.c点的混合溶液中,c(Na+)>c(K+)>c(OH?) 说明:本资料是梦挂梧桐工作室第一时间由专业老师整理而成,完全按照高考原题的格式且可编辑,答案为标准答案。 2020年普通高等学校招生全国统一考试 理科综合化学部分 注意事项: 7.国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,乙醚、75%乙醇、含氯消毒剂、过氧乙酸(CH3COOOH)、氯仿等均可有效灭活病毒。对于上述化学药品,下列说法错误的是 A.CH3CH2OH能与水互溶 B.NaClO通过氧化灭活病毒 C.过氧乙酸相对分子质量为76 D.氯仿的化学名称是四氯化碳 8.紫花前胡醇可从中药材当归和白芷中提取得到,能提高人体免疫力。有关该化合物,下列叙述错误的是 A.分子式为C14H14O4 B.不能使酸性重铬酸钾溶液变色 C.能够发生水解反应 D.能够发生消去反应生成双键 9.下列气体去除杂质的方法中,不能实现目的的是 10.铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化,反应过程如图所示。 下列叙述错误的是 A.CH3COI是反应中间体 B.甲醇羰基化反应为CH3OH+CO=CH3CO2H C.反应过程中Rh的成键数目保持不变D.存在反应CH3OH+HI=CH3I+H2O 11.1934年约里奥–居里夫妇在核反应中用α粒子(即氦核4 2He)轰击金属原子W Z X,得到核素30 Z+2 Y,开 创了人造放射性核素的先河: W Z X+4 2 He→30 Z+2 Y+1 n 其中元素X、Y的最外层电子数之和为8。下列叙述正确的是 A.W Z X的相对原子质量为26B.X、Y均可形成三氯化物 C.X的原子半径小于Y的D.Y仅有一种含氧酸 12.科学家近年发明了一种新型Zn?CO2水介质电池。电池示意图如下,电极为金属锌和选择性催化材料,放电时,温室气体CO2被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。 高考全国II卷英语 第二部分阅读理解(共两节,满分40分) A In the coming months, we are bringing together artists form all over the globe, to enjoy speaking Shakespeare’s plays in their own language, in our Globe, within the architecture Shakespeare wrote for. Please come and join us. National Theatre of China Beijing|Chinese This great occasion(盛会) will be the National Theatre of China’s first visit to the UK. The company’s productions show the new face of 21st century Chinese theatre. This production of Shakespeare’s Richard III will be directed by the National’s Associate Director,Wang Xiaoying. Date & Time : Saturday 28 April,2.30pm & Sunday 29 April,1.30pm & 6.30pm Marjanishvili Theatre Tbilisi | Georgian One of the most famous theatres in Georgia,the Marjanishvili,founded in 1928,appears regularly at theatre festivals all over the world. This new production of It is helmed(指导)by the company’s Artistic Director Levan Tsuladze. Date & Time :Friday 18May,2.30pm & Saturday 19May,7.30pm Deafinitely Theatre London | British Sign Language (BSL) By translating the rich and humourous text of Love’s Labour’s Lost into the physical language of BSL,Deafinitely Theatre creates a new interpretation of Shakespeare’s comedy and aims to build a bridge between deaf and hearing worlds by performing to both groups as one audience. Date & Time : Tuesday 22 May,2.30pm & Wednesday 23 May,7.30pm Habima National Theatre Tel Aviv | Hebrew The Habima is the centre of Hebrew-language theatre worldwide ,Founded in Moscow after the 1905 revolution, the company eventually settled in Tel Aviv in the late 1920s,Since 1958, they have been recognised as the national theatre of Israel .This production of Shakespeare’s The Merchant of Venice marks their first visit to the UK. Date & Time :Monday 28May,7.30 & Tuesday 29 May,7.30pm 21.which play will be performed by the National Theatre of China? A.Richard Ⅲ. B.Lover’s Labour’s Lost 绝密★启用前 2017年普通高等学校招生全国统一考试 理科综合能力测试 注意事项: 1、答题前,考生务必将自己的姓名、准考证号填写在试题卷和答题卡上。 2、回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其它答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。 3、考试结束后,将本试卷和答题卡一并交回。 可能遇到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5 K 39 Ti 48 Fe 56 I 127 一、选择题:本题共13小题,每小题6分,共78分。在每小题给出的四个选项中,只有一项是符合题目要求的。 7. 下列生活用品中主要由合成纤维制造的是 A.尼龙绳 B. 宣纸 C. 羊绒衫 D. 棉衬衣 8.《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳尖,长者为胜,平短者次之。”文中涉及的操作方法是 A. 蒸馏 B. 升华 C. 干馏 D. 萃取 9. (b)、(d)、(p)的分子式均为C6H6。下列说法正确的是 A.b的同分异构体只有d和p两种 B.b、d、p的二氯代物均只有三种 C.b、d、p均可与酸性高锰酸钾溶液反应 D.b、d、p中只有b的所有原子处于同一平面 10.实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气)。下列说法正确的是 A. ①、②、③中依次盛装KMnO 4溶液、浓H 2SO 4、焦性没食子酸溶液 B. 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度 C. 结束反应时,先关闭活塞K ,再停止加热 D. 装置Q (启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气 11. 支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是 A .通入保护电流使钢管桩表面腐蚀电流接近于零 B .通电后外电路电子被强制从高硅铸铁流向钢管柱 C. 高硅铸铁的作用是作为损耗阳极材料和传递电流 D. 通入的保护电流应该根据环境条件变化进行调整 12. 短周期主族元素W 、X 、Y 、Z 的原子序数依次增大,W 的简单氢化物可用作制冷剂,Y 的原子半径是所有短周期主族元素中最大的。由X 、Y 和Z 三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是 A .X 的简单氢化物的热稳定性比W 的强 B .Y 的简单离子与X 的具有相同的电子层结构 C .Y 与Z 形成化合物的水溶液可使蓝色石蕊试纸变红 D .Z 与X 属于同一主族,与Y 属于同一周期 13. 将NaOH 溶液滴加到己二酸(H 2X )溶液中,混合溶液的pH 与离子浓度变化的关系如图所示。下列叙述错误的是 A. K a1(H 2X )的数量级为10— 6 B. 曲线N 表示pH 与2(HX )lg (H X) c c -的变化关系 C. NaHX 溶液中(H )(OH )c c +->2019年高考语文全国2卷含答案
2019年高考语文真题及答案(全国卷)
2018年高考化学试卷(全国卷1)
2019年高考英语全国2卷含答案
2018年高考化学试卷(全国卷2) (2)
2019年高考全国2卷理科数学及答案
2019年高考化学试卷-(全国II卷与答案)
2019年高考地理全国2卷及答案
2019年高考化学试卷-(全国Ⅰ卷与答案)
2019年高考全国2卷理科数学及答案
2019年全国卷Ⅰ化学高考试题
2020高考化学试题—全国Ⅰ卷
2019年高考全国2卷英语试题及答案
全国统一高考1卷化学试卷(Word版)