
1.【2017新课标1卷】(15分)
钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)元素K 的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm (填标号)。
A .404.4
B .553.5
C .589.2
D .670.8
E .766.5
(2)基态K 原子中,核外电子占据最高能层的符号是_________,占据该能层电子的电子云轮
廓图形状为___________。K 和Cr 属于同一周期,且核外最外层电子构型相同,但金属K 的熔点、沸点等都比金属Cr 低,原因是___________________________。
(3)X 射线衍射测定等发现,I 3AsF 6中存在+3I 离子。+3I 离子的几何构型为_____________,中心
原子的杂化形式为________________。
(4)KIO 3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立方结构,边长为a =0.446 nm ,
晶胞中K 、I 、O 分别处于顶角、体心、面心位置,如图所示。
K 与O 间的最短距离为______nm ,与K 紧邻的O 个数为__________。
(5)在KIO 3晶胞结构的另一种表示中,I 处于各顶角位置,则K 处于______位置,
O 处于______位置。
【参考答案】(1)A (2)N 球形 K 的原子半径较大且价电子数较少,金属键较弱
(3)V 形 sp 3 (4)0.315 12 (5)体心 棱心
OF 2属于V 形,因此+3I 几何构型为V 形,其中心原子的杂化类型为sp 3;(4)根据晶胞结构,K
与O间的最短距离是面对角线的一半,即为2
0.446
nm=0.315nm,根据晶胞的结构,距离
K最近的O的个数为12个;(5)根据KIO3的化学式,以及晶胞结构,可知K处于体心,O处于棱心。
【名师点睛】本题考查化学选修3《物质结构与性质》的相关知识,以填空或简答方式考查,常涉及如下高频考点:原子结构与元素的性质(基态微粒的电子排布式、电离能及电负性的比较)、元素周期律;分子结构与性质(化学键类型、原子的杂化方式、分子空间构型的分析与判断);晶体结构与性质(晶体类型、性质及与粒子间作用的关系、以晶胞为单位的密度、微粒间距与微粒质量的关系计算及化学式分析等)。只有掌握这些,才可以更好的解决物质结构的问题。2.【2017新课标2卷】(15分)
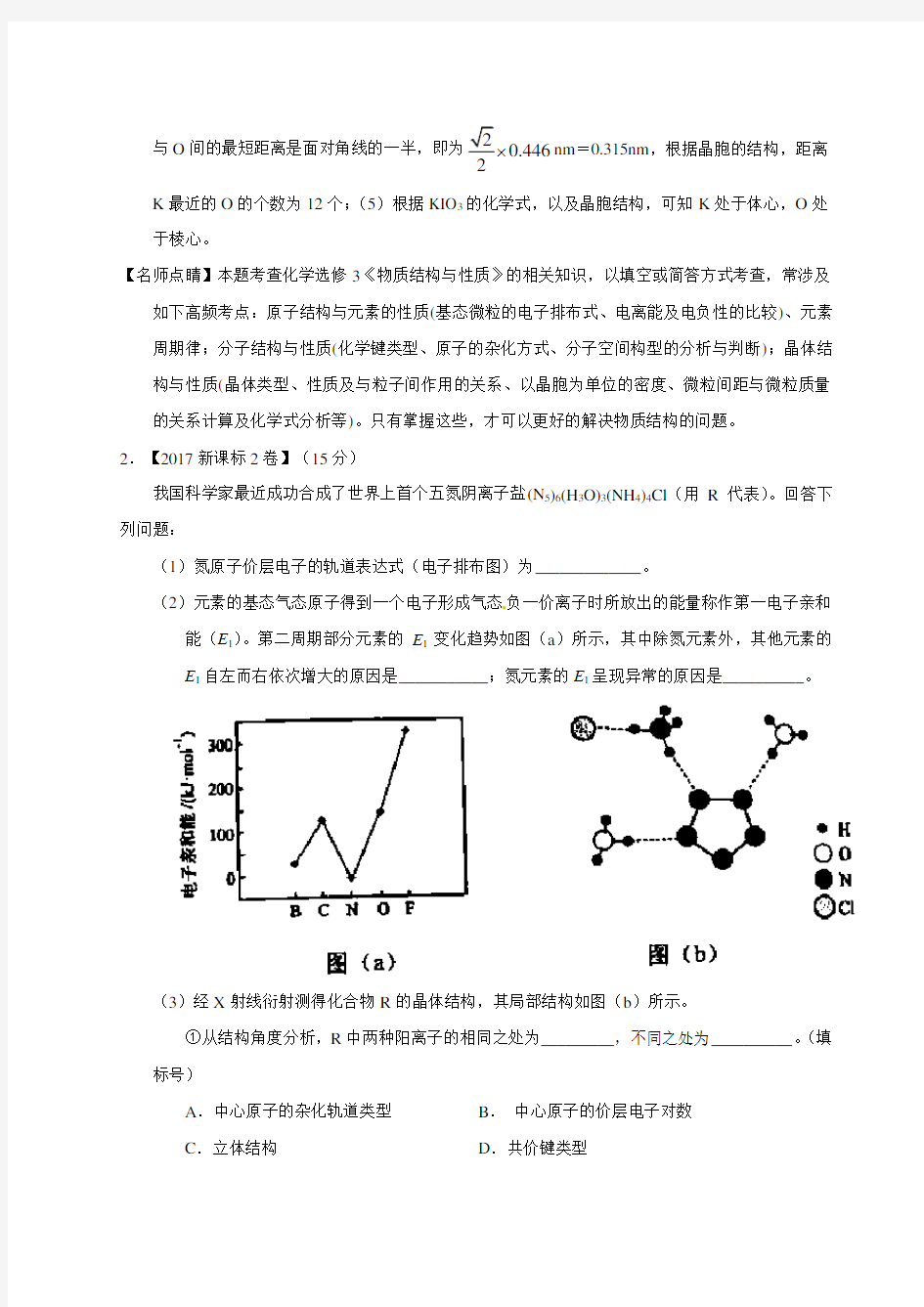
我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。回答下列问题:
(1)氮原子价层电子的轨道表达式(电子排布图)为_____________。
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是___________;氮元素的E1呈现异常的原因是__________。
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示。
①从结构角度分析,R中两种阳离子的相同之处为_________,不同之处为__________。(填
标号)
A.中心原子的杂化轨道类型B.中心原子的价层电子对数
C.立体结构D.共价键类型
②R 中阴离子5N -中的σ键总数为________个。分子中的大π键可用符号n
m ∏表示,其中m
代表参与形成大π键的原子数,n 代表参与形成大π键的电子数(如苯分子中的大π键可表
示为66∏)
,则5N -中的大π键应表示为____________。 ③图(b )中虚线代表氢键,其表示式为(+
4NH )N?H…Cl 、____________、____________。
(4)R 的晶体密度为d g·cm ?3,其立方晶胞参数为a nm ,晶胞中含有y 个单元,该单元的相对
质量为M ,则y 的计算表达式为______________。 【答案】(1)(2)同周期元素随核电荷数依次增大,原子半径逐渐变小,故结合一
个电子释放出的能量依次增大 N 原子的2p 轨道为半充满状态,具有额外稳定性,故不易结合一个电子
(3)①ABD C ②5 65∏ ③(H 3O +)O-H…N(5N -) (+
4NH )N-H…N(5N -) (4)3321
A 602(10)a dN a d M M
-?或 【解析】(1)N 原子位于第二周期第V A 族,价电子是最外层电子,即电子排布图是;
电子对数为(6?1?3)/2=1,价层电子对数为4,杂化类型为sp 3,空间构型为三角锥形,因此相同
之处为ABD ,不同之处为C ;②根据图(b),5N -中σ键总数为5个,5N -的大Π键应表示为65∏;
③根据图(b),还有的氢键是:(H 3O +)O-H…N(5N -)、(+
4NH )N-H…N(5N -); (4)根据密度的定义有,d =73(10)A y M N a -??g/cm 3,解得y =73(10)A d a N M -???=3602a d M
。 【名师点睛】本题考查化学选修3《物质结构与性质》的相关知识,以填空或简答方式考查,常涉及
如下高频考点:原子结构与元素的性质(基态微粒的电子排布式、电离能及电负性的比较)、元素
周期律;分子结构与性质(化学键类型、原子的杂化方式、分子空间构型的分析与判断);晶体结构与性质(晶体类型、性质及与粒子间作用的关系、以晶胞为单位的密度、微粒间距与微粒质量的关系计算及化学式分析等)。只有对基础知识积累牢固,这类问题才能比较容易解决;在做题过程中一定要注意审清楚问题问的是什么,如本题(1)问的是电子排布图,而不是电子排布式,另一个注意书写规范,如氢键的表示。
3.【2017新课标3卷】(15分)
研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为_____________。元素Mn与O中,第一电离能较大的是_________,基态原子核外未成对电子数较多的是_________________。
(2)CO2和CH3OH分子中C原子的杂化形式分别为__________和__________。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为_________________,原因是______________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在________。
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为________nm。MnO也属于NaCl型结构,晶胞参数为a' =0.448 nm,则r(Mn2+)为________nm。
【答案】(1)1s22s22p63s23p63d74s2或3d74s2O Mn (2)sp sp3
(3)H2O>CH3OH>CO2>H2H2O与CH3OH均为极性分子,H2O中氢键比甲醇多;CO2与H2均为非极性分子,CO2分子量较大、范德华力较大(4)离子键和π键(或键)(5)0.148
0.076
(2)CO2和CH3OH的中心原子C原子的价层电子对数分别为2和4,所以CO2和CH3OH分子中C原子的杂化形式分别为sp和sp3。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为H2O>CH3OH>CO2>H2,原因是常温下水和甲醇是液体而二氧化碳和氢气是气体,液体的沸点高于气体;H2O与CH3OH均为极性分子,H2O中氢键比甲醇多,所以水的沸点高于甲醇;CO2与H2均为非极性分子,CO2分子量较大、范德华力较大,所以CO2的沸点较高。
(4)硝酸锰是离子化合物,硝酸根和锰离子之间形成离子键,硝酸根中N原子与3个氧原子形成3个σ键,硝酸根中有一个氮氧双键,所以还存在π键。
(5)因为O2-是面心立方最密堆积方式,面对角线是O2-半径的4倍,即4r(O2-)=2a,解得
r(O2-)=
2
0.420
4
nm=0.148nm;MnO也属于NaCl型结构,根据晶胞的结构,晶胞参数=2 r(O2
-)+2 r(Mn2+),则r(Mn2+)=(0.448 nm-2×0.148 nm)/2=0.076nm。
【名师点睛】物质结构的考查,涉及电子排布式、第一电能能比较、杂化理论、化学键及分子间作用力和晶胞的计算等。其中杂化形式的判断是难点,具体方法是:先计算中心原子价电子对数,价
电子对数n=(中心原子的价电子数+配位原子的成键电子数±电荷数)。注意:①当上述公式中电荷数为正值时取“-”,电荷数为负值时取“+”;②当配位原子为氧原子或硫原子时,成键电子数为零;根据n值判断杂化类型:一般有如下规律:当n=2,sp杂化;n=3,sp2杂化;n=4,sp3杂化。
4.【2017江苏卷】
铁氮化合物(Fe x N y)在磁记录材料领域有着广泛的应用前景。某Fe x N y的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe3+基态核外电子排布式为____________________。
(2)丙酮()分子中碳原子轨道的杂化类型是_______________,1 mol 丙酮分子中
含有σ键的数目为______________。
(3)C、H、O三种元素的电负性由小到大的顺序为________________。
(4)乙醇的沸点高于丙酮,这是因为____________________。
(5)某Fe x N y的晶胞如题21图?1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x?n) Cu n N y。Fe x N y转化为两种Cu替代型产物的能量变化如题21图?2 所示,其中更稳定的Cu替代型产物的化学式为___________。
【答案】(1)3d5或1s22s22p63s23p63d5 (2)sp2和sp39 mol (3)H (4)乙醇分子间存在氢键(5)Fe3CuN 【名师点睛】本题考查了简单离子的基态核外电子排布式、简单分子中σ键的数目、C原子的原子轨道杂化类型、短周期常见元素的电负性比较、分子间氢键对物质性质的影响、晶胞中原子数的计算及晶体化学式的确定等有关物质结构的主干知识,同时还考查了物质所含能量的高低对物质稳定性的影响。要求我们要重视基础知识的掌握和应用,会用均摊法分析晶体的组成。均摊法确定晶胞中原(离)子数目及晶体化学式。对于平行六面体晶胞而言,用均摊法计算的依据是:①处于顶点的微粒,同时为8个晶胞所共享,每个微粒有1/8属于该晶胞;②处于棱上的微粒,同时为4个晶胞所共享,每个微粒有1/4属于该晶胞;③处于面上的微粒,同时为2个晶胞所共享,每个微粒有1/2属于该晶胞;④处于晶胞内部的微粒,完全属于该晶胞。 化学选修三 物质结构与性质综合测试题及答案 1、 选择题(每小题3分,共54分。每小题只有一个选项符合题意 ) 1.有关乙炔(H-C=C-H)分子中的化学键描述不正确的是A.两个碳原子采用sp杂化方式 B.两个碳原子采用sp2杂化方式 C.每个碳原子都有两个未杂化的2p轨道形成π键D.两个碳原子形成两个π键 2.下列物质中,难溶于CCl4的是 A.碘单质 B.水C.苯酚 D.己烷 3.下列分子或离子中,含有孤对电子的是 A.H2O B.CH4 C.SiH4 D.NH4+ 4.氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为 A .氨气分子是极性分子而甲烷是非极性分子。 B.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。 C.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。 D.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。 5.对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一现象的主 要原因 A.电子由激发态向基态跃迁时以光的形式释放能量 B.在电流的作用下,氖原子与构成灯管的物质发生反应 C.电子由基态向激发态跃迁时吸收除红光以外的光线 D.氖原子获得电子后转变成发出红光的物质 6.若某原子在处于能量最低状态时,外围电子排布为4d15s2,则下列说法正确的是 A.该元素原子处于能量最低状态时,原子中共有3个未成对电子B.该元素原子核外共有6个电子层 C.该元素原子的M能层共有8 个电子 D.该元素原子最外层共有2个电子 7.σ键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨 道以及一个原子的p轨道和另一个原子的p轨道以“头碰头”方式重叠而成。则下列分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的是 A.H2 B.HF C.Cl2 D.F2 8. 下列原子或离子原子核外电子排布不属于基态排布的是 A. S2-: 1s22s22p63s23p6 B. N: 1s22s22p3 C. Si: 1s22s22p63s23p2 D. Na: 1s22s22p53s2 9.元素电负性随原子序数的递增而增强的是 A.C,Si,Ge B.N, P, As C.Si, P, Cl D. F, S, Cl 10.某元素质量数51,中子数28,其基态原子未成对电子数为 A.3 B.1 C. 2 D.0 11,只有阳离子而没有阴离子的晶体是 ( )。 A.金属晶体 B.分子晶体 C.离子晶体 D.原子晶体 12,下列关于物质熔点的排列顺序,不正确的 是 ( )。 A.HI>HBr>HCl>HF B.CI4>CBr4>CCl4>CF4 C.KCl>KBr>KI D.金刚石>碳化硅>晶体硅 13、下列数据是对应物质的熔点,有关的判断错误的是() Na2O Na AlF3AlCl3Al2O3BCl3CO2SiO2 920℃97.8℃1291℃190℃2073℃-107℃-57℃1723℃ A.只要含有金属阳离子的晶体就一定是离子晶体 B.在上述共价化合物分子中各原子都形成8电子结构 C.同族元素的氧化物可形成不同类型的晶体 D.金属晶体的熔点不一定比离子晶体的高 绝密★启用前 2017年普通高等学校招生全国统一考试 英语 (考试时间:120分钟试卷满分:150分) 注意事项: 1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。 2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上,写在本试卷上无效。 3.考试结束后,将本试卷和答题卡一并交回。 第一部分听力(共两节,满分30分) 做题时,先将答案标在试卷上。录音内容结束后,你将有两分钟的时间将试卷上的答案转涂到答题卡上。 第一节(共5小题;每小题1.5分,满分7.5分) 听下面5段对话。每段对话后有一个小题,从题中所给的A、B、C三个选项中选出最佳选项。听完每段对话后,你都有10秒钟的时间来回答有关小题和阅读下一小题。每段对话仅读一遍。 例:How much is the shirt? A. £ 19. 15. B. £ 9. 18. C. £ 9. 15. 答案是C。 1. What does the woman think of the movie? A. It’s a musing. B. It’s exciting. C. It’s disappointing. 2. How will Susan spend most of her time in France? A. Traveling around. B. Studying at a school. C. Looking after her aunt. 3. What are the speakers talking about? A. Going out. B. Ordering drinks. C. Preparing for a party. 4. Where are the speakers? A. In a classroom. B. In a library. C. In a bookstore. 5. What is the man going to do ? A. Go on the Internet. B. Make a phone call. C. Take a train trip. 历年高考地理真题集锦 1.阅读图文材料,完成下列要求。 “一带一路”(如下图所示)是“丝绸之路经济带”和“21世起海上 丝之路”的简称,随着“一带一路”的实施,中国企业纷纷走出国门, 我国H集团是金球最大的电信设备创造企业,已在欧洲西部立研发、销售中心。我国一些著名轮胎厂也在东南亚投资建厂。 (1)与“丝绸之路经济带”相比,指出“海上丝绸之路”运输方式 的主要优缺点。 (2)说明H集团在欧洲西部建立研发、销售中心的原因。 (3)简述我国轮胎厂在东南亚投资建厂的主要有利条件。 (4)红木家具广受人们的喜爱。目前,我国红木原材主要依赖进口。越南是红木原材的主要出口国。近年来,越南规定红木原材 需经初加工方可出口。请从可持续发展角度说明越南限制红木原材 出口的原因。 2.阅读图文材料,完成下列要求。 橙橘是我国南方地区主要的水果,低温冻害是影响其生长的主 要障碍。对柑橘的利用除鲜果和柑橘汁外,近年来,欧美等发达国 家的科研机构相继从柑橘果品中分离提取出橙黄色素、柠檬苦素、 食用纤维素等许多功能性成分,这些高附加值产品被广泛地应用于 食品、化工、医药等领域,而在这方面我国的研究还处于起步阶段。图a和图b分别是我国江南丘陵某地1980年和2010年土地利用示意图。 (1)该地土地利用的变化,使水土流失和旱涝灾害减少,请分析 其成因过程。 (2)冬季夜晚,图b中②地的柑橘树比①地更易受低温冻害的影响,请说明原因。 (3)有人建议在该地大力发展柑橘加工工业,你认为是否合理, 请说出理由。 3.阅读图文材料,完成下列要求。 油棕属木本油料植物,喜高温、湿润和强光照环境,每天日照 5小时以上的地区最为理想。油棕在种植后3年里就可产果榨油, 经济寿命为25-30年。油棕果含油量高达50%以上,油棕亩产油量 是大豆的近10倍,有“世界油王”之称。棕油价格相对豆油十分低廉,是目前国际贸易量最大的植物油品种。 化学选修三物质结构与性质综合测试题及答案 一、选择题(每小题3分,共54分。每小题只有一个 ....选项符合题意 ) 1.有关乙炔(H-C=C-H)分子中的化学键描述不正确的是 A.两个碳原子采用sp杂化方式 B.两个碳原子采用sp2杂化方式C.每个碳原子都有两个未杂化的2p轨道形成π键D.两个碳原子形成两个π键 2.下列物质中,难溶于CCl4的是 A.碘单质 B.水C.苯酚 D.己烷 3.下列分子或离子中,含有孤对电子的是 A.H2O B.CH4 C.SiH4 D.NH4+ 4.氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为 A .氨气分子是极性分子而甲烷是非极性分子。 B.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。 C.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。 D.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。 5.对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一现象的主要原因 A.电子由激发态向基态跃迁时以光的形式释放能量 B.在电流的作用下,氖原子与构成灯管的物质发生反应 C.电子由基态向激发态跃迁时吸收除红光以外的光线 D.氖原子获得电子后转变成发出红光的物质 6.若某原子在处于能量最低状态时,外围电子排布为4d15s2,则下列说法正确的是 A.该元素原子处于能量最低状态时,原子中共有3个未成对电子 B.该元素原子核外共有6个电子层 C.该元素原子的M能层共有8个电子 D.该元素原子最外层共有2个电子 7.σ键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨道以及一个原子的p轨道和另一个原子的p轨道以“头碰头”方式重叠而成。则下列分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的是 A.H2 B.HF C.Cl2 D.F2 高考化学真题分类汇编专题物质结构与性质选 修好用版 Document number【SA80SAB-SAA9SYT-SAATC-SA6UT-SA18】 1.选修3——物质结构与性质] 19–Ⅰ【2016年高考海南卷】(6分) 下列叙述正确的有 A.第四周期元素中,锰原子价电子层中未成对电子数最多 B.第二周期主族元素的原子半径随核电荷数增大依次减小 C.卤素氢化物中,HCl的沸点最低的原因是其分子间的范德华力最小 2.【2016年高考海南卷】(14分) M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:(1)单质M的晶体类型为______,晶体中原子间通过_____作用形成面心立方密堆积,其中M原子的配位数为______。 (2)元素Y基态原子的核外电子排布式为________,其同周期元素中,第一电离能最大的是______(写元素符号)。元素Y的含氧酸中,酸性 最强的是________(写化学式),该酸根离子的立体构型为 ________。 (3)M与Y形成的一种化合物的立方晶胞如图所示。 ①该化合物的化学式为_______,已知晶胞参数a= nm,此晶体的密 度为_______g·cm–3。(写出计算式,不要求计算结果。阿伏加德罗常 数为N A) ②该化合物难溶于水但易溶于氨水,其原因是________。此化合物 的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式 为_______。 3.【2016年高考江苏卷】物质结构与性质] Zn(CN) 4 ]2-在水溶液中与HCHO发生如下反应: 4HCHO+Zn(CN) 4]2-+4H++4H 2 O===Zn(H 2 O) 4 ]2++4HOCH 2 CN (1)Zn2+基态核外电子排布式为____________________。 (2)1 mol HCHO分子中含有σ键的数目为____________mol。 (3)HOCH 2 CN分子中碳原子轨道的杂化类型是______________。 (4)与H 2 O分子互为等电子体的阴离子为________________。 (5)Zn(CN) 4 ]2-中Zn2+与CN-的C原子形成配位键。不考虑空间构型, Zn(CN) 4 ]2-的结构可用示意图表示为_____________。 4.【2016年高考上海卷】(本题共12分) NaCN超标的电镀废水可用两段氧化法处理: (1)NaCN与NaClO反应,生成NaOCN和NaCl (2)NaOCN与NaClO反应,生成Na 2CO 3 、CO 2 、NaCl和N 2 已知HCN(K i =×10-10)有剧毒;HCN、HOCN中N元素的化合价相同。 完成下列填空: (5)上述反应涉及到的元素中,氯原子核外电子能量最高的电子亚层是___________;H、C、N、O、Na的原子半径从小到大的顺序为_______。 (6)HCN是直线型分子,HCN是___________分子(选填“极性”或“非极性”)。HClO的电子式为___________。 5.【2016年高考四川卷】(13分)M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s电子的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:(1)R基态原子的电子排布式是①,X和Y中电负性较大的是② (填元素符号)。 2017年普通高等学校招生全国统一考试(江苏卷) 英语试题 注意事项: 1. 答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。用2B铅笔将答题卡上试卷类型A后的方框涂黑。 2. 选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。 3. 非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。 4. 考试结束后,请将本试题卷和答题卡一并上交。 第一部分听力(共两节,满分20 分) 做题时,先将答案标在试卷上,录音内容结束后,你将有两分钟的时间将试卷上的答案转涂到答题卡上。 第一节(共5 小题;每小题 1 分,满分5 分) 听下面5 段对话。每段对话后有一个小题,从题中所给的A、B、C 三个选项中选出最佳选项。听完每段对话后,你都有10秒钟的时间来回答有关小题和阅读下一小题。每段对话仅读一遍。 例:How much is the shirt.z.x.xk? A.?19.15. B.?9.18. C. ?9.15. 答案是C。 1.What does the woman think of the movie? A.It’s amusing. B. It’s exciting. C. It’s disappointing. 2.How will Susan spend most of her time in France? A.Traveling around. B.Studying at a school. C.Looking after her aunt. 3.What are the speakers talking about? A.Going out. B.Ordering drinks. 历年高考地理真题分类汇编 专题城乡规划 (?天津卷)图4、图5表示城市人口密度和城区在15年间的变化。读图回答6-7题。 6.结合图4中的信息推断,该市人口状况发生的变化是() A.其北部人口增加的数量最多 B.全市人口密度增加 C.市中心的人口密度有所降低 D.东部人口增长较慢 7.结合图5中信息推断,该城市空间结构发生的变化是() A.商业区的分布更加集中 B.新工业区向老工业区集聚 C.住宅区向滨湖地区聚集 D.中部、南部路网密度增大 【答案】6. B 7. D 【解析】 试题分析: 6.从图示中人口密度的图例分析,该市东部人口密度增加较大,人口增加较快;增加数量的多少还取决于面积的大小,所以不能判断各方向人口增加数量的多少;而全市的人口密度都增加。故选B。 (?四川卷)图3反映我国某城市某工作日0:00时和10:00时的人口集聚状况,该图由手机定位功能获取的人口移动数据制作而成,读图回答下列各题。 5、按城市功能分区,甲地带应为() A、行政区 B、商务区 C、住宅区 D、工业区 6、根据城市地域结构推断,该城市位于() A、丘陵地区 B、平原地区 C、山地地区 D、沟谷地区 【答案】5、C 6、B (?江苏卷)“国际慢城”是一种具有独特地方感的宜居城镇模式,要求人口在5万人以下、环境质量好、提倡传统手工业、无快餐区和大型超市等。下图为“国际慢城”桠溪镇的大山村土地利用今昔对比图。读图回答下列问题。 21.与“国际慢城“要求相符合的生产、生活方式是() A.骑单车出行 B.经营手工业作坊 C.去速食店就餐 D.建大型游乐场 22.大山村在成为“国际慢城”前后,产业结构的变化是() A.从传统农业到现代农业 B.从种植业到种植业与服务业相结合 C.从水稻种植业到商品谷物农业 D.从较单一的农作物到多种经济作物 选修三《物质结构与性质》综合测试(5) 本试卷分第I卷(选择题)和第II卷(非选择题)两部分。 分值:120分考试时间为90分钟。 第I卷(选择题共60分) 可能用到的相对原子原子质量:H─1 C─12 N─14 O─16 Na─23 Mg─24 Al─27 Cl─35.5 一.选择题(本题包括20小题,每小题3分,共60分。每小题只有一个 ....选项符合题意。) 1.在物质结构研究的历史上,首先提出原子内有电子学说的是() A.道尔顿 B.卢瑟福 C.汤姆生 D.波尔 2.一个电子排布为1s22s22p63s23p1的元素最可能的价态是( ) A +1 B +2 C +3 D -1 3. 以下能级符号不正确 ...的是() A.3s B.3p C .3d D.3f 4. 下列能跟氢原子形成最强极性键的原子是() A.F B.Cl C.Br D.I 5. 关于晶体的下列说法正确的是() A. 任何晶体中,若含有阳离子就一定有阴离子。 B. 原子晶体中只含有共价键。 C. 原子晶体的熔点一定比金属晶体的高。 D.离子晶体中只含有离子键,不含有共价键。 6.下列说法中,不符合 ...ⅦA族元素性质特征的是() A.易形成-1价离子 B.从上到下原子半径逐渐减小 C.从上到下单质的氧化性逐渐减弱 D.从上到下氢化物的稳定性依次减弱 7. 下列晶体熔化时不需破坏化学键的是() A. 晶体硅 B .食盐 C .干冰 D .金属钾 8. 向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是() A. 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变。 B. 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+。 C. 向反应后的溶液加入乙醇,溶液没有发生变化。 D. 在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道。 9. 关于CO2说法正确的是() A. 碳原子采取sp杂化。 B. CO2是正四面体型结构。 物质结构与性质(选修) 1.(2020年山东新高考)下列关于C 、Si 及其化合物结构与性质的论述错误的是 A .键能C C>Si Si —— 、C H>Si H —— ,因此C 2H 6稳定性大于Si 2H 6 B .立方型Si C 是与金刚石成键、结构均相似的共价晶体,因此具有很高的硬度 C .SiH 4中Si 的化合价为+4,CH 4中C 的化合价为-4,因此SiH 4还原性小于CH 4 D .Si 原子间难形成双键而C 原子间可以,是因为Si 的原子半径大于C ,难形成p p π— 键 【答案】C 【解析】A .因键能C —C >Si —Si 、C —H >Si —H ,故C 2H 6的键能总和大于Si 2H 6,键能越大越稳定,故C 2H 6的稳定性大于Si 2H 6,A 正确; B .Si C 的成键和结构与金刚石类似均为原子晶体,金刚石的硬度很大,类比可推测SiC 的硬度和很大,B 正确; C .SiH 4中Si 的化合价为-4价,C 的非金属性强于Si ,则C 的氧化性强于Si ,则Si 的阴离子的还原性强于C 的阴离子,则SiH 4的还原性较强,C 错误; D .Si 原子的半径大于C 原子,在形成化学键时纺锤形的p 轨道很难相互重叠形成π键,故Si 原子间难形成双键,D 正确; 故选C 。 2.(2020年山东新高考)B 3N 3H 6(无机苯)的结构与苯类似,也有大π键。下列关于B 3N 3H 6的说法错误的是 A .其熔点主要取决于所含化学键的键能 B .形成大π键的电子全部由N 提供 C .分子中B 和N 的杂化方式相同 D .分子中所有原子共平面 【答案】A 【解析】A .无机苯是分子晶体,其熔点主要取决于分子间的作用力,A 错误; B .B 原子最外层3个电子,与其它原子形成3个键,N 原子最外层5个电子,与其它原子形成3个键,还剩余2个电子,故形成大键的电子全部由N 原子提供,B 正确; C .无机苯与苯等电子体,分子中含有大键,故分子中B 、N 原子的杂化方式为sp 2杂化,C 正确; D .无机苯与苯等电子体,分子中含有大键,故分子中B 、N 原子的杂化方式为sp 2杂化,所以分子中所 2017 年普通高等学校招生全国统一考试 英语 (考试时间:120 分钟试卷满分: 150 分) 第I 卷 第一部分听力 (共两节,满分30 分 ) 1.What does the woman think of the movie? A.It ’ s amusing B.It’ s exciting C.It’ s disappointing 2.How will Susan spend most of her time in France? A. Traveling around B.Studying at a school C.Looking after her aunt 3.What are the speakers talking about? A. Going out B.Ordering drinks C.Preparing for a party 4.Where are the speakers? A.In a classroom B.In a library C.In a bookstore 5.What is the man going to do ? A.Go on the Internet B.Make a phone call C.Take a train trip 第二节(共15 小题;每小题 1.5分,满分22.5 分) 听第 6段材料,回答第6、 7题。 6. What is the woman looking for? A. An information office B.A police station C.A shoe repair shop 7. What is the Town Guide according to the man? A. A brochure B.A newspaper C.A map 听第 7 段材料,回答第8、 9 题。 8.What does the man say about the restaurant? A.It ’ s the biggest one around. B.It offers many tasty dishes. C. It ’ s famous for its seafood. 2019年高考地理真题分类汇编 专题自然地理环境的整体性与差异性 (2019?安徽卷)下图为25°N-32°N之间某区域遥感影像。完成下列问题。 23、图示地区主要的陆地自然带是() A.荒漠带 B.热带草原带 C.热带雨林带 D.亚热带常绿阔叶林带 24、图示地区有世界重要的海上交通贸易通道。该通道便捷地连接了() A.北美东岸与西欧 B.东亚与南亚 C.北美东岸与西岸 D.西欧与南亚 【答案】23.A 24.D 考点:考查区域定位及区域地理特征。 【名师点睛】解答此题的关键是空间定位,根据该区域的纬度范围25°N-32°N和轮廓,判断该区域为埃及,从而确定图示地区主要的陆地自然带是热点荒漠带;第2问,该地区作为世界重要的海上交通贸易通道,便捷地连接两个区域的判断,也是根据空间定位后,就能准确判断连接了西欧与南亚,其它三个选项都不符合条件。总体上,此难度不大,但对空间定位要求较 高,这样也就要求学生平时复习过程中,对世界区域的空间定位加强训练。 (2019?浙江卷)一地的自然景观主要取决于其水热条件。下图中北纬30°附近甲、乙两地的自然景观图,完成下列各题 3、下图为北纬30°附近①、②、③、④四地的气候统计图。与甲、乙两相对应的是() A、甲-①、乙-② B、甲-②、乙-④ C、甲-③、乙-① D、甲-④、乙-③ 4、甲、乙两地自然景观迥异的主要影响因素是() A、太阳辐射 B、距海远近 C、洋流性质 D、海拔高度 【答案】3、D 4、D 考点定位:本题考查不同气候类型特征差异,影响陆地自然景观的主要因素。 (2019?北京卷)从太白山的北麓往上,越上树木越密越高,上到山的中腰再往上,树木则越稀越矮。待到大稀大矮的境界。繁衍着狼的族类,也居住了一户猎狼的人家(引自贾平凹《太白山记》。太白山为秦岭主峰,海拔3767米)。据此,回答下列问题。 1.太白山() A、北麓为亚热带常绿阔叶林带 B、北坡山中腰降水量比山麓少 C、又密又高的树木在针叶林带 D、树木大稀大矮处为稀树草原 2.如果过度猎狼,将会() ①、造成山区生物多样性减少②、增加山区的环境承载力 ③、导致不良消费观念的形成④、破坏可持续发展的公平性 A.①② B.②③ C.③④ D.①④ 【答案】1.C 2.D 考点:地理环境的整体性、环境承载力、可持续发展。 【名师点睛】植被的垂直分布可以概括出以下规律:①基带为当地典型的植被带。②在各森林 高考化学练习题物质结构与性质物质结构与性质 考点1 原子结构与元素的性质 1.了解原子核外电子的能级分布,能用电子排布式表示常见元素(1~36号)原子核外电子的排布。了解原子核外电子的运动状态。 2.了解元素电离能的含义,并能用以说明元素的某些性质。 3.了解原子核外电子在一定条件下会发生跃迁,了解其简单应用。 4.了解电负性的概念,知道元素的性质与电负性的关系。 高频考点1 原子核外电子的排布规律 【样题1】下列各组原子中,彼此化学性质一定相似的是() A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子 C.2p轨道上有一个空轨道的X原子与3p轨道上只有一个空轨道的Y原子 D.最外层都只有一个电子的X、Y原子 【解题指导】A中1s2结构的He,1s22s2结构为Be,两者性质不相似。B项X原子为Mg,Y原子N层上有2个电子的有多种元素,如第四周期中Ca、Fe等都符合,化学性质不一 定相似。C项为同主族的元素,化学性质一定相似。D项最外层只有1个电子可能是第ⅠA族元素,过渡元素中也有很多最外层只有1个电子的,故性质不一定相似。 【答案】 C 【命题解读】原子核外电子的排布规律是中学化学原子结构的重点内容,也是元素周期律的基础。原子轨能级是决定核外电子排布和构型的重要因素,原子的外层电子构型是随原子序数的增加呈现周期性变化,而原子的外层电子构型的周期性变化又引起元素性质的周期性变化,元素性质周期性变化的规律称元素周期律,反映元素周期律的元素排布称元素周期表。 考点2 化学键与物质的性质 1.理解离子键的形成,能根据离子化合物的结构特征解释其物理性质。 2.了解共价键的主要类型键和键,能用键能、键长、键角等说明简单分子的某些性质。 3.了解简单配合物的成键情况。 4.了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。 5.理解金属键的含义,能用金属键理论解释金属的一些物理性质。 6.了解杂化轨道理论及常见的杂化轨道类型(sp,sp2,sp3), 专题18 物质结构与性质(选修) 1.[2019新课标Ⅰ]在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要村料。回答下列问题: (1)下列状态的镁中,电离最外层一个电子所需能量最大的是 (填标号 )。 A.B.C.D. (2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别 是、。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是,其中与乙二胺形成的化合物稳定性相对较高的是(填“Mg2+”或“Cu2+”)。 (3)一些氧化物的熔点如下表所示: 氧化物Li2O MgO P4O6SO2 熔点/°C 1570 2800 23.8 ?75.5 解释表中氧化物之间熔点差异的原因。 (4)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离= pm,Mg原子之间最短距离y= pm。设阿伏加德罗常数的值为N A,则MgCu2的密度是 g·cm?3(列出计算表达式)。 【答案】(1)A (2)sp3sp3乙二胺的两个N提供孤对电子给金属离子形成配位键Cu2+ (3)Li2O、MgO为离子晶体,P4O6、SO2为分子晶体。晶格能MgO>Li2O。分子间力(分子量)P4O6>SO2 (4 23 330 A 824+1664 10 N a- ?? ? 【解析】(1)A.[Ne]3s1属于基态的Mg+,由于Mg的第二电离能高于其第一电离能,故其再失去一个电子所需能量较高; B. [Ne] 3s2属于基态Mg原子,其失去一个电子变为基态Mg+; C. [Ne] 3s13p1属于激发态 2017年普通高等学校招生全国统一考试(全国卷1) 英语 (考试时间:120分钟试卷满分:150分) 注意事项: 1.本试卷由四个部分组成。其中,第一、二部分和第三部分の第一节为选择题。第三部分の第二节和第四部分为非选择题。 2.答卷前,考生务必将自己の姓名、准考证号填写在答题卡上。 3.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目の答案标号涂黑;回答非选择题时,将答案写在答题卡上,写在本试卷上无效。 4.考试结束后,将本试卷和答题卡一并交回。 第一部分听力(共两节,满分30分) 做题时,先将答案标在试卷上。录音内容结束后,你将有两分钟の时间将试卷上の答案转涂到答题卡上。 第一节(共5小题;每小题1.5分,满分7.5分) 听下面5段对话。每段对话后有一个小题,从题中所给のA、B、C三个选项中选出最佳选项,并标在试卷の相应位置。听完每段对话后,你都有10秒钟の时间来回答有关小题和阅读下一小题。每段对话仅读一遍。 例:How much is the shirt? A. £ 19. 15. B. £ 9. 18. C. £ 9. 15. 答案是C。 1.What does the woman think of the movie? A.It’s amusing B.It’s exciting C.It’s disappointing 2.How will Susan spend most of her time in France? A. Traveling around B.Studying at a school C.Looking after her aunt 3.What are the speakers talking about? A. Going out B.Ordering drinks C.Preparing for a party 4.Where are the speakers? A.In a classroom B.In a library C.In a bookstore 5.What is the man going to do ? 历年高考地理真题集锦参考答案第1题 (1)优点:运量大、运费低。缺点:速度慢、灵活性和连续性差 (2)欧洲西部科技发达;人口素质高;拓展欧洲市场(市场广阔)。 (3)当地盛产橡胶,原料丰富;有大量廉价的劳动力;产品靠海运,运输成本低。 (4)延长产业链,提高产品附加值;增加就业;促进经济发展;保护森林资源等。 【归纳】技术导向型工业产业分散原因 1.研发中心——科技发达;高素质人才多 2.销售中心——拓展市场 3.生产装配中心——降低成本 4.交通(快) 原料导向型工业产业分散原因,围绕中心:成本 1.原料 2.劳动力 3.地价(部交易成本) 4.交通(实惠) 政策支持(社会主义优越性) 第2题 (1)耕地变林地(桔园)后,下渗(和植物截留)增强,地表径流减小;同时由于树木的阻挡,水流速度变慢,流水侵蚀(或冲 刷)作用减弱,因此水土流失减小;耕地变林地(桔园)后,地下水增多,雨季汇入河流的水量减少,而旱季地下水补给河流水量增大,使河流流量(水位)季节变化减小,因此旱涝灾害减少。 (2)冬季夜晚,坡顶近地面因辐射冷却气温降低,冷而重的空气沿山坡下沉到②地(河谷),使②地(河谷)气温较高的暖空气被抬升到上空,导致②地(河谷)冷而①地(山坡)暖,因此,②地(河谷)的柑橘树比①地(山坡)更易受低温冻害的影响。 (3)合理。理由:该地原料丰富;市场需求量大;合理调整产业结构;促进就业,增加居民收入等。 或答:不合理。理由:可能会加大果树与粮食争地的矛盾;需要加大研发经费投入,资金投入高;劳动力素质较低等。 第3题 (1)纬度低,太阳高度角大,太阳辐射强烈,光照强;赤道地区多对流雨,强度大,但历时短,能保证每天光照时间充足(2)油棕生长在热带,经济寿命长,产果量大;油棕果含油量高,单位面积产油高;马来西亚属于发展中国家,廉价劳动力丰富,棕油加工成本低 (3)中国热带面积小,油棕适宜种植区少,棕油消费量大,需要大量进口;印尼地处热带地区,油棕种植面积大,棕油自产量大(4)①周边油棕种植广,接近原料产地;靠近港口,便于产品运输;园区占地面积大,小镇地价更便宜。(②延长产业链,增加附加值;利于产业集聚化,形成规模效应;方便产业之间生产联系,降低生产成本。 第4题 2017年全国高考英语试题分类汇编(共23份) 目录 2017全国高考汇编之定语从句 (2) 2017全国高考汇编之动词+动词短语 (13) 2017全国高考汇编之动词时态与语态 (30) 2017全国高考汇编之非谓语动词 (47) 2017全国高考汇编改错 (68) 2017全国高考汇编之交际用语 (82) 2017全国高考汇编之介词+连词 (96) 2017全国高考汇编之名词性从句 (112) 2017全国高考汇编之完型填空 (187) 2017全国高考汇编之形容词+副词 (330) 2017全国高考汇编之虚拟语气+情态动词 (341) 2017全国高考汇编阅读之广告应用类 (355) 2017全国高考汇编阅读之广告应用类 (375) 2017全国高考汇编阅读之科普知识类 (409) 2017全国高考汇编阅读之人物传记类 (456) 2017全国高考汇编阅读之社会生活类 (471) 2017全国高考汇编阅读之文化教育类 (552) 2017全国高考汇编阅读新题型 (658) 2017全国高考汇编阅读之新闻报告类 (712) 2017全国高考汇编之代词+名词+冠词 (740) 2017全国高考汇编之状语从句 (761) 2017全国高考汇编之定语从句 The exact year Angela and her family spent together in China was 2008. A. When B. where C. why D. which 【考点】考察定语从句 【答案】D 【举一反三】Between the two parts of the concert is an interval, _______ the audience can buy ice-cream. A. when B. where C. that D. which 【答案】A 二I borrow the book Sherlock Holmes from the library last week, ______ my classmates recommended to me.. A.who B. which C. when D. Where 【考点】考察定语从句 【答案】B 【举一反三】The Science Museum, we visited during a recent trip to Britain, is one of London’s tourist attractions. 高考地理真题汇编 -----------------------作者: -----------------------日期: ?更多资料请访问.(.....) ?更多资料请访问.(.....) 2011年高考地理真题汇编08—农业 (2011全国新课标卷)第二次世界大战以后,美国通过大量技术投入和大规模专业化生产,成为世界最大的大豆生产国和出口国。巴西自20世纪70年代开始种植大豆,在积极培育优良品种的同时,鼓励农民组建农场联合体,实现了大豆的规模化生产与经营。目前,巴西的大豆产量、出口量仅次于美国。中国曾是世界最大的大豆生产国和出口国,近些年大豆的质量下降(品种退化,出油率低),生产成本较高,成为世界最大的大豆进口国。据此完成3~5题。 3.巴西大豆总产量增加的潜力大于美国,主要是因为巴西 A.技术力量较雄厚 B.气候条件较优越 C.可开垦的土地资源较丰富 D.劳动力较充足 【答案】C 【解析】本题组主要考查影响农业生产的区位因素。解题时要根据材料,结合巴西、美国、中国的国情进行比较分析。本组题也是热点问题(转基因大豆)切入,着重考查学生获取解读信息的能力。巴西人口比美国少,巴西高原面积广大,适宜大豆种植,“20世纪70年代开始种植大豆”,开发种植较晚是最大的优势,C正确。4.在国际市场上,巴西大豆价格低于美国的主要原因是巴西 A.专业化水平较高 B.科技投入较大 C.劳动生产率较高 D.劳动力价格较低 【答案】 D 【解析】巴西大豆的专业化水平、科技投入、劳动生产率都没有美国高。巴西是发展中国家,劳动力价格便宜,D正确。 5.中国要提高大豆质量亟需 A.加大科技投入 B.扩大种植面积 C.增加劳动力投入 D.加大化肥使用量 【答案】 A 【解析】中国大豆种植历史悠久,“品种退化”严重,所以要提高大豆质量亟需加大科技投入,A正确。中国后备耕地资源少,不能扩大种植面积,增加劳动力投入,加大化肥使用量不能提高大豆质量。 (2011全国卷大纲卷) 36.(36分)阅读图文资料,完成下列各题。 黄麻适合在湿热的气候环境中生长。收获的黄麻在水中浸沤后,才能进行初加工以获取制作麻袋、麻布、纸张等的原料。图7中甲城市为世界最大的麻纺工业中心,也是该地区联系河运和海运的重要港口。图8为甲城市的气候资料。 (1)简述图示黄麻产区的气候特征。(8分) 【答案】:全年高温(各月均温都在20摄氏度以上);全年降水量大(年降水量1600毫米以上);5—10月(或者6—9月)降水较丰沛(为雨季);11月—次年4月(10月—次年5月)降水较少(为旱季)。 【分析】本题主要考察考生阅读气温曲线与降水柱状图、分析和判读图像能力以及对描述气候特征的正确思路和表达。某种气候的特征描述思路一般包括:气温和降水两个要素,气温从年均温高低、年较差大小、日较差大小三个方向描述,降水从年降水总量、降水季节分配和年际变化大小三个方面描述。结合所有季风气候共同特征,将图像语言转化为文字语言,看图说话就好。 (2)简析图示黄麻产区的地形特征。(6分) 【答案】(两)大河下游冲积平原和三角洲,(海拔低于200米)地势低平,自北(西北)向南(东南)倾斜(或者自内陆向沿海渐低 【分析】本题考查考生对等高线图区域图的判读以及地形特征描述一般方法的掌握程度,属于容易题,区分度不高。地形特征描述一般思路:根据等高线的数值特征、弯曲和延伸方向、疏密程度、河流的流向、海陆分布特点描述地形类型及其分布、海拔高度地势特征(某方向高、相反方向低)、起伏大小、可能的地质灾害等。由图中等高线数值可判断出大部分地区海拔在200米以下,应该为平原,再根据图中河流(恒河和布拉马普特拉河)流向(自西北流向东南)可得出:地势西北高、东南低,地势起伏小,主要地形为平原和河口三角洲。 (3)说明该地区有利于黄麻生产的水文条件。(8分) 【答案】水网密、水量丰、利于运输;利于干季时或干旱时对黄麻灌溉;便于浸沤黄麻。 《物质结构与性质》模块测试题 一、选择题(本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意。) 1.核磁共振(NMR )技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR 现象。试判断下列哪种原子不能..产生NMR 现象 A .13 6C B .147N C .168O D .31 15P 2.有关化学用语正确的是 A .Cl - 的电子排布式:1s 22s 22p 63s 23p 6 B.乙醇的结构简式:C 2H 6O C .硫离子的结构示意图: D.四氯化碳的电子式: 3. 膦(PH 3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常有磷化氢。它的分子构型是三角锥形。以下关于PH 3的叙述正确的是 A.PH 3分子中有未成键的孤对电子 B .PH 3是非极性分子 C .PH 3是一种强氧化剂 D .PH 3分子的P -H 键是非极性键 4.下列关于元素第一电离能的说法不正确...的是 A .钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠 B .因同周期元素的原子半径从左到右逐渐减小,故第一电离能必定依次增大 C .最外层电子排布为n s 2n p 6(若只有K 层时为1s 2)的原子,第一电离能较大 D .对于同一元素而言,原子的逐级电离能越来越大 5.具有下列电子排布式的原子中,半径最大的是 A .ls 22s 22p 63s 23p 3 B .1s 22s 22p 3 C .1s 22s 22p 4 D .1s 22s 22p 63s 23p 4 6.下列分子中,所有原子都满足8电子结构的是 A .六氟化硫 B .光气(COCl 2) C .二氟化氙 D .三氟化硼 7.下列说法中正确的是 A .处于最低能量的原子叫做基态原子 B .3p 2表示3p 能级有两个轨道 C .同一原子中,1s 、2s 、3s 电子的能量逐渐减小 D .同一原子中,2p 、3p 、4p 能级的轨道数依次增多 8.下列关于丙烯(CH 3—CH =CH 2)的说法正确的是 2 8 6 +16化学选修三物质结构与性质 综合测试题及答案
2017年高考英语真题三套打印版
历年高考地理真题集锦(题目)
化学选修三物质结构与性质综合测试题及答案
高考化学真题分类汇编专题物质结构与性质选修好用版
(完整版)2017江苏高考英语试题及答案
历年高考地理真题分类汇编
高中化学选修3《物质结构与性质》综合测试5
2020年高考化学真题和名校模拟好题分类集锦:物质结构与性质(选修)(解析版)
2017高考英语全国卷1卷原题及答案.docx
2019年高考地理真题分类汇编
高考化学练习题物质结构与性质-word
2019年高考化学真题分类汇编专题18 物质结构与性质(选修) (解析版)
2017年全国高考英语试题及答案-全国卷1
历年高考地理真题集锦(答案)
2017年全国高考英语试题分类汇编(共23份) (1)
高考地理真题汇编
物质结构与性质模块测试题